Карбонильное восстановление

В органической химии восстановление карбонила — это превращение любой карбонильной группы, обычно в спирт. Это обычная трансформация, которая практикуется разными способами. [ 1 ] Кетоны , альдегиды , карбоновые кислоты , сложные эфиры , амиды и галогенангидриды — некоторые из наиболее распространенных функциональных групп — содержат карбонильные соединения. Карбоновые кислоты, сложные эфиры и галогенангидриды могут быть восстановлены либо до альдегидов, либо до первичных спиртов , в зависимости от силы восстановителя. Альдегиды и кетоны восстанавливаются соответственно до первичных и вторичных спиртов . При дезоксигенации спиртовая группа может быть дополнительно восстановлена и полностью удалена путем замены на H.
Существуют две широкие стратегии восстановления карбонила. Один из методов, который пользуется популярностью в промышленности, использует в качестве восстановителя водород. Этот подход называется гидрированием и требует металлических катализаторов. Другой широкий подход использует стехиометрические реагенты, которые доставляют H. - и Х + отдельно. В данной статье основное внимание уделяется использованию этих реагентов. Среди этих реагентов особое место занимают соли боргидридов щелочных металлов и гидриды алюминия.
Общие соображения
[ редактировать ]
По механизму реакции осуществляют гидриды металлов нуклеофильное присоединение гидрида к карбонильному углероду. На легкость присоединения гидрида к карбонилу влияют электрофильность и объем карбонила, а также соответствующие электронные и стерические свойства гидридного реагента. Результатом этих тенденций является то, что галогенангидриды, кетоны и альдегиды обычно являются наиболее легко восстанавливаемыми соединениями, тогда как кислоты и сложные эфиры требуют более сильных восстановителей. Важно и характерно то, что эти гидридные реагенты обычно не атакуют связи C=C. [ 2 ]
Несколько факторов способствуют прочности металлогидридных восстановителей. На восстановительную способность боргидридных реагентов влияет противоион , такой как Na. + против Ли + который может активировать карбонилы путем координации с карбонильным кислородом. Ли + сильнее связывается с карбонильным кислородом, чем Na + . [ 3 ] Однако в случае тетрагидроалюминатов NaAlH 4 и LiAlH 4 ведут себя аналогично. [ 2 ] Многие металлические добавки были исследованы. Например, боргидрид цинка, номинально Zn(BH 4 ) 2 используется для мягкого селективного восстановления альдегидов и кетонов в присутствии других восстанавливаемых групп. [ 4 ]
Центральный металл (обычно B по сравнению с Al) сильно влияет на прочность восстановителя. Гидриды алюминия являются более нуклеофильными и лучшими восстановителями по сравнению с борогидридами. [ 5 ] Относительно слабый восстановитель боргидрид натрия обычно используется для восстановления кетонов и альдегидов. Толерантен ко многим функциональным группам (нитрогруппе, нитрилу, сложному эфиру). [ 6 ]
По своим эксплуатационным свойствам алюмогидрид лития и боргидрид натрия (и их производные) сильно различаются. С NaBH 4 гораздо легче обращаться, чем с LiAlH 4 , поскольку он устойчив на воздухе в течение нескольких недель. Его можно использовать с водой или этанолом в качестве растворителей, тогда как LiAlH 4 взрыво реагирует с протонными растворителями.
Заместители бора или алюминия модулируют мощность, селективность и эксплуатационные свойства этих восстановителей. Электроноакцепторные группы, такие как ацетокси и цианогруппы, снижают восстановительную способность, так что NaBH(OAc) 3 и NaBH 3 (CN) являются слабыми восстановителями. Электронодонорные группы, такие как алкильные группы, повышают восстановительную силу. супергидрид (триэтилборгидрид лития) и L-селектрид являются сильными восстановителями. Соответственно, с ними опасно обращаться.
Следующая таблица [ 7 ] иллюстрирует, какие карбонильные функциональные группы могут быть восстановлены с помощью восстановителей (эффективность некоторых из этих реагентов различается в зависимости от условий реакции):

Субстраты
[ редактировать ]Карбоновая кислота и ее эфиры
[ редактировать ]По сравнению с альдегидами и кетонами карбоновые кислоты трудно восстанавливаются. Литий-алюминийгидрид обычно эффективен. Первый этап включает депротонирование карбоновой кислоты. Последним этапом восстановления карбоновых кислот и эфиров является гидролиз алкоголята алюминия. [ 8 ] Эфиры (и амиды ) восстанавливаются легче, чем исходные карбоновые кислоты. Их восстановление дает спирты и амины соответственно. [ 9 ] Идеализированное уравнение восстановления сложного эфира литийалюминийгидридом:
- 2 RCO 2 R' + LiAlH 4 → LiAl(OCH 2 R) 2 (ИЛИ')
- LiAl(OCH 2 R) 2 (OR') + 4 H 2 O → LiAl(OH) 4 + 2 HOCH 2 R + 2 HOR'
Боргидрид натрия при некоторых обстоятельствах можно использовать для восстановления сложных эфиров, особенно с добавками. [ 1 ]
Образование альдегидов из производных карбоновых кислот является сложной задачей, поскольку более слабые восстановители (NaBH 4 ) часто очень медленно восстанавливают сложные эфиры и карбоновые кислоты, тогда как более сильные восстановители (LiAlH 4 ) немедленно восстанавливают образовавшийся альдегид до спирта. [ 10 ]

При восстановлении Фукуямы карбоновая кислота сначала превращается в тиоэфир путем добавления тиола (по механизму, аналогичному этерификации ). [ 11 ] Затем тиоэфир восстанавливают до альдегида силилгидридом с палладиевым катализатором.
Хлорангидриды кислот в альдегиды
[ редактировать ]Хлорангидриды кислот можно восстановить с образованием альдегидов с стерически затрудненными донорами гидридов. восстановитель DIBAL-H Для этой цели часто используется (гидрид диизобутилалюминия), хотя обычно он восстанавливает любой карбонил. DIBAL-H может избирательно восстанавливать хлорангидриды до уровня альдегидов, если при низких температурах используется только один эквивалент. [ 12 ] LiAlH(OtBu) 3 (образующийся in situ из LiAlH 4 и tBuOH). Аналогично ведет себя [ 13 ] Идеализированное уравнение восстановления хлорангидрида до альдегида алюмогидридом лития:
- RCOCl + LiAlH(OtBu) 3 → LiCl + «Al(OtBu) 3 » + RCHO
Традиционный метод образования альдегидов без восстановления до спиртов — с использованием затрудненных гидридов и реакционноспособных карбонилов — ограничен узкой областью применения и большой зависимостью от условий реакции. Одним из способов избежать этого метода является полное восстановление производного карбоновой кислоты до спирта, а затем обратное окисление спирта до альдегида. Другие альтернативы включают образование тиоэфира или амида Вайнреба, а затем восстановление новых разновидностей до альдегида посредством восстановления Фукуямы или реакции Вайнреба соответственно или использование каталитического гидрирования, как в реакции Розенмунда.
При синтезе кетонов Вейнреба ацилхлорид сначала преобразуется в амид Вейнреба, затем обрабатывается металлоорганическим реагентом с образованием кетона или алюмогидридом лития с образованием альдегида: [ 14 ]

Амид Вайнреба восстанавливается посредством стабильного хелата , а не электрофильного карбонила, который образуется в результате восстановления гидрида металла; поэтому хелат восстанавливается только один раз, как показано ниже:

Реакция Розенмунда восстанавливает ацилхлориды до альдегидов с использованием газообразного водорода с катализатором палладия на сульфате бария, небольшая площадь поверхности которого предотвращает чрезмерное восстановление. [ 15 ]
Альдегиды и кетоны
[ редактировать ]Кетоны менее реакционноспособны, чем альдегиды, из-за более сильных стерических эффектов, а также из-за того, что дополнительная алкильная группа увеличивает электронную плотность связи C=O, делая ее менее электрофильной. [ 16 ] Поскольку альдегиды восстанавливаются легче, чем кетоны, для них требуются более мягкие реагенты и более мягкие условия. С другой стороны, карбоновые кислоты, амиды и сложные эфиры плохо электрофильны и требуют сильных восстановителей. [ 17 ]
Идеализированное уравнение восстановления кетона борогидридом натрия:
- 4 RCOR' + NaBH 4 → NaB(OCHRR') 4
- NaB(OCHRR') 4 ) + 4 H 2 O → «NaB(OH) 4 » + 4 HOCHRR' + 4 HOR'

Восстановительное аминирование
[ редактировать ]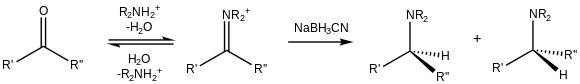
Помимо восстановления до спиртов, альдегиды и кетоны можно превращать в амины, т. е. восстановительное аминирование. [ 18 ] Из-за наличия цианозаместителя NaBH 3 CN является слабым восстановителем при умеренном pH (>4), поэтому он преимущественно восстанавливает катионы иминия, существующие в присутствии карбонилов:
α,β-ненасыщенные карбонилы
[ редактировать ]
При восстановлении α,β-ненасыщенного карбонила могут образоваться три продукта: аллиловый спирт в результате простого восстановления карбонила, насыщенный кетон или альдегид в результате 1,4-восстановления (также называемый сопряженным восстановлением ) или насыщенный спирт в результате двойного восстановления. . [ 19 ] Использование NaBH 4 может дать любой из этих результатов, но InCl 3 или NiCl 2 катализируют именно 1,4-восстановления. [ 1 ] Три(втор-бутил)борогидрид калия или лития иногда выбирает 1,4-восстановление, но этому могут препятствовать стерические препятствия. [ 20 ] Кластеры гидрида трифенилфосфиномеди направляют каталитическое гидрирование для выполнения специфического восстановления конъюгата.
Чтобы селективно образовать аллиловый спирт и избежать образования продукта 1,4, при восстановлении Люче используется «боргидрид церия», образующийся in situ из NaBH 4 и CeCl 3 (H 2 O) 7. [ 21 ] [ 22 ] Источник гидрида Zn(BH 4 ) 2 также демонстрирует селективность 1,2, а также большую диастереоселективность. Это происходит за счет координации не только с карбонильным кислородом, но и с соседними атомами: [ 23 ]

Гидрогенолиз
[ редактировать ]Особый случай восстановления карбонила влечет за собой полное дезоксигенирование, т.е. гидрогенолиз. Этот результат часто нежелателен, поскольку он предполагает дефункционализацию.
Некоторые реакции этого преобразования включают восстановление Клемменсена (в сильно кислых условиях) и восстановление Вольфа-Кишнера (в сильно основных условиях), а также различные модификации реакции Вольфа-Кишнера. Например, в модификации Кальоти используется тозилгидразон с донором гидрида в более мягких условиях без основания; [ 24 ] модификация Майерса заменяет гидразин бис(трет-бутилдиметилсилил)гидразином, использует более мягкие условия при комнатной температуре и является быстрой и эффективной. [ 25 ]
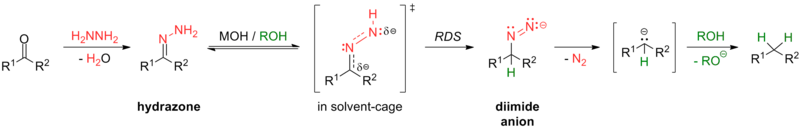
Ароматические карбонилы легче восстанавливаются до соответствующих алканов, чем алифатические соединения. [ 26 ] Например, кетоны восстанавливаются до соответствующих алкилбензолов путем каталитического гидрирования. [ 27 ] [ 28 ] или путем редукции Берча [ 29 ] в мягких условиях.
Стереоселективность
[ редактировать ]Диастереоселективное сокращение
[ редактировать ]При восстановлении циклогексанонов источник гидрида может атаковать аксиально с образованием экваториального спирта или экваториально с образованием аксиального спирта. При осевом воздействии (показано красным) гидрид испытывает 1,3-диаксиальную деформацию . При экваториальной атаке (показано синим цветом) гидрид избегает 1,3-диаксиального взаимодействия, но субстрат подвергается неблагоприятной деформации кручения , когда вновь образовавшийся спирт и добавленный атом водорода затмевают друг друга в промежуточном продукте реакции (как показано в проекции Ньюмана). для осевого спирта).

Крупным восстановителям, таким как LiBH(Me 2 CHCHMe) 3 , препятствуют 1,3-аксиальные взаимодействия, и поэтому они атакуют экваториально. [ 6 ] Небольшие восстановители, такие как NaBH 4 , преимущественно атакуют аксиально, чтобы избежать затмевающих взаимодействий, поскольку 1,3-диаксиальное взаимодействие для малых молекул минимально; Стереоэлектронные причины также были названы в пользу осевого предпочтения малых восстановителей. [ 30 ] Однако увеличение объема подложки (и усиление 1,3-осевых взаимодействий) снижает распространенность аксиальных атак даже для небольших доноров гидрида. [ 31 ]
Энантиоселективное восстановление
[ редактировать ]При восстановлении асимметричных кетонов образующийся вторичный спирт имеет хиральный центр, которым можно управлять с помощью хиральных катализаторов.
Хорошо известными карбонильными восстановлениями в асимметричном синтезе являются асимметричное гидрирование Нойори (восстановление бета-кетоэфира/Ru/BINAP) и восстановление CBS (BH 3 , хиральный катализатор, полученный из пролина).
История и альтернативные методы
[ редактировать ]Восстановление Буво -Блана с использованием смеси металлического натрия в присутствии спиртов было ранним методом восстановления карбонилов. [ 32 ] Сейчас оно во многом устарело. После открытия восстановления Буво-Блана было разработано множество методов, включая крупный прорыв в каталитическом гидрировании H 2 . , где восстановителем служит [ 33 ] Соли гидриды бора и алюминия, открытые начиная с 1940-х годов, оказались весьма удобными реагентами для восстановления карбонила.
При восстановлении Меервейна-Понндорфа-Верли изопропоксид алюминия действует как источник гидрида. Состояние этой реакции было резюмировано таким образом: «Химик-синтетик-органик редко будет пытаться использовать такой традиционный метод, как реакция Меервейна-Понндорфа-Верли (MPV)». [ 34 ]
См. также
[ редактировать ]- Пекарские дрожжи — путь биотрансформации для восстановления карбонила.
Ссылки
[ редактировать ]- ^ Jump up to: а б с Банфи, Люк; Нарисано, Генри; Рива, Рената; Стиасни, Николай; Хиерсеманн, Мартин; Ямада, Тору; Цубо, Тацуюки (2014). «Борогидрид натрия». Энциклопедия реагентов для органического синтеза . стр. 100-1 1–13. дои : 10.1002/047084289X.rs052.pub3 . ISBN 9780470842898 .
- ^ Jump up to: а б Браун, Герберт С.; Рамачандран, П. Вирарагаван (1996). «Шестьдесят лет сокращения гидридов». Сокращение органического синтеза . Серия симпозиумов ACS. Том. 641. стр. 1–30. дои : 10.1021/bk-1996-0641.ch001 . ISBN 9780841233812 .
- ^ Кениг, Буркхард (2009). «Реакции восстановления» (PDF) . Современные методы органического синтеза . Институт органической химии Регенсбургского университета. Архивировано из оригинала (PDF) 24 августа 2015 года . Проверено 1 декабря 2015 г.
- ^ Оиси, Такеши; Наката, Тадаши (2001). «Цинкборгидрид». Энциклопедия реагентов для органического синтеза . дои : 10.1002/047084289X.rz004 . ISBN 0471936235 .
- ^ Свитинг, Линда М. (2001). «Восстановители» . Таусонский университет. Архивировано из оригинала 16 ноября 2015 года . Проверено 1 декабря 2015 г.
- ^ Jump up to: а б БАНФИ, Лука; НАРИСАНО, Энрика; Рива, Рената (01 января 2001 г.). Боргидрид натрия . Джон Уайли и сыновья, ООО дои : 10.1002/047084289x.rs052 . ISBN 9780470842898 .
- ^ Смит, Майкл Б.; Марч, Джерри (2007), Продвинутая органическая химия: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, стр. 1790, ISBN 978-0-471-72091-1
- ^ Моффетт, Роберт Брюс (1953). «2-(1-пирролидил)пропанол». Органические синтезы . 33 : 82. дои : 10.15227/orgsyn.033.0082 .
- ^ Макмерри, Джон Э. (1973). «Реакция аннелирования изоксазола: 1-метил-4,4а,5,6,7,8-гексагидронафталин-2(3H ) -он». Органические синтезы . 53 : 70. дои : 10.15227/orgsyn.053.0070 .
- ^ Гейлорд, Норман Г. (1 августа 1957 г.). «Восстановление комплексными гидридами металлов». Журнал химического образования . 34 (8): 367. Бибкод : 1957ЖЧЭд..34..367Г . дои : 10.1021/ed034p367 .
- ^ Фукуяма, Тору; Линь, Шао Чэн; Ли, Лепинг (1 сентября 1990 г.). «Легкое восстановление этилтиоловых эфиров до альдегидов: применение для полного синтеза метилового эфира (+)-неотрамицина А». Журнал Американского химического общества . 112 (19): 7050–7051. дои : 10.1021/ja00175a043 . ISSN 0002-7863 .
- ^ Захаркин Л.И.; Хорлина, И. М. (1962). «Восстановление эфиров карбоновых кислот в альдегиды диизобутилалюминийгидридом». Буквы тетраэдра . 3 (14): 619–620. дои : 10.1016/s0040-4039(00)70918-x .
- ^ Кортес, Серхио (2010). «Использование водорода в качестве нуклеофила при восстановлении гидридов» (PDF) . Страница органической химии доктора Серхио Кортеса . Техасский университет в Далласе . Проверено 1 декабря 2015 г.
- ^ Нам, Стивен; Вайнреб, Стивен М. (1981). «N-метокси-н-метиламиды как эффективные ацилирующие агенты». Буквы тетраэдра . 22 (39): 3815–3818. дои : 10.1016/s0040-4039(01)91316-4 .
- ^ Мозеттиг, Эрих; Мозинго, Ральф (1 января 2004 г.). Восстановление Розенмунда хлоридов кислот до альдегидов . John Wiley & Sons, Inc., номер телефона : 10.1002/0471264180.or004.07 . ISBN 9780471264187 .
- ^ Рош, Алекс. «Кетоны и альдегиды» (PDF) . Университет Рутгерса . Проверено 1 декабря 2015 г.
- ^ Клейден, Джонатан (2012). Органическая химия . ОУП Оксфорд. п. 200. ИСБН 978-0199270293 .
- ^ Афанасьев Олег Иванович; Кучук Екатерина; Усанов Дмитрий Л.; Чусов, Денис (2019). «Восстановительное аминирование в синтезе фармацевтических препаратов». Химические обзоры . 119 (23): 11857–11911. doi : 10.1021/acs.chemrev.9b00383 . ПМИД 31633341 . S2CID 204814584 .
- ^ Смит, Майкл Б.; Марч, Джерри (2007), Продвинутая органическая химия: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, стр. 1070, ISBN 978-0-471-72091-1
- ^ Обратите внимание, что хотя Banfi et al. 2014 однозначно рекомендует втор- бутильное производное для 1,4-восстановления, первоначальный комментарий Хаббарда в Hubbard & Dake (2012) «Трисек - бутилборгидрид лития». Там же . doi : 10.1002/047084289X.rl145.pub2 дает только примеры 1,2‑редукций.
- ^ Стратегическое применение названных реакций в органическом синтезе (мягкая обложка), Ласло Курти, Барбара Чако ISBN 0-12-429785-4
- ^ Пакетт, Лео А.; Сабита, Г.; Ядав, Дж.С.; Шойерманн, Анжелика М.; Торговец, Рохан Р. (2021). «Церия(III) Хлорид». Энциклопедия реагентов для органического синтеза . стр. 1–15. дои : 10.1002/047084289X.rc041.pub3 . ISBN 9780471936237 .
- ^ Гривз, Ник (2015). «Диастереоселективное восстановление кетонов» . ChemTube3D . Университет Ливерпуля . Проверено 1 декабря 2015 г.
- ^ Кальоти, Л.; Маги, М. (1 января 1963 г.). «Реакция тозилгидразонов с литийалюминийгидридом». Тетраэдр . 19 (7): 1127–1131. дои : 10.1016/S0040-4020(01)98571-0 .
- ^ Ферроу, Майкл Э.; Майерс, Эндрю Г. (1 мая 2004 г.). «Практические методы получения N-трет-бутилдиметилсилилгидразонов и их использование в модифицированных восстановлениях Вольфа-Кишнера и в синтезе винилгалогенидов и гем-дигалогенидов». Журнал Американского химического общества . 126 (17): 5436–5445. дои : 10.1021/ja049694s . ISSN 0002-7863 . ПМИД 15113215 .
- ^ Нисимура, Сигео (2001). Справочник по гетерогенному каталитическому гидрированию для органического синтеза (1-е изд.). Нью-Йорк: Wiley-Interscience. п. 583. ИСБН 9780471396987 .
- ^ Заккерия, Федерика; Равазио, Николетта; Эрколи, Мауро; Аллегрини, Пьетро (2005). «Гетерогенные Cu-катализаторы восстановительного деоксигенирования ароматических кетонов без добавок». Буквы тетраэдра . 46 (45): 7743–7745. дои : 10.1016/j.tetlet.2005.09.041 .
- ^ Уокер, Гордон (1956). «Восстановление енолов. Новый синтез некоторых метоксибензсуберенов путем гидрирования дегидроуксусных кислот». Журнал Американского химического общества . 78 (13): 3201–3205. дои : 10.1021/ja01594a062 .
- ^ Холл, Стэн; Липски, Шэрон; Макинрой, Фрэнк; Бартельс, Энн (1971). «Литий-аммиачное восстановление ароматических кетонов до ароматических углеводородов». Журнал органической химии . 36 (18): 2588–2591. дои : 10.1021/jo00817a004 .
- ^ Вонг, Стивен С.; Паддон-Роу, Майкл Н. (январь 1990 г.). «Теоретические доказательства в поддержку электронной модели Ань-Эйзенштейна в контроле ?-лицевой стереоселективности в нуклеофильных добавках к карбонильным соединениям». Журнал Химического общества, Химические коммуникации (6): 456–458. дои : 10.1039/c39900000456 .
- ^ Кришнамурти, С.; Браун, Герберт К. (1 мая 1976 г.). «Трисиамилборгидрид лития. Новый стерически затрудненный реагент для восстановления циклических кетонов с исключительной стереоселективностью». Журнал Американского химического общества . 98 (11): 3383–3384. дои : 10.1021/ja00427a061 . ISSN 0002-7863 .
- ^ Буво, Луи ; Уайт, Гюстав Луи (1903). «Получение первичных спиртов с помощью соответствующих кислот» . Счет Возвращает. (на французском языке). 136 : 1676–1678.
- ^ Уилер, Оуэн Х. (1966). «Восстановление карбонильных групп». У Саула Патая (ред.). Карбонильная группа: Том. 1 (1966) . Химия функциональных групп ПАТАИ. стр. 507–566. дои : 10.1002/9780470771051.ch11 . ISBN 9780470771051 .
- ^ Ча, Джин Сун (2006). «Последние разработки в области Меервайна-Понндорфа-Верли и родственных реакций восстановления органических функциональных групп с использованием реагентов из алюминия, бора и других металлов: обзор». Исследования и разработки органических процессов . 10 (5): 1032–1053. дои : 10.1021/op068002c .