Окисление спирта
Окисление спиртов представляет собой совокупность реакций окисления в органической химии , которые превращают спирты в альдегиды , кетоны , карбоновые кислоты и сложные эфиры , где углерод имеет более высокую степень окисления . Реакция в основном применима к первичным и вторичным спиртам. Вторичные спирты образуют кетоны, а первичные спирты образуют альдегиды или карбоновые кислоты. [ 1 ]
Реакция может происходить с использованием различных окислителей.

В принципе, простой способ окисления спиртов использует атом кислорода и дает воду: На практике атомы кислорода недоступны, поэтому приведенное выше уравнение является лишь концептуальным. Вместо этого в большинстве процессов окисления используются реагенты на основе оксидов, такие как оксокомплексы металлов , сульфоксиды и оксиды йода.
С помощью различных механизмов удаление гидридного эквивалента превращает первичный или вторичный спирт в альдегид или кетон соответственно. Окисление первичных спиртов до карбоновых кислот обычно протекает через соответствующий альдегид, который превращается через гидрат альдегида ( гем -диол, R-CH(OH) 2 при реакции с водой ). Таким образом, окисление первичного спирта на уровне альдегида без дальнейшего окисления до карбоновой кислоты возможно при проведении реакции в отсутствие воды, так что гидрат альдегида не может образоваться.
Образование кетонов и альдегидов
[ редактировать ]
Многие реагенты окисляют вторичные спирты до кетонов, а первичные спирты до альдегидов. Аллиловые и бензиловые спирты представляют собой особые случаи. Альдегиды подвержены чрезмерному окислению до карбоновых кислот.
Реагенты хром(VI)
[ редактировать ]
Для этих окислений обычно используются реагенты хрома (VI). В одном семействе реагентов Cr(VI) используется комплекс CrO 3 (пиридин) 2 . [ 2 ]
- Реагент Саретта : раствор CrO 3 (пиридина) 2 в пиридине. Он был популяризирован для селективного окисления первичных и вторичных спиртов до карбонильных соединений.
- Реактив Коллинза представляет собой раствор того же CrO 3 (пиридина) 2 , но в дихлорметане. Вариант реактива Коллинза Рэтклиффа относится к деталям приготовления этого раствора, т. е. к добавлению триоксида хрома к раствору пиридина в метиленхлориде. [ 3 ]
Второе семейство реагентов Cr(VI) представляет собой соли , содержащие катион пиридиния (C 5 H 5 NH + ).
- Дихромат пиридиния (PDC) представляет собой пиридиевую соль дихромата, [Cr 2 O 7 ] 2- .
- хлорхромат пиридиния (PCC) представляет собой пиридиниевую соль [CrO 3 Cl] − .
Эти соли менее реакционноспособны, с ними легче обращаться и они более селективны, чем реагент Коллинза, при окислении спиртов.
Вышеупомянутые реагенты представляют собой усовершенствования по сравнению с более старым реагентом Джонса , раствором триоксида хрома в водной серной кислоте .
Десс-Мартин и родственные окисления
[ редактировать ]Периодинан Десса -Мартина является мягким окислителем, способствующим превращению спиртов в альдегиды или кетоны. [ 4 ] Реакцию проводят в стандартных условиях, при комнатной температуре, чаще всего в дихлорметане . Реакция длится от получаса до двух часов. Затем продукт отделяют от отработанного периодинана. [ 5 ] Было разработано множество окислителей на основе йодозила, например IBX .
Окисление Сверна
[ редактировать ]При окислении Сверна используются оксалилхлорид , диметилсульфоксид и органическое основание, такое как триэтиламин .
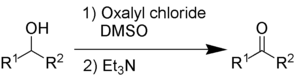
Побочными продуктами являются диметилсульфид (Me 2 S), окись углерода (CO), диоксид углерода (CO 2 ) и – когда в качестве основания используется триэтиламин – хлорид триэтиламмония (C 6 H 15 NHCl).
Окисление Оппенауэра
[ редактировать ]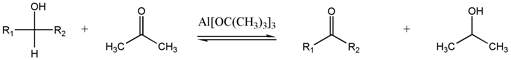
Этот редко используемый метод взаимно превращает спирты и карбонилы.
Нишевые методы
[ редактировать ]В окислении Лей используется NMO в качестве стехиометрического окислителя с перрутенатом тетрапропиламмония в качестве катализатора.
При окислении фетизоном , также редко используемом методе, используется карбонат серебра, нанесенный на целит. Этот реагент действует посредством одноэлектронного окисления катионами серебра.

Другой метод — окисление, катализируемое оксоаммонием .
Кроме того, гипохлорит натрия (или бытовой отбеливатель) в ацетоне эффективно преобразует вторичные спирты в присутствии первичных спиртов (окисление Стивенса). сообщалось, что [ 6 ]
Растворимые комплексы переходных металлов катализируют окисление спиртов в присутствии дикислорода или другого концевого окислителя. [ 7 ]
Окисление диолов
[ редактировать ]
Соединения, имеющие две гидроксильные группы, расположенные на соседних атомах углерода, то есть вицинальные диолы/1,2- диолы , подвергаются окислительному разрыву связи углерод-углерод с некоторыми окислителями, такими как периодат натрия (NaIO 4 ), (диацетоксииод)бензол (PhI( ОАк) 2 ) [ 8 ] или тетраацетат свинца (Pb(OAc) 4 ), что приводит к образованию двух карбонильных групп. Реакция также известна как расщепление гликоля .
Окисление первичных спиртов до карбоновых кислот.
[ редактировать ]
Когда первичный спирт превращается в карбоновую кислоту , концевой атом углерода увеличивает степень окисления на четыре. Прямое окисление первичных спиртов до карбоновых кислот можно проводить с использованием различных реагентов.
Альдегиды легко окисляются реагентами Cr(VI) и Mn(VII) до карбоновых кислот.
Перманганат калия
[ редактировать ]Перманганат калия (KMnO 4 ) очень эффективно окисляет первичные спирты до карбоновых кислот. Эта реакция, впервые подробно описанная Фурнье, [ 9 ] [ 10 ] обычно осуществляют путем добавления KMnO 4 к раствору или суспензии спирта в водном щелочном растворе. Чтобы реакция протекала эффективно, спирт должен быть хотя бы частично растворен в водном растворе. Этому можно способствовать добавлением органического сорастворителя, такого как диоксан , пиридин , ацетон или t -BuOH . KMnO 4 реагирует со многими функциональными группами , такими как вторичные спирты, 1,2-диолы, альдегиды, алкены, оксимы, сульфиды и тиолы, а также с двойными углерод-углеродными связями. Таким образом, избирательность является проблемой.

Окисление Джонса
[ редактировать ]Так называемый реактив Джонса , приготовленный из триоксида хрома (CrO 3 ) и водного раствора серной кислоты , окисляет спирты до карбоновой кислоты. Протокол часто дает значительные количества эфиров . [ 12 ] Проблемы заключаются в токсичности и неэкологичности реагента. каталитический вариант, включающий обработку избытком иодной кислоты (H 5 IO 6 ). Описан [ 13 ]

Двухстадийное окисление спиртов до кислот через изолированные альдегиды.
[ редактировать ]Поскольку многие из вышеупомянутых условий окисления первичных спиртов в кислоты суровы и несовместимы с обычными защитными группами, химики-органики часто используют двухстадийную процедуру окисления в кислоты. Спирт окисляется до альдегида с помощью одной из многих описанных выше процедур. Эта последовательность часто используется в синтезе натуральных продуктов, например, при синтезе платенцина. [ 15 ]
Нишевые методы и реагенты
[ редактировать ]Четырехокись рутения — агрессивный, редко используемый агент, допускающий мягкие условия реакции.
Окисление Хейнса. [ 16 ]
Использование хлоритов в качестве терминальных окислителей в сочетании как с гипохлоритами, так и с ТЕМПО дает карбоновые кислоты без побочных продуктов хлорирования. [ 17 ] Реакцию обычно проводят в две стадии в одном и том же котле: частичное окисление осуществляют ТЕМПО и гипохлоритом, затем для завершения окисления добавляют хлорит. Наблюдается только первичное окисление спирта. В сочетании с дигидроксилированием Шарплесса этот метод можно использовать для получения энантиочистых α-гидроксикислот. [ 18 ]
При окислении по Пиннику используется хлорит натрия . [ 19 ]
Ссылки
[ редактировать ]- ^ Бертон, Джордж и др. (2000). Продвинутая химия Солтерса: химия (2-е изд.) . Хайнеманн. ISBN 0-435-63120-9
- ^ «Реагенты на основе хрома». Окисление спиртов до альдегидов и кетонов . Основные реакции органического синтеза. 2006. стр. 1–95. дои : 10.1007/0-387-25725-X_1 . ISBN 0-387-23607-4 .
- ^ Дж. К. Коллинз, В. В. Гесс (1972). «Альдегиды из первичных спиртов окислением триоксидом хрома: гептаналь». Органические синтезы . 52 :5. дои : 10.15227/orgsyn.052.0005 .
- ^ Десс, Д.Б.; Мартин, JCJ Am. хим. Соц. 1991 , 113 , 7277–87.
- ^ Дж. С. Ядав и др. «Вторсырьевые ионные жидкости 2-го поколения как зеленые растворители для окисления спиртов реагентами гипервалентного йода», Тетраэдр , 2004 , 60 , 2131–35
- ^ Стивенс Р., Чепмен К.Т., Веллер Х.Н. (1980). «Удобный и недорогой метод окисления вторичных спиртов до кетонов». Журнал органической химии . 45 (10): 2030–2032. дои : 10.1021/jo01298a066 .
- ^ Пармеджани, Камилла; Кардона, Франческа (3 января 2012 г.). «Катализаторы на основе переходных металлов при аэробном окислении спиртов» . Зеленая химия . 14 (3): 547–564. дои : 10.1039/C2GC16344F . ISSN 1463-9270 .
- ^ Николау К.К., Адсол В.А., Хейл Ч.Р. (апрель 2010 г.). «Целевая методика окислительного разрыва олефиновых связей с помощью PhI(OAc)2, NMO и каталитического OsO4» . Органические письма . 12 (7): 1552–5. дои : 10.1021/ol100290a . ПМЦ 2848477 . ПМИД 20192259 .
- ^ Фурнье, Х.М. (1907). «Превращение предельных первичных спиртов в соответствующие одноосновные кислоты». ЧР акад. наук. : 331.
- ^ Фурнье, Ее Величество (20 июля 1909 г.). «О получении жирных кислот и их безводных» . Бык. Соц. хим. Пт .: 920.
- ^ Чуфолини, Массачусетс; Сваминатан, С. (1989). «Синтез модельного депсипептидного сегмента лузопептинов (BBM 928), мощных противоопухолевых и антиретровирусных антибиотиков». Тетраэдр Летт. 30 (23): 3027. doi : 10.1016/S0040-4039(00)99393-6 .
- ^ «Реагенты на основе хрома». Окисление спиртов до альдегидов и кетонов . Основные реакции органического синтеза. 2006. стр. 1–95. дои : 10.1007/0-387-25725-X_1 . ISBN 0-387-23607-4 .
- ^ Сонг, ZJ; Чжао, М.; Десмонд, Р.; Девайн, П.; Шэн, DM; Тиллер, Р.; Фрей, Л.; Хейд, Р.; Сюй, Ф.; Фостер, Б.; Ли, Дж.; Ример, Р.; Воланте, Р.; Грабовский, EJJ; Доллинг, США; Рейдер, П.Дж. (1999). «Практический асимметричный синтез антагониста рецептора эндотелина». Дж. Орг. хим. 64 (26): 9658. дои : 10.1021/jo991292t .
- ^ Кримминс, М.Т. и ДеБейли, AC (2006). «Энантиоселективный тотальный синтез бистрамида А» . Дж. Ам. хим. Соц. 128 (15): 4936–7. дои : 10.1021/ja057686l . ПМЦ 2546575 . ПМИД 16608311 .
- ^ Николау К.К.; Скотт Триа Дж.; Эдмондс диджей (2008). «Тотальный синтез платенцина». Энджью. хим. 120 (9): 1804. doi : 10.1002/ange.200800066 .
- ^ Маркос Фернандес; Габриэль Тодзё (2006). Окисление первичных спиртов до карбоновых кислот: Руководство по современной практике (основные реакции органического синтеза) . Берлин: Шпрингер. ISBN 0-387-35431-Х .
- ^ Песня, ZJ; Чжао, М.; Десмонд, Р.; Девайн, П.; Шэн, DM; Тиллер, Р.; Фрей, Л.; Хейд, Р.; Сюй, Ф.; Фостер, Б.; Ли, Дж.; Ример, Р.; Воланте, Р.; Грабовский, EJJ; Доллинг, США; Рейдер, П.Дж.; Окада, С.; Като, Ю.; Мано, EJ Org. хим. 1999 , 64 , 9658.
- ^ Шарплесс, КБ; Амберг, В.; Беннани, ЮЛ; Криспино, Джорджия; Хартунг, Дж.; Чон, Канзас; Квонг, HL; Морикава, К.; Ван, З.М.; Сюй, Д.; Чжан, XL J. Org. хим. 1992 , 57 , 2768.
- ^ Бал Б.С.; Чайлдерс-младший МЫ; Пинник HW (1981). «Окисление α,β-ненасыщенных альдегидов». Тетраэдр (аннотация). 37 (11): 2091. doi : 10.1016/S0040-4020(01)97963-3 .