Антибиотик
| Антибиотик | |
|---|---|
| Класс препарата | |
 Проверка чувствительности Staphylococcus aureus к антибиотикам методом диффузии дисков Кирби-Бауэра – антибиотики диффундируют из содержащих антибиотики дисков и подавляют рост S. aureus , в результате чего образуется зона ингибирования. | |
| Legal status | |
| In Wikidata |
Антибиотик вещества , – это тип противомикробного активного против бактерий . Это наиболее важный тип антибактериального средства для борьбы с бактериальными инфекциями , а антибиотики широко используются для лечения и профилактики таких инфекций. [1] [2] Они могут либо убивать , либо подавлять рост бактерий. Ограниченное число антибиотиков также обладают антипротозойной активностью. [3] [4] Антибиотики не эффективны против вирусов , например тех, которые вызывают простуду или грипп ; [5] препараты, подавляющие рост вирусов, называются противовирусными препаратами или противовирусными препаратами, а не антибиотиками. Они также не эффективны против грибков ; препараты, подавляющие рост грибков, называются противогрибковыми препаратами .
Sometimes, the term antibiotic—literally "opposing life", from the Greek roots ἀντι anti, "against" and βίος bios, "life"—is broadly used to refer to any substance used against microbes, but in the usual medical usage, antibiotics (such as penicillin) are those produced naturally (by one microorganism fighting another), whereas non-antibiotic antibacterials (such as sulfonamides and antiseptics) are fully synthetic. However, both classes have the same effect of killing or preventing the growth of microorganisms, and both are included in antimicrobial chemotherapy. "Antibacterials" include bactericides, bacteriostatics, antibacterial soaps, and chemical disinfectants, whereas antibiotics are an important class of antibacterials used more specifically in medicine[6] а иногда и в кормах для скота .
Antibiotics have been used since ancient times. Many civilizations used topical application of moldy bread, with many references to its beneficial effects arising from ancient Egypt, Nubia, China, Serbia, Greece, and Rome.[7] The first person to directly document the use of molds to treat infections was John Parkinson (1567–1650). Antibiotics revolutionized medicine in the 20th century. Synthetic antibiotic chemotherapy as a science and development of antibacterials began in Germany with Paul Ehrlich in the late 1880s.[8] Alexander Fleming (1881–1955) discovered modern day penicillin in 1928, the widespread use of which proved significantly beneficial during wartime. The first sulfonamide and the first systemically active antibacterial drug, Prontosil, was developed by a research team led by Gerhard Domagk in 1932 or 1933 at the Bayer Laboratories of the IG Farben conglomerate in Germany.[9][10][11] However, the effectiveness and easy access to antibiotics have also led to their overuse[12] and some bacteria have evolved resistance to them.[1][13][14][15] The World Health Organization has classified antimicrobial resistance as a widespread "serious threat [that] is no longer a prediction for the future, it is happening right now in every region of the world and has the potential to affect anyone, of any age, in any country".[16] Global deaths attributable to antimicrobial resistance numbered 1.27 million in 2019.[17]
Etymology
[edit]The term 'antibiosis', meaning "against life", was introduced by the French bacteriologist Jean Paul Vuillemin as a descriptive name of the phenomenon exhibited by these early antibacterial drugs.[8][18][19] Antibiosis was first described in 1877 in bacteria when Louis Pasteur and Robert Koch observed that an airborne bacillus could inhibit the growth of Bacillus anthracis.[18][20] These drugs were later renamed antibiotics by Selman Waksman, an American microbiologist, in 1947.[21]
The term antibiotic was first used in 1942 by Selman Waksman and his collaborators in journal articles to describe any substance produced by a microorganism that is antagonistic to the growth of other microorganisms in high dilution.[18][22] This definition excluded substances that kill bacteria but that are not produced by microorganisms (such as gastric juices and hydrogen peroxide). It also excluded synthetic antibacterial compounds such as the sulfonamides. In current usage, the term "antibiotic" is applied to any medication that kills bacteria or inhibits their growth, regardless of whether that medication is produced by a microorganism or not.[23][24]
The term "antibiotic" derives from anti + βιωτικός (biōtikos), "fit for life, lively",[25] which comes from βίωσις (biōsis), "way of life",[26] and that from βίος (bios), "life".[27][28] The term "antibacterial" derives from Greek ἀντί (anti), "against"[29] + βακτήριον (baktērion), diminutive of βακτηρία (baktēria), "staff, cane",[30] because the first bacteria to be discovered were rod-shaped.[31]
Usage
[edit]Medical uses
[edit]Antibiotics are used to treat or prevent bacterial infections,[32] and sometimes protozoan infections. (Metronidazole is effective against a number of parasitic diseases). When an infection is suspected of being responsible for an illness but the responsible pathogen has not been identified, an empiric therapy is adopted.[33] This involves the administration of a broad-spectrum antibiotic based on the signs and symptoms presented and is initiated pending laboratory results that can take several days.[32][33]
When the responsible pathogenic microorganism is already known or has been identified, definitive therapy can be started. This will usually involve the use of a narrow-spectrum antibiotic. The choice of antibiotic given will also be based on its cost. Identification is critically important as it can reduce the cost and toxicity of the antibiotic therapy and also reduce the possibility of the emergence of antimicrobial resistance.[33] To avoid surgery, antibiotics may be given for non-complicated acute appendicitis.[34]
Antibiotics may be given as a preventive measure and this is usually limited to at-risk populations such as those with a weakened immune system (particularly in HIV cases to prevent pneumonia), those taking immunosuppressive drugs, cancer patients, and those having surgery.[32] Their use in surgical procedures is to help prevent infection of incisions. They have an important role in dental antibiotic prophylaxis where their use may prevent bacteremia and consequent infective endocarditis. Antibiotics are also used to prevent infection in cases of neutropenia particularly cancer-related.[35][36]
The use of antibiotics for secondary prevention of coronary heart disease is not supported by current scientific evidence, and may actually increase cardiovascular mortality, all-cause mortality and the occurrence of stroke.[37]
Routes of administration
[edit]There are many different routes of administration for antibiotic treatment. Antibiotics are usually taken by mouth. In more severe cases, particularly deep-seated systemic infections, antibiotics can be given intravenously or by injection.[1][33] Where the site of infection is easily accessed, antibiotics may be given topically in the form of eye drops onto the conjunctiva for conjunctivitis or ear drops for ear infections and acute cases of swimmer's ear. Topical use is also one of the treatment options for some skin conditions including acne and cellulitis.[38] Advantages of topical application include achieving high and sustained concentration of antibiotic at the site of infection; reducing the potential for systemic absorption and toxicity, and total volumes of antibiotic required are reduced, thereby also reducing the risk of antibiotic misuse.[39] Topical antibiotics applied over certain types of surgical wounds have been reported to reduce the risk of surgical site infections.[40] However, there are certain general causes for concern with topical administration of antibiotics. Some systemic absorption of the antibiotic may occur; the quantity of antibiotic applied is difficult to accurately dose, and there is also the possibility of local hypersensitivity reactions or contact dermatitis occurring.[39] It is recommended to administer antibiotics as soon as possible, especially in life-threatening infections. Many emergency departments stock antibiotics for this purpose.[41]
Global consumption
[edit]Antibiotic consumption varies widely between countries. The WHO report on surveillance of antibiotic consumption published in 2018 analysed 2015 data from 65 countries. As measured in defined daily doses per 1,000 inhabitants per day. Mongolia had the highest consumption with a rate of 64.4. Burundi had the lowest at 4.4. Amoxicillin and amoxicillin/clavulanic acid were the most frequently consumed.[42]
Side effects
[edit]
Antibiotics are screened for any negative effects before their approval for clinical use, and are usually considered safe and well tolerated. However, some antibiotics have been associated with a wide extent of adverse side effects ranging from mild to very severe depending on the type of antibiotic used, the microbes targeted, and the individual patient.[43][44] Side effects may reflect the pharmacological or toxicological properties of the antibiotic or may involve hypersensitivity or allergic reactions.[4] Adverse effects range from fever and nausea to major allergic reactions, including photodermatitis and anaphylaxis.[45]
Common side effects of oral antibiotics include diarrhea, resulting from disruption of the species composition in the intestinal flora, resulting, for example, in overgrowth of pathogenic bacteria, such as Clostridium difficile.[46] Taking probiotics during the course of antibiotic treatment can help prevent antibiotic-associated diarrhea.[47] Antibacterials can also affect the vaginal flora, and may lead to overgrowth of yeast species of the genus Candida in the vulvo-vaginal area.[48] Additional side effects can result from interaction with other drugs, such as the possibility of tendon damage from the administration of a quinolone antibiotic with a systemic corticosteroid.[49]
Some antibiotics may also damage the mitochondrion, a bacteria-derived organelle found in eukaryotic, including human, cells.[50] Mitochondrial damage cause oxidative stress in cells and has been suggested as a mechanism for side effects from fluoroquinolones.[51] They are also known to affect chloroplasts.[52]
Interactions
[edit]Birth control pills
[edit]There are few well-controlled studies on whether antibiotic use increases the risk of oral contraceptive failure.[53] The majority of studies indicate antibiotics do not interfere with birth control pills,[54] such as clinical studies that suggest the failure rate of contraceptive pills caused by antibiotics is very low (about 1%).[55] Situations that may increase the risk of oral contraceptive failure include non-compliance (missing taking the pill), vomiting, or diarrhea. Gastrointestinal disorders or interpatient variability in oral contraceptive absorption affecting ethinylestradiol serum levels in the blood.[53] Women with menstrual irregularities may be at higher risk of failure and should be advised to use backup contraception during antibiotic treatment and for one week after its completion. If patient-specific risk factors for reduced oral contraceptive efficacy are suspected, backup contraception is recommended.[53]
In cases where antibiotics have been suggested to affect the efficiency of birth control pills, such as for the broad-spectrum antibiotic rifampicin, these cases may be due to an increase in the activities of hepatic liver enzymes' causing increased breakdown of the pill's active ingredients.[54] Effects on the intestinal flora, which might result in reduced absorption of estrogens in the colon, have also been suggested, but such suggestions have been inconclusive and controversial.[56][57] Clinicians have recommended that extra contraceptive measures be applied during therapies using antibiotics that are suspected to interact with oral contraceptives.[54] More studies on the possible interactions between antibiotics and birth control pills (oral contraceptives) are required as well as careful assessment of patient-specific risk factors for potential oral contractive pill failure prior to dismissing the need for backup contraception.[53]
Alcohol
[edit]Interactions between alcohol and certain antibiotics may occur and may cause side effects and decreased effectiveness of antibiotic therapy.[58][59] While moderate alcohol consumption is unlikely to interfere with many common antibiotics, there are specific types of antibiotics with which alcohol consumption may cause serious side effects.[60] Therefore, potential risks of side effects and effectiveness depend on the type of antibiotic administered.[61]
Antibiotics such as metronidazole, tinidazole, cephamandole, latamoxef, cefoperazone, cefmenoxime, and furazolidone, cause a disulfiram-like chemical reaction with alcohol by inhibiting its breakdown by acetaldehyde dehydrogenase, which may result in vomiting, nausea, and shortness of breath.[60] In addition, the efficacy of doxycycline and erythromycin succinate may be reduced by alcohol consumption.[62] Other effects of alcohol on antibiotic activity include altered activity of the liver enzymes that break down the antibiotic compound.[27]
Pharmacodynamics
[edit]The successful outcome of antimicrobial therapy with antibacterial compounds depends on several factors. These include host defense mechanisms, the location of infection, and the pharmacokinetic and pharmacodynamic properties of the antibacterial.[63] The bactericidal activity of antibacterials may depend on the bacterial growth phase, and it often requires ongoing metabolic activity and division of bacterial cells.[64] These findings are based on laboratory studies, and in clinical settings have also been shown to eliminate bacterial infection.[63][65] Since the activity of antibacterials depends frequently on its concentration,[66] in vitro characterization of antibacterial activity commonly includes the determination of the minimum inhibitory concentration and minimum bactericidal concentration of an antibacterial.[63][67]To predict clinical outcome, the antimicrobial activity of an antibacterial is usually combined with its pharmacokinetic profile, and several pharmacological parameters are used as markers of drug efficacy.[68]
Combination therapy
[edit]In important infectious diseases, including tuberculosis, combination therapy (i.e., the concurrent application of two or more antibiotics) has been used to delay or prevent the emergence of resistance. In acute bacterial infections, antibiotics as part of combination therapy are prescribed for their synergistic effects to improve treatment outcome as the combined effect of both antibiotics is better than their individual effect.[69][70] Fosfomycin has the highest number of synergistic combinations among antibiotics and is almost always used as a partner drug.[71] Methicillin-resistant Staphylococcus aureus infections may be treated with a combination therapy of fusidic acid and rifampicin.[69] Antibiotics used in combination may also be antagonistic and the combined effects of the two antibiotics may be less than if one of the antibiotics was given as a monotherapy.[69] For example, chloramphenicol and tetracyclines are antagonists to penicillins. However, this can vary depending on the species of bacteria.[72] In general, combinations of a bacteriostatic antibiotic and bactericidal antibiotic are antagonistic.[69][70]
In addition to combining one antibiotic with another, antibiotics are sometimes co-administered with resistance-modifying agents. For example, β-lactam antibiotics may be used in combination with β-lactamase inhibitors, such as clavulanic acid or sulbactam, when a patient is infected with a β-lactamase-producing strain of bacteria.[73]
Classes
[edit]- Molecular targets of antibiotics on the bacteria cell
- Protein synthesis inhibitors (antibiotics)
Antibiotics are commonly classified based on their mechanism of action, chemical structure, or spectrum of activity. Most target bacterial functions or growth processes.[8] Those that target the bacterial cell wall (penicillins and cephalosporins) or the cell membrane (polymyxins), or interfere with essential bacterial enzymes (rifamycins, lipiarmycins, quinolones, and sulfonamides) have bactericidal activities, killing the bacteria. Protein synthesis inhibitors (macrolides, lincosamides, and tetracyclines) are usually bacteriostatic, inhibiting further growth (with the exception of bactericidal aminoglycosides).[74] Further categorization is based on their target specificity. "Narrow-spectrum" antibiotics target specific types of bacteria, such as gram-negative or gram-positive, whereas broad-spectrum antibiotics affect a wide range of bacteria. Following a 40-year break in discovering classes of antibacterial compounds, four new classes of antibiotics were introduced to clinical use in the late 2000s and early 2010s: cyclic lipopeptides (such as daptomycin), glycylcyclines (such as tigecycline), oxazolidinones (such as linezolid), and lipiarmycins (such as fidaxomicin).[75][76]
Production
[edit]With advances in medicinal chemistry, most modern antibacterials are semisynthetic modifications of various natural compounds.[77] These include, for example, the beta-lactam antibiotics, which include the penicillins (produced by fungi in the genus Penicillium), the cephalosporins, and the carbapenems. Compounds that are still isolated from living organisms are the aminoglycosides, whereas other antibacterials—for example, the sulfonamides, the quinolones, and the oxazolidinones—are produced solely by chemical synthesis.[77] Many antibacterial compounds are relatively small molecules with a molecular weight of less than 1000 daltons.[78]
Since the first pioneering efforts of Howard Florey and Chain in 1939, the importance of antibiotics, including antibacterials, to medicine has led to intense research into producing antibacterials at large scales. Following screening of antibacterials against a wide range of bacteria, production of the active compounds is carried out using fermentation, usually in strongly aerobic conditions.[79]
Resistance
[edit]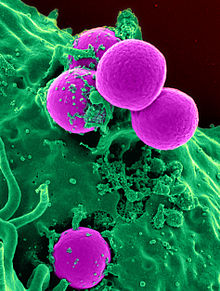
The emergence of antibiotic-resistant bacteria is a common phenomenon mainly caused by the overuse/misuse. It represents a threat to health globally.[80][81]
Emergence of resistance often reflects evolutionary processes that take place during antibiotic therapy. The antibiotic treatment may select for bacterial strains with physiologically or genetically enhanced capacity to survive high doses of antibiotics. Under certain conditions, it may result in preferential growth of resistant bacteria, while growth of susceptible bacteria is inhibited by the drug.[82] For example, antibacterial selection for strains having previously acquired antibacterial-resistance genes was demonstrated in 1943 by the Luria–Delbrück experiment.[83] Antibiotics such as penicillin and erythromycin, which used to have a high efficacy against many bacterial species and strains, have become less effective, due to the increased resistance of many bacterial strains.[84]
Resistance may take the form of biodegradation of pharmaceuticals, such as sulfamethazine-degrading soil bacteria introduced to sulfamethazine through medicated pig feces.[85]The survival of bacteria often results from an inheritable resistance,[86] but the growth of resistance to antibacterials also occurs through horizontal gene transfer. Horizontal transfer is more likely to happen in locations of frequent antibiotic use.[87]
Antibacterial resistance may impose a biological cost, thereby reducing fitness of resistant strains, which can limit the spread of antibacterial-resistant bacteria, for example, in the absence of antibacterial compounds. Additional mutations, however, may compensate for this fitness cost and can aid the survival of these bacteria.[88]
Paleontological data show that both antibiotics and antibiotic resistance are ancient compounds and mechanisms.[89] Useful antibiotic targets are those for which mutations negatively impact bacterial reproduction or viability.[90]
Several molecular mechanisms of antibacterial resistance exist. Intrinsic antibacterial resistance may be part of the genetic makeup of bacterial strains.[91][92] For example, an antibiotic target may be absent from the bacterial genome. Acquired resistance results from a mutation in the bacterial chromosome or the acquisition of extra-chromosomal DNA.[91] Antibacterial-producing bacteria have evolved resistance mechanisms that have been shown to be similar to, and may have been transferred to, antibacterial-resistant strains.[93][94] The spread of antibacterial resistance often occurs through vertical transmission of mutations during growth and by genetic recombination of DNA by horizontal genetic exchange.[86] For instance, antibacterial resistance genes can be exchanged between different bacterial strains or species via plasmids that carry these resistance genes.[86][95] Plasmids that carry several different resistance genes can confer resistance to multiple antibacterials.[95] Cross-resistance to several antibacterials may also occur when a resistance mechanism encoded by a single gene conveys resistance to more than one antibacterial compound.[95]
Antibacterial-resistant strains and species, sometimes referred to as "superbugs", now contribute to the emergence of diseases that were, for a while, well controlled. For example, emergent bacterial strains causing tuberculosis that are resistant to previously effective antibacterial treatments pose many therapeutic challenges. Every year, nearly half a million new cases of multidrug-resistant tuberculosis (MDR-TB) are estimated to occur worldwide.[96] For example, NDM-1 is a newly identified enzyme conveying bacterial resistance to a broad range of beta-lactam antibacterials.[97] The United Kingdom's Health Protection Agency has stated that "most isolates with NDM-1 enzyme are resistant to all standard intravenous antibiotics for treatment of severe infections."[98] On 26 May 2016, an E. coli "superbug" was identified in the United States resistant to colistin, "the last line of defence" antibiotic.[99][100]In recent years, even anaerobic bacteria, historically considered less concerning in terms of resistance, have demonstrated high rates of antibiotic resistance, particularly Bacteroides, for which resistance rates to penicillin have been reported to exceed 90%.[101]
Misuse
[edit]
Per The ICU Book "The first rule of antibiotics is to try not to use them, and the second rule is try not to use too many of them."[102] Inappropriate antibiotic treatment and overuse of antibiotics have contributed to the emergence of antibiotic-resistant bacteria. However, potential harm from antibiotics extends beyond selection of antimicrobial resistance and their overuse is associated with adverse effects for patients themselves, seen most clearly in critically ill patients in Intensive care units.[103] Self-prescribing of antibiotics is an example of misuse.[104] Many antibiotics are frequently prescribed to treat symptoms or diseases that do not respond to antibiotics or that are likely to resolve without treatment. Also, incorrect or suboptimal antibiotics are prescribed for certain bacterial infections.[43][104] The overuse of antibiotics, like penicillin and erythromycin, has been associated with emerging antibiotic resistance since the 1950s.[84][105] Widespread usage of antibiotics in hospitals has also been associated with increases in bacterial strains and species that no longer respond to treatment with the most common antibiotics.[105]
Common forms of antibiotic misuse include excessive use of prophylactic antibiotics in travelers and failure of medical professionals to prescribe the correct dosage of antibiotics on the basis of the patient's weight and history of prior use. Other forms of misuse include failure to take the entire prescribed course of the antibiotic, incorrect dosage and administration, or failure to rest for sufficient recovery. Inappropriate antibiotic treatment, for example, is their prescription to treat viral infections such as the common cold. One study on respiratory tract infections found "physicians were more likely to prescribe antibiotics to patients who appeared to expect them".[106] Multifactorial interventions aimed at both physicians and patients can reduce inappropriate prescription of antibiotics.[107][108] The lack of rapid point of care diagnostic tests, particularly in resource-limited settings is considered one of the drivers of antibiotic misuse.[109]
Several organizations concerned with antimicrobial resistance are lobbying to eliminate the unnecessary use of antibiotics.[104] The issues of misuse and overuse of antibiotics have been addressed by the formation of the US Interagency Task Force on Antimicrobial Resistance. This task force aims to actively address antimicrobial resistance, and is coordinated by the US Centers for Disease Control and Prevention, the Food and Drug Administration (FDA), and the National Institutes of Health, as well as other US agencies.[110] A non-governmental organization campaign group is Keep Antibiotics Working.[111] In France, an "Antibiotics are not automatic" government campaign started in 2002 and led to a marked reduction of unnecessary antibiotic prescriptions, especially in children.[112]
The emergence of antibiotic resistance has prompted restrictions on their use in the UK in 1970 (Swann report 1969), and the European Union has banned the use of antibiotics as growth-promotional agents since 2003.[113] Moreover, several organizations (including the World Health Organization, the National Academy of Sciences, and the U.S. Food and Drug Administration) have advocated restricting the amount of antibiotic use in food animal production.[114][unreliable medical source?] However, commonly there are delays in regulatory and legislative actions to limit the use of antibiotics, attributable partly to resistance against such regulation by industries using or selling antibiotics, and to the time required for research to test causal links between their use and resistance to them. Two federal bills (S.742[115] and H.R. 2562[116]) aimed at phasing out nontherapeutic use of antibiotics in US food animals were proposed, but have not passed.[115][116] These bills were endorsed by public health and medical organizations, including the American Holistic Nurses' Association, the American Medical Association, and the American Public Health Association.[117][118]
Despite pledges by food companies and restaurants to reduce or eliminate meat that comes from animals treated with antibiotics, the purchase of antibiotics for use on farm animals has been increasing every year.[119]
There has been extensive use of antibiotics in animal husbandry. In the United States, the question of emergence of antibiotic-resistant bacterial strains due to use of antibiotics in livestock was raised by the US Food and Drug Administration (FDA) in 1977. In March 2012, the United States District Court for the Southern District of New York, ruling in an action brought by the Natural Resources Defense Council and others, ordered the FDA to revoke approvals for the use of antibiotics in livestock, which violated FDA regulations.[120]
Studies have shown that common misconceptions about the effectiveness and necessity of antibiotics to treat common mild illnesses contribute to their overuse.[121][122]
Other forms of antibiotic associated harm include anaphylaxis, drug toxicity most notably kidney and liver damage, and super-infections with resistant organisms. Antibiotics are also known to affect mitochondrial function,[123] and this may contribute to the bioenergetic failure of immune cells seen in sepsis.[124] They also alter the microbiome of the gut, lungs and skin,[125] which may be associated with adverse effects such as Clostridium difficile associated diarrhoea. Whilst antibiotics can clearly be lifesaving in patients with bacterial infections, their overuse, especially in patients where infections are hard to diagnose, can lead to harm via multiple mechanisms.[103]
History
[edit]Before the early 20th century, treatments for infections were based primarily on medicinal folklore. Mixtures with antimicrobial properties that were used in treatments of infections were described over 2,000 years ago.[126] Many ancient cultures, including the ancient Egyptians and ancient Greeks, used specially selected mold and plant materials to treat infections.[127][128] Nubian mummies studied in the 1990s were found to contain significant levels of tetracycline. The beer brewed at that time was conjectured to have been the source.[129]
The use of antibiotics in modern medicine began with the discovery of synthetic antibiotics derived from dyes.[8][130][11][131][9]Various Essential oils have been shown to have anti-microbial properties.[132] Along with this, the plants from which these oils have been derived from can be used as niche anti-microbial agents.[133]
Synthetic antibiotics derived from dyes
[edit]
Synthetic antibiotic chemotherapy as a science and development of antibacterials began in Germany with Paul Ehrlich in the late 1880s.[8] Ehrlich noted certain dyes would colour human, animal, or bacterial cells, whereas others did not. He then proposed the idea that it might be possible to create chemicals that would act as a selective drug that would bind to and kill bacteria without harming the human host. After screening hundreds of dyes against various organisms, in 1907, he discovered a medicinally useful drug, the first synthetic antibacterial organoarsenic compound salvarsan,[8][130][11] now called arsphenamine.

This heralded the era of antibacterial treatment that was begun with the discovery of a series of arsenic-derived synthetic antibiotics by both Alfred Bertheim and Ehrlich in 1907.[131][9] Ehrlich and Bertheim had experimented with various chemicals derived from dyes to treat trypanosomiasis in mice and spirochaeta infection in rabbits. While their early compounds were too toxic, Ehrlich and Sahachiro Hata, a Japanese bacteriologist working with Ehrlich in the quest for a drug to treat syphilis, achieved success with the 606th compound in their series of experiments. In 1910, Ehrlich and Hata announced their discovery, which they called drug "606", at the Congress for Internal Medicine at Wiesbaden.[134] The Hoechst company began to market the compound toward the end of 1910 under the name Salvarsan, now known as arsphenamine.[134] The drug was used to treat syphilis in the first half of the 20th century. In 1908, Ehrlich received the Nobel Prize in Physiology or Medicine for his contributions to immunology.[135] Hata was nominated for the Nobel Prize in Chemistry in 1911 and for the Nobel Prize in Physiology or Medicine in 1912 and 1913.[136]
The first sulfonamide and the first systemically active antibacterial drug, Prontosil, was developed by a research team led by Gerhard Domagk in 1932 or 1933 at the Bayer Laboratories of the IG Farben conglomerate in Germany,[9][10][11] for which Domagk received the 1939 Nobel Prize in Physiology or Medicine.[137] Sulfanilamide, the active drug of Prontosil, was not patentable as it had already been in use in the dye industry for some years.[10] Prontosil had a relatively broad effect against Gram-positive cocci, but not against enterobacteria. Research was stimulated apace by its success. The discovery and development of this sulfonamide drug opened the era of antibacterials.[138][139]
Penicillin and other natural antibiotics
[edit]
Observations about the growth of some microorganisms inhibiting the growth of other microorganisms have been reported since the late 19th century. These observations of antibiosis between microorganisms led to the discovery of natural antibacterials. Louis Pasteur observed, "if we could intervene in the antagonism observed between some bacteria, it would offer perhaps the greatest hopes for therapeutics".[140]
In 1874, physician Sir William Roberts noted that cultures of the mould Penicillium glaucum that is used in the making of some types of blue cheese did not display bacterial contamination.[141]
In 1895 Vincenzo Tiberio, Italian physician, published a paper on the antibacterial power of some extracts of mold.[142]
In 1897, doctoral student Ernest Duchesne submitted a dissertation, "Contribution à l'étude de la concurrence vitale chez les micro-organismes: antagonisme entre les moisissures et les microbes" (Contribution to the study of vital competition in micro-organisms: antagonism between moulds and microbes),[143] the first known scholarly work to consider the therapeutic capabilities of moulds resulting from their anti-microbial activity. In his thesis, Duchesne proposed that bacteria and moulds engage in a perpetual battle for survival. Duchesne observed that E. coli was eliminated by Penicillium glaucum when they were both grown in the same culture. He also observed that when he inoculated laboratory animals with lethal doses of typhoid bacilli together with Penicillium glaucum, the animals did not contract typhoid. Duchesne's army service after getting his degree prevented him from doing any further research.[144] Duchesne died of tuberculosis, a disease now treated by antibiotics.[144]
In 1928, Sir Alexander Fleming postulated the existence of penicillin, a molecule produced by certain moulds that kills or stops the growth of certain kinds of bacteria. Fleming was working on a culture of disease-causing bacteria when he noticed the spores of a green mold, Penicillium rubens,[145] in one of his culture plates. He observed that the presence of the mould killed or prevented the growth of the bacteria.[146] Fleming postulated that the mould must secrete an antibacterial substance, which he named penicillin in 1928. Fleming believed that its antibacterial properties could be exploited for chemotherapy. He initially characterised some of its biological properties, and attempted to use a crude preparation to treat some infections, but he was unable to pursue its further development without the aid of trained chemists.[147][148]
Ernst Chain, Howard Florey and Edward Abraham succeeded in purifying the first penicillin, penicillin G, in 1942, but it did not become widely available outside the Allied military before 1945. Later, Norman Heatley developed the back extraction technique for efficiently purifying penicillin in bulk. The chemical structure of penicillin was first proposed by Abraham in 1942[149] and then later confirmed by Dorothy Crowfoot Hodgkin in 1945. Purified penicillin displayed potent antibacterial activity against a wide range of bacteria and had low toxicity in humans. Furthermore, its activity was not inhibited by biological constituents such as pus, unlike the synthetic sulfonamides. (see below) The development of penicillin led to renewed interest in the search for antibiotic compounds with similar efficacy and safety.[150] For their successful development of penicillin, which Fleming had accidentally discovered but could not develop himself, as a therapeutic drug, Chain and Florey shared the 1945 Nobel Prize in Medicine with Fleming.[151]
Florey credited René Dubos with pioneering the approach of deliberately and systematically searching for antibacterial compounds, which had led to the discovery of gramicidin and had revived Florey's research in penicillin.[152] In 1939, coinciding with the start of World War II, Dubos had reported the discovery of the first naturally derived antibiotic, tyrothricin, a compound of 20% gramicidin and 80% tyrocidine, from Bacillus brevis. It was one of the first commercially manufactured antibiotics and was very effective in treating wounds and ulcers during World War II.[152] Gramicidin, however, could not be used systemically because of toxicity. Tyrocidine also proved too toxic for systemic usage. Research results obtained during that period were not shared between the Axis and the Allied powers during World War II and limited access during the Cold War.[153]
Late 20th century
[edit]During the mid-20th century, the number of new antibiotic substances introduced for medical use increased significantly. From 1935 to 1968, 12 new classes were launched. However, after this, the number of new classes dropped markedly, with only two new classes introduced between 1969 and 2003.[154]
Antibiotic pipeline
[edit]Both the WHO and the Infectious Disease Society of America report that the weak antibiotic pipeline does not match bacteria's increasing ability to develop resistance.[155][156] The Infectious Disease Society of America report noted that the number of new antibiotics approved for marketing per year had been declining and identified seven antibiotics against the Gram-negative bacilli currently in phase 2 or phase 3 clinical trials. However, these drugs did not address the entire spectrum of resistance of Gram-negative bacilli.[157][158] According to the WHO fifty one new therapeutic entities - antibiotics (including combinations), are in phase 1-3 clinical trials as of May 2017.[155] Antibiotics targeting multidrug-resistant Gram-positive pathogens remains a high priority.[159][155]
A few antibiotics have received marketing authorization in the last seven years. The cephalosporin ceftaroline and the lipoglycopeptides oritavancin and telavancin have been approved for the treatment of acute bacterial skin and skin structure infection and community-acquired bacterial pneumonia.[160] The lipoglycopeptide dalbavancin and the oxazolidinone tedizolid has also been approved for use for the treatment of acute bacterial skin and skin structure infection. The first in a new class of narrow-spectrum macrocyclic antibiotics, fidaxomicin, has been approved for the treatment of C. difficile colitis.[160] New cephalosporin-lactamase inhibitor combinations also approved include ceftazidime-avibactam and ceftolozane-avibactam for complicated urinary tract infection and intra-abdominal infection.[160]
- Ceftolozane/tazobactam (CXA-201; CXA-101/tazobactam): Antipseudomonal cephalosporin/β-lactamase inhibitor combination (cell wall synthesis inhibitor). FDA approved on 19 December 2014.
- Ceftazidime/avibactam (ceftazidime/NXL104): antipseudomonal cephalosporin/β-lactamase inhibitor combination (cell wall synthesis inhibitor).[161] FDA approved on 25 February 2015.
- Ceftaroline/avibactam (CPT-avibactam; ceftaroline/NXL104): Anti-MRSA cephalosporin/ β-lactamase inhibitor combination (cell wall synthesis inhibitor).
- Cefiderocol: cephalosporin siderophore.[161] FDA approved on 14 November 2019.
- Imipenem/relebactam: carbapenem/ β-lactamase inhibitor combination (cell wall synthesis inhibitor).[161] FDA approved on 16 July 2019.
- Meropenem/vaborbactam: carbapenem/ β-lactamase inhibitor combination (cell wall synthesis inhibitor).[161] FDA approved on 29 August 2017.
- Delafloxacin: quinolone (inhibitor of DNA synthesis).[161] FDA approved on 19 June 2017.
- Plazomicin (ACHN-490): semi-synthetic aminoglycoside derivative (protein synthesis inhibitor).[161] FDA approved 25 June 2018.
- Eravacycline (TP-434): synthetic tetracycline derivative (protein synthesis inhibitor targeting bacterial ribosomes).[161] FDA approved on 27 August 2018.
- Omadacycline: semi-synthetic tetracycline derivative (protein synthesis inhibitor targeting bacterial ribosomes).[161] FDA approved on 2 October 2018.
- Lefamulin: pleuromutilin antibiotic.[161] FDA approved on 19 August 2019.
- Brilacidin (PMX-30063): peptide defense protein mimetic (cell membrane disruption). In phase 2.
- Zosurabalpin (RG-6006): lipopolysaccharide transport inhibitor. In phase 1.[162][163]
Possible improvements include clarification of clinical trial regulations by FDA. Furthermore, appropriate economic incentives could persuade pharmaceutical companies to invest in this endeavor.[158] In the US, the Antibiotic Development to Advance Patient Treatment (ADAPT) Act was introduced with the aim of fast tracking the drug development of antibiotics to combat the growing threat of 'superbugs'. Under this Act, FDA can approve antibiotics and antifungals treating life-threatening infections based on smaller clinical trials. The CDC will monitor the use of antibiotics and the emerging resistance, and publish the data. The FDA antibiotics labeling process, 'Susceptibility Test Interpretive Criteria for Microbial Organisms' or 'breakpoints', will provide accurate data to healthcare professionals.[164] According to Allan Coukell, senior director for health programs at The Pew Charitable Trusts, "By allowing drug developers to rely on smaller datasets, and clarifying FDA's authority to tolerate a higher level of uncertainty for these drugs when making a risk/benefit calculation, ADAPT would make the clinical trials more feasible."[165]
Replenishing the antibiotic pipeline and developing other new therapies
[edit]Because antibiotic-resistant bacterial strains continue to emerge and spread, there is a constant need to develop new antibacterial treatments. Current strategies include traditional chemistry-based approaches such as natural product-based drug discovery,[166][167] newer chemistry-based approaches such as drug design,[168][169] traditional biology-based approaches such as immunoglobulin therapy,[170][171] and experimental biology-based approaches such as phage therapy,[172][173] fecal microbiota transplants,[170][174] antisense RNA-based treatments,[170][171] and CRISPR-Cas9-based treatments.[170][171][175]
Natural product-based antibiotic discovery
[edit]Most of the antibiotics in current use are natural products or natural product derivatives,[167][176] and bacterial,[177][178] fungal,[166][179] plant[180][181][182][183] and animal[166][184] extracts are being screened in the search for new antibiotics. Organisms may be selected for testing based on ecological, ethnomedical, genomic, or historical rationales.[167] Medicinal plants, for example, are screened on the basis that they are used by traditional healers to prevent or cure infection and may therefore contain antibacterial compounds.[185][186] Also, soil bacteria are screened on the basis that, historically, they have been a very rich source of antibiotics (with 70 to 80% of antibiotics in current use derived from the actinomycetes).[167][187]
In addition to screening natural products for direct antibacterial activity, they are sometimes screened for the ability to suppress antibiotic resistance and antibiotic tolerance.[186][188] For example, some secondary metabolites inhibit drug efflux pumps, thereby increasing the concentration of antibiotic able to reach its cellular target and decreasing bacterial resistance to the antibiotic.[186][189] Natural products known to inhibit bacterial efflux pumps include the alkaloid lysergol,[190] the carotenoids capsanthin and capsorubin,[191] and the flavonoids rotenone and chrysin.[191] Other natural products, this time primary metabolites rather than secondary metabolites, have been shown to eradicate antibiotic tolerance. For example, glucose, mannitol, and fructose reduce antibiotic tolerance in Escherichia coli and Staphylococcus aureus, rendering them more susceptible to killing by aminoglycoside antibiotics.[188]
Natural products may be screened for the ability to suppress bacterial virulence factors too. Virulence factors are molecules, cellular structures and regulatory systems that enable bacteria to evade the body's immune defenses (e.g. urease, staphyloxanthin), move towards, attach to, and/or invade human cells (e.g. type IV pili, adhesins, internalins), coordinate the activation of virulence genes (e.g. quorum sensing), and cause disease (e.g. exotoxins).[170][183][192][193][194] Examples of natural products with antivirulence activity include the flavonoid epigallocatechin gallate (which inhibits listeriolysin O),[192] the quinone tetrangomycin (which inhibits staphyloxanthin),[193] and the sesquiterpene zerumbone (which inhibits Acinetobacter baumannii motility).[195]
Immunoglobulin therapy
[edit]Антитела ( противостолбнячный иммуноглобулин ) используются для лечения и профилактики столбняка с 1910-х годов. [196] and this approach continues to be a useful way of controlling bacterial diseases. The monoclonal antibody bezlotoxumab, for example, has been approved by the US FDA and EMA for recurrent Clostridium difficile infection, and other monoclonal antibodies are in development (e.g. AR-301 for the adjunctive treatment of S. aureus ventilator-associated pneumonia). Antibody treatments act by binding to and neutralizing bacterial exotoxins and other virulence factors.[170][171]
Фаготерапия
[ редактировать ]
Фаготерапия исследуется как метод лечения устойчивых к антибиотикам штаммов бактерий. Фаготерапия предполагает заражение бактериальных возбудителей вирусами . Бактериофаги организма-хозяина и их диапазоны хозяев чрезвычайно специфичны для определенных бактерий, поэтому, в отличие от антибиотиков, они не нарушают микробиоту кишечника . [198] Бактериофаги, также известные как фаги, заражают и убивают бактерии преимущественно во время литических циклов. [198] [197] Фаги вставляют свою ДНК в бактерию, где она транскрибируется и используется для создания новых фагов, после чего клетка лизируется, высвобождая новый фаг, способный заражать и уничтожать другие бактерии того же штамма. [197] Высокая специфичность фага защищает «хорошие» бактерии от разрушения. [199]
Однако существуют и некоторые недостатки использования бактериофагов. Бактериофаги могут содержать факторы вирулентности или токсичные гены в своих геномах, и перед использованием может быть разумно идентифицировать гены, сходные с известными факторами вирулентности или токсинами, путем геномного секвенирования. Кроме того, пероральное и внутривенное введение фагов для ликвидации бактериальных инфекций представляет гораздо более высокий риск безопасности, чем местное применение. Кроме того, существует дополнительная обеспокоенность по поводу неопределенных иммунных реакций на эти большие антигенные коктейли. [ нужна ссылка ]
Существуют значительные нормативные препятствия, которые необходимо устранить для такого лечения. [198] Несмотря на многочисленные проблемы, использование бактериофагов в качестве замены противомикробных препаратов против возбудителей МЛУ, которые больше не реагируют на обычные антибиотики, остается привлекательным вариантом. [198] [200]
Трансплантация фекальной микробиоты
[ редактировать ]
Трансплантация фекальной микробиоты предполагает передачу всей кишечной микробиоты от здорового человека-донора (в виде стула ) пациентам с C. difficile инфекцией . Хотя эта процедура не была официально одобрена FDA США , ее использование разрешено при некоторых условиях у пациентов с устойчивой к антибиотикам инфекцией C. difficile . Показатели излечения составляют около 90%, и ведется работа по созданию банков стула , стандартизированных продуктов и методов перорального приема . [170] Трансплантация фекальной микробиоты в последнее время также стала использоваться при воспалительных заболеваниях кишечника. [201]
Лечение на основе антисмысловой РНК
[ редактировать ]Лечение на основе антисмысловой РНК (также известное как терапия, подавляющая гены) включает (а) идентификацию бактериальных генов , которые кодируют важные белки (например, Pseudomonas aeruginosa гены acpP , lpxC и rpsJ ), (b) синтез одноцепочечной РНК , комплементарной мРНК, кодирующую эти важные белки, и (в) доставку одноцепочечной РНК к месту инфекции с использованием проникающих в клетку пептидов или липосом . Затем антисмысловая РНК гибридизуется с бактериальной мРНК и блокирует ее трансляцию в незаменимый белок. Было показано, что лечение на основе антисмысловой РНК эффективно на in vivo моделях вызванной P. aeruginosa, пневмонии, . [170] [171]
Помимо подавления важных бактериальных генов, антисмысловая РНК может использоваться для подавления бактериальных генов, ответственных за устойчивость к антибиотикам. [170] [171] Например, была разработана антисмысловая РНК, которая подавляет S. aureus ген mecA (ген, который кодирует модифицированный пенициллин-связывающий белок 2a и делает S. aureus штаммы устойчивыми к метициллину ). Было показано, что антисмысловая РНК, нацеленная на мРНК mecA , восстанавливает чувствительность метициллин-резистентных стафилококков к оксациллину в исследованиях как in vitro , так и in vivo . [171]
Лечение на основе CRISPR-Cas9
[ редактировать ]В начале 2000-х годов была открыта система, позволяющая бактериям защищаться от вторгающихся вирусов. Система, известная как CRISPR-Cas9, состоит из (а) фермента, разрушающего ДНК ( нуклеазы Cas9 ) и (б) последовательностей ДНК ранее встречавшихся вирусных захватчиков ( CRISPR ). Эти последовательности вирусной ДНК позволяют нуклеазе нацеливаться на чужеродную (вирусную), а не собственную (бактериальную) ДНК. [202]
Хотя функция CRISPR-Cas9 в природе заключается в защите бактерий, последовательности ДНК в компоненте системы CRISPR могут быть модифицированы таким образом, чтобы нуклеаза Cas9 была нацелена на гены устойчивости бактерий или гены бактериальной вирулентности вместо вирусных генов. Модифицированную систему CRISPR-Cas9 затем можно применять к бактериальным патогенам с помощью плазмид или бактериофагов. [170] [171] Этот подход успешно использовался для подавления устойчивости к антибиотикам и снижения вирулентности энтерогеморрагической кишечной палочки на in vivo . модели инфекции [171]
Снижение давления отбора в отношении устойчивости к антибиотикам
[ редактировать ]
Помимо разработки новых антибактериальных методов лечения, важно снизить давление отбора , способствующее возникновению и распространению устойчивости к антибиотикам . Стратегии достижения этой цели включают в себя хорошо зарекомендовавшие себя меры инфекционного контроля, такие как улучшение инфраструктуры (например, менее переполненное жилье), [204] [205] улучшение санитарных условий (например, безопасная питьевая вода и продукты питания) [206] [207] и разработка вакцин, [173] другие подходы, такие как рациональное использование антибиотиков , [208] [209] и экспериментальные подходы, такие как использование пребиотиков и пробиотиков для предотвращения инфекции. [210] [211] [212] [213] Предлагается циклический прием антибиотиков, при котором врачи чередуют антибиотики для лечения микробных заболеваний, но недавние исследования показали, что такие стратегии неэффективны против устойчивости к антибиотикам. [214] [215]
Вакцина
[ редактировать ]Вакцины основаны на иммунной модуляции или усилении. Вакцинация либо возбуждает, либо усиливает иммунную способность хозяина противостоять инфекции, что приводит к активации макрофагов , выработке антител , воспалению и другим классическим иммунным реакциям. Антибактериальные вакцины ответственны за резкое сокращение глобальных бактериальных заболеваний. [216] Вакцины, изготовленные из аттенуированных цельных клеток или лизатов, в значительной степени заменены менее реактогенными, бесклеточными вакцинами, состоящими из очищенных компонентов, в том числе капсульных полисахаридов и их конъюгатов, с белками-носителями, а также инактивированных токсинов (токсоидов) и белков. [217]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с «Антибиотики» . Национальная служба здравоохранения. 5 июня 2014 года. Архивировано из оригинала 18 января 2015 года . Проверено 17 января 2015 г.
- ^ «Информационный бюллетень для экспертов» . Европейский центр профилактики и контроля заболеваний. Архивировано из оригинала 21 декабря 2014 года . Проверено 21 декабря 2014 г.
- ^ Например, метронидазол : «Метронидазол» . Американское общество фармацевтов системы здравоохранения. Архивировано из оригинала 6 сентября 2015 года . Проверено 31 июля 2015 г.
- ^ Перейти обратно: а б Химический анализ остатков антибиотиков в пищевых продуктах . John Wiley & Sons, Inc., 2012. стр. 1–60 . ISBN 978-1-4496-1459-1 .
- ^ «Почему антибиотики нельзя использовать для лечения простуды или гриппа» . www.health.qld.gov.au . 6 мая 2017 г. Архивировано из оригинала 9 августа 2020 г. . Проверено 13 мая 2020 г.
- ^ «Общая информация: антибиотики» . Альянс за разумное использование антибиотиков . Архивировано из оригинала 14 декабря 2014 года . Проверено 21 декабря 2014 г.
- ^ Гулд К. (март 2016 г.). «Антибиотики: от предыстории до наших дней» . Журнал антимикробной химиотерапии . 71 (3): 572–575. дои : 10.1093/jac/dkv484 . ISSN 0305-7453 . ПМИД 26851273 .
- ^ Перейти обратно: а б с д и ж Кальдерон CB, Сабундайо BP (2007). Классификации противомикробных препаратов: лекарства от насекомых. В Швальбе Р., Стил-Мур Л., Гудвин АС. Протоколы тестирования чувствительности к противомикробным препаратам. ЦРК Пресс. Группа Тейлор и Фрэнсис. ISBN 978-0-8247-4100-6
- ^ Перейти обратно: а б с д Гудман Л.С. , Гилман А. (1941). Фармакологические основы терапии . Нью-Йорк: Макмиллан.
- ^ Перейти обратно: а б с Аминов Р.И. (2010). «Краткая история эры антибиотиков: извлеченные уроки и задачи на будущее» . Границы микробиологии . 1 : 134. дои : 10.3389/fmicb.2010.00134 . ПМК 3109405 . ПМИД 21687759 .
- ^ Перейти обратно: а б с д Бош Ф, Росич Л (2008). «Вклад Пауля Эрлиха в фармакологию: дань уважения столетнему юбилею его Нобелевской премии» . Фармакология . 82 (3): 171–9. дои : 10.1159/000149583 . ПМЦ 2790789 . ПМИД 18679046 .
- ^ Лаксминараян Р., Дузе А., Ваттал С., Заиди А.К., Вертхайм Х.Ф., Сумпрадит Н. и др. (декабрь 2013 г.). «Устойчивость к антибиотикам – необходимость глобальных решений» . «Ланцет». Инфекционные болезни . 13 (12): 1057–98. дои : 10.1016/S1473-3099(13)70318-9 . hdl : 10161/8996 . ПМИД 24252483 . S2CID 19489131 . Архивировано из оригинала 10 июня 2020 года . Проверено 25 августа 2020 г.
- ^ Брукс М. (16 ноября 2015 г.). «Общественность в замешательстве по поводу устойчивости к антибиотикам, говорит ВОЗ» . Многопрофильность Medscape . Архивировано из оригинала 20 ноября 2015 года . Проверено 21 ноября 2015 г.
- ^ Гулд К. (март 2016 г.). «Антибиотики: от предыстории до наших дней» . Журнал антимикробной химиотерапии . 71 (3): 572–5. дои : 10.1093/jac/dkv484 . ПМИД 26851273 .
- ^ Гуалерци КО, Брэнди Л., Фаббретти А., Пон КЛ (4 декабря 2013 г.). Антибиотики: мишени, механизмы и устойчивость . Джон Уайли и сыновья. п. 1. ISBN 978-3-527-33305-9 .
- ^ Устойчивость к противомикробным препаратам: глобальный отчет о эпиднадзоре (PDF) . Всемирная организация здравоохранения. Апрель 2014 г. ISBN. 978-92-4-156474-8 . Архивировано (PDF) из оригинала 6 июня 2016 года . Проверено 13 июня 2016 г.
- ^ Мюррей С.Дж., Икута К.С., Шарара Ф., Светчински Л., Оукс Игл Г., Грей А. и др. (февраль 2022 г.). «Глобальное бремя бактериальной устойчивости к противомикробным препаратам в 2019 году: систематический анализ» . Ланцет . 399 (10325): 629–655. дои : 10.1016/S0140-6736(21) 02724-0 ПМЦ 8841637 . ПМИД 35065702 .
- ^ Перейти обратно: а б с Саксена С (2015). «Глава 8: Микробы в производстве тонких химикатов (антибиотики, лекарства, витамины и аминокислоты)». Прикладная микробиология . Спрингер Индия. стр. 83–120. дои : 10.1007/978-81-322-2259-0 . ISBN 978-81-322-2258-3 . S2CID 36527513 .
- ^ Фостер В., Рауль А. (декабрь 1974 г.). «Ранние описания антибиотиков» . Журнал Королевского колледжа врачей общей практики . 24 (149): 889–894. ПМК 2157443 . ПМИД 4618289 .
- ^ Ландсберг Х (1949). «Прелюдия к открытию пенициллина». Исида . 40 (3): 225–7. дои : 10.1086/349043 . S2CID 143223535 .
- ^ Ваксман С.А. (1947). «Что такое антибиотик или антибиотическое вещество?». Микология . 39 (5): 565–569. дои : 10.1080/00275514.1947.12017635 . ПМИД 20264541 .
- ^ Ваксман С.А. (1947). «Что такое антибиотик или антибиотическое вещество?». Микология . 39 (5): 565–9. дои : 10.2307/3755196 . JSTOR 3755196 . ПМИД 20264541 .
- ^ Ученый Э.М., Пратт В.Б. (2000). Противомикробные препараты . Издательство Оксфордского университета, США. стр. 3 . ISBN 978-0-19-512529-0 .
- ^ Дэвис Дж., Дэвис Д. (сентябрь 2010 г.). «Происхождение и эволюция устойчивости к антибиотикам» . Обзоры микробиологии и молекулярной биологии . 74 (3): 417–33. дои : 10.1128/MMBR.00016-10 . ПМЦ 2937522 . ПМИД 20805405 .
- ^ Лидделл Х.Г., Скотт Р. (ред.). «βιωτικός» . Греко-английский лексикон . Архивировано из оригинала 25 апреля 2023 года . Проверено 20 февраля 2021 г. - через проект Персей .
- ^ Лидделл Х.Г., Скотт Р. (ред.). «βίωσις» . Греко-английский лексикон . Архивировано из оригинала 25 февраля 2021 года . Проверено 20 февраля 2021 г. - через проект Персей .
- ^ Перейти обратно: а б «Часто задаваемые вопросы по антибиотикам» . Университет Макгилла, Канада. Архивировано из оригинала 16 февраля 2008 года . Проверено 17 февраля 2008 г.
- ^ Лидделл Х.Г., Скотт Р. (ред.). «βίος» . Греко-английский лексикон . Архивировано из оригинала 27 февраля 2021 года . Проверено 20 февраля 2021 г. - через проект Персей .
- ^ Лидделл Х.Г., Скотт Р. (ред.). «ἀντί» . Греко-английский лексикон . Архивировано из оригинала 10 октября 2012 года . Проверено 20 февраля 2021 г. - через проект Персей .
- ^ Лидделл Х.Г., Скотт Р. (ред.). «βακτηρία» . Греко-английский лексикон . Архивировано из оригинала 24 февраля 2021 года . Проверено 20 февраля 2021 г. - через проект Персей .
- ^ бактериальный. Архивировано 27 августа 2021 года в Wayback Machine , в Оксфордских словарях.
- ^ Перейти обратно: а б с Антибиотики в упрощенном виде . Издательство Джонс и Бартлетт. 2011. С. 15–17. ISBN 978-1-4496-1459-1 . Архивировано из оригинала 2 января 2024 года . Проверено 28 апреля 2024 г.
- ^ Перейти обратно: а б с д Лиха С., Террелл К.Л., Эдсон Р.С. (февраль 2011 г.). «Общие принципы антимикробной терапии» . Труды клиники Мэйо . 86 (2): 156–67. дои : 10.4065/mcp.2010.0639 . ПМК 3031442 . ПМИД 21282489 .
- ^ Роллинз К.Э., Варадхан К.К., Нил К.Р., Лобо Д.Н. (октябрь 2016 г.). «Антибиотики по сравнению с аппендэктомией для лечения неосложненного острого аппендицита: обновленный метаанализ рандомизированных контролируемых исследований». Всемирный журнал хирургии . 40 (10): 2305–18. дои : 10.1007/s00268-016-3561-7 . ПМИД 27199000 . S2CID 4802473 .
- ^ Флауэрс С.Р., Зайденфельд Дж., Боу Э.Дж., Картен С., Глисон С., Хоули Д.К. и др. (февраль 2013 г.). «Антимикробная профилактика и амбулаторное лечение лихорадки и нейтропении у взрослых, получающих лечение от злокачественных новообразований: рекомендации по клинической практике Американского общества клинической онкологии». Журнал клинической онкологии . 31 (6): 794–810. дои : 10.1200/JCO.2012.45.8661 . ПМИД 23319691 .
- ^ Bow EJ (июль 2013 г.). «Инфекция у онкологических больных с нейтропенией». Клиники интенсивной терапии . 29 (3): 411–41. дои : 10.1016/j.ccc.2013.03.002 . ПМИД 23830647 .
- ^ Сетхи Н.Дж., Сафи С., Коранг С.К., Хробьяртссон А., Скуг М., Глууд С. и др. (Кокрейновская кардиологическая группа) (февраль 2021 г.). «Антибиотики для вторичной профилактики ишемической болезни сердца» . Кокрановская база данных систематических обзоров . 2 (5): CD003610. дои : 10.1002/14651858.CD003610.pub4 . ПМК 8094925 . ПМИД 33704780 .
- ^ Пангилинан Р., Тайс А., Тиллотсон Г. (октябрь 2009 г.). «Местное лечение антибиотиками неосложненных инфекций кожи и структур кожи: обзор литературы». Экспертный обзор противоинфекционной терапии . 7 (8): 957–65. дои : 10.1586/eri.09.74 . ПМИД 19803705 . S2CID 207217730 .
- ^ Перейти обратно: а б Липский Б.А., Хоуи С. (ноябрь 2009 г.). «Местная противомикробная терапия при лечении хронических ран» . Клинические инфекционные болезни . 49 (10): 1541–9. дои : 10.1086/644732 . ПМИД 19842981 .
- ^ Хил К.Ф., Бэнкс Дж.Л., Леппер П.Д., Контопантелис Э., ван Дрил М.Л. (ноябрь 2016 г.). «Местные антибиотики для профилактики инфекции области хирургического вмешательства при ранах, заживающих первичным натяжением» . Кокрановская база данных систематических обзоров . 2016 (11): CD011426. дои : 10.1002/14651858.CD011426.pub2 . ПМК 6465080 . ПМИД 27819748 .
- ^ Хунг К.К., Лам Р.П., Ло Р.С., Тенни Дж.В., Ян М.Л., Тай М.К. и др. (декабрь 2018 г.). «Поперечное исследование по лечению сепсиса в отделениях неотложной помощи» . Гонконгский медицинский журнал = Сянган И Сюэ За Чжи . 24 (6): 571–578. дои : 10.12809/hkmj177149 . ПМИД 30429360 .
- ^ «Потребление антибиотиков в Великобритании вдвое превышает потребление в Нидерландах, говорится в докладе ВОЗ» . Фармацевтический журнал. 14 ноября 2018 г. Архивировано из оригинала 22 декабря 2018 г. Проверено 22 декабря 2018 г.
- ^ Перейти обратно: а б Слама Т.Г., Амин А., Брантон С.А., Файл ТМ, Милькович Г., Родволд К.А. и др. (июль 2005 г.). «Руководство для клиницистов по правильному и точному использованию антибиотиков: критерии Совета по соответствующей и рациональной антибиотикотерапии (CARAT)» . Американский медицинский журнал . 118 (7А): 1С–6С. doi : 10.1016/j.amjmed.2005.05.007 . ПМИД 15993671 .
- ^ Слама Т.Г., Амин А., Брантон С.А., Файл ТМ, Милькович Г., Родволд К.А. и др. (Совет по соответствующей рациональной антибиотикотерапии (CARAT)) (июль 2005 г.). «Руководство для клиницистов по правильному и точному использованию антибиотиков: критерии Совета по соответствующей и рациональной антибиотикотерапии (CARAT)» . Американский медицинский журнал . 118 (7А): 1С–6С. doi : 10.1016/j.amjmed.2005.05.007 . ПМИД 15993671 .
- ^ «Антибиотики – Побочные эффекты» . Выбор Национальной службы здравоохранения . Национальная служба здравоохранения (NHS), Великобритания. 6 мая 2014 года. Архивировано из оригинала 7 февраля 2016 года . Проверено 6 февраля 2016 г.
- ^ «Антибиотико-ассоциированная диарея – все, что вам следует знать» . Архивировано из оригинала 25 апреля 2015 года . Проверено 28 декабря 2014 г.
- ^ Роджерс Б., Кирли К., Маунси А. (март 2013 г.). «PURLs: прописать антибиотик? Соединить его с пробиотиками» . Журнал семейной практики . 62 (3): 148–50. ПМК 3601687 . ПМИД 23520586 .
- ^ Пиротта М.В., Гарланд С.М. (сентябрь 2006 г.). «Генитальные виды Candida обнаружены в образцах женщин в Мельбурне, Австралия, до и после лечения антибиотиками» . Журнал клинической микробиологии . 44 (9): 3213–7. дои : 10.1128/JCM.00218-06 . ПМК 1594690 . ПМИД 16954250 .
- ^ Льюис Т., Кук Дж. (1 января 2014 г.). «Фторхинолоны и тендинопатии: руководство для спортсменов и спортивных врачей и систематический обзор литературы» . Журнал спортивной подготовки . 49 (3): 422–7. дои : 10.4085/1062-6050-49.2.09 . ПМК 4080593 . ПМИД 24762232 .
- ^ Презант Т.Р., Агапян Й.В., Больман MC, Бу Х, Озтас С., Цю В.К. и др. (июль 1993 г.). «Мутация митохондриальной рибосомальной РНК, связанная как с глухотой, вызванной антибиотиками, так и с несиндромальной глухотой» . Природная генетика . 4 (3): 289–294. дои : 10.1038/ng0793-289 . ISSN 1546-1718 .
- ^ Марчант Дж. (март 2018 г.). «Когда антибиотики становятся токсичными» . Природа . 555 (7697): 431–433. Бибкод : 2018Natur.555..431M . дои : 10.1038/d41586-018-03267-5 . ПМИД 29565407 .
- ^ Ван X, Рю Д., Хауткупер Р.Х., Ауверкс Дж. (октябрь 2015 г.). «Использование и злоупотребление антибиотиками: угроза для митохондрий и хлоропластов, оказывающая влияние на исследования, здоровье и окружающую среду» . Биоэссе . 37 (10): 1045–53. doi : 10.1002/bies.201500071 . ПМК 4698130 . ПМИД 26347282 .
- ^ Перейти обратно: а б с д Андерсон К.К., Шварц, доктор медицинских наук, Лиу С.О. (январь 2013 г.). «Антибиотики и эффективность ОК». ЯАПА . 26 (1): 11. дои : 10.1097/01720610-201301000-00002 . ПМИД 23355994 .
- ^ Перейти обратно: а б с Уивер К., Глейзер А. (февраль 1999 г.). «Взаимодействие антибиотиков широкого спектра действия и комбинированных пероральных контрацептивов. Обзор литературы». Контрацепция . 59 (2): 71–8. дои : 10.1016/S0010-7824(99)00009-8 . ПМИД 10361620 .
- ^ Вайсберг Э. (май 1999 г.). «Взаимодействие между пероральными контрацептивами и противогрибковыми/антибактериальными средствами. Является ли результатом неудача контрацепции?». Клиническая фармакокинетика . 36 (5): 309–13. дои : 10.2165/00003088-199936050-00001 . ПМИД 10384856 . S2CID 25187892 .
- ^ Хасан Т. (март 1987 г.). «Фармакологические соображения для пациентов, принимающих пероральные контрацептивы». Студенческий журнал стоматологов Коннектикута . 7 :7–8. ПМИД 3155374 .
- ^ Орм М.Л., Back DJ (декабрь 1990 г.). «Факторы, влияющие на энтерогепатическую циркуляцию пероральных контрацептивных стероидов» . Американский журнал акушерства и гинекологии . 163 (6, часть 2): 2146–52. дои : 10.1016/0002-9378(90)90555-L . ПМИД 2256523 . Архивировано из оригинала 13 июля 2015 года . Проверено 11 марта 2009 г.
- ^ Лванга Дж., Мирс, Бингхэм Дж.С., Брэдбир К.С. (2008). «Смешиваются ли антибиотики и алкоголь? Мнения посетителей мочеполовой клиники». БМЖ . 337 : а2885. дои : 10.1136/bmj.a2885 . S2CID 58765542 .
- ^ «антибиотики и алкоголь» . Архивировано из оригинала 12 июня 2011 года. , Клиника Майо.
- ^ Перейти обратно: а б «Можно ли пить алкоголь во время приема антибиотиков?» . NHS Direct (электронная служба здравоохранения Великобритании). Архивировано из оригинала 24 октября 2010 года . Проверено 17 февраля 2008 г.
- ^ Мур А.А., Уайтман Э.Дж., Уорд К.Т. (март 2007 г.). «Риски комбинированного употребления алкоголя и лекарств пожилыми людьми» . Американский журнал гериатрической фармакотерапии . 5 (1): 64–74. doi : 10.1016/j.amjopharm.2007.03.006 . ПМК 4063202 . ПМИД 17608249 .
- ^ Стокли IH (2002). Взаимодействие Стокли с лекарствами (6-е изд.). Лондон: Фармацевтическая пресса. [ нужна страница ]
- ^ Перейти обратно: а б с Панки Г.А., Сабат Л.Д. (март 2004 г.). «Клиническая значимость бактериостатических и бактерицидных механизмов действия при лечении грамположительных бактериальных инфекций» . Клинические инфекционные болезни . 38 (6): 864–70. дои : 10.1086/381972 . ПМИД 14999632 .
- ^ Масцио К.Т., Олдер Дж.Д., Сильверман Дж.А. (декабрь 2007 г.). «Бактерицидное действие даптомицина в отношении стационарно-фазовых и неделящихся клеток золотистого стафилококка» . Антимикробные средства и химиотерапия . 51 (12): 4255–60. дои : 10.1128/AAC.00824-07 . ПМК 2167999 . ПМИД 17923487 .
- ^ Пельчар М.Дж., Чан Э.К., Криг Н.Р. (2010). «Взаимодействие хозяина и паразита; Неспецифическая устойчивость хозяина». Концепции и приложения микробиологии (6-е изд.). Нью-Йорк: МакГроу-Хилл. стр. 478–479.
- ^ Ри К.Ю., Гардинер Д.Ф. (сентябрь 2004 г.). «Клиническая значимость бактериостатической и бактерицидной активности при лечении грамположительных бактериальных инфекций» . Клинические инфекционные болезни . 39 (5): 755–6. дои : 10.1086/422881 . ПМИД 15356797 .
- ^ Виганд И., Хильперт К., Хэнкок Р.Э. (январь 2008 г.). «Методы разведения агара и бульона для определения минимальной ингибирующей концентрации (МИК) антимикробных веществ». Протоколы природы . 3 (2): 163–75. дои : 10.1038/nprot.2007.521 . ПМИД 18274517 . S2CID 3344950 .
- ^ Далхофф А., Эмброуз П.Г., Мутон Дж.В. (август 2009 г.). «Долгий путь от тестирования минимальной ингибирующей концентрации к клинически прогнозируемым контрольным точкам: детерминистический и вероятностный подходы к получению контрольных точек». Инфекция . 37 (4): 296–305. дои : 10.1007/s15010-009-7108-9 . ПМИД 19629383 . S2CID 20538901 .
- ^ Перейти обратно: а б с д Окампо П.С., Лазар В., Папп Б., Арнольдини М., Абель цур Виш П., Буса-Фекете Р. и др. (август 2014 г.). «Преобладает антагонизм между бактериостатическими и бактерицидными антибиотиками» . Антимикробные средства и химиотерапия . 58 (8): 4573–82. дои : 10.1128/AAC.02463-14 . ПМК 4135978 . ПМИД 24867991 .
- ^ Перейти обратно: а б Болленбах Т. (октябрь 2015 г.). «Противомикробные взаимодействия: механизмы и последствия для открытия лекарств и эволюции устойчивости» . Современное мнение в микробиологии . 27 : 1–9. дои : 10.1016/j.mib.2015.05.008 . ПМИД 26042389 .
- ^ Антонелло Р.М., Принсипи Л., Мараоло А.Е., Виаджи В., Пол Р., Фаббиани М. и др. (август 2020 г.). «Фосфомицин как лекарственный препарат-партнер для лечения системных инфекций. Систематический обзор его синергических свойств на основе исследований in vitro и in vivo» . Антибиотики . 9 (8): 500. doi : 10.3390/antibiotics9080500 . ПМК 7460049 . ПМИД 32785114 .
- ^ «антагонизм» . Архивировано из оригинала 26 августа 2014 года . Проверено 25 августа 2014 г.
- ^ Дроз С.М., Бономо Р.А. (январь 2010 г.). «Три десятилетия ингибиторов бета-лактамаз» . Обзоры клинической микробиологии . 23 (1): 160–201. дои : 10.1128/CMR.00037-09 . ПМК 2806661 . ПМИД 20065329 .
- ^ Финберг Р.В., Мёллеринг Р.К., Талли Ф.П., Крейг В.А., Пэнки Г.А., Деллинджер Е.П. и др. (ноябрь 2004 г.). «Значение бактерицидных препаратов: будущие направления в области инфекционных болезней» . Клинические инфекционные болезни . 39 (9): 1314–20. дои : 10.1086/425009 . ПМИД 15494908 .
- ^ Кунья Б.А. (2009). Основы антибиотиков . Джонс и Бартлетт Обучение. п. 180. ИСБН 978-0-7637-7219-2 .
- ^ Шривастава А., Талауэ М., Лю С., Деген Д., Эбрайт Р.Ю., Синева Е. и др. (октябрь 2011 г.). «Новая мишень для ингибирования бактериальной РНК-полимеразы: «область переключения» » . Современное мнение в микробиологии . 14 (5): 532–43. дои : 10.1016/j.mib.2011.07.030 . ПМК 3196380 . ПМИД 21862392 .
- ^ Перейти обратно: а б Нуссбаум Ф., Брэндс М., Хинцен Б., Вейганд С., Хабих Д. (август 2006 г.). «Антибактериальные натуральные продукты в медицинской химии - исход или возрождение?». Прикладная химия . 45 (31): 5072–129. дои : 10.1002/anie.200600350 . ПМИД 16881035 .
- ^ Догерти Т.Дж., Пуччи М.Дж. (2011). Открытие и разработка антибиотиков . Спрингер. п. 800. ISBN 978-1-4614-1400-1 . Архивировано из оригинала 2 января 2024 года . Проверено 28 апреля 2024 г.
- ^ Федоренко В., Жениллу О., Хорбаль Л., Марконе Г.Л., Маринелли Ф., Пайтан Ю. и др. (2015). «Антибактериальные открытия и разработки: от гена к продукту и обратно» . БиоМед Исследования Интернэшнл . 2015 : 591349. doi : 10.1155/2015/591349 . ПМЦ 4538407 . ПМИД 26339625 .
- ^ Образец I (26 марта 2018 г.). «Призывы к ограничению использования антибиотиков после того, как исследование показало рост на 65% во всем мире» . Хранитель . Архивировано из оригинала 8 апреля 2018 года . Проверено 28 марта 2018 г.
- ^ Сингх Дж., Рана А., Смрити (28 мая 2024 г.). «Расшифровка устойчивости к противомикробным препаратам: раскрытие молекулярных механизмов и целевые стратегии» . Архив микробиологии . 206 (6): 280. дои : 10.1007/s00203-024-03998-2 . ISSN 1432-072X .
- ^ Леви С.Б. (октябрь 1994 г.). «Балансирование уравнения лекарственной устойчивости». Тенденции в микробиологии . 2 (10): 341–2. дои : 10.1016/0966-842X(94)90607-6 . ПМИД 7850197 .
- ^ Лурия SE, Дельбрюк М (ноябрь 1943 г.). «Мутации бактерий от чувствительности к вирусам до устойчивости к вирусам» . Генетика . 28 (6): 491–511. дои : 10.1093/генетика/28.6.491 . ПМК 1209226 . ПМИД 17247100 . Архивировано из оригинала 11 сентября 2009 года . Проверено 3 февраля 2009 г.
- ^ Перейти обратно: а б Пирсон С. (28 февраля 2007 г.). «Быстрорастущая проблема устойчивости к антибиотикам во всем мире» . Голос Америки. Архивировано из оригинала 2 декабря 2008 года . Проверено 29 декабря 2008 г.
- ^ Топп Э., Чепмен Р., Деверс-Ламрани М., Хартманн А., Марти Р., Мартин-Лоран Ф. и др. (2013). «Ускоренная биодеградация ветеринарных антибиотиков в сельскохозяйственной почве после длительного воздействия и выделение вещества, разлагающего сульфаметазин» . Журнал качества окружающей среды . 42 (1): 173–8. дои : 10.2134/jeq2012.0162 . ПМИД 23673752 . Архивировано из оригинала 12 декабря 2013 года . Проверено 22 ноября 2013 г.
- ^ Перейти обратно: а б с Витте В. (сентябрь 2004 г.). «Международное распространение устойчивых к антибиотикам штаммов бактериальных возбудителей». Инфекция, генетика и эволюция . 4 (3): 187–91. Бибкод : 2004InfGE...4..187W . дои : 10.1016/j.meegid.2003.12.005 . ПМИД 15450197 .
- ^ Дайер Б.Д. (2003). «Глава 9, Патогены» . Полевое руководство по бактериям . Издательство Корнельского университета. ISBN 978-0-8014-8854-2 .
- ^ Андерссон Д.И. (октябрь 2006 г.). «Биологическая цена мутационной устойчивости к антибиотикам: какие-нибудь практические выводы?». Современное мнение в микробиологии . 9 (5): 461–5. дои : 10.1016/j.mib.2006.07.002 . ПМИД 16890008 .
- ^ Д'Коста В.М., Кинг С.Э., Калан Л., Морар М., Сунг В.В., Шварц С. и др. (август 2011 г.). «Устойчивость к антибиотикам имеет древнюю историю». Природа . 477 (7365): 457–61. Бибкод : 2011Natur.477..457D . дои : 10.1038/nature10388 . ПМИД 21881561 . S2CID 4415610 .
- ^ Гладки А., Качановский С., Щесны П., Зеленкевич П. (февраль 2013 г.). «Скорость эволюции мишеней для антибактериальных препаратов» . БМК Биоинформатика . 14 (1): 36. дои : 10.1186/1471-2105-14-36 . ПМЦ 3598507 . ПМИД 23374913 .
- ^ Перейти обратно: а б Алекшун М.Н., Леви С.Б. (март 2007 г.). «Молекулярные механизмы множественной лекарственной устойчивости антибактериальных препаратов» . Клетка . 128 (6): 1037–50. дои : 10.1016/j.cell.2007.03.004 . ПМИД 17382878 . S2CID 18343252 .
- ^ Павловски А.С., Ван В., Котева К., Бартон Х.А., МакАртур А.Г., Райт Г.Д. (декабрь 2016 г.). «Разнообразный внутренний антибиотикорезистом из пещерной бактерии» . Природные коммуникации . 7 : 13803. Бибкод : 2016NatCo...713803P . дои : 10.1038/ncomms13803 . ПМК 5155152 . ПМИД 27929110 .
- ^ Маршалл К.Г., Лессард И.А., Парк И., Райт Г.Д. (сентябрь 1998 г.). «Гены устойчивости к гликопептидным антибиотикам в организмах, продуцирующих гликопептиды» . Антимикробные средства и химиотерапия . 42 (9): 2215–20. дои : 10.1128/AAC.42.9.2215 . ПМЦ 105782 . ПМИД 9736537 .
- ^ Никайдо Х (февраль 2009 г.). «Множественная лекарственная устойчивость бактерий» . Ежегодный обзор биохимии . 78 (1): 119–46. doi : 10.1146/annurev.biochem.78.082907.145923 . ПМЦ 2839888 . ПМИД 19231985 .
- ^ Перейти обратно: а б с Бейкер-Остин С., Райт М.С., Степанаускас Р., МакАртур Дж.В. (апрель 2006 г.). «Совместный выбор устойчивости к антибиотикам и металлам». Тенденции в микробиологии . 14 (4): 176–82. дои : 10.1016/j.tim.2006.02.006 . ПМИД 16537105 .
- ^ «Министры здравоохранения должны ускорить усилия по борьбе с лекарственно-устойчивым туберкулезом» . Всемирная организация здравоохранения (ВОЗ).
- ^ Бозли С. (12 августа 2010 г.). «Готовы ли вы к миру без антибиотиков?» . Хранитель . Лондон. Архивировано из оригинала 30 ноября 2010 года.
- ^ «Мультирезистентные больничные бактерии связаны с Индией и Пакистаном» . Отчет об охране здоровья . Агентство по охране здоровья. 3 июля 2009 г. Архивировано из оригинала 14 июля 2014 г. Проверено 16 августа 2010 г.
- ^ МакГанн П., Снесруд Э., Мэйбанк Р., Кори Б., Онг А.С., Клиффорд Р. и др. (июль 2016 г.). «Escherichia coli, содержащая mcr-1 и blaCTX-M на новой плазмиде IncF: первое сообщение о mcr-1 в Соединенных Штатах» . Антимикробные средства и химиотерапия . 60 (7): 4420–1. дои : 10.1128/AAC.01103-16 . ПМЦ 4914657 . ПМИД 27230792 .
- ^ Мойер М.В. (27 мая 2016 г.). «Новые опасные бактерии, устойчивые к антибиотикам, достигли США», Scientific American . Архивировано из оригинала 28 июля 2020 года . Проверено 27 мая 2016 г.
- ^ Ди Белла С., Антонелло Р.М., Сансон Дж., Мараоло А.Е., Джакоббе Д.Р., Сепулькри С. и др. (июнь 2022 г.). «Анаэробные инфекции кровотока в Италии (ITANAEROBY): 5-летнее ретроспективное общенациональное исследование». Анаэроб . 75 : 102583. doi : 10.1016/j.anaerobe.2022.102583 . HDL : 11368/3020691 . ПМИД 35568274 . S2CID 248736289 .
- ^ Марино П.Л. (2007). «Противомикробная терапия». Книга ОИТ . Хагерстаун, Мэриленд: Липпинкотт Уильямс и Уилкинс. п. 817. ИСБН 978-0-7817-4802-5 .
- ^ Перейти обратно: а б Арулкумаран Н., Рутледж М., Шлебуш С., Липман Дж., Конвей Моррис А. (февраль 2020 г.). «Вред, связанный с противомикробными препаратами в реанимации: обзор повествования» . Интенсивная медицина . 46 (2): 225–235. дои : 10.1007/s00134-020-05929-3 . ПМК 7046486 . ПМИД 31996961 .
- ^ Перейти обратно: а б с Ларсон Э (2007). «Общественные факторы развития устойчивости к антибиотикам» . Ежегодный обзор общественного здравоохранения . 28 (1): 435–47. doi : 10.1146/annurev.publhealth.28.021406.144020 . ПМИД 17094768 .
- ^ Перейти обратно: а б Хоки ПМ (сентябрь 2008 г.). «Растущее бремя устойчивости к противомикробным препаратам». Журнал антимикробной химиотерапии . 62 (Приложение 1): i1-9. CiteSeerX 10.1.1.629.3960 . дои : 10.1093/jac/dkn241 . ПМИД 18684701 .
- ^ Онг С., Накасе Дж., Моран Г.Дж., Каррас Дж.Д., Кюнерт М.Дж., Талан Д.А. (сентябрь 2007 г.). «Использование антибиотиков у пациентов отделений неотложной помощи с инфекциями верхних дыхательных путей: практика назначения, ожидания пациентов и удовлетворенность пациентов». Анналы неотложной медицины . 50 (3): 213–20. doi : 10.1016/j.annemergmed.2007.03.026 . ПМИД 17467120 .
- ^ Метлей Дж.П., Камарго К.А., Маккензи Т., Маккаллох С., Маселли Дж., Левин С.К. и др. (сентябрь 2007 г.). «Кластерное рандомизированное исследование по улучшению использования антибиотиков у взрослых с острыми респираторными инфекциями, получающими лечение в отделениях неотложной помощи». Анналы неотложной медицины . 50 (3): 221–30. doi : 10.1016/j.annemergmed.2007.03.022 . ПМИД 17509729 .
- ^ Коксетер П., Дель Мар CB, МакГрегор Л., Беллер Э.М., Хоффманн Т.С. (ноябрь 2015 г.). «Вмешательства, способствующие совместному принятию решений по использованию антибиотиков при острых респираторных инфекциях в первичной медико-санитарной помощи» . Кокрановская база данных систематических обзоров . 11 (11): CD010907. дои : 10.1002/14651858.CD010907.pub2 . ПМК 6464273 . ПМИД 26560888 .
- ^ Мендельсон М., Рёттинген Дж.А., Гопинатан У., Хамер Д.Х., Вертхайм Х., Баснят Б. и др. (январь 2016 г.). «Максимизация доступа для достижения надлежащего использования противомикробных препаратов среди людей в странах с низким и средним уровнем дохода». Ланцет . 387 (10014): 188–98. дои : 10.1016/S0140-6736(15)00547-4 . ПМИД 26603919 . S2CID 13904240 .
- ^ « [1] Архивировано 27 декабря 2017 года в Wayback Machine ». Центры по контролю и профилактике заболеваний . Проверено 12 марта 2009 г.
- ^ «Держите антибиотики в рабочем состоянии» . Поддерживайте эффективность антибиотиков. Архивировано из оригинала 24 октября 2010 года . Проверено 21 мая 2010 г.
- ^ Сабунку Э., Дэвид Дж., Бернед-Бодюэн С., Пепен С., Лерой М., Боэль П.Ю. и др. (июнь 2009 г.). Клугман КП (ред.). «Значительное сокращение использования антибиотиков среди населения после общенациональной кампании во Франции в 2002–2007 годах» . ПЛОС Медицина . 6 (6): e1000084. doi : 10.1371/journal.pmed.1000084 . ПМЦ 2683932 . ПМИД 19492093 .
- ^ «Регламент (ЕС) № 1831/2003 Европейского парламента и Совета» . Архивировано из оригинала 9 января 2009 года.
- ^ «Чрезмерное использование антибиотиков при кормлении животных угрожает общественному здоровью» . Отчеты потребителей. Архивировано из оригинала 28 июня 2016 года . Проверено 4 июля 2016 г.
- ^ Перейти обратно: а б «Закон о сохранении антибиотиков для медицинского лечения 2005 г. (2005 г. – С. 742)» . GovTrack.us . Архивировано из оригинала 15 апреля 2019 года . Проверено 15 апреля 2019 г.
- ^ Перейти обратно: а б «Закон о сохранении антибиотиков для медицинского лечения 2005 г. (2005 г. - HR 2562)» . GovTrack.us . Архивировано из оригинала 15 апреля 2019 года . Проверено 15 апреля 2019 г.
- ^ «Работа антибиотиков Ки» (PDF) . Архивировано из оригинала (PDF) 25 марта 2009 года . Проверено 12 ноября 2008 г.
- ^ «Закон о сохранении антибиотиков для медицинского лечения 2005 г. (S. 742/HR 2562)» (PDF) . Институт сельского хозяйства и торговой политики. Архивировано (PDF) из оригинала 30 октября 2020 г. Проверено 4 октября 2020 г.
- ^ Чарльз Д. (22 декабря 2016 г.). «Несмотря на обещания сократить расходы, фермы все еще используют антибиотики» . ЭНЕРГЕТИЧЕСКИЙ ЯДЕРНЫЙ РЕАКТОР . Архивировано из оригинала 26 июля 2020 года . Проверено 5 апреля 2018 г.
- ^ Гевер Дж (23 марта 2012 г.). «FDA посоветовало прекратить использование антибиотиков в животноводстве» . МедПейдж сегодня . Архивировано из оригинала 27 апреля 2021 года . Проверено 24 марта 2012 г.
- ^ Барнс С. «Исследование Рутгерса показывает, что чрезмерное употребление антибиотиков вызвано заблуждениями и финансовыми стимулами» . Ежедневный Таргум . Архивировано из оригинала 6 декабря 2021 года . Проверено 16 февраля 2021 г.
- ^ Блазер М.Дж., Мелби М.К., Лок М., Нихтер М. (февраль 2021 г.). «Учет различий в применении и чрезмерном использовании антибиотиков среди людей» . Биоэссе . 43 (2): e2000163. doi : 10.1002/bies.202000163 . ПМИД 33410142 . S2CID 230811912 . Архивировано из оригинала 16 февраля 2021 года . Проверено 16 февраля 2021 г.
- ^ Калгатги С., Спина К.С., Костелло Х.К., Лиза М., Моронес-Рамирес Дж.Р., Сломович С. и др. (июль 2013 г.). «Бактерицидные антибиотики вызывают митохондриальную дисфункцию и окислительное повреждение в клетках млекопитающих» . Наука трансляционной медицины . 5 (192): 192ра85. doi : 10.1126/scitranslmed.3006055 . ПМК 3760005 . ПМИД 23825301 .
- ^ Певица М (январь 2014 г.). «Роль митохондриальной дисфункции в полиорганной недостаточности, вызванной сепсисом» . Вирулентность . 5 (1): 66–72. дои : 10.4161/viru.26907 . ПМЦ 3916385 . ПМИД 24185508 .
- ^ Аланья Л., Бандера А., Патруно А., Мускателло А., Читерио Г., Гори А. (май 2019 г.). «Микробиота в отделении интенсивной терапии – не только проблема кишечника» . Интенсивная медицина . 45 (5): 733–737. дои : 10.1007/s00134-018-05516-7 . ПМИД 30671622 . S2CID 58949829 .
- ^ Линдблад WJ (июнь 2008 г.). «Соображения относительно определения того, является ли натуральный продукт эффективным ранозаживляющим средством». Международный журнал ран нижних конечностей . 7 (2): 75–81. дои : 10.1177/1534734608316028 . ПМИД 18483011 . S2CID 5059255 .
- ^ Форрест Р.Д. (март 1982 г.). «Ранняя история лечения ран» . Журнал Королевского медицинского общества . 75 (3): 198–205. дои : 10.1177/014107688207500310 . ПМЦ 1437561 . ПМИД 7040656 .
- ^ Уэйнрайт М. (1989). «Формы в древней и новейшей медицине». Миколог . 3 (1): 21–23. дои : 10.1016/S0269-915X(89)80010-2 .
- ^ Армелагос, Джордж (2000). «Возьмите два пива и позвоните мне через 1600 лет: использование тетрациклина нубийцами и древними египтянами» (PDF) . Естественная история (5 мая): 50–53 . Проверено 13 марта 2017 г. [ постоянная мертвая ссылка ]
- ^ Перейти обратно: а б Лимберд ЛЕ (декабрь 2004 г.). «Концепция рецептора: продолжающаяся эволюция». Молекулярные вмешательства . 4 (6): 326–36. дои : 10.1124/ми.4.6.6 . ПМИД 15616162 .
- ^ Перейти обратно: а б Уильямс К.Дж. (август 2009 г.). «Внедрение «химиотерапии» с использованием арсфенамина – первое чудодейственное средство» . Журнал Королевского медицинского общества . 102 (8): 343–348. дои : 10.1258/jrsm.2009.09k036 . ПМК 2726818 . ПМИД 19679737 .
- ^ Чоухан С., Шарма К., Гулерия С. (август 2017 г.). «Противомикробная активность некоторых эфирных масел: современное состояние и перспективы» . Лекарства . 4 (3): 58. doi : 10.3390/medicines4030058 . ПМЦ 5622393 . ПМИД 28930272 .
- ^ Коуэн М.М. (октябрь 1999 г.). «Продукты растительного происхождения как противомикробные средства» . Обзоры клинической микробиологии . 12 (4): 564–582. дои : 10.1128/CMR.12.4.564 . ПМЦ 88925 . ПМИД 10515903 .
- ^ Перейти обратно: а б Фрит Дж. «Мышьяк – «Яд королей» и «Спаситель от сифилиса » . Журнал здоровья военных и ветеранов . 21 (4). Архивировано из оригинала 26 февраля 2017 года . Проверено 31 января 2017 г.
- ^ «Нобелевская премия по физиологии и медицине 1908 года» . NobelPrize.org . Архивировано из оригинала 14 августа 2018 года . Проверено 13 июня 2017 г.
- ^ «Архив номинаций» . NobelPrize.org . Апрель 2020. Архивировано из оригинала 26 июля 2020 года . Проверено 13 июня 2017 г.
- ^ «Физиология и медицина 1939 г. – Презентационная речь» . Нобелевский фонд. Архивировано из оригинала 14 января 2015 года . Проверено 14 января 2015 г.
- ^ Райт П.М., Сейпл И.Б., Майерс А.Г. (август 2014 г.). «Развивающаяся роль химического синтеза в открытии антибактериальных препаратов» . Ангеванде Хеми . 53 (34): 8840–69. дои : 10.1002/anie.201310843 . ПМЦ 4536949 . ПМИД 24990531 .
- ^ Аминов Р.И. (1 января 2010 г.). «Краткая история эры антибиотиков: извлеченные уроки и задачи на будущее» . Границы микробиологии . 1 : 134. дои : 10.3389/fmicb.2010.00134 . ПМК 3109405 . ПМИД 21687759 .
- ^ Кингстон W (июнь 2008 г.). «Ирландский вклад в происхождение антибиотиков». Ирландский журнал медицинских наук . 177 (2): 87–92. дои : 10.1007/s11845-008-0139-x . ПМИД 18347757 . S2CID 32847260 .
- ^ Фостер В., Рауль А. (декабрь 1974 г.). «Ранние описания антибиотиков» . Журнал Королевского колледжа врачей общей практики . 24 (149): 889–94. ПМК 2157443 . ПМИД 4618289 .
первые научные наблюдения антагонистического действия различных микроорганизмов были сделаны... Уильямом Робертсом из Манчестера (1874 г.) и Джоном Тиндалем из Лондона (1876 г.).
- ^ Буччи Р., Галли П. (11 мая 2012 г.). «Уголок истории общественного здравоохранения Винченцо Тиберио: неправильно понятый исследователь» . Итальянский журнал общественного здравоохранения . 8 (4). Архивировано из оригинала 20 сентября 2018 года . Проверено 30 сентября 2017 г.
- ^ Дюшен Э (23 сентября 2017 г.). Антагонизм Дюшена между плесенью и бактериями, английский разговорный перевод . Перевод Уитти М. Опубликовано независимо. ISBN 978-1-5498-1696-3 .
- ^ Перейти обратно: а б Страанд Дж., Градманн С., Симонсен Г.С., Линдбек М. (2008). Международная энциклопедия общественного здравоохранения: Разработка антибиотиков и устойчивость к ним . Академическая пресса. п. 200. Архивировано из оригинала 4 октября 2016 года . Проверено 31 января 2017 г.
- ^ Патак А., Ноуэлл Р.В., Уилсон К.Г., Райан М.Дж., Барракло Т.Г. (сентябрь 2020 г.). Александра Флеминга «Сравнительная геномика оригинального изолята Penicillium (IMI 15378) выявляет расхождение последовательностей генов синтеза пенициллина» . Научные отчеты . 10 (1): Статья 15705. Бибкод : 2020НацСР..1015705П . дои : 10.1038/s41598-020-72584-5 . ПМЦ 7515868 . ПМИД 32973216 .
- ^ Тан С.Ю., Тацумура Ю. (июль 2015 г.). «Александр Флеминг (1881-1955): первооткрыватель пенициллина» . Сингапурский медицинский журнал . 56 (7): 366–7. дои : 10.11622/smedj.2015105 . ПМК 4520913 . ПМИД 26243971 .
- ^ Флеминг А. (1980). «Классика инфекционных заболеваний: об антибактериальном действии культур пенициллий с особым упором на их использование при выделении B. influenzae Александром Флемингом, перепечатано из Британского журнала экспериментальной патологии 10:226-236, 1929» . Обзоры инфекционных болезней . 2 (1): 129–39. дои : 10.1093/clinids/2.1.129 . ПМК 2041430 . ПМИД 6994200 . ; Перепечатка Крылов А.К. (929). «[Гастроэнтерологические аспекты клинической картины внутренних болезней]». Терапевтический архив . 63 (2): 139–41. ПМИД 2048009 .
- ^ Сайкс Р. (2001). «Пенициллин: от открытия к продукту» . Бюллетень Всемирной организации здравоохранения . 79 (8): 778–9. ПМК 2566502 . ПМИД 11545336 .
- ^ Джонс Д.С., Джонс Дж.Х. (1 декабря 2014 г.). «Сэр Эдвард Пенли Абрахам CBE. 10 июня 1913 г. - 9 мая 1999 г.» . Биографические мемуары членов Королевского общества . 60 : 5–22. дои : 10.1098/rsbm.2014.0002 . ISSN 0080-4606 . Архивировано из оригинала 26 ноября 2023 года . Проверено 10 мая 2017 г.
- ^ Флори Х.В. (ноябрь 1945 г.). «Использование микроорганизмов в терапевтических целях» . Британский медицинский журнал . 2 (4427): 635–42. дои : 10.1136/bmj.2.4427.635 . ПМК 2060276 . ПМИД 20786386 .
- ^ «Нобелевская премия по физиологии и медицине 1945 года» . Организация Нобелевской премии. Архивировано из оригинала 23 мая 2020 года . Проверено 13 января 2018 г.
- ^ Перейти обратно: а б Ван Эппс Х.Л. (февраль 2006 г.). «Рене Дюбо: открытие антибиотиков» . Журнал экспериментальной медицины . 203 (2): 259. doi : 10.1084/jem.2032fta . ПМК 2118194 . ПМИД 16528813 .
- ^ Капоччи М. (1 января 2014 г.). «Лекарства от простуды. Обращение, производство и разведка антибиотиков в послевоенные годы». Медицина Неи Секоли . 26 (2): 401–21. ПМИД 26054208 .
- ^ Конли Дж., Джонстон Б. (май 2005 г.). «Где все новые антибиотики? Новый парадокс антибиотиков» . Канадский журнал инфекционных заболеваний и медицинской микробиологии . 16 (3): 159–60. дои : 10.1155/2005/892058 . ПМК 2095020 . ПМИД 18159536 .
- ^ Перейти обратно: а б с Антибактериальные средства в клинической разработке: анализ хода клинических разработок антибактериальных средств, включая туберкулез. Женева: Всемирная организация здравоохранения; 2017 г. (WHO/EMP/IAU/2017.12). Лицензия: CC BY-NC-SA 3.0 IGO.
- ^ Баучер Х.В., Талбот Г.Х., Бенджамин Д.К., Брэдли Дж., Гвидос Р.Дж., Джонс Р.Н. и др. (июнь 2013 г.). «Прогресс 10 x '20 — разработка новых лекарств, активных против грамотрицательных бацилл: обновленная информация Американского общества инфекционистов» . Клинические инфекционные болезни . 56 (12): 1685–94. дои : 10.1093/cid/cit152 . ПМК 3707426 . ПМИД 23599308 .
- ^ Стинхейсен Дж. (18 апреля 2013 г.). «Период разработки лекарств от худших супербактерий «на жизнеобеспечении»: отчет» . Рейтер . Архивировано из оригинала 25 декабря 2015 года . Проверено 23 июня 2013 г.
- ^ Перейти обратно: а б Баучер Х.В., Талбот Г.Х., Бенджамин Д.К., Брэдли Дж., Гвидос Р.Дж., Джонс Р.Н. и др. (июнь 2013 г.). «Прогресс 10 x '20 — разработка новых лекарств, активных против грамотрицательных бацилл: обновленная информация Американского общества инфекционистов» . Клинические инфекционные болезни . 56 (12). Американское общество инфекционистов: 1685–94. дои : 10.1093/cid/cit152 . ПМК 3707426 . ПМИД 23599308 .
- ^ Лю Дж., Беделл Т.А., Вест Дж.Г., Соренсен Э.Дж. (июнь 2016 г.). «Дизайн и синтез молекулярных каркасов с противоинфекционной активностью» . Тетраэдр . 72 (25): 3579–3592. дои : 10.1016/j.tet.2016.01.044 . ПМЦ 4894353 . ПМИД 27284210 .
- ^ Перейти обратно: а б с Фернандес П., Мартенс Э. (июнь 2017 г.). «Антибиотики на поздних стадиях клинической разработки» . Биохимическая фармакология . 133 : 152–163. дои : 10.1016/j.bcp.2016.09.025 . ПМИД 27687641 .
- ^ Перейти обратно: а б с д и ж г час я Батлер М.С., Патерсон Д.Л. (июнь 2020 г.). «Антибиотики в клинической разработке в октябре 2019 года» . Журнал антибиотиков . 73 (6): 329–364. дои : 10.1038/s41429-020-0291-8 . ПМЦ 7223789 . ПМИД 32152527 .
- ^ Зампалони С., Маттеи П., Блейхер К., Винтер Л., Тете С., Бухер С. и др. (3 января 2024 г.). «Новый класс антибиотиков, нацеленный на переносчик липополисахаридов» . Природа . 625 (7995): 566–571. Бибкод : 2024Nature.625..566Z . дои : 10.1038/s41586-023-06873-0 . ПМЦ 10794144 . ПМИД 38172634 .
- ^ Пахил К.С., Гилман М., Байдин В., Клерфей Т., Маттеи П., Бьениоссек С. и др. (3 января 2024 г.). «Новый антибиотик улавливает липополисахарид в его межмембранном переносчике» . Природа . 625 (7995): 572–577. Бибкод : 2024Natur.625..572P . дои : 10.1038/s41586-023-06799-7 . ПМЦ 10794137 . ПМИД 38172635 .
- ^ «Закон о разработке антибиотиков для улучшения лечения пациентов от 2013 г.» (PDF) . Конгресс США. 12 декабря 2013 г. Архивировано (PDF) из оригинала 9 октября 2022 г.
- ^ Кларк Т. (19 сентября 2014 г.). «Конгресс США призвал принять закон об ускорении разработки антибиотиков» . Рейтер . Рейтер. Архивировано из оригинала 9 декабря 2015 года . Проверено 19 сентября 2014 г.
- ^ Перейти обратно: а б с Молони М.Г. (август 2016 г.). «Натуральные продукты как источник новых антибиотиков» . Тенденции в фармакологических науках . 37 (8): 689–701. дои : 10.1016/j.tips.2016.05.001 . ПМИД 27267698 . S2CID 3537191 . Архивировано из оригинала 27 июля 2021 года . Проверено 25 августа 2020 г.
- ^ Перейти обратно: а б с д и Кушни Т.П., Кушни Б., Эчеверриа Дж., Фоусантир В., Таммават С., Доджсон Дж.Л. и др. (июнь 2020 г.). «Биопоиск антибактериальных препаратов: междисциплинарный взгляд на исходный материал натуральных продуктов, выбор биоанализа и ошибки, которых можно избежать» . Фармацевтические исследования . 37 (7): 125. дои : 10.1007/s11095-020-02849-1 . ПМИД 32529587 . S2CID 219590658 . Архивировано из оригинала 2 декабря 2020 года . Проверено 17 сентября 2020 г.
- ^ Машалидис Э.Х., Ли С.Ю. (август 2020 г.). «Структуры бактериального MraY и GPT человека дают представление о рациональном дизайне антибиотиков» . Журнал молекулярной биологии . 432 (18): 4946–4963. дои : 10.1016/j.jmb.2020.03.017 . ПМЦ 8351759 . ПМИД 32199982 .
- ^ Ся Дж., Фэн Б., Вэнь Г., Сюэ В., Ма Г., Чжан Х. и др. (июль 2020 г.). «Путь биосинтеза бактериальных липопротеинов как потенциальная мишень для структурного дизайна антибактериальных агентов». Современная медицинская химия . 27 (7): 1132–1150. дои : 10.2174/0929867325666181008143411 . ПМИД 30360704 . S2CID 53097836 .
- ^ Перейти обратно: а б с д и ж г час я дж к Тойретцбахер Ю, Пиддок LJ (июль 2019 г.). «Нетрадиционные антибактериальные терапевтические возможности и проблемы» . Клетка-хозяин и микроб . 26 (1): 61–72. дои : 10.1016/j.chom.2019.06.004 . ПМИД 31295426 .
- ^ Перейти обратно: а б с д и ж г час я Гош С., Саркар П., Исса Р., Халдар Дж. (апрель 2019 г.). «Альтернативы обычным антибиотикам в эпоху антимикробной резистентности». Тенденции в микробиологии . 27 (4): 323–338. дои : 10.1016/j.tim.2018.12.010 . ПМИД 30683453 . S2CID 59274650 .
- ^ Абедон С.Т., Куль С.Дж., Бласдел Б.Г., Каттер Э.М. (март 2011 г.). «Фаговая терапия инфекций человека» . Бактериофаг . 1 (2): 66–85. дои : 10.4161/bact.1.2.15845 . ПМЦ 3278644 . ПМИД 22334863 .
- ^ Перейти обратно: а б Чаплевски Л., Бакс Р., Клоки М., Доусон М., Фэйрхед Х., Фишетти В.А. и др. (февраль 2016 г.). «Альтернативы антибиотикам: обзор портфолио перспективных решений» (PDF) . «Ланцет». Инфекционные болезни . 16 (2): 239–51. дои : 10.1016/S1473-3099(15)00466-1 . ПМИД 26795692 . S2CID 21677232 . Архивировано (PDF) из оригинала 17 августа 2019 года . Проверено 22 ноября 2018 г.
- ^ Моайеди П., Юань Й., Бахарит Х., Форд AC (август 2017 г.). «Трансплантация фекальной микробиоты при диарее, связанной с Clostridium difficile : систематический обзор рандомизированных контролируемых исследований». Медицинский журнал Австралии . 207 (4): 166–172. дои : 10.5694/mja17.00295 . ПМИД 28814204 . S2CID 24780848 .
- ^ Вранчану СО, Георге I, Чобор И.Б., Кифирюк М.К. (июнь 2020 г.). «Профили устойчивости к антибиотикам, молекулярные механизмы и инновационные стратегии лечения Acinetobacter baumannii » . Микроорганизмы . 8 (6): Статья 935. doi : 10.3390/microorganisms8060935 . ПМЦ 7355832 . ПМИД 32575913 .
- ^ Хатчингс М.И., Трумэн А.В., Уилкинсон Б. (октябрь 2019 г.). «Антибиотики: прошлое, настоящее и будущее» . Современное мнение в микробиологии . 51 : 72–80. дои : 10.1016/j.mib.2019.10.008 . ПМИД 31733401 .
- ^ Холмс Н.А., Дивайн Р., Цинь З., Зейпке Р.Ф., Уилкинсон Б., Хатчингс М.И. (январь 2018 г.). «Полная последовательность генома Streptomyces formicae KY5, производителя формамицина» . Журнал биотехнологии . 265 : 116–118. дои : 10.1016/j.jbiotec.2017.11.011 . ПМИД 29191667 .
- ^ «Ресурсы и информация hutchingslab» . www3.hutchingslab.uk . Архивировано из оригинала 7 апреля 2023 года . Проверено 22 августа 2022 г.
- ^ Биллс Г.Ф., Глоер Дж.Б., Ан З. (октябрь 2013 г.). «Копрофильные грибы: открытие антибиотиков и их функции на малоизученной арене микробного защитного мутуализма». Современное мнение в микробиологии . 16 (5): 549–65. дои : 10.1016/j.mib.2013.08.001 . ПМИД 23978412 .
- ^ Кенни CR, Фьюри А, Люси Б (2015). «Надвигается постантибиотическая эра: смогут ли исследования растительных натуральных продуктов заполнить пустоту?». Британский журнал биомедицинской науки . 72 (4): 191–200. дои : 10.1080/09674845.2015.11665752 . ПМИД 26738402 . S2CID 41282022 .
- ^ Аль-Хабиб А., Аль-Салех Э., Сафер А.М., Афзал М. (июнь 2010 г.). «Бактерицидное действие экстракта виноградных косточек на метициллин-резистентный золотистый стафилококк (MRSA)» . Журнал токсикологических наук . 35 (3): 357–64. дои : 10.2131/jts.35.357 . ПМИД 20519844 .
- ^ Смаллен Дж., Куцу Г.А., Фостер Х.А., Зумбе А., Стори Д.М. (2007). «Антибактериальная активность растительных экстрактов, содержащих полифенолы, против Streptococcus mutans». Исследования кариеса . 41 (5): 342–9. дои : 10.1159/000104791 . ПМИД 17713333 . S2CID 44317367 .
- ^ Перейти обратно: а б Монте Дж., Абреу А.С., Борхес А., Симойнс Л.К., Симойнс М. (июнь 2014 г.). «Антимикробная активность отдельных фитохимических веществ против Escherichia coli и Staphylococcus aureus и их биопленок» . Патогены . 3 (2): 473–98. doi : 10.3390/pathogens3020473 . ПМЦ 4243457 . ПМИД 25437810 .
- ^ Танака Н., Кусама Т., Кашивада Ю., Кобаяши Дж. (апрель 2016 г.). «Бромпирроловые алкалоиды из окинавских морских губок Agelas spp» . Химический и фармацевтический вестник . 64 (7): 691–4. дои : 10.1248/cpb.c16-00245 . ПМИД 27373625 .
- ^ Коуэн М.М. (октябрь 1999 г.). «Продукты растительного происхождения как противомикробные средства» . Обзоры клинической микробиологии . 12 (4): 564–82. дои : 10.1128/CMR.12.4.564 . ПМЦ 88925 . ПМИД 10515903 .
- ^ Перейти обратно: а б с Абреу А.С., Макбейн А.Дж., Симойнс М. (сентябрь 2012 г.). «Растения как источники новых противомикробных препаратов и средств, модифицирующих устойчивость». Отчеты о натуральных продуктах . 29 (9): 1007–21. дои : 10.1039/c2np20035j . ПМИД 22786554 .
- ^ Махаджан ГБ, Балачандран Л (июнь 2017 г.). «Источники антибиотиков: Горячие источники». Биохимическая фармакология . 134 : 35–41. дои : 10.1016/j.bcp.2016.11.021 . ПМИД 27890726 .
- ^ Перейти обратно: а б Эллисон К.Р., член парламента Бринильдсена, Коллинз Дж.Дж. (май 2011 г.). «Уничтожение бактерий-персистеров с помощью метаболитов с помощью аминогликозидов» . Природа . 473 (7346): 216–20. Бибкод : 2011Natur.473..216A . дои : 10.1038/nature10069 . ПМЦ 3145328 . ПМИД 21562562 .
- ^ Маркес Б. (декабрь 2005 г.). «Бактериальные эффлюксные системы и ингибиторы эффлюксных насосов». Биохимия . 87 (12): 1137–47. дои : 10.1016/j.biochi.2005.04.012 . ПМИД 15951096 .
- ^ Кушни Т.П., Кушни Б., Лэмб Эй.Дж. (ноябрь 2014 г.). «Алкалоиды: обзор их антибактериальной, усиливающей действие антибиотиков и противовирусной активности» . Международный журнал противомикробных средств . 44 (5): 377–86. дои : 10.1016/j.ijantimicag.2014.06.001 . ПМИД 25130096 . S2CID 205171789 . Архивировано из оригинала 18 августа 2020 года . Проверено 19 июля 2019 г.
- ^ Перейти обратно: а б Мольнар Дж., Энги Х., Хохманн Дж., Молнар П., Дели Дж., Весоловска О. и др. (2010). «Обращение множественной лекарственной устойчивости с помощью натуральных веществ растений». Актуальные темы медицинской химии . 10 (17): 1757–68. дои : 10.2174/156802610792928103 . ПМИД 20645919 .
- ^ Перейти обратно: а б Кушни Т.П., Лэмб Эй.Дж. (август 2011 г.). «Последние достижения в понимании антибактериальных свойств флавоноидов» . Международный журнал противомикробных средств . 38 (2): 99–107. дои : 10.1016/j.ijantimicag.2011.02.014 . ПМИД 21514796 . Архивировано из оригинала 26 июля 2020 года . Проверено 19 июля 2019 г.
- ^ Перейти обратно: а б Сюэ Л, Чен Ю, Ян Цз, Лу В, Ван Д, Чжу Х (июль 2019 г.). «Стафилоксантин: потенциальная мишень для противовирусной терапии» . Инфекции и устойчивость к лекарствам . 12 : 2151–2160. дои : 10.2147/IDR.S193649 . ПМК 6647007 . ПМИД 31410034 .
- ^ Мок Н., Чан С.Ю., Лю С.Ю., Чуа С.Л. (июль 2020 г.). «Ванилин ингибирует PqsR-опосредованную вирулентность Pseudomonas aeruginosa». Еда и функции . 11 (7): 6496–6508. дои : 10.1039/D0FO00046A . hdl : 10397/88306 . ПМИД 32697213 . S2CID 220699939 .
- ^ Ким Х.Р., Шин Д.С., Чан ХИ, Эом Ю.Б. (август 2020 г.). «Антибиопленочное и противовирулентное действие зерумбони в отношении Acinetobacter baumannii » . Микробиология . 166 (8): 717–726. дои : 10.1099/mic.0.000930 . ПМИД 32463353 .
- ^ Плоткин С.А. , Оренштейн В.А. , Оффит П.А. (2012). Вакцина . Elsevier Науки о здоровье. стр. 100-1 103, 757. ISBN 978-1-4557-0090-5 . Архивировано из оригинала 9 января 2017 года.
- ^ Перейти обратно: а б с Сулаквелидзе А, Алавидзе З, Моррис Дж.Г. (март 2001 г.). «Бактериофаготерапия» . Антимикробные средства и химиотерапия . 45 (3): 649–59. doi : 10.1128/aac.45.3.649-659.2001 . ПМК 90351 . ПМИД 11181338 .
- ^ Перейти обратно: а б с д Гилл Э.Э., Франко О.Л., Хэнкок Р.Э. (январь 2015 г.). «Антибиотические адъюванты: разнообразные стратегии борьбы с лекарственно-устойчивыми патогенами» . Химическая биология и дизайн лекарств . 85 (1): 56–78. дои : 10.1111/cbdd.12478 . ПМК 4279029 . ПМИД 25393203 .
- ^ Данн М., Рупф Б., Тала М., Кабрати Х., Эрнст П., Шен Ю. и др. (октябрь 2019 г.). «Перепрограммирование диапазона хозяев бактериофагов посредством структурно-ориентированного проектирования химерных рецепторсвязывающих белков» . Отчеты по ячейкам . 29 (5): 1336–1350.e4. дои : 10.1016/j.celrep.2019.09.062 . hdl : 20.500.11850/374453 . PMID 31665644 . S2CID 204967212 .
- ^ Опал СМ (декабрь 2016 г.). «Неантибиотические методы лечения бактериальных заболеваний в эпоху прогрессирующей устойчивости к антибиотикам» . Критическая помощь . 20 (1): 397. дои : 10.1186/s13054-016-1549-1 . ПМК 5159963 . ПМИД 27978847 .
- ^ Д'Одорико I, Ди Белла С., Монтичелли Дж., Джакоббе Д.Р., Болдок Э., Луццати Р. (июнь 2018 г.). «Роль трансплантации фекальной микробиоты при воспалительных заболеваниях кишечника». Журнал пищеварительных заболеваний . 19 (6): 322–334. дои : 10.1111/1751-2980.12603 . ПМИД 29696802 . S2CID 24461869 .
- ^ Ишино Ю., Крупович М., Фортер П. (апрель 2018 г.). «История CRISPR-Cas от встречи с загадочной повторяющейся последовательностью до технологии редактирования генома» . Журнал бактериологии . 200 (7): e00580-17. дои : 10.1128/JB.00580-17 . ПМЦ 5847661 . ПМИД 29358495 .
- ^ Ричи, Розер, Миспи, Ортис-Оспина (2018) «Измерение прогресса в достижении целей устойчивого развития». (ЦУР 6). Архивировано 1 ноября 2020 г. на веб-сайте Wayback Machine SDG-Tracker.org.
- ^ «Бытовая скученность» . Всемирная организация здравоохранения. Архивировано из оригинала 6 января 2021 года . Проверено 17 сентября 2020 г.
- ^ Али Ш., Фостер Т., Холл Н.Л. (декабрь 2018 г.). «Взаимосвязь между инфекционными заболеваниями и содержанием жилья в домохозяйствах коренных народов Австралии» . Международный журнал экологических исследований и общественного здравоохранения . 15 (12): Статья 2827. doi : 10.3390/ijerph15122827 . ПМК 6313733 . ПМИД 30545014 .
- ^ «Вода, санитария и гигиена связаны со здоровьем» . Всемирная организация здравоохранения. Архивировано из оригинала 7 сентября 2020 года . Проверено 17 сентября 2020 г.
- ^ Кертис В., Шмидт В., Луби С., Флорес Р., Туре О., Биран А. (апрель 2011 г.). «Гигиена: новые надежды, новые горизонты» . «Ланцет». Инфекционные болезни . 11 (4): 312–21. дои : 10.1016/S1473-3099(10)70224-3 . ПМК 7106354 . ПМИД 21453872 .
- ^ Джентри Э.М., Кестер С., Фишер К., Дэвидсон Л.Е., Пассаретти К.Л. (март 2020 г.). «Ошибки и лекарства: сотрудничество между профилактикой инфекций и контролем использования антибиотиков». Клиники инфекционных заболеваний Северной Америки . 34 (1): 17–30. дои : 10.1016/j.idc.2019.10.001 . ПМИД 31836329 . S2CID 209358146 .
- ^ Фиренс Дж., Депюдт П.О., Де Ваэле Дж.Дж. (август 2019 г.). «Практический подход к клиническому назначению антибиотиков у пациентов отделения интенсивной терапии с тяжелой инфекцией». Семинары по респираторной медицине и медицине интенсивной терапии . 40 (4): 435–446. дои : 10.1055/s-0039-1693995 . ПМИД 31585470 . S2CID 203720304 .
- ^ Ньюман А.М., Аршад М. (сентябрь 2020 г.). «Роль пробиотиков, пребиотиков и синбиотиков в борьбе с организмами с множественной лекарственной устойчивостью» . Клиническая терапия . 42 (9): 1637–1648. doi : 10.1016/j.clinthera.2020.06.011 . ПМК 7904027 . ПМИД 32800382 .
- ^ Джордано М., Бальдассаре М.Э., Палмьери В., Торрес Д.Д., Карбоне В., Сантанджело Л. и др. (май 2019 г.). «Лечение гастроэнтерита STEC: есть ли роль пробиотиков?» . Международный журнал экологических исследований и общественного здравоохранения . 16 (9): Статья 1649. doi : 10.3390/ijerph16091649 . ПМК 6539596 . ПМИД 31083597 .
- ^ Джа Р, Дас Р, Оук С, Мишра П (октябрь 2020 г.). «Пробиотики (микробные препараты прямого кормления) в питании птицы и их влияние на использование питательных веществ, рост и продуктивность яйцекладки, а также здоровье кишечника: систематический обзор» . Животные . 10 (10): 1863. doi : 10.3390/ani10101863 . ПМК 7602066 . ПМИД 33066185 .
- ^ Джа Р, Мишра П. (апрель 2021 г.). «Пищевая клетчатка в питании птицы и ее влияние на использование питательных веществ, продуктивность, здоровье кишечника и окружающую среду: обзор» . Журнал зоотехники и биотехнологии . 12 (1): 51. дои : 10.1186/s40104-021-00576-0 . ПМК 8054369 . ПМИД 33866972 .
- ^ Бекли А.М., Райт Э.С. (октябрь 2021 г.). «Идентификация пар антибиотиков, которые избегают одновременной резистентности, посредством ретроспективного анализа результатов тестов на чувствительность к противомикробным препаратам» . «Ланцет». Микроб . 2 (10): е545–е554. дои : 10.1016/S2666-5247(21)00118-X . ПМЦ 8496867 . ПМИД 34632433 .
- ^ Ма Ю, Чуа С.Л. (15 ноября 2021 г.). «Отсутствие сопутствующей чувствительности к антибиотикам при чередовании пар антибиотиков» . Ланцетный микроб . 3 (1): e7. дои : 10.1016/S2666-5247(21)00270-6 . ISSN 2666-5247 . ПМИД 35544116 . S2CID 244147577 .
- ^ Дональд Р.Г., Андерсон А.С. (2011). «Современные стратегии разработки антибактериальных вакцин». В Миллер П.Ф. (ред.). Новые тенденции в области открытия антибактериальных средств: ответ на призыв к оружию . Горизонт Научная Пресса. п. 283.
- ^ Миллер А.А. (2011). Миллер П.Ф. (ред.). Новые тенденции в области открытия антибактериальных средств: ответ на призыв к оружию . Кайстер Академик Пресс . ISBN 978-1-904455-89-9 . [ нужна страница ]
Дальнейшее чтение
[ редактировать ]- Гулд К. (март 2016 г.). «Антибиотики: от предыстории до наших дней» . Журнал антимикробной химиотерапии . 71 (3): 572–5. дои : 10.1093/jac/dkv484 . ПМИД 26851273 .
- Дэвис Дж., Дэвис Д. (сентябрь 2010 г.). «Происхождение и эволюция устойчивости к антибиотикам» . Обзоры микробиологии и молекулярной биологии . 74 (3): 417–33. дои : 10.1128/MMBR.00016-10 . ПМЦ 2937522 . ПМИД 20805405 .
- «Антибиотики: МедлайнПлюс» . nih.gov. Архивировано из оригинала 27 июля 2016 года . Проверено 19 июля 2016 г.
- «Первый глобальный доклад ВОЗ об устойчивости к антибиотикам выявил серьезную глобальную угрозу общественному здравоохранению» . ВОЗ . Архивировано из оригинала 30 апреля 2014 года.
- Пью Р., Грант С., Кук Р.П., Демпси Дж. (август 2015 г.). «Короткокурсовая и длительная антибиотикотерапия внутрибольничной пневмонии у взрослых в критическом состоянии» . Кокрановская база данных систематических обзоров . 2015 (8): CD007577. дои : 10.1002/14651858.CD007577.pub3 . ПМК 7025798 . ПМИД 26301604 .
- Гедрайтене А, Виткаускене А, Нагинене Р, Павилонис А (1 января 2011 г.). «Механизмы устойчивости клинически важных бактерий к антибиотикам» . Лекарство . 47 (3): 137–46. дои : 10.3390/medicina47030019 . ПМИД 21822035 .