Pharmacokinetics of estradiol
 | |
| Clinical data | |
|---|---|
| Routes of administration | • By mouth (tablet) • Sublingual (tablet) • Intranasal (nasal spray) • Transdermal (patch, gel, cream, emulsion, spray) • Vaginal (tablet, cream, suppository, insert, ring) • IM injection (oil solution) • SC injection (aq. soln.) • Subcutaneous implant |
| Drug class | Estrogen; Antigonadotropin |
| Pharmacokinetic data | |
| Bioavailability | Oral: 5% (0.1–12%)[1][2] SL: 10% (in marmosets)[3] IM: 100%[4] |
| Protein binding | ~98%:[1][5] • Albumin: 60% • SHBG: 38% • Free: 2% |
| Metabolism | Liver (via hydroxylation, sulfation, glucuronidation) |
| Metabolites | Major (90%):[1] • Estrone • Estrone sulfate • Estrone glucuronide • Estradiol glucuronide |
| Elimination half-life | Oral: 13–20 hours[1] Sublingual: 8–18 hours[6] Transdermal (gel): 37 hours[7] IM (as EV): 4–5 days[4] IM (as EC): 8–10 days[8] IV (as E2): 0.5–2 hours[4][9] |
| Excretion | Urine: 54%[1] Feces: 6%[1] |
The pharmacology of estradiol, an estrogen medication and naturally occurring steroid hormone, concerns its pharmacodynamics, pharmacokinetics, and various routes of administration.[10][11][12]
Estradiol is a naturally occurring and bioidentical estrogen, or an agonist of the estrogen receptor, the biological target of estrogens like endogenous estradiol.[10] Due to its estrogenic activity, estradiol has antigonadotropic effects and can inhibit fertility and suppress sex hormone production in both women and men.[13][14] Estradiol differs from non-bioidentical estrogens like conjugated estrogens and ethinylestradiol in various ways, with implications for tolerability and safety.[10]
Estradiol can be taken by mouth, held under the tongue, as a gel or patch that is applied to the skin, in through the vagina, by injection into muscle or fat, or through the use of an implant that is placed into fat, among other routes.[10]
Routes of administration
[edit]Estradiol can be taken by a variety of different routes of administration.[10] These include oral, buccal, sublingual, intranasal, transdermal (gels, creams, patches), vaginal (tablets, creams, rings, suppositories), rectal, by intramuscular or subcutaneous injection (in oil or aqueous), and as a subcutaneous implant.[10] The pharmacokinetics of estradiol, including its bioavailability, metabolism, biological half-life, and other parameters, differ by route of administration.[10] Likewise, the potency of estradiol, and its local effects in certain tissues, most importantly the liver, differ by route of administration as well.[10] In particular, the oral route is subject to a high first-pass effect, which results in high levels of estradiol and consequent estrogenic effects in the liver and low potency due to first-pass hepatic and intestinal metabolism into metabolites like estrone and estrogen conjugates.[10] Conversely, this is not the case for parenteral (non-oral) routes, which bypass the intestines and liver.[10]
Different estradiol routes and dosages can achieve widely varying circulating estradiol levels (see the table below).[10] For purposes of comparison with normal physiological circumstances, menstrual cycle circulating levels of estradiol in premenopausal women are 40 pg/mL in the early follicular phase, 250 pg/mL at the middle of the cycle, and 100 pg/mL during the mid-luteal phase.[15] Mean integrated levels of circulating estradiol in premenopausal women across the whole menstrual cycle are in the range of 80 to 150 pg/mL, according to some sources.[16][17][18] In postmenopausal women, circulating levels of estradiol are below 15 pg/mL.[10][15] During normal human pregnancy, estrogen production increases progressively and extremely high estrogen levels are attained.[19] Estradiol levels range from 1,000 to 40,000 pg/mL across pregnancy,[20] are on average 25,000 pg/mL at term, and reach levels as high as 75,000 pg/mL in some women.[21]
| Route | Ingredient | Form | Dose[b] | Brand names[c] |
|---|---|---|---|---|
| Oral | Estradiol | Tablet | 0.1, 0.2, 0.5, 1, 2, 4 mg | Estrace, Ovocyclin |
| Estradiol valerate | Tablet | 0.5, 1, 2, 4 mg | Progynova | |
| Transdermal | Estradiol | Patch | 14, 25, 37.5, 50, 60, 75, 100 µg/d | Climara, Vivelle |
| Gel pump | 0.06% (0.52, 0.75 mg/pump) | Elestrin, EstroGel | ||
| Gel packet | 0.1% (0.25, 0.5, 1.0 mg/pk.) | DiviGel, Sandrena | ||
| Emulsion | 0.25% (25 µg/pouch) | Estrasorb | ||
| Spray | 1.53 mg/spray | Evamist, Lenzetto | ||
| Vaginal | Estradiol | Tablet | 10, 25 µg | Vagifem |
| Cream | 0.01% (0.1 mg/gram) | Estrace | ||
| Insert | 4, 10 µg | Imvexxy | ||
| Ring | 2 mg/ring (7.5 µg/d, 3 mon.) | Estring | ||
| Estradiol acetate | Ring | 50, 100 µg/d, 3 months | Femring | |
| Injection[d] | Estradiol | Microspheres | 1 mg/mL | Juvenum E |
| Estradiol benzoate | Oil solution | 0.167, 0.2, 0.333, 1, 1.67, 2, 5, 10, 20, 25 mg/mL | Progynon-B | |
| Estradiol cypionate | Oil solution | 1, 3, 5 mg/mL | Depo-Estradiol | |
| Estradiol valerate | Oil solution | 5, 10, 20, 40 mg/mL | Progynon Depot | |
| Implant | Estradiol | Pellet | 20, 25, 50, 100 mg, 6 mon. | Estradiol Implants |
Notes and sources: | ||||
Oral administration
[edit]Absorption and bioavailability
[edit]The oral bioavailability of estradiol is very low.[2][36][37] This is due to the fact that estradiol is poorly soluble in water, which limits its dissolution and absorption, and is additionally subject to extensive metabolism during the first pass through the intestines and liver.[3][38] Estradiol is micronized and/or conjugated with an ester, as in estradiol valerate or estradiol acetate, to improve its oral bioavailability and potency.[2][36][37] Micronization decreases the particle size of estradiol crystals and hence increases the surface area for absorption, thereby improving the rate and extent of absorption.[39][3][40] In addition, there is an improvement in metabolic stability.[3][40] Oral micronized estradiol consists of more than 80% of estradiol particles micronized to a size smaller than 20 μm in diameter, or to about 1 to 3 μm on average.[41][42][40][43] All oral formulations of estradiol available today are micronized,[36] and oral estradiol valerate tablets also seem to be micronized.[44]
Oral non-micronized estradiol and oral micronized estradiol do not appear to have ever been directly compared in a study.[45][42][46][47] Both have been assessed independently however, and have been found to produce significant estrogenic effects.[45][42][46][48] Micronization of other poorly water-soluble steroids such as spironolactone and norethisterone acetate has been found to increase their potency by several-fold.[49][50][51][52][53] In accordance, studies of the amount of oral estradiol necessary for endometrial proliferation in women have reported a total dose of 60 mg for micronized estradiol[54] relative to 120 to 300 mg or more for non-micronized estradiol.[55][56][57] As such, micronization has been said to substantially improve the potency of oral estradiol.[40]

A study compared different particle sizes of oral micronized estradiol.[38][58][59] A preparation with the smallest particles (mainly <0.6 μm) was found to have the most rapid absorption and the highest bioavailability.[38][59] However, a sharp peak in estradiol levels, without an accompanying rise in estrone levels, was observed during the first 2 hours with this particle size.[38][59] It was suggested that the smallest estradiol particles may have been absorbed by the lymphatic system, partially bypassing first-pass metabolism and resulting in very high initial estradiol levels.[38] The preparations with the larger particle sizes (mainly <3.5 μm and <20 μm) were found to be absorbed more slowly, without a pronounced initial peak in estradiol levels.[38][59] Levels of estradiol were more even and similar to physiological levels with these particle sizes.[38][59] Differences in area-under-the-curve estradiol levels with the different particle sizes were relatively small.[38] As such, micronization may improve absorption but does not necessarily improve therapeutic effect.[59]
Micronized estradiol is rapidly and completely absorbed with oral administration.[3][12] This is true for oral doses of 2 mg and 4 mg, but absorption was found to be incomplete for an oral dose of 8 mg.[3][60] This dose showed 76% of the expected bioavailability based on dose proportionality and area-under-the-curve levels, indicating a small deviation from linearity.[3][60] The absolute bioavailability of oral micronized estradiol is approximately 5%, with a possible range of 0.1% to 12%.[1][2][59] As such, the bioavailability of oral estradiol is very low even with micronization.[59] There is high interindividual variability in the levels of estradiol achieved with oral estradiol, which is likely related to the high first-pass effect.[12] This variation has been reported to be in the range of 28 to 127%, or about 4.6-fold maximal difference in levels between individuals, in terms of mean area-under-the-curve levels of estradiol.[12]
In postmenopausal women, a dosage of 1 mg/day oral micronized estradiol has been found to produce circulating concentrations of 30 to 50 pg/mL estradiol and 150 to 300 pg/mL estrone, while a dosage of 2 mg/day has been found to result in circulating levels of 50 to 180 pg/mL estradiol and 300 to 850 pg/mL estrone.[15] A study of oral micronized estradiol in transgender women found that mean estradiol levels across a dosage range of 1 to 8 mg/day were about 50 pg/mL at 1 mg/day, 100 pg/mL at 4 mg/day, and 150 pg/mL at 8 mg/day, with a wide degree of variation.[61] In another study, mean estradiol levels at steady state with 4 mg/day and 6 mg/day oral micronized estradiol were approximately 180 pg/mL and 265 pg/mL, respectively.[62] A study that used high to very high-dose oral micronized estradiol in postmenopausal women found that steady-state estradiol levels with 6 mg/day were about 300 pg/mL and with 30 mg/day were about 2,400 pg/mL.[63]
Estradiol valerate is rapidly hydrolyzed into estradiol in the intestines.[10][64][65] For this reason, oral estradiol and oral estradiol valerate have very similar pharmacokinetics.[10][64][65] Due to the presence of its valeric acid ester and differences in molecular weight, estradiol valerate contains about 76% of the same amount of estradiol by weight.[66][67][68][69] As a result, 2 mg oral estradiol valerate produces equivalent estradiol levels to about 1.5 mg oral estradiol.[66][67][68][69]
| Compound | Dosage for specific uses (mg usually)[a] | ||||||
|---|---|---|---|---|---|---|---|
| ETD[b] | EPD[b] | MSD[b] | MSD[c] | OID[c] | TSD[c] | ||
| Estradiol (non-micronized) | 30 | ≥120–300 | 120 | 6 | - | - | |
| Estradiol (micronized) | 6–12 | 60–80 | 14–42 | 1–2 | >5 | >8 | |
| Estradiol valerate | 6–12 | 60–80 | 14–42 | 1–2 | - | >8 | |
| Estradiol benzoate | - | 60–140 | - | - | - | - | |
| Estriol | ≥20 | 120–150[d] | 28–126 | 1–6 | >5 | - | |
| Estriol succinate | - | 140–150[d] | 28–126 | 2–6 | - | - | |
| Estrone sulfate | 12 | 60 | 42 | 2 | - | - | |
| Conjugated estrogens | 5–12 | 60–80 | 8.4–25 | 0.625–1.25 | >3.75 | 7.5 | |
| Ethinylestradiol | 200 μg | 1–2 | 280 μg | 20–40 μg | 100 μg | 100 μg | |
| Mestranol | 300 μg | 1.5–3.0 | 300–600 μg | 25–30 μg | >80 μg | - | |
| Quinestrol | 300 μg | 2–4 | 500 μg | 25–50 μg | - | - | |
| Methylestradiol | - | 2 | - | - | - | - | |
| Diethylstilbestrol | 2.5 | 20–30 | 11 | 0.5–2.0 | >5 | 3 | |
| DES dipropionate | - | 15–30 | - | - | - | - | |
| Dienestrol | 5 | 30–40 | 42 | 0.5–4.0 | - | - | |
| Dienestrol diacetate | 3–5 | 30–60 | - | - | - | - | |
| Hexestrol | - | 70–110 | - | - | - | - | |
| Chlorotrianisene | - | >100 | - | - | >48 | - | |
| Methallenestril | - | 400 | - | - | - | - | |
Sources and footnotes: | |||||||
Metabolism and elimination
[edit]When taken orally, about 95% of a dose of estradiol is metabolized in the intestines and liver into estrone and estrogen conjugates such as estrone sulfate, estrone glucuronide, and estradiol sulfate, among others, prior to entering the circulation.[3][88][89][90] As a result, circulating estrone and estrogen conjugate levels are markedly elevated, in a highly unphysiological manner, with oral estradiol.[88][91] Whereas the ratio of circulating estradiol to estrone is about 1:1 in premenopausal women and with transdermal estradiol, oral estradiol produces a ratio of about 1:5 on average and as high as 1:20 in some women.[1][10][92][60] In addition, whereas levels of estradiol with menopausal replacement dosages of oral estradiol are in the range of the follicular phase of the normal menstrual cycle, levels of estrone resemble those during the first trimester of pregnancy.[93][94] Moreover, whereas normal physiological estrone sulfate levels are 10 to 25 times higher than those of estradiol and estrone in premenopausal women,[95] levels of estrone sulfate with oral estradiol are an additional 8 to 20 times higher than normal premenopausal or postmenopausal estrone sulfate levels.[91][96][97] One study found that estrone sulfate levels were 200-fold higher than estradiol levels with 2 mg/day oral micronized estradiol or oral estradiol valerate, and estrone sulfate levels can reach up to nearly 1,000-fold higher concentrations than estradiol in some cases.[10][12] In contrast to oral estradiol, due to the lack of the first pass, an excess in estrone and estrogen conjugate levels does not occur with transdermal estradiol or other parenteral estradiol routes.[88][91]
The transformation of estradiol into estrone and estrogen conjugates is reversible.[10] As such, these metabolites can be converted back into estradiol.[10] About 15% of orally administered estradiol is transformed into estrone and 65% into estrone sulfate.[12] About 5% of estrone and 1.4% of estrone sulfate is converted back into estradiol.[12] An additional 21% of estrone sulfate is converted into estrone, whereas transformation of estrone into estrone sulfate is approximately 54%.[12] The interconversion between estradiol and estrone is mediated by 17β-hydroxysteroid dehydrogenases (17β-HSDs),[12] whereas the conversion of estrone into estrone sulfate is mediated by estrogen sulfotransferases (ESTs) and the transformation of estrone sulfate into estrone by steroid sulfatase (STS).[98][99] The metabolic clearance rates and hence blood half-lives of estrogen conjugates like estrone sulfate are much longer than those of estradiol and estrone.[10][12][91] Estrogen conjugates, primarily estrone sulfate, serve as a large circulating reservoir for estradiol, and because of this, they function to greatly extend the biological half-life of oral estradiol.[10][12] As such, the biological half-life of oral estradiol is a composite parameter that is dependent on interconversion between estradiol and estrogen conjugates, as well as on enterohepatic recirculation.[12] Whereas the biological half-life of estradiol given by intravenous injection is about 0.5 to 2 hours, the biological half-life of oral estradiol has a range of 13 to 20 hours due to the large and long-lasting pool of estrogen conjugates that is formed during first-pass metabolism and that serves to continuously replenish circulating estradiol levels.[12][10][9]
First-pass effect and differences from other routes
[edit]The first-pass effect that occurs with oral estradiol results in unusually high levels of estrone and estrogen conjugates in the circulation as well as of estradiol in the liver.[10] These unique properties of oral estradiol result in a number of pharmacological differences relative to the other routes of administration of estradiol.[10]
The high levels of estrone and estrogen conjugates that occur with oral estradiol raise the question of the pharmacodynamic significance of these metabolites.[10] In contrast to estradiol however, estrone has very low activity as an estrogen.[10][100][101] The affinities of estrone for the human ERs and its estrogenic activity have been reported to be approximately 3 to 4% of those of estradiol.[10] In addition, unlike estradiol and estriol, estrone is not accumulated in target tissues.[10] Because estrone can be transformed into estradiol, most of its activity in vivo is actually due to conversion into estradiol.[10] In accordance, doses of oral and transdermal estradiol that achieve similar levels of estradiol have been found, in spite of markedly elevated levels of estrone with oral estradiol but not with transdermal estradiol, to possess equivalent and non-significantly different potency in terms of clinical measures including suppression of LH and FSH levels, inhibition of bone resorption, and relief of menopausal symptoms such as hot flashes.[10][88][102][103][96][104] In addition, estradiol levels were found to correlate with these effects, while estrone levels did not.[88][102] These findings suggest that estrone contributes very little or not at all to the estrogenic potency of estradiol, while also not antagonizing the estrogenic activity of estradiol.[10][88][102][103] This contradicts some cell-free in-vitro research suggesting that high concentrations of estrone might be able to partially antagonize the actions of estradiol.[105][106][107]
On the other hand, it has been suggested by some authors that the high levels of estrone and/or estrone conjugates with oral estradiol may result in excessive estradiol levels in certain tissues such as the breasts and endometrium, due to high expression in these tissues of the requisite enzymes (17β-HSDs and STS) necessary to transform these metabolites back into estradiol.[94][91][111][112] In accordance, circulating levels of estrone sulfate have been found to be positively associated with breast density in postmenopausal women treated with oral estradiol, with 1.3% higher breast density observed for every 1 ng/mL greater level of estrone sulfate.[113][114] Similarly, levels of estradiol, estrone, and estrone sulfate are all strongly associated with the risk of breast cancer in women.[113] Preclinical studies have shown that estrone sulfate, via local transformation into estradiol, stimulates the growth of mammary cancer cells.[115][116]
Due to the first pass through the liver, disproportionate and supraphysiological levels of estrogens occur locally in the liver with oral estradiol.[117][12] These levels are approximately 4- to 5-fold higher than in the circulation, based on differences in hepatic estrogenic potency for oral estradiol relative to transdermal estradiol.[117][10] As a result, there is abnormally high estrogenic signaling in the liver with oral estradiol, and a variety of unphysiological effects on liver protein synthesis result.[10][12] Through modulation of liver protein synthesis, conjugated oral estrogen increases the risk of blood clots,[118] increases circulating levels of a variety of binding proteins including thyroid binding globulin (TBG), cortisol binding globulin (CBG), sex hormone binding globulin (SHBG), growth hormone binding protein (GHBP),[119] insulin-like growth factor-binding proteins (IGFBPs),[120] and copper binding protein (CBP),[89][121] suppresses growth hormone (GH)-mediated insulin-like growth factor 1 (IGF-1) production,[122][123] and produces positive blood lipid changes, among a variety of other effects.[90][124][12] In contrast to oral estradiol, transdermal estradiol has relatively minimal impact on liver protein synthesis.[10] As an example, a study found that 1 mg/day oral estradiol significantly increased SHBG levels by 45%, while 50 μg/day transdermal estradiol increased SHBG levels non-significantly by only 12%.[125][126][127]
In the circulation, approximately 38% of estradiol is reversibly bound to SHBG and 60% is reversibly bound to albumin in women under normal physiological circumstances, with 2 to 3% of total estradiol circulating free or unbound at any given time.[3][2][1] Only estradiol that is free or unbound is able to be enter target cells and hence is biologically active.[1][12]: 249 [17] The increase in SHBG levels with oral estradiol (e.g., +50%) can result in a clinically meaningful increase in the fractions of sex hormones like estradiol and testosterone that are bound to SHBG, whereas this is not the case with typical clinical dosages of transdermal estradiol.[128][17] The increase in the fraction of estradiol bound to SHBG results in a significant decrease in the percentage of free or unbound and hence bioactive estradiol.[1][17] As a result, the bioavailability and potency of oral estradiol may be diminished relative to parenteral estradiol routes by some amount.[17][1] However, a study found that the free fraction of estradiol was similar with doses of oral and topical estradiol that resulted in equivalent total estradiol levels.[129]
Experimental oral formulations
[edit]Estradiol decanoate, estradiol cyclooctyl acetate, estradiol 3-saccharinylmethyl ether, and EC508 (estradiol 17β-(1-(4-(aminosulfonyl)benzoyl)-L-proline)) are estradiol esters and novel oral forms of estradiol that have been developed with improved properties, such as greater bioavailability and reduced first-pass effect.[130][131][132][133][134][135][136][137][138][139][140][141] Estradiol decanoate and estradiol cyclooctyl acetate were studied for potential use in menopausal hormone therapy and birth control pills but were never marketed.[130][131][132][133][134][135][136][137] EC508 is currently under active development for use in menopausal hormone therapy.[140][141]
Graphs
[edit]-
Estradiol levels after a single oral dose of 2, 4, or 8 mg estradiol in premenopausal women.
-
Estradiol and estrone levels following a single 2 mg dose of oral estradiol in postmenopausal women.
-
Mean estradiol levels during 1 to 8 mg/day oral estradiol therapy alone or in combination with 100 to 200 mg/day spironolactone in transgender women.
-
Percent change in estradiol (E2), estrone (E1), LH, and FSH levels over a 24-hour period following a single dose of 2 mg oral estradiol in women.
-
Levels of estradiol, estrone, and estrone sulfate following a single 2 mg oral dose of estradiol valerate in postmenopausal women.
-
Estradiol levels after a single dose of 2 mg oral estradiol or 2 mg oral estradiol valerate and with continuous administration of 2 mg/day oral estradiol or 2 mg/day oral estradiol valerate (at steady state) in postmenopausal women.
Buccal administration
[edit]
Estradiol has been studied for use by buccal administration.[10][72][142][143][144][145][146][147] Preclinical studies of buccal estradiol have also been conducted.[148][149][150][151] Buccal and sublingual administration of estradiol have similar characteristics.[10]
Administration of a troche (lozenge) containing 0.25 mg estradiol via the buccal route resulted in peak estradiol levels of about 450 pg/mL at 1 hour post-dose in postmenopausal women.[10][142] Following this, estradiol levels decreased to about 60 pg/mL at 4 hours post-dose and to about 15 pg/mL at 12 hours post-dose.[10][142] With continuous twice daily administration of 0.25 mg estradiol (0.5 mg/day total) via the buccal route once every 12 hours, peak estradiol levels at steady state after the last dose were about 500 pg/mL.[10][142]
Sublingual administration
[edit]Estradiol tablets can be taken sublingually instead of orally.[10][152][153] Non-micronized estradiol tablets in doses of 0.125, 0.25, and 1 mg were previously marketed for use by sublingual administration under brand names such as Diogynets, Estradiol Membrettes, and Dimenformon in the 1950s.[154][155][156][157][158] Non-micronized estradiol has poor water solubility, but micronized estradiol is rapidly absorbed by the sublingual route.[152] All oral estradiol tablets are micronized, as this improves the efficiency of estradiol absorption in the gastrointestinal tract.[36] Likewise, all oral estradiol valerate tablets seem to be micronized.[44] The sublingual route is, in actuality, probably a combination of sublingual and oral delivery of estradiol due to incidental swallowing of some of the estradiol.[95]
The absorption of sublingual estradiol can be attributed to the rich vascularization under the tongue.[152] With administration of an oral estradiol tablet sublingually, complete dissolution of the tablet occurs within a few minutes and circulating levels of estradiol begin to rise within 5 minutes.[152] Maximal levels of estradiol occur after 30 to 60 minutes of administration.[152] After this, estradiol levels drop steeply within 4 hours, and this is followed by a more gradual decline in levels of estradiol and a return to baseline concentrations by 24 hours.[152] The rapid rise and steep fall of estradiol levels with sublingual administration of estradiol is analogous to the case of intravenous injection and intranasal administration of the hormone.[10][12][4]
Sublingual administration of medications that are subject to a high first-pass effect with oral administration can result in improved bioavailability because the first pass through the intestines and liver is bypassed.[152] As a result, sublingual estradiol has been found to result in estradiol levels and a ratio of estradiol to estrone that are substantially higher than oral estradiol.[10][152][159] Maximal circulating levels of estradiol are as much as 10-fold higher with sublingual administration than with oral administration, and the absolute bioavailability of estradiol is approximately 5-fold higher.[10][152] On the other hand, levels of estradiol fall rapidly with sublingual administration, whereas they remain elevated for a prolonged period of time with oral administration.[10][12] This is due to the large circulating pool of hormonally inert estrogen conjugates with long half-lives that is reversibly generated with oral estradiol during first-pass metabolism, which serves as a metabolism-resistant and long-lasting reservoir for continuous reconversion back into estradiol.[10][12] It is also responsible for the differences in ratios between sublingual estradiol and oral estradiol in terms of maximal estradiol levels (10:1) achieved and absolute bioavailability (5:1).[10][12] A study in marmoset monkeys found that the bioavailability of sublingual estradiol was 10% of that of estradiol administered by intramuscular injection.[3]
After a dose of sublingual estradiol, levels of estrone start to slowly but progressively rise within 10 minutes.[152] Estrone levels surpass estradiol levels at around 2 hours post-dose and reach a maximum at about 4 hours.[152] It has been speculated that the high delayed levels of estrone with sublingual estradiol may be due to the rich lymphatic drainage in the neck region, which may result in estradiol being taken up by the reticuloendothelial system and then metabolized into estrone.[152]
Sublingual administration of a single 0.25 mg tablet of micronized estradiol has been found to produce peak levels of 300 pg/mL estradiol and 60 pg/mL estrone within 1 hour.[10] A higher dose of 1 mg estradiol was found to result in maximum levels of 450 pg/mL estradiol and 165 pg/mL estrone, which was followed by a rapid decline in estradiol levels to 85 pg/mL within 3 hours.[10] Conversely, the decline in estrone levels was much slower and reached a level of 80 pg/mL after 18 hours.[10] A single administration of 4 mg micronized estradiol (two 2-mg Estrace tablets) under the tongue, considered a very high dose of sublingual estradiol, has been found to result in maximal levels of estradiol of 1759 ± 704 pg/mL, with a range of 634 to 2840 pg/mL, after 1 hour in a mixed group of normotensive and hypertensive postmenopausal women.[160] A replication of this study using the same dosage and protocols measured estradiol levels of 2227 ± 1180 pg/mL for the whole group of women but found that estradiol levels between the normotensive and hypertensive groups were significantly different at 1790 ± 869 pg/mL and 2664 ± 1490 pg/mL, respectively.[161][162]
Although sublingual administration of estradiol has a relatively short duration, the medication can be administered multiple times per day in divided doses to compensate for this.[10][163][164] Studies that used high doses of sublingual estradiol in the treatment of severe postpartum depression have administered a dose of 1 mg 3 to 8 times per day.[165][166][163][164] In one study, which administered a mean total dosage of sublingual estradiol of 4.8 mg/day, estradiol levels remained elevated at about 130 pg/mL on average in the morning before the first dose of the day.[165]
Oral micronized estradiol valerate tablets can be taken sublingually as well.[167][168] The administration of 2 mg oral micronized estradiol valerate tablets (Progynova, Schering) sublingually 3 or 4 times per day resulted in circulating estradiol levels of about 290 pg/mL to 460 pg/mL in premenopausal women (time of measurements not given).[167][168] Steady-state levels of estradiol were achieved within about 5 or 6 days.[167][168] Levels of progesterone, luteinizing hormone, and follicle-stimulating hormone were all considerably suppressed, and ovulation, as well as the associated mid-cycle hormonal surges, were prevented.[167][168] Sublingual estradiol valerate is used for cycle control in egg donation and surrogacy in cisgender women and is used in hormone therapy for transgender women.[167][168][169]
Cyclodextrin-containing formulations of sublingual estradiol with improved water solubility and absorption have been developed and studied.[170][171][172][173][174]
Clinical effects
[edit]The total endometrial proliferation dose of sublingual estradiol in women is 60 to 140 mg per cycle or 14 days and of sublingual estradiol benzoate in women is 60 to 180 mg per cycle or 14 days.[75]: 310 Both sublingual estradiol and sublingual estradiol benzoate have a persistence of estrogenic effect after a dose of only one day.[75]: 310 The effects of sublingual estradiol on gonadotropin levels have also been studied in postmenopausal women.[152][175][153][176] After a dose of sublingual estradiol, levels of luteinizing hormone (LH) and follicle-stimulating hormone (FSH) decrease precipitously within 4 hours.[152] Following this, LH and FSH levels gradually increase, and return to near-baseline levels by 24 hours.[152] One study found no difference between oral and sublingual estradiol in suppression of LH levels.[152] However, FSH levels were suppressed to a greater extent with sublingual estradiol than with oral estradiol in the study.[152]
It is notable that the magnitude of the genomic effects of estradiol (i.e., signaling through the nuclear ERs) may, at least in some cases, be dependent on the total estrogenic exposure as opposed to the duration of exposure.[10] For instance, in normal human epithelial breast cells and ER-positive breast cancer cells, the rate of breast cell proliferation has been found not to differ with estradiol incubation of 1 nM for 24 hours and incubation of 24 nM for 1 hour.[10] In other words, short-term high concentrations and long-term low concentrations of estradiol appear to have the same degree of effect in terms of genomic estrogenic signaling, at least in terms of breast cell proliferation over a 24-hour period.[10] On the other hand, non-genomic actions of estradiol, such as signaling through membrane estrogen receptors like the GPER, may be reduced with short-term high concentrations of estradiol relative to more sustained levels.[10] For instance, although daily intranasal administration of estradiol is associated with comparable clinical effectiveness (e.g., for hot flashes) relative to longer acting routes of estradiol administration in postmenopausal women, it is also associated with significantly lower rates of breast tension (tenderness and enlargement) relative to longer acting estradiol routes, and this is thought to reflect comparatively diminished non-genomic signaling.[10]
Graphs
[edit]-
Estradiol levels over a 24-hour period following a single 0.25, 0.5, or 1 mg dose of sublingual estradiol or a single 0.5 or 1 mg dose of oral estradiol in postmenopausal women. Source: Price et al. (1997).
-
Hormone levels after a single 0.5 mg dose of sublingual estradiol in postmenopausal women. Source: Burnier et al. (1981).
-
Hormone levels after a single 2 mg dose of sublingual estradiol in premenopausal women. Source: Casper & Yen (1981).
-
Hormone levels after a single 0.5 mg dose of sublingual estradiol in postmenopausal women. Source: Fiet et al. (1982).
-
Estradiol levels with 2 to 12 mg/day sublingual estradiol in transgender women. Error bars are SEM. Time of blood collection and time and frequency of administration were not specified. Source: Jain et al. (2019).
-
Hormone levels with 2 mg oral micronized estradiol valerate tablets (Progynova, Schering) taken 3 or 4 times per day (6–8 mg/day total) sublingually (SL) in premenopausal women. Time of blood collection after medication administration was not specified. Sources: Serhal et al. (1989, 1990).
-
Trough estradiol levels and MADRS scores with 1 mg sublingual micronized estradiol 3 to 8 times per day (3 to 8 mg/day total; mean 4.8 mg/day total) in women with postpartum depression. Blood was drawn specifically in the mornings before the first dose of sublingual estradiol for the day. Source: Akohas et al. (2001).
Intranasal administration
[edit]
Estradiol has been studied and used by intranasal administration.[72][10] It was available as a cyclodextrin-containing nasal spray under the brand name Aerodiol in some countries,[178][179][180][181] although this specific product was discontinued in 2007.[182][183] The product was administered once per day as one 150-μg spray in each nostril (300 μg/day total).[184] Intranasal estradiol has pharmacokinetics similar to those of sublingual and intravenous administration of estradiol, including a sharp peak and then rapid decline in estradiol levels.[10] Despite the relatively short duration of intranasal estradiol, it has similar effectiveness to other, longer-lasting routes of administration in terms of relief of menopausal symptoms like hot flashes.[10]
Transdermal administration
[edit]Transdermal estradiol is available in the forms of patches, gels, emulsions, and sprays.[185][186][10][17][187] In the case of gels, emulsions, and sprays, the route is sometimes referred to as topical rather than as transdermal.[186][188][5] Topical administration can also refer to vaginal administration of gels and creams however. [citation needed]
Estradiol has moderate skin permeability, which is based on the lipophilicity and hydrophilicity of a compound.[10][189] In general, the more polar groups, such as hydroxyl groups, that are present in a steroid, and hence the more hydrophilic and less lipophilic it is, the lower its skin permeability.[10][189] For this reason, estrone and progesterone have higher skin permeability, while estriol and cortisol have lower skin permeability.[10] The transdermal bioavailability of estradiol in an alcohol solution is approximately 10%.[190][189] Transdermal estradiol reservoir patches have been reported to have a bioavailability of 3 to 5%.[191] Estradiol is a highly potent compound and circulates at picomolar concentrations (pg/mL), which makes it ideal for transdermal application as only small amounts of substance need to be delivered across the skin.[96] Conversely, progesterone, which circulates at levels in the nanomolar range and requires a far higher quantity of substance for biological effect, is not well-suited for transdermal delivery.[96] Fatty acid esters of estradiol, such as estradiol benzoate, estradiol valerate, and estradiol cypionate, have been found to have similar estrogenic potency to estradiol but a comparatively longer duration with transdermal administration in animal studies.[192][193]
Regardless of administration form, such as patch or gel, transdermal estradiol is transported into the skin, including through the stratum corneum, epidermis, and dermis, by a passive diffusion process.[10][194] Following this, estradiol is then taken up by local capillary blood vessels and delivered into the circulation.[10] There is a depot effect in the skin with transdermal estradiol, which results in continuous delivery of transdermal estradiol into the circulation.[17][194] This is because the skin functions as a semipermeable membrane and there is a concentration gradient between the application site of transdermal estradiol and capillary blood, with the rate of diffusion of estradiol across the stratum corneum being the specific rate-limiting factor in absorption.[10][194] As a result, peaks and troughs in circulating estradiol levels are limited, and the skin and subcutaneous fat act as a reservoir of estradiol that maintains circulating estradiol levels between doses.[17] For these reasons, transdermal estradiol can provide near-constant circulating levels of estradiol, similarly to oral estradiol.[17][10] Enzymes that metabolize estradiol are minimally expressed in the skin, and for this reason, the metabolism of estradiol in the skin is low.[10]
The site of application of transdermal estradiol can influence its bioavailability.[96] A study found comparable absorption of transdermal estradiol patches (within ±25% of reference) for a number of skin sites including the abdomen, upper arm, upper thigh, lower back, and side.[195][196] However, absorption was 15% lower for the upper thigh compared to the abdomen and the difference was significant.[197][196] Another study found that transdermal estradiol patches had 20 to 25% higher bioavailability when applied to the buttocks than when applied to the abdomen.[96] Studies of topical steroids have found that the scrotum is especially permeable among skin sites.[198] Studies of transdermal testosterone cream, gel, and patches applied to the scrotum in men have observed 5- to 8-fold higher levels of testosterone than with application to conventional skin sites.[199][200] In a study of topical application of hydrocortisone solution in men, skin permeability (defined as total radiolabeled urinary excretion) relative to the forearm (1.0) was 42.0 for the scrotum, 13.0 for the jaw angle, 6.0 for the forehead, 3.6 for the underarm, 3.5 for the scalp, 1.7 for the back, 0.8 for the palm of the hand, 0.4 for the ankle, and 0.1 for the sole of the foot.[198][201][202][203] In accordance with findings with other topical steroids, a study in men with prostate cancer treated with transdermal estradiol patches applied to the scrotum observed about 5-fold higher estradiol levels relative to application to conventional skin sites such as the forearm.[204][205] Penile skin may have similarly enhanced absorption characteristics relative to scrotal skin.[206]
Transdermal estradiol bypasses the intestines and liver and hence the first-pass metabolism that is associated with oral administration.[10][96] In addition, unlike oral estradiol, transdermal estradiol is not associated with supraphysiological concentrations of estrone or estrogen conjugates like estradiol sulfate, and transdermal estradiol does not have disproportionate effects on liver protein synthesis.[10][96] In accordance, estradiol, at typical menopausal replacement dosages, has been found not to increase the risk of blood clots or insulin resistance,[118][12] nor to affect hepatic SHBG, IGF-1, GHBP,[119] IGFBP,[120] and other protein production and by extension circulating hepatic protein levels.[122][123][121][96] However, at higher doses, transdermal estradiol has been associated with a significantly higher incidence of stroke in postmenopausal women, probably due to blood clots.[207][208] Another larger study did not find a significantly higher risk of blood clots with similar doses of transdermal estradiol however.[209]
Transdermal patches
[edit]
Estradiol patches have an extended duration and are available for twice-weekly (3–4-day) and once-weekly (7-day) application, while gels, emulsions, and sprays are administered daily.[186][15][10][210] There are two types of estradiol patches: reservoir patches, which have been described as first-generation patches, and matrix patches, which are considered to be improved second-generation patches.[10][12][186] Reservoir patches were designed for twice-weekly application, while matrix patches have been produced for both twice-weekly and once-weekly application.[12] Reservoir patches of estradiol (e.g., Estraderm) are mostly no longer used, with most estradiol patches available today being matrix patches (e.g., Alora, Climara, Esclim, Estradot, FemPatch, Menostar, Oesclim, Vivelle, and Vivelle-Dot).[186]
| Brand name | Dose (µg/day) |
DOA (d) | Size[b][c] (cm2) |
Levels (pg/mL) |
Intro. |
|---|---|---|---|---|---|
| Alora | 25, 50, 75, 100 | 3–4 | 9, 18, 27, 36 | 43–144 | 1996 |
| Climara[d] | 25, 37.5, 50, 60, 75, 100 |
7 | 6.5, 9.375, 12.5, 15, 18.75, 25 |
17–174 | 1994 |
| Climara Pro[e] | E2 (45) LNG (15) |
7 | 22 | 27–54 | 2003 |
| CombiPatch[e] | E2 (50) NETA (14, 25) |
3–4 | 9, 16 | 27–71 | 1998 |
| Menostar | 14 | 7 | 3.25 | 13–21 | 2004 |
| Minivelle | 25, 37.5, 50, 75, 100 |
3–4 | 1.65, 2.48, 3.3, 4.95, 6.6 |
30–117 | 2012 |
| Vivelle | 50, 100 | 3–4 | 14.5, 29 | 30–145 | 2000 |
| Vivelle-Dot[d] | 25, 37.5, 50, 75, 100 |
3–4 | 2.5, 3.75, 5, 7.5, 10 |
30–145 | 1996 |
| |||||
A dosage of 1 mg/day oral estradiol is considered to be roughly equivalent to 25 or 50 μg/day transdermal estradiol and a dosage of 2 mg/day oral estradiol is considered to be equivalent to 50 or 100 μg/day transdermal estradiol depending on the source.[213][97][12][10] Estradiol patches delivering a daily dosage of 0.05 mg (50 μg) achieve mean estradiol and estrone levels of 30 to 65 pg/mL and 40 to 45 pg/mL, respectively, while a daily dosage of 0.1 mg (100 μg) attains respective mean levels of 50 to 90 pg/mL and 30 to 65 pg/mL of estradiol and estrone.[15] In general, Climara-type estradiol transdermal patches have an approximate 1:1 ratio of estradiol delivered in μg/day relative to circulating estradiol concentration in pg/mL.[205] In other words, a 100 μg/day Climara estradiol patch may be expected to produce circulating estradiol levels of around 100 pg/mL.[205] Transdermal estradiol patches produce an estradiol to estrone ratio of about 1:1.[10][12] Following removal of an estradiol patch, circulating estradiol levels decrease to baseline within 24 hours.[10]
Typical dosages of estradiol patches are intended to provide the minimum amount of estrogen replacement necessary for the effective alleviation of menopausal symptoms, and for this reason, they achieve relatively low levels of estradiol.[10] A dosage of two to six 100 μg/day transdermal estradiol patches can achieve mean levels of estradiol in the area of 200 to 400 pg/mL and can be used as a form of high-dose estrogen therapy, for instance to suppress testosterone levels in the treatment of prostate cancer in men and in feminizing hormone therapy for transgender women.[14][214][215] High-dose transdermal estradiol patches have also been studied in the treatment of postpartum depression and postpartum psychosis; in one such study, 200, 400, and 800 μg/day estradiol in the form of transdermal patches resulted in estradiol levels of 286 pg/mL, 675 pg/mL, and 1032 pg/mL, respectively.[216] In another study, estradiol levels with 800 μg/day estradiol in the form of transdermal patches (Estraderm TTS) resulted in estradiol levels of 690 to 815 pg/mL.[217] However, there is erratic absorption and considerable variation in estradiol levels using high-dose estradiol patches both between and within individuals, with one study finding that estradiol levels ranged from 70 pg/mL to 1,045 pg/mL (mean 460.7 pg/mL) with six 100 μg/day estradiol patches.[218][219]
The Prostate Adenocarcinoma: TransCutaneous Hormones (PATCH) study is a randomized controlled trial of high-dose transdermal estradiol patches versus gonadotropin-releasing hormone agonist monotherapy in the treatment of prostate cancer in approximately 2,200 men.[220][221][222] It is specifically comparing three to four 100 μg/day estradiol patches (FemSeven) against goserelin implants.[220] The study was started in March 2006 and is estimated for completion in August 2021.[220] Its objectives include comparison of survival, cardiovascular mortality and morbidity, pharmacological activity (e.g., suppression of testosterone levels), other side effects and toxicities, and quality of life.[220] In addition to the PATCH trial, the Systemic Therapy in Advancing or Metastatic Prostate Cancer: Evaluation of Drug Efficacy (STAMPEDE) study added a high-dose estradiol patches arm (~2,000 men) in July 2017.[223][221][222]
Estradiol patches are associated with local skin reactions and such as irritation in 14.2% of individuals (with reservoir patches), mild-to-moderate erythema (redness) in 50 to 60% of individuals, and allergic reactions due to cutaneous sensitization.[10][12] Up to 5% of people using reservoir patches may discontinue therapy due to skin reactions.[12] Visible adhesive residues are also often left by estradiol patches following their removal.[10] Transdermal estradiol gel can serve as an alternative to transdermal estradiol patches for individuals who experience intolerable skin reactions with them.[224] Estradiol patches should not be applied to the breast as this may result in high local levels of estradiol in the breasts and hence an increased likelihood of breast tenderness.[225]
-
Levels of estradiol over a period of 8 days after a single application of a 50 or 100 μg/day Climara-type (Climara, Menostar, Mylan generic) once-weekly transdermal estradiol matrix patch to the abdomen and removed on day 7 in postmenopausal women.[232]
-
Levels of estradiol and estrone with application of a single 50 µg/day estradiol transdermal reservoir patch (Estraderm) in postmenopausal women.[188]
-
Estradiol level with a single 100 µg/day estradiol reservoir patch (Estraderm) with and without ethanol added in postmenopausal women.[17][233] This patch has a 3- to 4-day duration and is designed for twice-weekly application. In one group, ethanol was injected into the area between the patch and the skin on day 3.[17][233] This gave significantly higher and prolonged estradiol levels.[17][233]
-
Estradiol levels with 50 to 100 μg/day transdermal estradiol patches applied to the forearm and to the scrotum in a crossover study in 2 men with prostate cancer.[204] In 35 men treated continuously with one 100 μg/day estradiol patch scrotally, the mean estradiol level was ~500 pg/mL (range ~125–1,200 pg/mL).[204]
Transdermal gel
[edit]Estradiol is available as a transdermal gel in the form of gel dispensers and gel packets. Major estradiol gel dispenser products include EstroGel and Elestrin while major estradiol gel packet products include DiviGel and Sandrena. Estradiol gels are administered daily.[186][15][10][212] When estradiol is administered as a hydroalcoholic gel, it dries within 2 to 5 minutes following application to the skin.[194] A single application of a transdermal estradiol gel results in a sustained increase in estradiol levels for at least 24 hours.[17][194] The apparent elimination half-life of estradiol with transdermal estradiol gel is 36 hours.[194]
Once daily application of 1.25 g topical gel containing 0.75 mg estradiol (brand name EstroGel) for 2 weeks was found to produce mean peak estradiol and estrone levels of 46.4 pg/mL and 64.2 pg/mL, respectively.[194] The time-averaged levels of circulating estradiol and estrone with this formulation over the 24-hour dose interval were 28.3 pg/mL and 48.6 pg/mL, respectively.[194] Levels of estradiol and estrone are stable and change relatively little over the course of the 24 hours following an application, indicating a long duration of action of this route.[194] Steady-state levels of estradiol are achieved after 3 days of application.[194] A higher dosage of estradiol gel containing 1.5 mg estradiol per daily application has been found to produce mean estradiol levels of 40 to 100 pg/mL and estrone levels of 90 pg/mL, while 3 mg per day has been found to result in respective mean estradiol and estrone levels of 60 to 140 pg/mL and 45 to 155 pg/mL.[15] Topical estradiol gel at a dosage of 3 mg/day has been reported to be equipotent with 2 mg oral estradiol in terms of therapeutic effects and FSH suppression, as well as to produce similar estradiol levels.[129] Transdermal estradiol gel produces an estradiol to estrone ratio of about 1:1.[10][12]
Transdermal estradiol gel can be used as a form of high-dose estrogen in transgender women.[224] However, the doses needed require application to a large surface of skin that amounts to the combined area of both legs for proper absorption.[224] As a result, high-dose transdermal estradiol gel is not a primary choice of estrogen therapy for most transgender individuals.[224] Similarly to transdermal estradiol patches, high-dose transdermal estradiol gel has been studied in the treatment of prostate cancer as well.[235][236][237][238][239][240][241] In these studies, levels of estradiol with estradiol gel or ointment were 84 pg/mL with 3 mg/day, 185 pg/mL with 6 mg/day, 107 pg/mL with 10 mg/day, and 473 pg/mL with 20 mg/day.[236][237][238][239][240][241] In women, high doses of estradiol gel, including 3 mg/day, 4 mg/day, and 8 mg/day, have been reported to produce estradiol levels of 99 pg/mL, 117 pg/mL, and 204 pg/mL, respectively.[242][70]
Studies have found that topical application of estradiol to the breasts increases local levels of estradiol in breast tissue.[243][244][245][246]
The total endometrial proliferation dose of transdermal estradiol gel in women has been reported to be 150 mg per cycle or 14 days.[247][75]: 310 However, it has also been found that 6 mg/day estradiol gel is effective for endometrial proliferation in women.[248]
-
Levels of estradiol and estrone with once daily application of 1.25 g of a transdermal estradiol gel (EstroGel) containing 0.06% or 0.75 mg estradiol after 14 days of continuous therapy in postmenopausal women.[194]
-
Estradiol levels after the last dose with 1 mg/day transdermal estradiol gel applied to different amounts of skin area (200 cm2, 400 cm2, or as large as possible) in postmenopausal women.[250]
Other transdermal formulations
[edit]

Estradiol is available in the form of transdermal emulsions (e.g., Estrasorb) and sprays (e.g., Lenzetto, Evamist).[187] Estradiol emulsions and sprays are administered daily.[186][15][10][212] The pharmacokinetics of these preparations have been studied.[251][252][253]
Variability in pharmacokinetics
[edit]Transdermal estradiol patches are described as delivering a fixed amount of estradiol such as 50 μg/day or 100 μg/day.[10] However, there is large interindividual variability and intraindividual variability in the pharmacokinetic parameters of transdermal estradiol, and fluctuations in circulating estradiol levels with estradiol patches are almost as great as with oral estradiol.[10][96][12][17] As such, the actual delivery rate of estradiol and mean levels of estradiol achieved with transdermal estradiol patches may be different from what is described and from the mean levels observed in clinical studies, respectively.[10]
A wide range of estradiol levels are measured in women using the same estradiol patch or gel and dosage, with an up to about 10-fold difference in levels.[10][96][17] In a study of estradiol gel and patches, the maximal difference in peak levels between individuals was 11-fold for the gel and 7-fold for the patch, and the maximal difference in area-under-the-curve levels (total exposure) was 6-fold for the gel and 8-fold for the patch.[96] It has likewise been reported that the interindividual variability in bioavailability with Estraderm reservoir patches ranges from 25 to 225%.[17] In as many as 30% of women treated with a 50 μg/day estradiol patch, estradiol levels are low.[10] There are also significant short-term intraindividual differences in estradiol levels with estradiol patches; estradiol levels can fluctuate considerably from hour to hour.[10][188] In addition, estradiol levels with estradiol patches are higher in the evening than in the morning, which may be due to circadian variations in skin blood flow that may influence absorption.[10] In terms of area-under-the-curve levels of estradiol, the interindividual variability of transdermal estradiol has been found to be 20 to 44% using different transdermal formulations, and the intraindividual variability with transdermal estradiol has been found to be 20%.[12]
Factors which may contribute to inter- and intraindividual variability with transdermal estradiol include skin location and thickness; hair follicle density; solvent (alcohol) evaporation; skin dehydration, ambient temperature, and humidity; and reservoir size.[17]
Vaginal administration
[edit]Vaginal estradiol is available in the forms of tablets, creams, inserts or suppositories, and rings.[186][10][185] Vaginal estradiol tablets, creams, and inserts are usually administered once daily to twice weekly, whereas vaginal estradiol rings have a sustained action and are replaced once every 90 days.[186][10] Vaginal estradiol can be used both as a systemic form of estradiol therapy, and at very low doses to selectively achieve a local vaginal effect without systemic effects, for instance in the treatment of menopausal symptoms such as vaginal atrophy and dryness.[10][254]
Vaginal estradiol is rapidly and almost completely absorbed.[72] The absorption of vaginal estradiol is slightly greater in women with vaginal atrophy.[72] Vaginal estradiol has high bioavailability and greatly increased potency compared to oral estradiol, with about 10- to 20-fold the comparative potency of oral estradiol.[10] The greater potency of vaginal estradiol relative to oral estradiol is due to the lack of the first pass associated with oral estradiol and due to low local metabolism of estradiol in the vagina.[10] Because of the high estradiol levels achieved, LH and FSH are more strongly suppressed with vaginal estradiol than with other routes.[72]
A daily dosage of 0.5 mg vaginal micronized estradiol has been found to result in estradiol and estrone levels of 250 pg/mL and 130 pg/mL, respectively.[15] Vaginal estradiol has a much higher estradiol-to-estrone ratio in comparison to oral estradiol.[10] The average ratio of estradiol to estrone with vaginal estradiol is 5:1, compared to 1:5 in the case of oral estradiol, a 10-fold difference.[10]
As vaginal estradiol is not subject to a first pass and bypasses the intestines and liver, it does not affect liver protein synthesis at menopausal replacement dosages, similarly to transdermal estradiol.[255] On the other hand, a first pass effect in the uterus may occur with vaginal administration of estradiol and this may have implications for uterine safety.[256]
Rectal administration
[edit]
Estradiol has been assessed for use by rectal administration in a number of studies.[242][70][261][262][263] Uses of estradiol by this route have included treatment of menopausal symptoms in postmenopausal women.[242][70][261][262] Rectal administration of estradiol is described as qualitatively and quantitatively similar to vaginal administration of estradiol.[261][262][264] The use of estradiol by the rectal route considerably bypasses the liver and hence the first-pass metabolism that occurs with oral estradiol, similarly to other parenteral routes of estradiol such as vaginal and transdermal administration.[242][265] Irritation of the intestines does not usually occur with rectal estradiol.[261] The use of estradiol by the rectal route is not well-accepted by all individuals,[261] and due to its inconvenience, it has been said that rectal administration of estradiol has gained no practical clinical importance.[265]
Lauritzen (1986) reported that 3 hours after a single rectal dose of 1 mg micronized estradiol, estradiol levels increased by 620 pg/mL and estrone levels increased by 120 pg/mL.[261][72] Subsequently, Lauritzen (1987, 1990) reported that 0.5 mg/day and 1 mg/day rectal estradiol resulted in respective estradiol levels of 363 pg/mL and 515 pg/mL 6 hours following the last dose.[242][70] These estradiol levels are fairly similar to those achieved by vaginal estradiol.[261][70][72] The estradiol-to-estrone ratio of rectal estradiol is about 5:1, which likewise is the same as that of vaginal estradiol.[242][261][72] Absorption of rectal estradiol occurs rapidly within 30 to 60 minutes, maximal estradiol levels occur at 3 hours post-dose, and circulating estradiol levels are reportedly maintained for 4 to 10 hours.[261][262][72] The duration of rectal estradiol is said to necessitate repeated administration 1 to 2 times per day.[261][262]
Rectal administration of estriol, which has similar properties to estradiol, has also been studied.[266] Administration of a rectal suppository containing 100 mg estriol resulted in estriol levels in pregnant women at term increasing by about 53%.[266] Estriol levels at term are normally between 5,000 and 20,000 pg/mL, which suggests that estriol levels may have increased following the suppository by about 5,000 to 10,000 pg/mL (precise levels were not provided).[267][268][269]
Intramuscular injection
[edit]Intramuscular injections are injections into muscle, for instance the gluteal or deltoid muscle. Estradiol and estradiol esters can be administered in a variety of forms by intramuscular injection.[270][10][271] Aqueous solutions of estradiol and estradiol esters by intramuscular injection have a rapid onset and duration analogously to but slightly more delayed than intravenous injection.[citation needed] However, intramuscular injections of oil solutions, crystalline aqueous suspensions, and emulsions of estradiol and estradiol esters, as well as solutions and suspensions of estradiol polymers and estradiol microspheres, act as long-lasting depot injections.[citation needed]
Estradiol esters, including but not limited to estradiol benzoate, estradiol valerate, estradiol cypionate, estradiol enanthate, and estradiol undecylate, are inactive prodrugs of estradiol that are converted into estradiol in the body.[10][272] The aforementioned estradiol esters are fatty acid esters and are more lipophilic (fat-soluble) than estradiol.[citation needed] More lipophilic compounds are absorbed more slowly from the injection site when given by depot intramuscular injection (as oil solutions, aqueous suspensions, and emulsions), and hence more lipophilic estradiol esters have longer durations than free estradiol or less lipophilic estradiol esters via this route.[citation needed] Polyestradiol phosphate is a polymer of the hydrophilic (water-soluble) estradiol ester estradiol phosphate which circulates in the blood but is metabolized into estradiol very slowly.[citation needed]
The bioavailability of estradiol and estradiol esters given by intramuscular injection is said to be essentially complete.[4] For comparison, the bioavailability of oral estradiol is around 5%.[10] The estradiol levels that result with typical clinical doses of estradiol and estradiol esters by intramuscular injection tend to be high compared to the typical estradiol levels that occur with other clinically used routes and forms of estradiol.[10][16][273][274][13]
Aqueous solutions
[edit]Aqueous solutions are solutions of a compound with water.[citation needed] In contrast to other formulations, such as oil solutions, aqueous suspensions, and emulsions, aqueous solutions of estradiol and estradiol esters by intramuscular injection are not depot injections.[citation needed] Instead, they are rapidly absorbed and eliminated, analogously to intravenous injections of estradiol and estradiol esters.[citation needed] The durations of aqueous solutions of estradiol and estradiol esters by intramuscular injection are measured in hours.[citation needed]
Oil solutions
[edit]Oil solutions are solutions of a compound with oil, for instance sesame oil or castor oil.[citation needed] When free steroids like estradiol are administered in oil solution by intramuscular injection, they are rapidly absorbed and the duration is relatively short.[270][275] A single 1 to 2 mg dose of estradiol in oil solution by intramuscular injection has a duration of about 1 or 2 days.[265][276][277] Little prolongation of duration is achieved with the use of larger doses.[270][278][279] Nonetheless, the duration of estradiol in oil solution by intramuscular injection is significantly longer than an intravenous injection of estradiol or estradiol valerate, which show a duration of only a few hours.[10][12][4][60][280][281]
Conversely, intramuscular injections of estradiol esters in oil solution have durations of days to months, depending on the ester administered.[265] Following a single 4 or 5 mg intramuscular injection in oil solution, peak estradiol levels are about 950 pg/mL with estradiol benzoate after 2 days, 400 to 650 pg/mL with estradiol valerate after 2 days, and 250 to 350 pg/mL with estradiol cypionate after 4 days.[274][16][273] The durations with a 5 mg dose are 4 or 5 days with estradiol benzoate, 7 or 8 days with estradiol valerate, and 11 to 14 days with estradiol cypionate.[274][16][273] The differences in estradiol levels and the different durations with estradiol levels are due to their different rates of release from the oily depot at the injection site.[274] The longer and hence more lipophilic the fatty acid ester, the slower the release from the depot, the lower the peak estradiol levels, and the longer the duration.[274][10][265]
The duration of estradiol esters in oil solution by intramuscular injection is dose-dependent.[282] With estradiol valerate, it is reported that a dose of 5 mg has a duration of 7 to 8 days,[274] 10 mg a duration of 10 to 14 days,[265][282] 40 mg a duration of 2 to 3 weeks, and 100 mg a duration of 3 to 4 weeks.[282] High doses of estradiol valerate, such as 40 mg per week, can achieve pregnancy levels of estradiol.[283] A study of pseudopregnancy with intramuscular injections of 40 mg/week estradiol valerate and 250 mg/week hydroxyprogesterone caproate observed estradiol levels of about 2,500 to 3,000 pg/mL.[283]
Aqueous suspensions
[edit]Aqueous suspensions are suspensions of crystal particles of a compound in water.[citation needed] Estradiol in microcrystalline aqueous suspension for use by intramuscular injection was previously marketed in the 1950s under brand names such as Aquadiol, Diogyn, Progynon Aqueous Suspension, and Progynon Micropellets.[284][285][286][287][288][289][290][291] It was used at a dose of 0.5 to 1.5 mg 2 or 3 times per week.[290] Newman (1950) found that 0.5 to 2 mg once per week was satisfactory.[292] As such, the preparation presumably had a duration in the range of 2 to 7 days.[290][292]
Microcrystalline aqueous suspensions of estradiol esters, for instance of estradiol benzoate (brand names Agofollin Depot alone and Follivirin in combination with testosterone isobutyrate),[293][294] have been found to have longer duration of actions than oil solutions of the same esters when administered via intramuscular injection.[295][296][271][297][298][49][299]: 310 Whereas the duration of a single intramuscular injection of amorphous estradiol benzoate in oil solution is 6 days, the duration of a single intramuscular injection of microcrystalline estradiol benzoate in aqueous suspension is 16 to 21 days.[75][296][300][301]
The duration of crystalline aqueous suspensions is highly dependent on crystal size.[302][303][298][304][305] Steroids and steroid fatty acid esters are lipophilic and have very low water solubility.[306] When they are suspended in the form of crystals in water, these crystals dissolve slowly, releasing steroid from their surfaces in the process.[306][307] The larger the particle sizes of the crystals, the slower the dissolution rate.[306] When a crystalline aqueous suspension of steroid is administered via intramuscular injection, a crystalline depot suspended in fluid is formed locally within the muscle.[306][307] These crystals slowly dissolve and the steroid is gradually absorbed into the body, resulting in the long durations of such preparations.[306][307] Particle sizes of 10 μm or less have no apparent depot effect.[308]
A larger needle size is needed for aqueous suspensions of steroids to allow the steroid crystals to pass through the needle lumen.[309][310] Aqueous suspensions pose a risk of injection site reactions such as local irritation, swelling, and redness, with often severe pain.[303][310] The reactions are worse with larger crystal sizes.[303][311] Particle sizes of more than 300 μm in the case of estradiol benzoate have been found to be too painful for use.[311] The local injection site reactions, which do not occur with oil solutions, have limited the clinical use of aqueous suspensions of estradiol and its esters as well as other steroids.[312][313][314]
Emulsions
[edit]Emulsions are mixtures of immiscible liquids. Water-in-oil emulsions of estradiol benzoate were evaluated as long-acting preparations for use by intramuscular injection in the 1940s and 1950s.[298][271] Formulations of estradiol benzoate alone under the brand name Menformon-Emulsion and with progesterone under the brand name Di-Pro-Emulsion were previously marketed.[315][316] A 10 mg dose of estradiol benzoate in emulsion by intramuscular injection is said to have a duration of about 2 to 3 weeks.[315] This is similar to the duration of an aqueous suspension of 10 mg estradiol benzoate or an oil solution of 10 mg estradiol valerate.[315] Emulsions of steroids by intramuscular injection have similar properties (e.g., duration) relative to aqueous suspensions.[298][271] Painful injection site reactions have been reported with emulsions similarly to suspensions.[317]
Polymers
[edit]Polymers are large molecules of repeating subunits. Polyestradiol phosphate (brand name Estradurin) is a water-soluble estradiol ester in the form of a polymer and a very slowly hydrolyzed prodrug of estradiol.[318][319] It is formulated as an aqueous solution and is given by intramuscular injection.[318][319] The medication has an exceptionally long duration of action, with an elimination half-life of about 70 days or 10 weeks following a single injection.[320] Estradiol levels during polyestradiol phosphate therapy are very constant and uniform.[320] Levels of estradiol after 6 months of treatment with polyestradiol phosphate were about 350, 450, and 650 pg/mL with doses of 160, 240, and 320 mg once per month, respectively.[13] Polyestradiol phosphate has mostly been discontinued and remains available only in a few countries.[319][321]
Microspheres
[edit]Microspheres are microscopic spherical particles which can be used to encapsulate compounds.[citation needed] Estradiol is available in the form of an aqueous suspension of 1.0 mg estradiol in microspheres for use by intramuscular injection once a month under the brand name Juvenum E in Mexico.[322][323] It achieves circulating estradiol levels of 163 pg/mL to 219 pg/mL in the first 3 to 12 hours following injection, which decrease to 42 to 66 pg/mL during the first 4 days post-injection and to 20 to 35 pg/mL after 8 days, with levels remaining in this range thereafter over 30 days.[322] These estradiol levels are similar to the normal levels that occur during the early follicular phase of the menstrual cycle in premenopausal women (24 to 75 pg/mL).[322] The elimination of the formulation follows three phases: a rapid phase in the first 2 days, a second phase during days 2 to 12 days with a biological half-life of 7 to 10 days, and a third phase in which estradiol levels remain elevated above baseline for up to 30 days.[322]
Graphs
[edit]-
Tritiated estradiol radioactivity in blood with a single intramuscular injection of 1.5 to 2.8 μg tritiated estradiol in aqueous solution in four women.[324] Peak blood radioactivity occurred within 15 minutes in three of the women and in the remaining woman after 2 hours.[324] Source: Davis et al. (1963).[324]
-
Estradiol levels after a single intramuscular injection of 5 mg estradiol benzoate, 5 mg estradiol valerate, or 5 mg estradiol cypionate in oil solution in women.[274] Source: Oriowo et al. (1980).[274]
-
Simplified curves of estradiol levels after intramuscular injection of different 5 mg estradiol benzoate, 5 mg estradiol valerate, 5 mg estradiol cypionate, or 10 mg estradiol enanthate in oil solution in women.[326] Source: Garza-Flores (1994).[326]
-
Vaginal cornification with a single intramuscular injection of 5 mg estradiol benzoate, 5 mg estradiol dipropionate, or 5 to 25 mg estradiol cypionate in oil solution in women.[327] Source: Schwartz & Soule (1955).[327]
-
Estradiol levels after a short intravenous infusion of 20 mg estradiol in aqueous solution or an intramuscular injection of an equimolar dose of estradiol benzoate, estradiol valerate, or estradiol undecylate in oil solution in women.[328][280] Sources: Geppert (1975) and Leyendecker et al. (1975).[328][280]
-
Estradiol levels after a single intramuscular injection of 10 mg estradiol valerate or 100 mg estradiol undecylate in oil solution.[329] Source: Vermeulen (1975).[329]
-
Estradiol and testosterone levels after a single intramuscular injection of 320 mg polyestradiol phosphate in aqueous solution in men with prostate cancer.[320] Source: Stege et al. (1996).[320]
-
Estradiol levels after the fourth dose during continuous therapy with estradiol and progesterone microspheres in aqueous suspension by intramuscular injection once per month in menopausal women.[330][331] Source: Espino y Sosa et al. (2019).[330]
Subcutaneous injection
[edit]
Estradiol esters like estradiol valerate and estradiol cypionate can be given by subcutaneous injection instead of intramuscular injection.[332] Subcutaneous and intramuscular injection of estradiol cypionate in an aqueous suspension has been found to result in levels of estradiol and other pharmacokinetic parameters (e.g., duration) that were virtually identical.[8] Studies have shown that subcutaneous injection of closely related steroid esters in oil like the androgen esters testosterone cypionate, testosterone enantate, and nandrolone decanoate is effective and has similar pharmacokinetics to intramuscular injection as well.[333][215][334][335][336][337][338][339] In addition, studies have found that many intramuscular injections are really subcutaneous injections, as individuals often do not actually penetrate deep enough to inject into muscle when attempting to perform an intramuscular injection and instead inject into the subcutaneous fat layer above the muscle.[340][341] This is particularly prevalent with injections into the buttocks and in overweight and obese individuals, due to the thicker layer of fat over muscle.[340][341] Subcutaneous injections of estradiol esters may be easier and less painful to perform than intramuscular injections, and hence may result in improved compliance and satisfaction with therapy.[8]
Subcutaneous implantation
[edit]
Estradiol can be administered in a very long-lasting form via subcutaneous implantation of pure crystalline estradiol compressed into a small solid cylindrical pellet.[10][343] These pellets slowly and completely dissolve and are replaced once every 6 to 12 months, achieving high and very constant circulating levels of estradiol.[10][344][345] They are surgically inserted with the aid of a trocar by a trained physician in a medical office or clinic, and can be placed into locations including the lower abdomen, lower back, buttocks, or hips.[10][344][343] Subcutaneous pellets containing 20 mg estradiol (brand name Meno-Implant) or 25, 50, or 100 mg estradiol (brand name Estradiol Implants; discontinued) for replacement usually once every 6 months (range 4 to 8 months) are or have been available as approved pharmaceutical medications.[345] Up to 800 mg estradiol per implantation has been used.[346] Pharmaceutical estradiol pellet implants have been used almost exclusively in the United Kingdom, but have also been available in Australia and the Netherlands.[347][348] However, estradiol pellets have been discontinued in both the United Kingdom and Australia.[349][350] An estradiol implant has not been approved by the FDA as a pharmaceutical medication in the United States, but hormone pellet implants, including estradiol pellets, are available as custom compounded products in this country.[351][352][353]
Estradiol pellet implants are advantageous in that some women seem to need higher levels of estradiol for adequate relief of menopausal symptoms, and subcutaneous estradiol pellets are easily able to achieve such levels.[345][10] Conversely, this is not necessarily the case with oral or transdermal estradiol.[345][10] Another major advantage of estradiol pellet implants is convenience and guaranteed compliance.[345] They also do not have the issues pertaining to first-pass metabolism and liver protein synthesis of oral estradiol.[345][10] A major disadvantage of estradiol pellet implants is that they cannot be easily removed should this be necessary.[345] There are also concerns about accumulation of estradiol levels with long-term repeated pellet implantation.[345][10] Estradiol levels may remain above baseline for a year or in some cases 3 to 4 years following the last pellet insertion.[345] During this time, progestogen therapy should be continued to avoid the risk of endometrial changes.[345][344] Regular monitoring of estradiol levels and adjustment of dosing is recommended during therapy with estradiol pellet implants.[345]
Tachyphylaxis of relief of vasomotor symptoms, or hot flashes returning even with normal or supraphysiological estradiol levels, may occur in a small subset of cases with estradiol pellet implants.[345][10][347][354][344] The reason for this is unknown, but has been hypothesized to be a paradoxical effect of the high levels of estradiol achieved and/or a result of receptor desensitization caused by the long-term gradually decreasing levels of estradiol.[345][10] Such symptoms have been said to occur once estradiol levels begin to decrease, although there are also reports of such symptoms occurring 3 to 16 weeks (1 to 4 months) after pellet insertion, when estradiol levels should still be constant.[345][10] Hot flashes have notably been reported in pregnant women, who have very high and constantly increasing levels of estradiol.[355] When recurrence of hot flashes occurs with estradiol pellets, treated women often complain that their pellet has "run out".[345] Such symptoms can be temporarily offset with the use of supplemental oral or transdermal estradiol.[345]
Following insertion of an estradiol pellet, levels of estradiol rapidly increase, remain constant for about 4 months, and then gradually decrease.[345] A 25 mg subcutaneous estradiol pellet has been found to result in average estradiol levels of 90 pg/mL for 6 months, while two 25 mg pellets (50 mg total) resulted in estradiol levels of 180 pg/mL after 24 hours and levels of 100 to 120 pg/mL for 6 months.[10] Higher-dose pellets resulted in estradiol levels for 50 mg of 100 pg/mL, for 75 mg of 140 pg/mL, and for 100 mg of 150 pg/mL.[10] Estradiol levels are generally 50% higher than those of estrone, for an estradiol-to-estrone ratio of 1.5:1.[10] Very high levels of estradiol of between 400 and 1,000 pg/mL have been observed in a small subset of women treated with estradiol pellets and notably in those experiencing symptoms of tachyphylaxis.[345][10]
Estradiol pellet implants have been studied in the treatment of prostate cancer in men.[356][357][358][359][360]
Intrauterine administration
[edit]Intrauterine estradiol has been studied in the treatment of uterine hypoplasia in women.[361][362][297]
Intravenous injection
[edit]The administration of estradiol by intravenous injection has been studied.[60][280][363][364][9] It achieves extremely high peak levels of estradiol but has a very short duration.[60][280][9] Kuhnz et al. (1993) reported that a single intravenous injection of 0.3 mg estradiol resulted in peak estradiol concentrations of 8,321 pg/mL at 5 minutes post-injection.[60] Estradiol levels decreased to 1,628 pg/mL after 30 minutes, to 778 pg/mL after 1 hour, and to 23 pg/mL after 6 hours.[60] Leyendecker et al. (1975) reported that a single intravenous injection of 20 mg estradiol resulted in estradiol levels of 2,950 pg/mL at 12 hours after the injection (earlier time points were not measured).[280] Following this, estradiol levels decreased to around 400 pg/mL by 24 hours post-injection and reached near-baseline levels of 45 pg/mL after 48 hours.[280] The ratio of estradiol to estrone is very high initially (e.g., around 10:1 at peak) but becomes smaller as estradiol levels decline.[60][280] The distribution half-life of intravenous estradiol is about 6 minutes and the terminal half-life of intravenous estradiol is about 0.5 to 2 hours.[10][12][4][9] The peak estradiol levels are far higher and the duration far shorter when estradiol is given by intravenous injection than when estradiol esters are administered by intramuscular or subcutaneous injection.[280][10]
The administration of estradiol valerate by intravenous injection has been studied as well.[4][365] It has been found to be very rapidly cleaved into estradiol in the blood.[4][365] The metabolism of estradiol valerate does not differ with intravenous versus intramuscular injection.[365]
While estradiol itself has not been used clinically by intravenous injection, certain estrogen preparations such as conjugated estrogens and estramustine phosphate are available in formulations indicated for intravenous injection.[366] Both of these medications act in part as prodrugs of estradiol.[367][368][369] The intravenous formulation of conjugated estrogens is available at a dose of 25 mg per injection and is used in the treatment of abnormal uterine bleeding due to its ability to rapidly and temporarily enhance coagulation.[366] It has also been used off-label to treat severe bleeding after hysteroscopic metroplasty and as an emergency contraceptive.[366][370][368] The formulation is given in a single injection but can be repeated after 6 to 12 hours if necessary.[366][370][368] Intravenous estramustine phosphate has a relatively long duration and, like oral estramustine phosphate, is used in the treatment of prostate cancer.[369][371] Estramustine phosphate was initially introduced as an intravenous formulation and was only later introduced as an oral medication.[371] Following introduction of the more convenient oral formulation, intravenous estramustine phosphate has largely been abandoned.[371]
The administration of large doses of estrogens intravenously has been studied.[372][373][374]
-
Baseline-corrected levels of estradiol, estrone, and estrone conjugates (e.g., estrone sulfate) after a single intravenous infusion of 0.3 mg estradiol in aqueous solution in women.[60]
-
Estradiol levels after a short intravenous infusion of 20 mg estradiol in aqueous solution or an intramuscular injection of an equimolar dose of estradiol benzoate, estradiol valerate, or estradiol undecylate in oil solution in women.[281][280] Earlier time points than 12 hours post-infusion for intravenous estradiol were not measured.[281][280]
General
[edit]Absorption
[edit]Estradiol is well-absorbed regardless of route of administration.[10] However, the bioavailability of estradiol differs substantially with different routes of administration.[10][4] Oral estradiol has an average bioavailability of around 5%, requiring relatively high dosages of estradiol for effects.[10] Estradiol administered in the form of an ester by intramuscular or subcutaneous injection has complete bioavailability.[4][332][8]
Distribution
[edit]Estradiol is rapidly distributed throughout the body, with a distribution phase of about 6 minutes following intravenous injection.[12] Estradiol is taken up into cells via passive diffusion due to its lipophilicity.[375] Due to binding to the ERs, estradiol is preferentially concentrated in tissues with the highest ER content.[12] In animals, these tissues have included the uterus, vagina, mammary glands, pituitary gland, hypothalamus, other brain regions, adipose tissue, liver, and adrenal glands, among other tissues.[12][376] In contrast to estradiol, due to its low affinities for the ERs, estrone is not accumulated in target tissues.[10] Estradiol has been found to cross the blood–brain barrier in rhesus monkeys.[12] The volume of distribution of estradiol has been found to be 0.85 to 1.17 L/kg.[12] In another study however, its volume of distribution was only 0.082 ± 0.015 L/kg (4.8 L in women of average weight 58.4 kg).[9]
In terms of plasma protein binding, estradiol is bound loosely to albumin and tightly to SHBG, with approximately 97 to 98% of estradiol bound to plasma proteins.[2] In the circulation, approximately 38% of estradiol is bound to SHBG and 60% is bound to albumin, with 2 to 3% free or unbound.[3] However, with oral estradiol, there is an increase in hepatic SHBG production and hence SHBG levels (e.g., +50%), and this results in a relatively reduced fraction of free estradiol.[1][17] As only free estradiol that is not bound to plasma proteins or SHBG is biologically active, this may reduce the potency of oral estradiol by some degree.[12][17] However, a study found that the free fraction of estradiol was similar with doses of oral and topical estradiol that resulted in equivalent total estradiol levels.[129]
Metabolism
[edit] Metabolic pathways of estradiol in humans
|
There are several major pathways of estradiol metabolism, which occur both in the liver and in other tissues:[12][10][1]
- Dehydrogenation by 17β-hydroxysteroid dehydrogenase (17β-HSD) into estrone
- Conjugation by estrogen sulfotransferases and UDP-glucuronyltransferases into C3 and/or C17β estrogen conjugates like estrone sulfate and estradiol glucuronide
- Hydroxylation by cytochrome P450 enzymes such as CYP1A1 and CYP3A4 into catechol estrogens like 2-hydroxyestrone and 2-hydroxyestradiol as well as 16-hydroxylated estrogens like 16α-hydroxyestrone and estriol (16α-hydroxyestradiol)
The liver is almost entirely responsible for metabolism of estradiol.[377]
Both dehydrogenation of estradiol by 17β-HSD into estrone and conjugation into estrogen conjugates are reversible transformations.[12][10] However, in regards to sulfation and desulfation, transformation of estrone into estrone sulfate is predominant relative to the reverse reaction.[12][110]
Estradiol can also be reversibly converted into long-lived lipoidal estradiol forms like estradiol palmitate and estradiol stearate as a minor route of metabolism.[11]
The elimination half-life of estradiol administered via intravenous injection has been found to be 2 hours in men and 27 to 50 minutes in women.[4][9][378][379] Other routes of administration of estradiol like oral administration or intramuscular injection have far longer elimination half-lives and durations of action due to (1) the formation of a large circulating reservoir of metabolism-resistant estrogen conjugates that can be reconverted back into estradiol and/or (2) the formation of slowly-releasing depots.[12][10]
The metabolic clearance rates of estradiol, estrone, and estrone sulfate are 580 L/day/m2, 1,050 L/day/m2, and 80 L/day/m2, respectively.[10]
Elimination
[edit]A single dose of oral estradiol valerate is eliminated 54% in urine and 6% in feces.[1] A substantial amount of estradiol is also excreted in bile.[1] The urinary metabolites of estradiol are predominantly present in the form of estrogen conjugates, including glucuronides and, to a lesser extent, sulfates.[1] The main metabolites of estradiol in urine are estrone glucuronide (13–30%), 2-hydroxyestrone (2.6–10.1%), unchanged estradiol (5.2–7.5%), estriol (2.0–5.9%), and 16α-hydroxyestrone (1.0–2.9%).[1] Following an intravenous injection of labeled estradiol in women, almost 90% is excreted in urine and feces within 4 to 5 days.[378][379] Enterohepatic recirculation causes a delay in excretion of estradiol.[378]
See also
[edit]- Pharmacodynamics of estradiol
- Pharmacodynamics of progesterone
- Pharmacokinetics of progesterone
- Pharmacokinetics of testosterone
References
[edit]- ^ Jump up to: a b c d e f g h i j k l m n o p q r Stanczyk FZ, Archer DF, Bhavnani BR (June 2013). "Ethinyl estradiol and 17β-estradiol in combined oral contraceptives: pharmacokinetics, pharmacodynamics and risk assessment". Contraception. 87 (6): 706–727. doi:10.1016/j.contraception.2012.12.011. PMID 23375353.
- ^ Jump up to: a b c d e f O'Connell MB (1995). "Pharmacokinetic and pharmacologic variation between different estrogen products". J Clin Pharmacol. 35 (9 Suppl): 18S–24S. doi:10.1002/j.1552-4604.1995.tb04143.x. PMID 8530713. S2CID 10159196.
- ^ Jump up to: a b c d e f g h i j k Kuhnz W, Blode H, Zimmermann H (1993). "Pharmacokinetics of Exogenous Natural and Synthetic Estrogens and Antiestrogens". Estrogens and Antiestrogens II. Handbook of Experimental Pharmacology. Vol. 135 / 2. pp. 261–322. doi:10.1007/978-3-642-60107-1_15. ISBN 978-3-642-64261-6. ISSN 0171-2004.
- ^ Jump up to: a b c d e f g h i j k l Düsterberg B, Nishino Y (1982). "Pharmacokinetic and pharmacological features of oestradiol valerate". Maturitas. 4 (4): 315–24. doi:10.1016/0378-5122(82)90064-0. PMID 7169965.
- ^ Jump up to: a b Falcone T, Hurd WW (2007). Clinical Reproductive Medicine and Surgery. Elsevier Health Sciences. pp. 22, 362, 388. ISBN 978-0-323-03309-1.
- ^ Price TM, Blauer KL, Hansen M, Stanczyk F, Lobo R, Bates GW (March 1997). "Single-dose pharmacokinetics of sublingual versus oral administration of micronized 17 beta-estradiol". Obstetrics and Gynecology. 89 (3): 340–345. doi:10.1016/S0029-7844(96)00513-3. PMID 9052581. S2CID 71641652.
- ^ Naunton M, Al Hadithy AF, Brouwers JR, Archer DF (2006). "Estradiol gel: review of the pharmacology, pharmacokinetics, efficacy, and safety in menopausal women". Menopause. 13 (3): 517–527. doi:10.1097/01.gme.0000191881.52175.8c. PMID 16735950. S2CID 42748448.
- ^ Jump up to: a b c d e Sierra-Ramírez JA, Lara-Ricalde R, Lujan M, Velázquez-Ramírez N, Godínez-Victoria M, Hernádez-Munguía IA, et al. (December 2011). "Comparative pharmacokinetics and pharmacodynamics after subcutaneous and intramuscular administration of medroxyprogesterone acetate (25 mg) and estradiol cypionate (5 mg)". Contraception. 84 (6): 565–570. doi:10.1016/j.contraception.2011.03.014. PMID 22078184.
- ^ Jump up to: a b c d e f g White CM, Ferraro-Borgida MJ, Fossati AT, McGill CC, Ahlberg AW, Feng YJ, et al. (1998). "The pharmacokinetics of intravenous estradiol--a preliminary study". Pharmacotherapy. 18 (6): 1343–1346. doi:10.1002/j.1875-9114.1998.tb03157.x. PMID 9855336. S2CID 9970669.
- ^ Jump up to: a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at au av aw ax ay az ba bb bc bd be bf bg bh bi bj bk bl bm bn bo bp bq br bs bt bu bv bw bx by bz ca cb cc cd ce cf cg ch ci cj ck cl cm cn co cp cq cr cs ct cu cv cw cx cy cz da db dc dd de df dg dh di dj dk dl dm dn do dp dq dr ds dt du Kuhl H (2005). "Pharmacology of estrogens and progestogens: influence of different routes of administration" (PDF). Climacteric. 8 (Suppl 1): 3–63. doi:10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
- ^ Jump up to: a b Oettel M, Schillinger E (6 December 2012). Estrogens and Antiestrogens I: Physiology and Mechanisms of Action of Estrogens and Antiestrogens. Springer Science & Business Media. pp. 121, 226, 235–237. ISBN 978-3-642-58616-3.
- ^ Jump up to: a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq Oettel M, Schillinger E (6 December 2012). Estrogens and Antiestrogens II: Pharmacology and Clinical Application of Estrogens and Antiestrogen. Springer Science & Business Media. pp. 163–178, 235–237, 252–253, 261–276, 538–543. ISBN 978-3-642-60107-1.
- ^ Jump up to: a b c Stege R, Carlström K, Collste L, Eriksson A, Henriksson P, Pousette A (1988). "Single drug polyestradiol phosphate therapy in prostatic cancer". Am. J. Clin. Oncol. 11 (Suppl 2): S101–3. doi:10.1097/00000421-198801102-00024. PMID 3242384. S2CID 32650111.
- ^ Jump up to: a b c Ockrim JL, Lalani EN, Laniado ME, Carter SS, Abel PD (May 2003). "Transdermal estradiol therapy for advanced prostate cancer--forward to the past?". J. Urol. 169 (5): 1735–7. doi:10.1097/01.ju.0000061024.75334.40. PMID 12686820.
- ^ Jump up to: a b c d e f g h i Lobo RA (5 June 2007). Treatment of the Postmenopausal Woman: Basic and Clinical Aspects. Academic Press. pp. 177, 217–226, 770–771. ISBN 978-0-08-055309-2.
- ^ Jump up to: a b c d Notelovitz M, van Keep PA (6 December 2012). The Climacteric in Perspective: Proceedings of the Fourth International Congress on the Menopause, held at Lake Buena Vista, Florida, October 28 – November 2, 1984. Springer Science & Business Media. pp. 397, 399. ISBN 978-94-009-4145-8.
[...] following the menopause, circulating estradiol levels decrease from a premenopausal mean of 120 pg/mL to only 13 pg/mL.
- ^ Jump up to: a b c d e f g h i j k l m n o p q r s Christian C, von Schoultz B (15 March 1994). Hormone Replacement Therapy: Standardized or Individually Adapted Doses?. CRC Press. pp. 9–16, 60. ISBN 978-1-85070-545-1.
The mean integrated estradiol level during a full 28-day normal cycle is around 80 pg/mL.
- ^ Müller EE, MacLeod RM (6 December 2012). Neuroendocrine Perspectives. Springer Science & Business Media. pp. 121–. ISBN 978-1-4612-3554-5.
[...] [premenopausal] mean [estradiol] concentration of 150 pg/mL [...]
- ^ Becker KL (2001). Principles and Practice of Endocrinology and Metabolism. Lippincott Williams & Wilkins. pp. 889, 1059–1060, 2153. ISBN 978-0-7817-1750-2.
- ^ "ARCHITECT Estradiol assay" (PDF). Abbott Laboratories. November 2009. Archived from the original (PDF) on 27 November 2021. Retrieved 20 December 2018.
- ^ Troisi R, Potischman N, Roberts JM, Harger G, Markovic N, Cole B, Lykins D, Siiteri P, Hoover RN (2003). "Correlation of serum hormone concentrations in maternal and umbilical cord samples". Cancer Epidemiol. Biomarkers Prev. 12 (5): 452–6. PMID 12750241.
- ^ "Drugs@FDA: FDA Approved Drug Products". United States Food and Drug Administration. Retrieved 26 July 2018.
- ^ Lobo RA (5 June 2007). Treatment of the Postmenopausal Woman: Basic and Clinical Aspects. Academic Press. pp. 177, 217–226, 770–771. ISBN 978-0-08-055309-2.
- ^ Falcone T, Hurd WW (14 June 2017). Clinical Reproductive Medicine and Surgery: A Practical Guide. Springer. pp. 179–. ISBN 978-3-319-52210-4.
- ^ Becker KL (2001). Principles and Practice of Endocrinology and Metabolism. Lippincott Williams & Wilkins. pp. 889, 1059–1060, 2153. ISBN 978-0-7817-1750-2.
- ^ Kleemann A, Engel J, Kutscher B, Reichert D (14 May 2014). Pharmaceutical Substances, 5th Edition, 2009: Syntheses, Patents and Applications of the most relevant APIs. Thieme. pp. 1167–1174. ISBN 978-3-13-179525-0.
- ^ Muller (19 June 1998). European Drug Index: European Drug Registrations, Fourth Edition. CRC Press. pp. 276, 454–455, 566–567. ISBN 978-3-7692-2114-5.
- ^ Krishna UR, Sheriar NK (1996). Menopause. Orient Blackswan. pp. 70–. ISBN 978-81-250-0910-8.
- ^ "NNR: Products Recently Accepted by the A. M. A. Council on Pharmacy and Chemistry". Journal of the American Pharmaceutical Association (Practical Pharmacy ed.). 10 (11): 692–694. 1949. doi:10.1016/S0095-9561(16)31995-8. ISSN 0095-9561.
- ^ "AERODIOL (Oestradiol hemihydrate 150 micrograms/actuation)" (PDF). Servier Laboratories (Aust) Pty Ltd.
- ^ "Estradiol". Drugs.com.
- ^ Sahin FK, Koken G, Cosar E, Arioz DT, Degirmenci B, Albayrak R, Acar M (2008). "Effect of Aerodiol administration on ocular arteries in postmenopausal women". Gynecol. Endocrinol. 24 (4): 173–7. doi:10.1080/09513590701807431. PMID 18382901.
300 μg 17β-estradiol (Aerodiol®; Servier, Chambrayles-Tours, France) was administered via the nasal route by a gynecologist. This product is unavailable after March 31, 2007 because its manufacturing and marketing are being discontinued.
- ^ Plouffe Jr L, Ravnikar VA, Speroff L, Watts NB (6 December 2012). Comprehensive Management of Menopause. Springer Science & Business Media. pp. 271–. ISBN 978-1-4612-4330-4.
- ^ Hospital Formulary and Compendium of Useful Information. University of California Press. 1952. pp. 49–. GGKEY:2UAAZRZ5LN0.
- ^ Leidenberger FA (17 April 2013). Klinische Endokrinologie für Frauenärzte. Springer-Verlag. pp. 527–. ISBN 978-3-662-08110-5.
- ^ Jump up to: a b c d Meikle AW (1 June 1999). Hormone Replacement Therapy. Springer Science & Business Media. pp. 380–. ISBN 978-1-59259-700-0.
- ^ Jump up to: a b James VH, Pasqualini JR (22 October 2013). Hormonal Steroids: Proceedings of the Sixth International Congress on Hormonal Steroids. Elsevier Science. pp. 821–. ISBN 978-1-4831-9067-9.
- ^ Jump up to: a b c d e f g h i Englund DE, Johansson ED (1981). "Oral versus vaginal absorption in oestradiol in postmenopausal women. Effects of different particles sizes". Upsala Journal of Medical Sciences. 86 (3): 297–307. doi:10.3109/03009738109179241. PMID 7324289.
- ^ Dosage Form Design Considerations. Elsevier Science. 28 July 2018. pp. 159–. ISBN 978-0-12-814424-4.
- ^ Jump up to: a b c d e Henzl MR (1978). "Natural and Synthetic Female Sex Hormones". In Yen SS, Jaffe RB (eds.). Reproductive Endocrinology: Physiology, Pathophysiology, and Clinical Management. W.B. Saunders Co. pp. 421–468. ISBN 978-0-7216-9625-6.
- ^ Stanczyk FZ (1998). "Pharmacological background of estrogen replacement therapy and continuance". In Fraser IS, Jansen RP, Lobo RA, Whitehead MI (eds.). Estrogens and Progestogens in Clinical Practice. Churchill Livingstone. pp. 655–666. ISBN 978-0-443-04706-0.
- ^ Jump up to: a b c Yen SS, Martin PL, Burnier AM, Czekala NM, Greaney MO, Callantine MR (March 1975). "Circulating estradiol, estrone and gonadotropin levels following the administration of orally active 17beta-estradiol in postmenopausal women". The Journal of Clinical Endocrinology and Metabolism. 40 (3): 518–521. doi:10.1210/jcem-40-3-518. PMID 1117058.
- ^ Hammond CB, Maxson WS (June 1986). "Estrogen replacement therapy". Clin Obstet Gynecol. 29 (2): 407–30. doi:10.1097/00003081-198606000-00022. PMID 3522011. S2CID 31166713.
A micronized form of estradiol in which 80% of the particles present are 20 × 106 M or less results in effective oral, sublingual, or vaginal absorption.61
- ^ Jump up to: a b Devroey P, Pados G (1998). "Preparation of endometrium for egg donation". Hum. Reprod. Update. 4 (6): 856–61. doi:10.1093/humupd/4.6.856. PMID 10098476.
Oestradiol valerate and oestradiol in a micronized form are the most widely used oestrogen per os for steroid substitution therapy. Our regimen, as of most other groups [...] is oestradiol valerate (Progynova; Schering, Berlin, Germany) given in various concentrations throughout the cycle [...]. According to Norfolk's protocol, 2 mg of micronized oestradiol valerate are given on cycle days 1–5. [...] In tablet form, micronized oestradiol valerate is also efficiently absorbed [...]
- ^ Jump up to: a b Martin PL, Burnier AM, Greaney MO (May 1972). "Oral menopausal therapy using 17- micronized estradiol. A preliminary study of effectiveness, tolerance and patient preference". Obstetrics and Gynecology. 39 (5): 771–774. PMID 5023261.
- ^ Jump up to: a b Herr F, Revesz C, Manson AJ, Jewell JB (1970). "Biological Properties of Estrogen Sulfates". Chemical and Biological Aspects of Steroid Conjugation. pp. 368–408. doi:10.1007/978-3-642-49793-3_8 (inactive 1 September 2024). ISBN 978-3-642-49506-9.
{{cite book}}: CS1 maint: DOI inactive as of September 2024 (link) - ^ Martinez-Manautou J, Rudel HW (1966). "Antiovulatory Activity of Several Synthetic and Natural Estrogens". In Greenblatt RB (ed.). Ovulation: Stimulation, Suppression, and Detection. Lippincott. pp. 243–253. ISBN 9780397590100.
- ^ Jump up to: a b Martinez-Manautou J, Rudel HW (1966). "Antiovulatory Activity of Several Synthetic and Natural Estrogens". In Robert Benjamin Greenblatt (ed.). Ovulation: Stimulation, Suppression, and Detection. Lippincott. pp. 243–253.
- ^ Jump up to: a b Dorfman RI (5 December 2016). Steroidal Activity in Experimental Animals and Man. Elsevier Science. pp. 40, 392. ISBN 978-1-4832-7299-3.
Ferin (1952) also studied duration of action in women with estrogen deficiency by recording the days of freedom from hot flushes. He rates estradiol-3-benzoate, estradiol-3-furoate, estradiol dipropionate, estradiol-17-caprylate, estradiol-3-benzoate-17-caprylate in oil, and finally estradiol-3-benzoate in emulsion or as microcrystals in that order of duration of action. After 10 mg. of each of the above preparations, a woman would typically remain free of symptoms for 10 days. This could, however, be as much as 50 days.
- ^ Horsky J, Presl J (6 December 2012). Ovarian Function and its Disorders: Diagnosis and Therapy. Springer Science & Business Media. pp. 313–. ISBN 978-94-009-8195-9.
- ^ Brotherton J (1976). Sex Hormone Pharmacology. Academic Press. p. 34. ISBN 978-0-12-137250-7.
- ^ Gibian H, Kopp R, Kramer M, Neumann F, Richter H (1968). "Effect of particle size on biological activity of norethisterone acetate". Acta Physiologica Latino Americana. 18 (4): 323–326. PMID 5753386.
- ^ He CH, Shi YE, Liao DL, Zhu YH, Xu JQ, Matlin SA, et al. (May 1990). "Comparative cross-over pharmacokinetic study on two types of postcoital contraceptive tablets containing levonorgestrel". Contraception. 41 (5): 557–567. doi:10.1016/0010-7824(90)90064-3. PMID 2112080.
- ^ Göretzlehner G, Lauritzen C, Römer T, Rossmanith W (30 November 2011). Praktische Hormontherapie in der Gynäkologie. Walter de Gruyter. pp. 44–. ISBN 978-3-11-024568-4.
- ^ Ryden AB (1950). "Natural and synthetic oestrogenic substances; their relative effectiveness when administered orally". Acta Endocrinologica. 4 (2): 121–139. doi:10.1530/acta.0.0040121. PMID 15432047.
- ^ Ryden A (1947). "Natural and synthetic estrogenic substances; a comparison of the effect upon the endometrium in castrated women". Acta Pathologica et Microbiologica Scandinavica. 24 (3–4): 213–241. doi:10.1111/j.1699-0463.1947.tb00592.x. PMID 18900891.
- ^ Kottmeier HL (1947). "Ueber blutungen in der menopause: Speziell der klinischen bedeutung eines endometriums mit zeichen hormonaler beeinflussung: Part I". Acta Obstetricia et Gynecologica Scandinavica. 27 (s6): 1–121. doi:10.3109/00016344709154486. ISSN 0001-6349. S2CID 81371648.
There is no doubt that the conversion of the endometrium with injections of both synthetic and native estrogenic hormone preparations succeeds, but the opinion whether native, orally administered preparations can produce a proliferation mucosa changes with different authors. PEDERSEN-BJERGAARD (1939) was able to show that 90% of the folliculin taken up in the blood of the vena portae is inactivated in the liver. Neither KAUFMANN (1933, 1935), RAUSCHER (1939, 1942) nor HERRNBERGER (1941) succeeded in bringing a castration endometrium into proliferation using large doses of orally administered preparations of estrone or estradiol. Other results are reported by NEUSTAEDTER (1939), LAUTERWEIN (1940) and FERIN (1941); they succeeded in converting an atrophic castration endometrium into an unambiguous proliferation mucosa with 120–300 mg oestradiol or with 380 mg oestrone.
- ^ Kvorning I, Christensen MS (1981). "Bioavailability of Four Oestradiol Suspensions with Different Particle-Sizes - In Vivo/In Vitro Correlation". Drug Development and Industrial Pharmacy. 7 (3). Informa UK Limited: 289–303. doi:10.3109/03639048109051946. ISSN 0363-9045.
- ^ Jump up to: a b c d e f g h Fotherby K (August 1996). "Bioavailability of orally administered sex steroids used in oral contraception and hormone replacement therapy". Contraception. 54 (2): 59–69. doi:10.1016/0010-7824(96)00136-9. PMID 8842581.
- ^ Jump up to: a b c d e f g h i j k Kuhnz W, Gansau C, Mahler M (September 1993). "Pharmacokinetics of estradiol, free and total estrone, in young women following single intravenous and oral administration of 17β-estradiol". Arzneimittelforschung. 43 (9): 966–73. ISSN 0004-4172. PMID 8240460.
- ^ Leinung MC, Feustel PJ, Joseph J (2018). "Hormonal Treatment of Transgender Women with Oral Estradiol". Transgend Health. 3 (1): 74–81. doi:10.1089/trgh.2017.0035. PMC 5944393. PMID 29756046.
- ^ Lewin A, Pisov G, Turgeman R, Fatum M, Shufaro Y, Simon A, Laufer N, Revel A, Reubinoff B, Safran A (April 2002). "Simplified artificial endometrial preparation, using oral estradiol and novel vaginal progesterone tablets: a prospective randomized study". Gynecol. Endocrinol. 16 (2): 131–6. doi:10.1080/gye.16.2.131.136. PMID 12012623. S2CID 40295755.
- ^ Ellis MJ, Gao F, Dehdashti F, Jeffe DB, Marcom PK, Carey LA, Dickler MN, Silverman P, Fleming GF, Kommareddy A, Jamalabadi-Majidi S, Crowder R, Siegel BA (August 2009). "Lower-dose vs high-dose oral estradiol therapy of hormone receptor-positive, aromatase inhibitor-resistant advanced breast cancer: a phase 2 randomized study". JAMA. 302 (7): 774–80. doi:10.1001/jama.2009.1204. PMC 3460383. PMID 19690310.
- ^ Jump up to: a b c Kuhl H (September 1990). "Pharmacokinetics of oestrogens and progestogens". Maturitas. 12 (3): 171–197. doi:10.1016/0378-5122(90)90003-o. PMID 2170822.
- ^ Jump up to: a b Fotherby K (1976). "Pharmacology of Natural and Synthetic Estrogens". In Campbell S (ed.). The Management of the Menopause & Post-Menopausal Years: The Proceedings of the International Symposium held in London 24–26 November 1975 Arranged by the Institute of Obstetrics and Gynaecology, The University of London. pp. 87–95. doi:10.1007/978-94-011-6165-7_7. ISBN 978-94-011-6165-7.
- ^ Jump up to: a b Fruzzetti F, Bitzer J (January 2010). "Review of clinical experience with estradiol in combined oral contraceptives". Contraception. 81 (1): 8–15. doi:10.1016/j.contraception.2009.08.010. PMID 20004267.
- ^ Jump up to: a b Vree TB, Timmer CJ (August 1998). "Enterohepatic cycling and pharmacokinetics of oestradiol in postmenopausal women". The Journal of Pharmacy and Pharmacology. 50 (8): 857–864. doi:10.1111/j.2042-7158.1998.tb04000.x. PMID 9751449. S2CID 23550553.
- ^ Jump up to: a b Timmer CJ, Geurts TB (1999). "Bioequivalence assessment of three different estradiol formulations in postmenopausal women in an open, randomized, single-dose, 3-way cross-over study". European Journal of Drug Metabolism and Pharmacokinetics. 24 (1): 47–53. doi:10.1007/BF03190010. PMID 10412891. S2CID 20513936.
- ^ Jump up to: a b Wiegratz I, Fink T, Rohr UD, Lang E, Leukel P, Kuhl H (September 2001). "[Cross-over comparison of the pharmacokinetics of estradiol during hormone replacement therapy with estradiol valerate or micronized estradiol]" [Cross-over comparison of the pharmacokinetics of estradiol during hormone replacement therapy with estradiol valerate or micronized estradiol]. Zentralblatt für Gynäkologie (in German). 123 (9): 505–512. doi:10.1055/s-2001-18223. PMID 11709743. S2CID 260353858.
- ^ Jump up to: a b c d e f g Lauritzen C (September 1990). "Clinical use of oestrogens and progestogens". Maturitas. 12 (3): 199–214. doi:10.1016/0378-5122(90)90004-P. PMID 2215269.
- ^ Lauritzen C (June 1977). "[Estrogen thearpy in practice. 3. Estrogen preparations and combination preparations]" [Estrogen therapy in practice. 3. Estrogen preparations and combination preparations]. Fortschritte Der Medizin (in German). 95 (21): 1388–92. PMID 559617.
- ^ Jump up to: a b c d e f g h i j k Wolf AS, Schneider HP (12 March 2013). Östrogene in Diagnostik und Therapie. Springer-Verlag. pp. 78–. ISBN 978-3-642-75101-1.
- ^ Göretzlehner G, Lauritzen C, Römer T, Rossmanith W (1 January 2012). Praktische Hormontherapie in der Gynäkologie. Walter de Gruyter. pp. 44–. ISBN 978-3-11-024568-4.
- ^ Knörr K, Beller FK, Lauritzen C (17 April 2013). Lehrbuch der Gynäkologie. Springer-Verlag. pp. 212–213. ISBN 978-3-662-00942-0.
- ^ Jump up to: a b c d e Horský J, Presl J (1981). "Hormonal Treatment of Disorders of the Menstrual Cycle". In Horsky J, Presl J (eds.). Ovarian Function and its Disorders: Diagnosis and Therapy. Springer Science & Business Media. pp. 309–332. doi:10.1007/978-94-009-8195-9_11. ISBN 978-94-009-8195-9.
- ^ Pschyrembel W (1968). Praktische Gynäkologie: für Studierende und Ärzte. Walter de Gruyter. pp. 598–599. ISBN 978-3-11-150424-7.
- ^ Lauritzen CH (January 1976). "The female climacteric syndrome: significance, problems, treatment". Acta Obstetricia Et Gynecologica Scandinavica. Supplement. 51: 47–61. doi:10.3109/00016347509156433. PMID 779393.
- ^ Lauritzen C (1975). "The Female Climacteric Syndrome: Significance, Problems, Treatment". Acta Obstetricia et Gynecologica Scandinavica. 54 (s51): 48–61. doi:10.3109/00016347509156433. ISSN 0001-6349.
- ^ Kopera H (1991). "Hormone der Gonaden". Hormonelle Therapie für die Frau. Kliniktaschenbücher. pp. 59–124. doi:10.1007/978-3-642-95670-6_6. ISBN 978-3-540-54554-5. ISSN 0172-777X.
- ^ Scott WW, Menon M, Walsh PC (April 1980). "Hormonal Therapy of Prostatic Cancer". Cancer. 45 (Suppl 7): 1929–1936. doi:10.1002/cncr.1980.45.s7.1929. PMID 29603164.
- ^ Leinung MC, Feustel PJ, Joseph J (2018). "Hormonal Treatment of Transgender Women with Oral Estradiol". Transgender Health. 3 (1): 74–81. doi:10.1089/trgh.2017.0035. PMC 5944393. PMID 29756046.
- ^ Ryden AB (1950). "Natural and synthetic oestrogenic substances; their relative effectiveness when administered orally". Acta Endocrinologica. 4 (2): 121–39. doi:10.1530/acta.0.0040121. PMID 15432047.
- ^ Ryden AB (1951). "The effectiveness of natural and synthetic oestrogenic substances in women". Acta Endocrinologica. 8 (2): 175–91. doi:10.1530/acta.0.0080175. PMID 14902290.
- ^ Kottmeier HL (1947). "Ueber blutungen in der menopause: Speziell der klinischen bedeutung eines endometriums mit zeichen hormonaler beeinflussung: Part I". Acta Obstetricia et Gynecologica Scandinavica. 27 (s6): 1–121. doi:10.3109/00016344709154486. ISSN 0001-6349.
There is no doubt that the conversion of the endometrium with injections of both synthetic and native estrogenic hormone preparations succeeds, but the opinion whether native, orally administered preparations can produce a proliferation mucosa changes with different authors. PEDERSEN-BJERGAARD (1939) was able to show that 90% of the folliculin taken up in the blood of the vena portae is inactivated in the liver. Neither KAUFMANN (1933, 1935), RAUSCHER (1939, 1942) nor HERRNBERGER (1941) succeeded in bringing a castration endometrium into proliferation using large doses of orally administered preparations of estrone or estradiol. Other results are reported by NEUSTAEDTER (1939), LAUTERWEIN (1940) and FERIN (1941); they succeeded in converting an atrophic castration endometrium into an unambiguous proliferation mucosa with 120–300 oestradiol or with 380 oestrone.
- ^ Rietbrock N, Staib AH, Loew D (11 March 2013). Klinische Pharmakologie: Arzneitherapie. Springer-Verlag. pp. 426–. ISBN 978-3-642-57636-2.
- ^ Herr F, Revesz C, Manson AJ, Jewell JB (1970). "Biological Properties of Estrogen Sulfates". Chemical and Biological Aspects of Steroid Conjugation. pp. 368–408. doi:10.1007/978-3-642-49793-3_8. ISBN 978-3-642-49506-9.
- ^ Duncan CJ, Kistner RW, Mansell H (October 1956). "Suppression of ovulation by trip-anisyl chloroethylene (TACE)". Obstetrics and Gynecology. 8 (4): 399–407. PMID 13370006.
- ^ Jump up to: a b c d e f Selby P, McGarrigle HH, Peacock M (March 1989). "Comparison of the effects of oral and transdermal oestradiol administration on oestrogen metabolism, protein synthesis, gonadotrophin release, bone turnover and climacteric symptoms in postmenopausal women". Clinical Endocrinology. 30 (3): 241–249. doi:10.1111/j.1365-2265.1989.tb02232.x. PMID 2512035. S2CID 26077537.
- ^ Jump up to: a b Wang-Cheng R, Neuner JM, Barnabei VM (2007). Menopause. ACP Press. pp. 91–. ISBN 978-1-930513-83-9.
- ^ Jump up to: a b Anderson JJ, Garner SC (24 October 1995). Calcium and Phosphorus in Health and Disease. CRC Press. pp. 215–216. ISBN 978-0-8493-7845-4.
- ^ Jump up to: a b c d e Slater CC, Hodis HN, Mack WJ, Shoupe D, Paulson RJ, Stanczyk FZ (2001). "Markedly elevated levels of estrone sulfate after long-term oral, but not transdermal, administration of estradiol in postmenopausal women". Menopause. 8 (3): 200–203. doi:10.1097/00042192-200105000-00009. PMID 11355042. S2CID 19233142.
- ^ Hogervorst E (24 September 2009). Hormones, Cognition and Dementia: State of the Art and Emergent Therapeutic Strategies. Cambridge University Press. pp. 82–. ISBN 978-0-521-89937-6.
- ^ Wright JV (December 2005). "Bio-identical steroid hormone replacement: selected observations from 23 years of clinical and laboratory practice". Annals of the New York Academy of Sciences. 1057 (1): 506–524. Bibcode:2005NYASA1057..506W. doi:10.1196/annals.1356.039. PMID 16399916. S2CID 38877163.
- ^ Jump up to: a b Friel PN, Hinchcliffe C, Wright JV (March 2005). "Hormone replacement with estradiol: conventional oral doses result in excessive exposure to estrone". Alternative Medicine Review. 10 (1): 36–41. PMID 15771561.
- ^ Jump up to: a b Lobo RA (March 1987). "Absorption and metabolic effects of different types of estrogens and progestogens". Obstetrics and Gynecology Clinics of North America. 14 (1): 143–167. doi:10.1016/S0889-8545(21)00577-5. PMID 3306517.
- ^ Jump up to: a b c d e f g h i j k l m Potts RO, Lobo RA (May 2005). "Transdermal drug delivery: clinical considerations for the obstetrician-gynecologist". Obstetrics and Gynecology. 105 (5 Pt 1): 953–961. doi:10.1097/01.AOG.0000161958.70059.db. PMID 15863530. S2CID 23411589.
- ^ Jump up to: a b Borgelt LM (2010). Women's Health Across the Lifespan: A Pharmacotherapeutic Approach. ASHP. pp. 257–. ISBN 978-1-58528-194-7.
- ^ Russo J, Russo IH (28 June 2011). Molecular Basis of Breast Cancer: Prevention and Treatment. Springer Science & Business Media. pp. 92–. ISBN 978-3-642-18736-0.
- ^ Huether SE, McCance KL (27 December 2013). Understanding Pathophysiology. Elsevier Health Sciences. pp. 845–. ISBN 978-0-323-29343-3.
- ^ Ruggiero RJ, Likis FE (2002). "Estrogen: physiology, pharmacology, and formulations for replacement therapy". Journal of Midwifery & Women's Health. 47 (3): 130–138. doi:10.1016/s1526-9523(02)00233-7. PMID 12071379.
- ^ Escande A, Pillon A, Servant N, Cravedi JP, Larrea F, Muhn P, et al. (May 2006). "Evaluation of ligand selectivity using reporter cell lines stably expressing estrogen receptor alpha or beta". Biochemical Pharmacology. 71 (10): 1459–1469. doi:10.1016/j.bcp.2006.02.002. PMID 16554039.
- ^ Jump up to: a b c Powers MS, Schenkel L, Darley PE, Good WR, Balestra JC, Place VA (August 1985). "Pharmacokinetics and pharmacodynamics of transdermal dosage forms of 17 beta-estradiol: comparison with conventional oral estrogens used for hormone replacement". American Journal of Obstetrics and Gynecology. 152 (8): 1099–1106. doi:10.1016/0002-9378(85)90569-1. PMID 2992279.
- ^ Jump up to: a b Fåhraeus L, Larsson-Cohn U (December 1982). "Oestrogens, gonadotrophins and SHBG during oral and cutaneous administration of oestradiol-17 beta to menopausal women". Acta Endocrinologica. 101 (4): 592–596. doi:10.1530/acta.0.1010592. PMID 6818806.
- ^ De Lignieres B, Basdevant A, Thomas G, Thalabard JC, Mercier-Bodard C, Conard J, et al. (March 1986). "Biological effects of estradiol-17 beta in postmenopausal women: oral versus percutaneous administration". The Journal of Clinical Endocrinology and Metabolism. 62 (3): 536–541. doi:10.1210/jcem-62-3-536. PMID 3080464.
- ^ Kloosterboer HJ, Schoonen WG, Verheul HA (11 April 2008). "Proliferation of Breast Cells by Steroid Hormones and Their Metabolites". In Pasqualini JR (ed.). Breast Cancer: Prognosis, Treatment, and Prevention. CRC Press. pp. 343–366. ISBN 978-1-4200-5873-4.
- ^ Sasson S, Notides AC (July 1983). "Estriol and estrone interaction with the estrogen receptor. II. Estriol and estrone-induced inhibition of the cooperative binding of [3H]estradiol to the estrogen receptor". The Journal of Biological Chemistry. 258 (13): 8118–8122. doi:10.1016/S0021-9258(20)82036-5. PMID 6863280.
- ^ Lundström E, Conner P, Naessén S, Löfgren L, Carlström K, Söderqvist G (2015). "Estrone - a partial estradiol antagonist in the normal breast". Gynecological Endocrinology. 31 (9): 747–749. doi:10.3109/09513590.2015.1062866. PMID 26190536. S2CID 13617050.
- ^ Martel C, Rhéaume E, Takahashi M, Trudel C, Couët J, Luu-The V, Simard J, Labrie F (March 1992). "Distribution of 17 beta-hydroxysteroid dehydrogenase gene expression and activity in rat and human tissues". J. Steroid Biochem. Mol. Biol. 41 (3–8): 597–603. doi:10.1016/0960-0760(92)90390-5. PMID 1314080.
- ^ Michael Oettel; Ekkehard Schillinger (6 December 2012). Estrogens and Antiestrogens I: Physiology and Mechanisms of Action of Estrogens and Antiestrogens. Springer Science & Business Media. pp. 121, 226, 235–237. ISBN 978-3-642-58616-3.
- ^ Jump up to: a b Miki Y, Nakata T, Suzuki T, Darnel AD, Moriya T, Kaneko C, Hidaka K, Shiotsu Y, Kusaka H, Sasano H (December 2002). "Systemic distribution of steroid sulfatase and estrogen sulfotransferase in human adult and fetal tissues". J. Clin. Endocrinol. Metab. 87 (12): 5760–8. doi:10.1210/jc.2002-020670. PMID 12466383.
- ^ Jump up to: a b Quirk JG, Wendel GD (1983). "Biologic Effects of Natural and Synthetic Estrogens". In Buchsbaum JJ (ed.). The Menopause. Clinical Perspectives in Obstetrics and Gynecology. pp. 55–75. doi:10.1007/978-1-4612-5525-3_5. ISBN 978-1-4612-5525-3. ISSN 0178-0328.
- ^ Borgelt LM (2010). Women's Health Across the Lifespan: A Pharmacotherapeutic Approach. ASHP. pp. 256–. ISBN 978-1-58528-194-7.
- ^ Jump up to: a b Rezvanpour A, Don-Wauchope AC (March 2017). "Clinical implications of estrone sulfate measurement in laboratory medicine". Crit Rev Clin Lab Sci. 54 (2): 73–86. doi:10.1080/10408363.2016.1252310. PMID 27960570. S2CID 1825531.
- ^ Crandall CJ, Guan M, Laughlin GA, Ursin GA, Stanczyk FZ, Ingles SA, Barrett-Connor E, Greendale GA (July 2008). "Increases in serum estrone sulfate level are associated with increased mammographic density during menopausal hormone therapy". Cancer Epidemiol. Biomarkers Prev. 17 (7): 1674–81. doi:10.1158/1055-9965.EPI-07-2779. PMC 2745228. PMID 18628419.
- ^ Pasqualini JR (17 July 2002). Breast Cancer: Prognosis, Treatment, and Prevention. CRC Press. pp. 195–. ISBN 978-0-203-90924-9.
- ^ James MR, Skaar TC, Lee RY, MacPherson A, Zwiebel JA, Ahluwalia BS, Ampy F, Clarke R (April 2001). "Constitutive expression of the steroid sulfatase gene supports the growth of MCF-7 human breast cancer cells in vitro and in vivo". Endocrinology. 142 (4): 1497–505. doi:10.1210/endo.142.4.8091. PMID 11250930.
- ^ Jump up to: a b Fritz MA, Speroff L (28 March 2012). Clinical Gynecologic Endocrinology and Infertility. Lippincott Williams & Wilkins. pp. 753–. ISBN 978-1-4511-4847-3.
- ^ Jump up to: a b Alkjaersig N, Fletcher AP, de Ziegler D, Steingold KA, Meldrum DR, Judd HL (February 1988). "Blood coagulation in postmenopausal women given estrogen treatment: comparison of transdermal and oral administration". The Journal of Laboratory and Clinical Medicine. 111 (2): 224–228. PMID 2448408.
- ^ Jump up to: a b Nugent AG, Leung KC, Sullivan D, Reutens AT, Ho KK (December 2003). "Modulation by progestogens of the effects of oestrogen on hepatic endocrine function in postmenopausal women". Clinical Endocrinology. 59 (6): 690–698. doi:10.1046/j.1365-2265.2003.01907.x. PMID 14974909. S2CID 40208417.
- ^ Jump up to: a b Isotton AL, Wender MC, Casagrande A, Rollin G, Czepielewski MA (February 2012). "Effects of oral and transdermal estrogen on IGF1, IGFBP3, IGFBP1, serum lipids, and glucose in patients with hypopituitarism during GH treatment: a randomized study". European Journal of Endocrinology. 166 (2): 207–213. doi:10.1530/EJE-11-0560. PMID 22108915.
- ^ Jump up to: a b Jasonni VM, Bulletti C, Naldi S, Ciotti P, Di Cosmo D, Lazzaretto R, Flamigni C (December 1988). "Biological and endocrine aspects of transdermal 17 beta-oestradiol administration in post-menopausal women". Maturitas. 10 (4): 263–270. doi:10.1016/0378-5122(88)90062-x. PMID 3226336.
- ^ Jump up to: a b Weissberger AJ, Ho KK, Lazarus L (February 1991). "Contrasting effects of oral and transdermal routes of estrogen replacement therapy on 24-hour growth hormone (GH) secretion, insulin-like growth factor I, and GH-binding protein in postmenopausal women". The Journal of Clinical Endocrinology and Metabolism. 72 (2): 374–381. doi:10.1210/jcem-72-2-374. PMID 1991807.
- ^ Jump up to: a b Sonnet E, Lacut K, Roudaut N, Mottier D, Kerlan V, Oger E (May 2007). "Effects of the route of oestrogen administration on IGF-1 and IGFBP-3 in healthy postmenopausal women: results from a randomized placebo-controlled study". Clinical Endocrinology. 66 (5): 626–631. doi:10.1111/j.1365-2265.2007.02783.x. PMID 17492948. S2CID 24086563.
- ^ Dansuk R, Unal O, Karageyim Y, Esim E, Turan C (May 2004). "Evaluation of the effect of tibolone and transdermal estradiol on triglyceride level in hypertriglyceridemic and normotriglyceridemic postmenopausal women". Gynecological Endocrinology. 18 (5): 233–239. doi:10.1080/09513590410001715199. PMID 15346658. S2CID 43326076.
- ^ Notelovitz M (March 2006). "Clinical opinion: the biologic and pharmacologic principles of estrogen therapy for symptomatic menopause". MedGenMed. 8 (1): 85. PMC 1682006. PMID 16915215.
- ^ Goodman MP (February 2012). "Are all estrogens created equal? A review of oral vs. transdermal therapy". Journal of Women's Health. 21 (2): 161–169. doi:10.1089/jwh.2011.2839. PMID 22011208.
- ^ Nachtigall LE, Raju U, Banerjee S, Wan L, Levitz M (2000). "Serum estradiol-binding profiles in postmenopausal women undergoing three common estrogen replacement therapies: associations with sex hormone-binding globulin, estradiol, and estrone levels". Menopause. 7 (4): 243–250. doi:10.1097/00042192-200007040-00006. PMID 10914617. S2CID 3076514.
- ^ Santoro N, Worsley R, Miller KK, Parish SJ, Davis SR (March 2016). "Role of Estrogens and Estrogen-Like Compounds in Female Sexual Function and Dysfunction". J Sex Med. 13 (3): 305–16. doi:10.1016/j.jsxm.2015.11.015. PMID 26944462.
- ^ Jump up to: a b c Nilsson B, Holst J, von Schoultz B (October 1984). "Serum levels of unbound 17 beta-oestradiol during oral and percutaneous postmenopausal replacement therapy". Br J Obstet Gynaecol. 91 (10): 1031–6. doi:10.1111/j.1471-0528.1984.tb03683.x. PMID 6541503. S2CID 5733463.
- ^ Jump up to: a b Kicovic PM, Luisi M, Franchi F, Alicicco E (July 1977). "Effects of orally administered oestradiol decanoate on plasma oestradiol, oestrone and gonadotrophin levels, vaginal cytology, cervical mucus and endometrium in ovariectomized women". Clinical Endocrinology. 7 (1): 73–77. doi:10.1111/j.1365-2265.1977.tb02941.x. PMID 880735. S2CID 13639429.
- ^ Jump up to: a b Luisi M, Kicovic PM, Alicicco E, Franchi F (April 1978). "Effects of estradiol decanoate in ovariectomized women". Journal of Endocrinological Investigation. 1 (2): 101–106. doi:10.1007/BF03350355. PMID 755846. S2CID 38187367.
- ^ Jump up to: a b de Visser J, van der Vies J (June 1977). "Oestrogenic activity of oestradiol-decanoate after oral administration to rodents". Acta Endocrinologica. 85 (2): 422–428. doi:10.1530/acta.0.0850422. PMID 577331.
- ^ Jump up to: a b Chaudhury RR (1 January 1981). Pharmacology of Estrogens. Elsevier Science & Technology Books. p. 36. ISBN 978-0-08-026869-9.
- ^ Jump up to: a b Bastianelli C, Farris M, Rosato E, Brosens I, Benagiano G (November 2018). "Pharmacodynamics of combined estrogen-progestin oral contraceptives 3. Inhibition of ovulation". Expert Review of Clinical Pharmacology. 11 (11): 1085–1098. doi:10.1080/17512433.2018.1536544. PMID 30325245. S2CID 53246678.
- ^ Jump up to: a b Dahlgren E, Crona N, Janson PO, Samsioe G (1985). "Oral replacement with estradiol-cyclooctyl acetate: a new estradiol analogue. Effects on serum lipids, proteins, gonadotrophins, estrogens and uterine endometrial morphology". Gynecologic and Obstetric Investigation. 20 (2): 84–90. doi:10.1159/000298978. PMID 3932144.
- ^ Jump up to: a b Schubert W, Cullberg G (1987). "Ovulation inhibition with 17 beta-estradiol cyclo-octyl acetate and desogestrel". Acta Obstetricia et Gynecologica Scandinavica. 66 (6): 543–547. doi:10.3109/00016348709015732. PMID 2962418. S2CID 73200770.
- ^ Jump up to: a b Schubert W, Cullberg G (1988). "Fat-soluble 17 beta-estradiol: a way of reducing dosage in steroid hormonal substitution?". Acta Obstetricia et Gynecologica Scandinavica. 67 (3): 271–275. doi:10.3109/00016348809004218. PMID 2972162. S2CID 39664429.
- ^ Patel JU, Prankerd RJ, Sloan KB (October 1994). "A prodrug approach to increasing the oral potency of a phenolic drug. 1. Synthesis, characterization, and stability of an O-(imidomethyl) derivative of 17 beta-estradiol". Journal of Pharmaceutical Sciences. 83 (10): 1477–1481. doi:10.1002/jps.2600831022. PMID 7884673.
- ^ Patel J, Katovich MJ, Sloan KB, Curry SH, Prankerd RJ (February 1995). "A prodrug approach to increasing the oral potency of a phenolic drug. Part 2. Pharmacodynamics and preliminary bioavailability of an orally administered O-(imidomethyl) derivative of 17 beta-estradiol". Journal of Pharmaceutical Sciences. 84 (2): 174–178. doi:10.1002/jps.2600840210. PMID 7738796.
- ^ Подпрыгнуть до: а беременный Элджер В., Вирва Р., Ахмед Г., Мис Ф., Наир Х.Б., Сантхамма Б. и др. (Январь 2017). «Пролекарства эстрадиола (EP) для эффективного перорального лечения эстрогена и отмены воздействия на функции эстрогена, модулированные функциями печени». Журнал стероидной биохимии и молекулярной биологии . 165 (Pt B): 305–311. doi : 10.1016/j.jsbmb.2016.07.008 . PMID 27449818 . S2CID 26650319 .
- ^ Подпрыгнуть до: а беременный Ахмед Г., Элджер В., Мис Ф., Наир Х.Б., Шнайдер Б., Вирва Р., Никиш К (октябрь 2017 г.). «Пролекарство для улучшения устного поглощения и уменьшения взаимодействия печени». Биоорганическая и лекарственная химия . 25 (20): 5569–5575. doi : 10.1016/j.bmc.2017.08.027 . PMID 28886996 .
- ^ Подпрыгнуть до: а беременный в дюймовый и Рен Б.Г., Дэй Р.О., Маклахлан А.Дж., Уильямс К.М. (июнь 2003 г.). «Фармакокинетика эстрадиола, прогестерона, тестостерона и дегидроэпиандростерона после трансбуккальной введения женщин в постменопаузы». Климактерий . 6 (2): 104–111. doi : 10.1080/cmt.6.2.104.111 . PMID 12841880 . S2CID 26455195 .
- ^ Gass MS, Rebar RW, Cuffie-Jackson C, Cedars MI, Lobo RA, Shoupe D, et al. (Октябрь 2004). «Короткое исследование в лечении горячих вспышек с использованием щека в введении 17-бета-эстрадиола». Матурирование . 49 (2): 140–147. doi : 10.1016/j.maturitas.2003.12.004 . PMID 15474758 .
- ^ Чандрасекхара Д.С., Али В., Прост Х.М., Надер-Эстехари С. (2002). «Буккальный эстроген в исследовании зубной пасты: системное поглощение эстрадиола в постменопаузальной или хирургической менопаузальной женщинах при введении в качестве компонента в зубной пасте» . Плодородие и бесплодия . 78 : S98. doi : 10.1016/s0015-0282 (02) 03639-7 . ISSN 0015-0282 .
- ^ Perloff WH (январь 1950). «Эстрадиол Буккальные таблетки при лечении менопаузы». Американский журнал акушерства и гинекологии . 59 (1): 223–225. doi : 10.1016/0002-9378 (50) 90390-5 . PMID 15408716 .
- ^ Холл GJ (апрель 1949 г.). «Буккальное введение эстрадиола». Журнал клинической эндокринологии и метаболизма . 9 (4): 382–384. doi : 10.1210/JCEM-9-4-382 . PMID 18120722 .
- ^ Бодор Н., Бучвальд П. (2006). «Нацеленная на мозг доставки эстрадиола». Американский журнал о доставке наркотиков . 4 (3): 161–175. doi : 10.2165/00137696-200604030-00004 . ISSN 1175-9038 . S2CID 68203212 .
- ^ Ван дер Биджл П., Ван Эйк А.Д., Томпсон Ио (апрель 1998 г.). «Проницаемость 17бета-эстрадиола через вагинальную и щечную слизистую оболочку человека». Хирургия полости рта, пероральная медицина, патология полости рта, радиология полости рта и эндодонтика . 85 (4): 393–398. doi : 10.1016/s1079-2104 (98) 90063-4 . PMID 9574947 .
- ^ Николаццо Дж.А., Рид Б.Л., Финнин до н.э. (февраль 2004 г.). «Оценка влияния додецилсульфата натрия на проницаемость кофеина и эстрадиола кофеина и эстрадиола». Журнал фармацевтических наук . 93 (2): 431–440. doi : 10.1002/jps.10559 . PMID 14705199 .
- ^ Китано М., Майтани Ю., Такаяма К., Нагай Т (1998). «Процессочное поглощение через золотой хомяк в щеке сумку in vitro и in vivo 17β-эстрадиола из гидрогелей, содержащих три типа усилителей поглощения». Международный журнал фармацевтики . 174 (1–2): 19–28. doi : 10.1016/s0378-5173 (98) 00234-8 . ISSN 0378-5173 .
- ^ Николаццо Дж.А., Рид Б.Л., Финнин до н.э. (апрель 2005 г.). «Улучшенная задержка слизистой оболочки щека и снижение проницаемости белости эстрадиола в присутствии падимат O и азона: механистическое исследование». Журнал фармацевтических наук . 94 (4): 873–882. doi : 10.1002/jps.20240 . PMID 15736191 .
- ^ Подпрыгнуть до: а беременный в дюймовый и фон глин час я Дж k л м не а п Q. Pines A, Averbuch M, Fisman EZ, Rosano GM (сентябрь 1999). «Острые эффекты сублингвального 17бета-эстрадиола на сердечно-сосудистую систему». Матурирование . 33 (1): 81–5. doi : 10.1016/s0378-5122 (99) 00036-5 . PMID 10585176 .
- ^ Подпрыгнуть до: а беременный Casper RF, Yen SS (1981). «Быстрое поглощение микронизированного эстрадиола-17 бета после сублингвального введения». Акушер гинекол . 57 (1): 62–4. PMID 7454177 .
- ^ Врач общей практики . Американская академия общей практики. Апрель 1954 г. с. 168–170.
Diogynets * [...] * бренд эстрадиол -трансмукозальных таблеток, забитый: 0,125 мг., 0,25 мг. и 1,0 мг, бутылки 50 и 100.
- ^ Уэльс Ал (1951). Дерматологический формул: руководство для студентов -медиков и врачей -резидентов по дерматологии . Образовательные издатели. п. 155
- ^ Калифорнийский университет (1868–1952) (1952). Формарный запас больницы и сборник полезной информации . Калифорнийский университет. С. 49–. GGKEY: 2UAAZRZ5LN0.
{{cite book}}: CS1 Maint: числовые имена: список авторов ( ссылка ) - ^ Спенс AW (1953). Клиническая эндокринология . Касселл. п. 547.
- ^ Новак Е., Брюер Джи, Джонс Г.С., Новак Эр (1961). Учебник гинекологии . Уильямс и Уилкинс. п. 120.
- ^ Прайс Т.М., Блауэр К.Л., Хансен М., Станкик Ф., Лобо Р., Бейтс Г.В. (март 1997 г.). «Однодозированная фармакокинетика сублингвального и перорального введения микронизированного 17 бета-эстрадиола». Акушер гинекол . 89 (3): 340–5. doi : 10.1016/s0029-7844 (96) 00513-3 . PMID 9052581 . S2CID 71641652 .
- ^ Pines A, Fisman EZ, Droory Y, Shapira I, Averbuch M, Eckstein N, Motro M, Levo Y, Ayalon D (1998). «Влияние сублингвального эстрадиола на функцию левого желудочка в покое и физические упражнения у женщин в постменопаузе: эхокардиографическая оценка». Менопауза . 5 (2): 79–85. doi : 10.1097/00042192-199805020-00004 . PMID 9689200 . S2CID 33257234 .
- ^ Куль Х (2000). «Фармакология эстрадиола и эстрала». Менопауза обзор . 5 Европейское общество менопаузы: 23–44. ISSN 1272-9868 . OCLC 473540298 .
- ^ Fisman EZ, Tenenbaum A, Shapira I, Motro M, Pines A (октябрь 1999). «Острые эффекты сублингвального эстрадиола на диастолическую функцию левого желудочка у нормотензивных и гипертонических женщин в постменопаузе». Матурирование . 33 (2): 145–52. doi : 10.1016/s0378-5122 (99) 00051-1 . PMID 10597879 .
- ^ Подпрыгнуть до: а беременный Ahokas A, Kaukoranta J, Wahlbeck K, Aito M (май 2001 г.). «Дефицит эстрогена при тяжелой послеродовой депрессии: успешное лечение сублингвиальным физиологическим 17бета-эстрадиолом: предварительное исследование». J Clin Psychiatry . 62 (5): 332–6. doi : 10.4088/jcp.v62n0504 . PMID 11411813 .
- ^ Подпрыгнуть до: а беременный Ahokas A, Kaukoranta J, Aito M (сентябрь 1999 г.). «Влияние эстрадиола на послеродовую депрессию». Психофармакология . 146 (1): 108–10. doi : 10.1007/s002130051095 . PMID 10485972 . S2CID 23729117 .
- ^ Подпрыгнуть до: а беременный NG RC, Hirata CK, Yeung W, Haller E, Finley PR (сентябрь 2010 г.). «Фармакологическое лечение послеродовой депрессии: систематический обзор». Фармакотерапия . 30 (9): 928–41. doi : 10.1592/phco.30.9.928 . PMID 20795848 . S2CID 23053672 .
- ^ Di Scalea TL, Wisner KL (ноябрь 2009 г.). «Фармакотерапия послеродовой депрессии» . Эксперт мнение Фармакотера . 10 (16): 2593–607. doi : 10.1517/14656560903277202 . PMC 2929691 . PMID 19874247 .
- ^ Подпрыгнуть до: а беременный в дюймовый и Serhal PF, Craft IL (май 1989). «Пожертвование ооцитов у 61 пациента». Лансет . 1 (8648): 1185–7. doi : 10.1016/s0140-6736 (89) 92762-1 . PMID 2566746 . S2CID 21953983 .
- ^ Подпрыгнуть до: а беременный в дюймовый и Серхал П (июль 1990 г.). «Пожертвование ооцитов и суррогатное материнство». Бренд Медик Бык 46 (3): 796–812. doi : 10.1093/oxfordjournals.bmb.a072432 . PMID 2207608 .
- ^ Lim HH, Jang YH, Choi Gy, Lee JJ, Lee ES (январь 2019). «Гендерная позитивная забота о трансгендерных людях: опыт одного центра в Корее» . Obstet Gynecol Sci . 62 (1): 46–55. doi : 10.5468/ogs.2019.62.1.46 . PMC 6333764 . PMID 30671393 .
Когда мы прописали эстрадиол, мы предпочитали сублингвальный эстрадиол валеровщик вместо пероральной формы для феминизации HT, поскольку предыдущие исследователи сообщили о эффективности сублингвального введения в поддержании высокой концентрации эстрадиола в крови и низкого отношения E1/E2 [13].
- ^ Pitha J, Harman SM, Michel Me (февраль 1986 г.). «Производные гидрофильного циклодекстрина обеспечивают эффективное пероральное введение стероидных гормонов». J Pharm Sci . 75 (2): 165–7. doi : 10.1002/jps.2600750213 . PMID 3958926 .
- ^ Hoon TJ, Dawood My, Khan-Dawood FS, Ramos J, Batenhorst RL (ноябрь 1993 г.). «Биоэквивалентность 17-эстрадиол-гидроксипропил-бета-циклодекстрина у женщин в постменопаузе». J Clin Pharmacol . 33 (11): 1116–21. doi : 10.1002/j.1552-4604.1993.tb01949.x . PMID 8300895 . S2CID 72588405 .
- ^ Свобода Хис Х., Лофтссон Т., Гудмундссон и Бьярнасон Г.Дж., Кьелд М., Торштейнссон Т. (январь 1996 г.). «Проектирование и тестирование in vivo 17 бета-эсрадиол-бета-CD Subingual Tablets». Фармази . 51 (1): 39–42. PMID 8999433 .
- ^ Brewster Me, Howes J, Griffith W, Garty N, Bodor N, Anderson WR, Pop E (1996). «Внутривенные и бурные 2-гидроксипропил-β-циклодекстриновые составы E2-CDS-клинические испытания I фазы». Материалы восьмого международного симпозиума по циклодекстринам . С. 507–510. doi : 10.1007/978-94-011-54448-2_112 . ISBN 978-0-7923-4029-4 .
- ^ Loftsson T, Gudmundsson JA, Arnadóttir RO, Fridriksdóttir H (май 2003). «Субблингвальная доставка 17бета-эстрадиола из циклодекстрина, содержащих таблетки» . Фармази . 58 (5): 358–9. PMID 12779059 .
- ^ Burnier AM, Martin PL, Yen SS, Brooks P (май 1981). «Сублингвальное поглощение микронизированного 17бета-эстрадиола». Являюсь. J. Obstet. Гинекол . 140 (2): 146–50. doi : 10.1016/0002-9378 (81) 90101-0 . PMID 6786097 .
- ^ Fiet J, Hermano M, Witte J, Villette JM, Haimart M, Gourmel B, Tabuteau F, Rouffy J, Dreux C (сентябрь 1982). «Постменопаузальные концентрации эстрадиола в плазме, эстроне, FSH и LH и общего мочеистого эстрадиола и эстророна после единой сублингвальной дозы бета-эстрадиола-17». Acta Эндокринол . 101 (1): 93–7. doi : 10.1530/acta.0.1010093 . PMID 6812348 .
- ^ Devissaguet JP, Brion N, Lhote O, Deloffre P (1999). «Импульсная терапия эстрогенами: фармакокинетика интраназального 17-бета-эстрадиола (S21400) у женщин в постменопаузе и сравнение с пероральными и трансдермальными составами». EUR J MENTABE METAB PHARMACOKINET . 24 (3): 265–71. doi : 10.1007/bf03190030 . PMID 10716066 . S2CID 22359030 .
- ^ Dooley M, Spencer CM, Ormrod D (2001). «Эстрадиол-интраназальный: обзор его использования в управлении менопаузой». Наркотики . 61 (15): 2243–2262. doi : 10.2165/00003495-200161150-00012 . PMID 11772138 . S2CID 209145169 .
- ^ Лопес П., Розенберг С., Грааф Дж., Фернандес-Виллория Э., Мариановски Л (июнь 2001 г.). «Аэродиол против трансдермального маршрута: перспективы предпочтения пациента». Матурирование . 38 (Suppl 1): S31 - S39. doi : 10.1016/s0378-5122 (01) 00202-x . PMID 11390122 .
- ^ Аронсон JK (21 февраля 2009 г.). Побочные эффекты Мейлера эндокринных и метаболических препаратов . Elsevier. С. 173–. ISBN 978-0-08-093292-7 .
- ^ Ryden J, Blumenthal PD (2002). Практическая гинекология: руководство для врача первичной медицинской помощи . ACP Press. С. 436–. ISBN 978-0-943126-94-4 .
- ^ Сахин Ф.К., Кокен Г., Косар Е., Ариоз Д.Т., ДеГерси Б., Албайрак Р., Акар М (апрель 2008 г.). «Влияние введения аэродиола на глазные артерии у женщин в постменопаузе». Гинекологическая эндокринология . 24 (4): 173–177. doi : 10.1080/09513590701807431 . PMID 18382901 . S2CID 205632378 .
300 мкг 17β-эстрадиола (Aerodiol®; Servier, Chambrayles-Tours, France) вводили через носовое маршрут гинекологом. Этот продукт недоступен после 31 марта 2007 года, потому что его производство и маркетинг прекращаются.
- ^ , Аэродол спрей (декабрь 2006 г.) " NetDoctor 19 января
- ^ «Аэродиол эстрадиол гемигидрат» (PDF) . Servier Laboratories (Aust) Pty Ltd. Июль 2007.
- ^ Подпрыгнуть до: а беременный Комплексная токсикология . Elsevier Science. 1 декабря 2017 года. С. 2-. ISBN 978-0-08-100612-2 .
- ^ Подпрыгнуть до: а беременный в дюймовый и фон глин час я Rippe JM (15 марта 2013 г.). Медицина образа жизни, второе издание . CRC Press. С. 279 -. ISBN 978-1-4398-4542-4 .
- ^ Подпрыгнуть до: а беременный Бастер JE (июнь 2010 г.). «Трансдермальная менопаузальная гормональная терапия: доставка через кожу меняет правила». Эксперт мнение Фармакотера . 11 (9): 1489–99. doi : 10.1517/14656561003774098 . PMID 20426703 . S2CID 24104591 .
- ^ Подпрыгнуть до: а беременный в Шах вице -президент, Майбах Хи (29 июня 2013 г.). Актуальная биодоступность препарата, биоэквивалентность и проникновение . Springer Science & Business Media. С. 47–50. ISBN 978-1-4899-1262-6 .
- ^ Подпрыгнуть до: а беременный в Sitruk-Ware R (февраль 1993 г.). «Чрескожная и трансдермальная заместительная терапия эстрогена». Анналы медицины . 25 (1): 77–82. doi : 10.3109/07853899309147862 . PMID 8435193 .
- ^ Sitruk-Ware R (январь 1989 г.). «Трансдермальная доставка стероидов». Контрацепция . 39 (1): 1–20. doi : 10.1016/0010-7824 (89) 90012-7 . PMID 2642780 .
- ^ Wiedersberg S, Guy RH (сентябрь 2014 г.). «Трансдермальная доставка наркотиков: 30+ лет войны и все еще борются!» (PDF) . Журнал контролируемого выпуска . 190 : 150–156. doi : 10.1016/j.jconrel.2014.05.022 . PMID 24852092 . S2CID 13842061 .
- ^ Oppenheimer E, Greene RR, Burrill MW (1942). «Чрескожная активность этерифицированного и неэтерифицированного эстрадиола». Эндокринология . 30 (2): 317–322. doi : 10.1210/endo-30-2-317 . ISSN 0013-7227 .
- ^ Morgan CF (1963). «Сравнение местных и подкожных методов введения шестнадцати эстрогенов». Журнал эндокринологии . 26 (3): 317–329. doi : 10.1677/joe.0.0260317 (неактивный 1 сентября 2024 г.). ISSN 0022-0795 .
{{cite journal}}: CS1 Maint: doi неактивен по состоянию на сентябрь 2024 года ( ссылка ) - ^ Подпрыгнуть до: а беременный в дюймовый и фон глин час я Дж k «Estrogel® 0,06% (эстрадиол гель) для местного использования метки FDA» (PDF) . Управление по контролю за продуктами и лекарствами . 2017 . Получено 22 июля 2018 года .
- ^ Schenkel L, Barlier D, Riera M, Barner A (1986). «Трансдермальное поглощение эстрадиола 101 из разных мест тела сопоставимо». Журнал контролируемого выпуска . 4 (3): 195–201. doi : 10.1016/0168-3659 (86) 90003-9 . ISSN 0168-3659 .
- ^ Подпрыгнуть до: а беременный Balfour JA, Heel RC (октябрь 1990). «Трансдермальный эстрадиол. Обзор его фармакодинамических и фармакокинетических свойств, а также терапевтическую эффективность при лечении жалоб на менопауза». Наркотики . 40 (4): 561–582. doi : 10.2165/00003495-199040040-00006 . PMID 2083514 . S2CID 46969753 .
- ^ Смит К, Риш Д.М., Хеньян Н. (15 апреля 2010 г.). Клинические данные о лекарствах (11 -е изд.). McGraw Hill Professional. ISBN 978-0-07-162686-6 .
- ^ Подпрыгнуть до: а беременный Feldmann RJ, Maibach Hi (февраль 1967 г.). Восстановленное проникновение 14C Cortsol также на месте " расследования Журнал 48 (2): 181–1 doi : 10.1038/jid . PMID 6020682 .
- ^ Iyer R, Mok SF, Savkovic S, Turner L, Fraser G, Desai R, et al. (Июль 2017). «Фармакокинетика крема тестостерона, нанесенная на кожу мошонки» . Андрология . 5 (4): 725–731. doi : 10.1111/andr.12357 . PMID 28334510 . S2CID 3595479 .
- ^ Kühnert B, Byrne M, Simoni M, Köpcke W, Gerss J, Lemmnitz G, Nieschlag E (август 2005 г.). «Замена тестостерона новым трансдермальным гидроэлколольным гелем, примененным к мошонке или некротальной коже: многоцентровое исследование» . Европейский журнал эндокринологии . 153 (2): 317–326. doi : 10.1530/eje.1.01964 . PMID 16061839 .
- ^ Barth-Jones J (2016). «Принципы местной терапии». Учебник Рука о дерматологии . Уайли. С. 1–51. doi : 10.1002/9781118441213.rtd0018 . ISBN 978-1-118-44121-3 .
- ^ Benedetti MS, Whomsley R, Poggesi I, Cawello W, Mathy FX, Delporte ML, et al. (2009). «Метаболизм наркотиков и фармакокинетика» . Обзоры метаболизма наркотиков . 41 (3): 344–390. doi : 10.1080/10837450902891295 . PMC 3086155 . PMID 19601718 .
- ^ Wester RC, Maibach Mi (2 января 2002 г.). «Региональные изменения в чрескожном поглощении» . В Броно Р.Л., Майбах Хи (ред.). Актуальное поглощение дерматологических продуктов . CRC Press. С. 33–42. doi : 10.3109/9780203904015-6 . ISBN 978-0-203-90401-5 .
- ^ Подпрыгнуть до: а беременный в Re I, Asenjo G, Maximino G, Micheletti L (2005). «Лечение распространенного рака предстательной железы с помощью трансдермальных эстрогенов мошонки (ETE)» [трансдермальные пластыри эстрогена мошонка (TSEP) при лечении развития рака простаты]. Аргентинский журнал урологии (по -испански). 70 (4): 231. ISSN 0325-2531 . Арчндд из оригинала 27 января 2020 года . Получено 1 декабря 2019 года .
- ^ Подпрыгнуть до: а беременный в Wisner KL, Sit DK, Moses-Kolko EL, Driscoll KE, Prairie BA, Stika CS, ENG HF, Dills JL, Luther JF, Wisniewski SR (август 2015 г.). «Трансдермальное лечение эстрадиолом для послеродовой депрессии: пилот, рандомизированное исследование» . J Clin Psychopharmacol . 35 (4): 389–95. doi : 10.1097/jcp.0000000000000351 . PMC 4485597 . PMID 26061609 .
Спонсируемые Berlex фармакокинетические исследования трансдермальной системы Climara® E2 продемонстрировали приблизительное соотношение 1: 1 [E2 в MCG], доставляемое к концентрации [сывороточной E2 PG/мл] у женщин в менопаузе) [11]. Таким образом, мы ожидали, что дозы E2 50, 100, 150 и 200 мкг/день получат 50, 100, 150 и 200 концентраций в сыворотке/мл.
- ^ Mulcahy JJ (16 ноября 2007 г.). Мужская сексуальная функция: руководство по клиническому лечению . Springer Science & Business Media. С. 309 -. ISBN 978-1-59745-155-0 .
- ^ Лобо Р.А. (май 2011). «Риск венозной тромбоэмболии по пути введения эстрогена». Менопауза . 18 (5): 469–470. doi : 10.1097/gme.0b013e318211745b . PMID 21407136 .
- ^ Renoux C, Dell'aniello S, Garbe E, Suissa S (июнь 2010 г.). «Трансдермальная и пероральная заместительная терапия и риск инсульта: вложенное исследование случай-контроль» . BMJ . 340 (Jun03 4): C2519. doi : 10.1136/bmj.c2519 . PMID 20525678 . S2CID 1569339 .
- ^ Vinogradova Y, Coupland C, Hippisley-Cox J (январь 2019). «Использование гормональной заместительной терапии и риск венозной тромбоэмболии: вложенные исследования случай-контроль с использованием баз данных QResearch и CPRD» . BMJ . 364 : K4810. doi : 10.1136/bmj.k4810 . PMC 6326068 . PMID 30626577 .
- ^ «Препараты@FDA: FDA одобрено лекарственными средствами» . Управление по контролю за продуктами и лекарствами США . Получено 26 июля 2018 года .
- ^ Хенцл М.Р., Тумба П.К. (июль 2003 г.). «Трансдермальная доставка половых стероидов для гормональной заместительной терапии и контрацепции. Обзор принципов и практики». J Reprod Med . 48 (7): 525–40. PMID 12953327 .
- ^ Подпрыгнуть до: а беременный в «Препараты@FDA: FDA одобрено лекарственными средствами» . Управление по контролю за продуктами и лекарствами США . Получено 26 июля 2018 года .
- ^ Bruni V, Pampaloni F (2019). «Гормональная заместительная терапия при преждевременной недостаточности яичника». Менструальный цикл, связанные с расстройствами . Isge series. Спрингер. С. 111–142. doi : 10.1007/978-3-030-14358-9_10 . ISBN 978-3-030-14357-2 Полем ISSN 2197-8735 . S2CID 198307066 .
- ^ Подпрыгнуть до: а беременный Лэнгли Р.Е., Годсленд И.Ф., Кинастон Х., Кларк Н.В., Розен С.Д., Морган Р.К., Поллок П., Кокельберг Р., Лалани Э.Н., Дирнали Д., Пармар М., Абель П.Д. (август 2008 г.). «Ранние гормональные данные из многоцентрового исследования II фазы с использованием трансдермальных пятен эстрогена в качестве гормональной терапии первой линии у пациентов с локально распространенным или метастатическим раком простаты» . BJU Int . 102 (4): 442–5. doi : 10.1111/j.1464-410x.2008.07583.x . PMC 2564109 . PMID 18422771 .
- ^ Подпрыгнуть до: а беременный Deutsch MB, Bhakri V, Kubicek K (2015). «Влияние кросс-полового гормонального лечения на трансгендерных женщин и мужчин» . Акушер гинекол . 125 (3): 605–10. doi : 10.1097/aog.0000000000000692 . PMC 4442681 . PMID 25730222 .
- ^ Кумар С., Макивор Р.Дж., Дэвис Т., Браун Н., Пападопулос А., Вик А., Чекли С.А., Кэмпбелл И.К., Маркс М.Н. (февраль 2003 г.). «Введение эстрогена не снижает скорость рецидива аффективного психоза после родов». J Clin Psychiatry . 64 (2): 112–8. doi : 10.4088/jcp.v64n0202 . PMID 12633118 .
- ^ Справедливость AJ, de Wit H (январь 2000 г.). «Острые последствия предварительной обработки эстрадиола на реакцию на D-амфетамин у женщин». Нейроэндокринология . 71 (1): 51–59. doi : 10.1159/000054520 . PMID 10644899 . S2CID 25517508 .
- ^ Lycette JL, Bland LB, Garzotto M, Beer TM (декабрь 2006 г.). «Парентеральные эстрогены для рака простаты: может ли новый путь введения преодолеть старую токсичность?». Клинический генитурин Рак . 5 (3): 198–205. doi : 10.3816/cgc.2006.n.037 . PMID 17239273 .
- ^ Блэнд Л.Б., Гарзотто М., Делерией Т.Г., Райан К.В., Шуфф К.Г., Версингер Э.М., Леммон Д., Пивная ТМ (февраль 2005 г.). «Фаза II исследование трансдермального эстрадиола при андроген-независимой карциноме предстательной железы» . Рак . 103 (4): 717–23. doi : 10.1002/cncr.20857 . PMID 15641029 . S2CID 770930 .
- ^ Подпрыгнуть до: а беременный в дюймовый Аденокарцинома простаты « Clinicaltrials.gov . Национальная библиотека медицины США . Получено 21 июня 2019 года .
- ^ Подпрыгнуть до: а беременный Гилберт Д.К., Дуонг Т., Сидес М., Бара А., Кларк Н., Абель П. и др. (Май 2018). «Трансдермальный эстрадиол как метод подавления андрогенов при раке предстательной железы в исследуемой платформе дата» . BJU International . 121 (5): 680–683. doi : 10.1111/bju.14153 . HDL : 10044/1/57083 . PMID 29388336 . S2CID 13738982 .
- ^ Подпрыгнуть до: а беременный Singla N, Ghandour RA, Raj GV (март 2019 г.). «Исследовательские агонисты лютеинизирующих гормонов, высвобождающие гормоны (LHRH) и другие гормональные агенты в ранних стадиях клинических испытаний для рака предстательной железы». Экспертное мнение по расследованию лекарств . 28 (3): 249–259. doi : 10.1080/13543784.2019.1570130 . PMID 30649971 . S2CID 58546028 .
- ^ «Системная терапия при развитии или метастатическом раке предстательной железы: оценка эффективности лекарственного средства (Patmede)» . Clinicaltrials.gov . Национальная библиотека медицины США . Получено 21 июня 2019 года .
- ^ Подпрыгнуть до: а беременный в дюймовый Дал М., Фельдман Дж.Л., Голдберг Дж.М., Джабери А. (2006). «Физические аспекты трансгендерной эндокринной терапии». Международный журнал трансгендеризма . 9 (3–4): 111–134. doi : 10.1300/j485v09n03_06 . ISSN 1553-2739 . S2CID 146232471 .
- ^ Elami-Suzin M, Schenker JG (2017). «Подростка беременность и контрацепция». Границы в гинекологической эндокринологии . Isge series. Спрингер. С. 199–227. doi : 10.1007/978-3-319-41433-1_14 . ISBN 978-3-319-41431-7 Полем ISSN 2197-8735 .
- ^ «Предписательная информация: Vivelle (трансдермальная система эстрадиола)» (PDF) . Управление по контролю за продуктами и лекарствами США.
- ^ «Предписательная информация: Vivelle-Dot (трансдермальная система эстрадиола)» (PDF) . Управление по контролю за продуктами и лекарствами США.
- ^ "Эстрадиол патч" . Daily Med . Национальная библиотека медицины США.
- ^ «Климара (трансдермальная система эстрадиола)» (PDF) . Управление по контролю за продуктами и лекарствами США.
- ^ «Menostar (трансдермальная система эстрадиола)» (PDF) . Управление по контролю за продуктами и лекарствами США.
- ^ "Эстрадиол патч" . Daily Med . Национальная библиотека медицины США.
- ^ "Климара Форте" . HPRA . Получено 22 декабря 2018 года .
- ^ Подпрыгнуть до: а беременный в Смит Р.Д., Робинсон Д.Е., Делинььер Б., Альбертсон Б.Д., Томай Т.П., Зинаман М.Дж., Саймон Дж. А (декабрь 1991 г.). «Влияние добавок транспортных средств на общее поглощение эстрадиола от трансдермальной системы доставки эстрадиола». Фертил. Стерил . 56 (6): 1029–33. doi : 10.1016/s0015-0282 (16) 54712-8 . PMID 1743317 .
- ^ Ockrim J, Lalani EN, Abel P (октябрь 2006 г.). «Проницательность терапии: парентеральное лечение эстрогена при раке предстательной железы-новый рассвет для старой терапии». NAT CLIN PRACT ONCOL . 3 (10): 552–63. doi : 10.1038/ncponc0602 . PMID 17019433 . S2CID 6847203 .
- ^ Норман Г., Дин Я, Лэнгли Р.Е., Ходжес З.К., Ричи Г., Пармар М.К. и др. (Февраль 2008 г.). «Парентеральный эстроген при лечении рака простаты: систематический обзор» . Британский журнал рака . 98 (4): 697–707. doi : 10.1038/sj.bjc.6604230 . PMC 2259178 . PMID 18268497 .
- ^ Подпрыгнуть до: а беременный Steg A, Benoit G (октябрь 1979 г.). «Чрескожный 17 бета-эстрадиол при лечении рака простаты». Урология . 14 (4): 373–375. doi : 10.1016/0090-4295 (79) 90083-9 . PMID 227153 .
- ^ Подпрыгнуть до: а беременный Steg A, Benoit G, Limouzin-Lamotte A, Mahoudeau J, Caillens M, Raichvarg D (1979). «Рак предстательной железы: метаболические эффекты чрескожного геев-бета-эстрадиола» [Рак предстательной железы: метаболический эффект чрескожного бета-эстрадиола]. Новая медицинская пресса . 8 (46): 3801–3802. ISSN 0035-3655 .
- ^ Подпрыгнуть до: а беременный Steg A, Benoit G, Limouzin-Lamotte A, Mahoudeau J, Caillens M, Raichvarg D (ноябрь 1980 г.). «[Рак предстательной железы: метаболические эффекты печенично вводимых бета-эстрадиола]» [Рак простаты: метаболические эффекты гварстозного бета-эстрадиола]. Revue Médicale de la Suisse Romande (по -французски). 100 (11): 895–897. PMID 7466061 .
- ^ Подпрыгнуть до: а беременный Steg A, Benoit G, Maisonneuve P, Tallet F, Nahoul K, Sulatna Y, Raichwarg D, Limousinlamotte MA (1983). «Сравнительное исследование диэтилстильбоэстрола и 17 бета-бета на ко-кожный при лечении рака простаты» [сравнительное исследование чрескожного 17 бета-эстрадиола и диэтилстилбестрола при лечении рака простатических рака]. Энн Урол (Париж) (по -французски). 17 : 197–202. ISSN 0003-4401 .
- ^ Подпрыгнуть до: а беременный Steg A, Benoit G (1983). «Сравнительное исследование больших доз эстрадиола-17β, вводимых на ко-кожный путь, и двусторонней орхидектомии при лечении рака предстательной железы» [карцинома простатической простатики. Двусторонняя орхиэктомия в сравнении с чрескожным введением больших доз 17β-эстрадиола. Сравнительное исследование.]. Анналы урологии . 17 (5): 286–288. ISSN 0003-4401 .
- ^ Подпрыгнуть до: а беременный Бенуа Г. (1985). «Что думать о гормональном лечении рака простаты» [Мысли о гормональном лечении рака простаты]. Медицинская газета . 92 (5): 33–39. ISSN 0760-758X .
- ^ Подпрыгнуть до: а беременный в дюймовый и фон глин Lauritzen C (март 1987 г.). «[Новые точки зрения в лечении жалоб в постменопаузе]». Архивы гинекологии и акушерства (на немецком языке). 242 (1–4): 471–479. doi : 10.1007/bf01783219 . EISSN 1432-0711 . PMID 3688962 . S2CID 22450751 .
- ^ Hindle WH (1998). «Структурные отношения и метаболизм эстрогенов и прогестогенов». В Фрейзере, Янсен Р.П., Лобо Р.А., Уайтхед М.И. (ред.). Эстрогены и прогестогены в клинической практике . Черчилль Ливингстон. С. 187–194. ISBN 978-0-443-04706-0 .
- ^ Chang KJ, Lee TT, Linares-Cruz G, Fournier S, De Ligniéres B (апрель 1995 г.). «Влияние чрескожного введения эстрадиола и прогестерона на эпителиальный цикл молочной железы человека in vivo» . Фертил. Стерил . 63 (4): 785–91. doi : 10.1016/s0015-0282 (16) 57482-2 . PMID 7890063 .
- ^ Spicer DV, Ursin G, Pike MC (май 1996 г.). «Концентрации прогестерона-физиологические или фармакологические?» Полем Фертил. Стерил . 65 (5): 1077–8. doi : 10.1016/s0015-0282 (16) 58295-8 . PMID 8612843 .
- ^ Foidart JM, Colin C, Denoo X, Desreux J, Béliard A, Fournier S, De Lignières B (май 1998). «Эстрадиол и прогестерон регулируют пролиферацию эпителиальных клеток молочной железы человека» . Фертил. Стерил . 69 (5): 963–9. doi : 10.1016/s0015-0282 (98) 00042-9 . PMID 9591509 .
- ^ PsChyrembel W (1968). Практическая гинекология: для студентов и врачей . Уолтер де Грютер. С. ISBN 978-3-11-150424-7 .
- ^ Shahrokh Tehraninejad E, Kabodmehri R, Hosein Rashidi B, Jafarabadi M, Keikha F, Masomi M, Hagholahi F (январь 2018 г.). «Транс -кожный эстроген (эстрогель) для подготовки эндометрия в цикле переноса эмбрионов заморозки: РКИ» . Int J Reprod Biomed (Yazd) . 16 (1): 51–56. doi : 10.29252/ijrm.16.1.51 (неактивный 1 сентября 2024 г.). PMC 5899770 . PMID 29675488 .
{{cite journal}}: CS1 Maint: doi неактивен по состоянию на сентябрь 2024 года ( ссылка ) - ^ Скотт Р.Т., Росс Б., Андерсон С., Арчер Д.Ф. (май 1991). «Фармакокинетика чрескожного эстрадиола: перекрестное исследование с использованием геля и трансдермальной системы по сравнению с пероральным микронизированным эстрадиолом». Акушер гинекол . 77 (5): 758–64. doi : 10.1016/0020-7292 (92) 90761-7 . PMID 2014092 . S2CID 3155316 .
- ^ Järvinen A, Granander M, Nykänen S, Laine T, Geurts P, Viitanen A (ноябрь 1997). «Устойчивая фармакокинетика эстрадиол геля у женщин в постменопаузе: воздействие зоны применения и промывки». Br J Obstet Gynaecol . 104 (Suppl 16): 14–8. doi : 10.1111/j.1471-0528.1997.tb11562.x . PMID 9389778 . S2CID 36677042 .
- ^ Подпрыгнуть до: а беременный Morton TL, Gattermeir DJ, Petersen CA, Day WW, Schumacher RJ (сентябрь 2009 г.). «Устойчивая фармакокинетика после применения нового трансдермального спрея эстрадиола у здоровых женщин в постменопаузе». J Clin Pharmacol . 49 (9): 1037–46. doi : 10.1177/0091270009339187 . PMID 19628730 . S2CID 23511531 .
- ^ Подпрыгнуть до: а беременный «Estrasorb (эмульсия эстрадиола) для местного использования» (PDF) . Exeltis USA, Inc. Управление по контролю за продуктами и лекарствами США. Ноябрь 2017 года.
- ^ Подпрыгнуть до: а беременный Саймон Дж. (Январь 2007 г.). «Эстрадиола Актуальная эмульсия для лечения вазомоторных симптомов средней до тяжелой степени, связанных с менопаузой» . Женское здоровье . 3 (1): 29–37. doi : 10.2217/17455057.3.1.29 . PMID 19803862 . S2CID 10170446 .
- ^ Кауфманн М., Коста С.Б., Шарл А (27 ноября 2013 г.). Гинекология . Springer Publishing House. С. ISBN 978-3-662-11496-4 .
- ^ Холл Г., Блумбак М., Ландгрен Б.М., Бремм К. (2002). «Влияние вагинально вводила высокие дозы эстрадиола на гормональную фармакокинетику и гемостаз у женщин в постменопаузе» . Фертил. Стерил . 78 (6): 1172–7. doi : 10.1016/s0015-0282 (02) 04285-1 . PMID 12477507 .
- ^ Santen RJ, Pinkerton JV, Liu JH, Matsumoto AM, Lobo RA, Davis Sr, Simon Ja (июнь 2020 г.). «Семинар по нормальным этапам эстрадиола у женщин в постменопаузе, сентябрь 2019 г., Чикаго, Иллинойс». Менопауза . 27 (6): 614–624. doi : 10.1097/gme.0000000000001556 . PMID 32379215 . S2CID 218534107 .
- ^ Schiff I, Tulchinsky D, Ryan KJ (октябрь 1977 г.). «Влагалищное поглощение эстрона и 17бета-эстрадиола» . Фертил. Стерил . 28 (10): 1063–6. doi : 10.1016/s0015-0282 (16) 42855-4 . PMID 908445 .
- ^ Вон Т.К., Хаммонд CB (март 1981 г.). «Заместительная терапия эстрогена». Clin Abstet Gynecol . 24 (1): 253–83. doi : 10.1097/00003081-198103000-00023 . PMID 6783358 .
- ^ Эдман CD (1983). «Заместительная терапия эстрогена». В Бучсбаум JJ (ред.). Менопауза . Клинические перспективы в акушерстве и гинекологии. Спрингер. С. 77–84. doi : 10.1007/978-1-4612-5525-3_6 . ISBN 978-1-4612-5525-3 Полем ISSN 0178-0328 .
- ^ Ригг Л.А., Миланс Б., Виллануева Б., Йен С.С. (декабрь 1977 г.). «Эффективность внутривагинального и интраназального введения микронизированного эстрадиола-17бета» . J. Clin. Эндокринол. Метаб . 45 (6): 1261–4. doi : 10.1210/jcem-45-6-1261 . PMID 591620 .
- ^ Подпрыгнуть до: а беременный в дюймовый и фон глин час я Дж k Lauritzen C (декабрь 1986 г.). «[Лечение нарушений климактерий вагинальным, ректальным и трансдермальным заменой эстрогена]» [Лечение нарушений климактерий вагинальным, ректальным и трансдермальным заменой эстрогена]. Der Gynakologe (на немецком языке). 19 (4): 248–253. PMID 3817597 .
- ^ Подпрыгнуть до: а беременный в дюймовый и Göretzlehner G (1989). «[Эффективность различных эстрогенов в зависимости от способа применения]» [Эффективность различных эстрогенов в качестве режима применения]. Zentralblatt für Gynäkologie (на немецком языке). 111 (16): 1093–1100. PMID 2683509 .
- ^ Ницца М., Джардинелли М (август 1954 г.). «[Активность природных и синтетических эстрогенов, вводимых ректальным путем: исследование с помощью влагалищного мазки]» [Активность природных и синтетических эстрогенов, вводимых ректальным путем: исследование с помощью мазки влагалища]. Minerva ginecologica (на итальянском языке). 6 (15): 548–551. PMID 13203215 .
- ^ Göretzlehner GS (1990). «Эффективный спектр разных эстрогенов» [спектр различного эстрогена]. В Wolf AS, Schneider HP (Eds.). Эстрогены в диагностике и терапии [ эстроген в диагностике и терапии ] (на немецком языке). Springer Publishing House. С. Doi : 10.1007/978-3-642-75101-1_9 . ISBN 978-3-642-75101-1 .
- ^ Подпрыгнуть до: а беременный в дюймовый и фон Labhart A (6 декабря 2012 г.). Клиническая эндокринология: теория и практика . Springer Science & Business Media. с. 548, 551. ISBN 978-3-642-96158-8 .
- ^ Подпрыгнуть до: а беременный Моран DJ, McGarrigle HH, Lachelin GC (январь 1994 г.). «Уровни прогестерона в материнской плазме падают после прямой кишки в введение эстраола». Журнал клинической эндокринологии и метаболизма . 78 (1): 70–2. doi : 10.1210/jcem.78.1.8288717 . PMID 8288717 .
- ^ Норман А.В., Литвак Г. (23 октября 1997 г.). Гормоны . Академическая пресса. С. 398 -. ISBN 978-0-08-053413-8 .
- ^ Курджак А., Черенак Ф.А. (25 сентября 2006 г.). Учебник по перинатальной медицине, второе издание CRC Press. Стр. 699 -. ISBN 978-1-4398-1469-7 .
- ^ Greene MF, Creasy RK, Resnik R, Iams JD, Lockwood CJ, Moore T (25 ноября 2008 г.). Медицина Creasy and Resnik по материнскому фетату: принципы и практика электронной книги . Elsevier Health Sciences. с. 115–. ISBN 978-1-4377-2135-5 .
- ^ Подпрыгнуть до: а беременный в Emmens CW (22 октября 2013 г.). Гормональный анализ . Elsevier Science. С. 394–. ISBN 978-1-4832-7286-3 .
- ^ Подпрыгнуть до: а беременный в дюймовый Ферин Дж (январь 1952). «Относительная продолжительность действия естественных и синтетических эстрогенов, вводимых парентерально у женщин с дефицитом эстрогена». Журнал клинической эндокринологии и метаболизма . 12 (1): 28–35. doi : 10.1210/jcem-12-1-28 . PMID 14907837 .
- ^ Hochberg RB (июнь 1998 г.). «Биологическая этерификация стероидов» . Эндокринные обзоры . 19 (3): 331–48. doi : 10.1210/edrv.19.3.0330 . PMID 9626557 .
- ^ Подпрыгнуть до: а беременный в Арун Н., Нарендра М, Шиха С. (15 декабря 2012 г.). Прогресс в акушерстве и гинекологии - 3 . Jaypee Brothers Medical Publishers Pvt. ООО с. 416–418. ISBN 978-93-5090-575-3 .
- ^ Подпрыгнуть до: а беременный в дюймовый и фон глин час Ориово М.А., Ландгрен Б.М., Стенстрем Б., Дикфалузи Е (апрель 1980 г.). «Сравнение фармакокинетических свойств трех эфиров эстрадиола». Контрацепция . 21 (4): 415–24. doi : 10.1016/s0010-7824 (80) 80018-7 . PMID 7389356 .
- ^ Кантор Э.Б. (сентябрь 1956 г.). «Обзор эстрогенов». Аспирантура . 20 (3): 224–231. doi : 10.1080/00325481.1956.11691266 . PMID 13359169 .
- ^ Браун JB (декабрь 1957 г.). «Взаимосвязь между эстрогенами мочи и эстрогенами, полученными в теле». Журнал эндокринологии . 16 (2): 202–212. doi : 10.1677/joe.0.0160202 . PMID 13491750 .
- ^ Пиво CT, Gallagher TF (май 1955 г.). «Исключение метаболитов эстрогена людьми. I. Судьба небольших доз эстрона и эстрадиола-17 бета» . Журнал биологической химии . 214 (1): 335–349. doi : 10.1016/s0021-9258 (18) 70972-1 . PMID 14367392 .
- ^ Diczfalusy E, Lauritzen C (1961). Эстрогены у людей: с 86 иллюстрациями . Springer Publishing House. п. 436. ISBN 9783540026433 .
- ^ Mazer C, Israel SL, Charny CW (1951). Диагностика и лечение менструальных расстройств и бесплодия . PB Hoeber. п. 46.
Более того, мы, таким образом, определили, что, независимо от того, насколько велика доза этих эстрогенов, растворенных в масле, вводится внутримышечной Эстрогены в масле должны быть с интервалами не более четырех дней (рис. 17). Насколько нам известно, существует только одно исключение из этого правила, а именно дипропионат эстрадиола в масле. Этот эстроген может быть предоставлен с еженедельными интервалами, потому что он медленно поглощается и устраняется, чем другие маслянистые препараты эстрогена.
- ^ Подпрыгнуть до: а беременный в дюймовый и фон глин час я Дж k л Leyendecker G, Geppert G, Nocke W, Ufer J (май 1975). после введения эстрадиола-17бета, эстрадиолбензоата, эстрадиол-валериата и эстрадиол-вандецилат у самки (автора перевода)]" "[Эстрадиол-17бета, эстрон, LH и FSH в сыворотке Введение эстрадиола 17β, бензоат эстрадиола, эстрадиола валериата и эстрадиола ундецилат у самки]. Geburtshilfe und frauenheilkunde (на немецком языке). 35 (5): 370–374. PMID 1150068 .
- ^ Подпрыгнуть до: а беременный в дюймовый Гепперт Г. (1975). эстрадиола-17β, эстрадиол-бензоата, эстрадиола валерианата и эстрадиола почасовой цилат у женщин: курс концентрации östradiol-17β, östron, LH и FS Исследования фармакокинетики , Эстрадиол, эстрадиол, бензоат эстрадиола, эстрадиол валератов и эстрадиол ундецилат у женщин: прогрессирование концентрации сывороточного эстрадиола-17β, эстрона, LH и FSH ]. С. OCLC 632312599 .
- ^ Подпрыгнуть до: а беременный в Lauritzen C (1988). «Природные и синтетические половые гормоны - биологические основы и принципы лечения» [Природные и синтетические половые гормоны - биологические основные и медицинские принципы]. В Schneider HP, Lauritzen C, Nieschlag E (Eds.). Основы и клиника репродукции человека [ основы и клиника репродукции человека ] (на немецком языке). Уолтер де Грютер. С. ISBN 978-3-11-010968-9 Полем OCLC 35483492 .
- ^ Подпрыгнуть до: а беременный Ульрих У., Пфайфер Т., Лаурицен С. (1994). «Быстрое увеличение плотности кости поясничного отдела позвоночника у женщин остеопеников с помощью инъекций с высокими дозами внутримышечных инъекций эстрогена. Предварительный отчет». Горм Метаб. Резерв 26 (9): 428–31. doi : 10.1055/s-2007-1001723 . PMID 7835827 . S2CID 260169203 .
- ^ AMA Оценка наркотиков . Америкальная медицинская ассоциация. 1971. с. 318
- ^ Темы наркотиков Redbook . Темы издательская компания. 1976. с. 580.
- ^ Krantz JC, Carr CJ, Aviado DM (1972). Фармакологические принципы медицинской практики Кранца и Карра: учебник по фармакологии и терапии для студентов и практиков медицины, фармации и стоматологии . Уильямс и Уилкинс. п. 1258. ISBN 9780683002928 .
- ^ Говард меня (1949). Современная лекарственная энциклопедия и терапевтический индекс . Лекарственные публикации. п. 697.
- ^ Vademecum International . J. Morgan Jones Publications. 1959. с. 147
- ^ Meyers FH, Jawetz E, Goldfien A (1978). Обзор медицинской фармакологии . Lange Medical Pub. п. 400. ISBN 978-0-87041-151-9 .
- ^ Подпрыгнуть до: а беременный в Осол А., Пратт Р. (1973). Соединенные Штаты Дисенсатор . Липпинкотт. п. 498. ISBN 978-0-397-55901-5 Полем
Следующие дозировки эстрадиола в форме водной суспензии, инъецированной внутримышечной, или имплантированных гранул подкожно, рекомендуются ведущим маунфакфейтером: синдром менопауза. - В средних случаях 1 мг. внутримышечно 2 или 3 раза в неделю в течение 2 или 3 недель; В более тяжелых случаях от 1 до 1,5 мг. После этого дозировка снижается до минимальной потребности, обычно в диапазоне от 0,5 до 1 мг. эстрадиола два раза в неделю.
- ^ Гудман Л.С. (1980). Гудман и Гилман - фармакологическая основа терапии . Макмиллан. п. 1428 . ISBN 978-0-02-344720-4 Полем
Эстрадиол, USP (Aquadiol, Progynon, другие), доступен в водной суспензии, содержащей 0,5 или 1 мг/мл для внутримышечной инъекции, и как гранулы 25 мг для подкожной имплантации. Различные сложные эфиры эстрадиола (бензоат, цивионат, энантат, пропионат, ундецилат и валерат) готовятся в водных суспензиях или жирных растворах для медленного высвобождения после внутримышечной инъекции. Эти препараты содержат от 0,5 до 40 мг/мл и продаются под различными торговыми наименованиями (Delestrogen, Depoestestradiol, Ovocylin, многие другие). Полиэстрадиол фосфат (эстрадурин) также доступен для внутримышечного использования при карциноме предстательной железы. Различные сульфатные эфиры эстрона, USP, доступны в таблетках, содержащих от 0,75 до 6 мг (Ogen, другие). Эти сложные эфиры и эстрон также поставляются под различными торговыми названиями в водной суспензии и жирном растворе, содержащем от 1 до 5 мг/мл для внутримышечной инъекции.
- ^ Подпрыгнуть до: а беременный Newman GT (сентябрь 1950). «Терапия эстрогенами путем имплантации кристаллов эстрадиола». Являюсь. J. Obstet. Гинекол . 60 (3): 661–4. doi : 10.1016/0002-9378 (50) 90438-8 . PMID 14771156 .
- ^ «Агофоллиновый депо инмекчни суспензиз (бензоас эстрадиоли)» [Суспензия депо Агофоллин для инъекции (эстрадиол бензоаза)] (PDF) . www.sukl.cz (в чешском). Архивировано из оригинала (PDF) 19 мая 2019 года . Получено 15 января 2022 года .
- ^ «Суспензия фоливирина для инъекции (бензоат эстрадиола, изобутират тестостерона)» (PDF) . Биотика как (в чешском).
- ^ Уоттенвил Х (1944). «О новом типе применения эстрогенных веществ» [новый тип применения эстрогенного вещества]. Швейцария. Мед. (на немецком языке). 74 : 159–161.
- ^ Подпрыгнуть до: а беременный Toppozada HK (1950). «Эстрогенная терапия с длительным действием». Акушерская и гинекологическая служба . 5 (4): 531. DOI : 10.1097/00006254-195008000-00021 . ISSN 0029-7828 .
- ^ Подпрыгнуть до: а беременный Field-Richards S (апрель 1955 г.). «Предварительная серия случаев гипоплазии матки, получавшей локальную инъекцию эстрогенной эмульсии». Журнал акушерства и гинекологии Британской империи . 62 (2): 205–213. doi : 10.1111/j.1471-0528.1955.tb14121.x . PMID 14368390 . S2CID 41256797 .
Эстрадиол монобензоат или эстрадиол дипропроорат медленно поглощаются из маслянистого раствора после внутримышечной инъекции, и для этой цели должны быть предпочтительнее неэтерифицированной формы. В качестве еще более медленного поглощения эстрадиол монобензоат можно получить из водной эмульсии этого гормона (Lens, Overbeek and Polderman, 1949). Такая подготовка к парентеральному использованию была доступна для этого эксперимента господами Organon Laboratories Limited.
- ^ Подпрыгнуть до: а беременный в дюймовый Lens J, Overbeek GA, Polderman J (1949). «Эффект половых гормонов в некоторых органических растворителях; эмульгирован в воде». Acta Endocrinologica . 2 (4): 396–404. doi : 10.1530/acta.0.0020396 . PMID 18140399 .
- ^ Horský J, Presl J (1981). «Гормональное лечение расстройств менструального цикла» . В Horsky J, Presl J (Eds.). Функция яичников и ее расстройства . Springer Science & Business Media. С. 309–332. doi : 10.1007/978-94-009-8195-9_11 . ISBN 978-94-009-8195-9 .
- ^ Кайзер Р (сентябрь 1961). «[Экскреция эстрогена во время цикла и после инъекции эстрадиольных эфиров. Вклад в терапию с депо -эстрогенами]» [экскреция эстрогена во время цикла и после инъекции эфиров эстрадиола. Вклад в терапию с депо эстрогенами]. Geburtshilfe und frauenheilkunde (на немецком языке). 21 : 868–878. PMID 13750804 .
- ^ Император Р. (1962). «Об экскреции эстрогена после инъекции эстрадуолдеров» [экскреция эстрогена после инъекции эстрадиольных эфиров]. Ткани и нейрогормоны [ ткани и нейрогормоны: физиология меланофорного гормона ] (на немецком языке). Спрингер, Берлин, Гейдельберг. С. Doi : 10.1007/978-3-642-86860-3_24 . ISBN 978-3-540-02909-0 .
- ^ Ширман Р.П. (июнь 1975 г.). «Развитие контрацептивов депо». Журнал стероидной биохимии . 6 (6): 899–902. doi : 10.1016/0022-4731 (75) 90323-4 . PMID 1177432 .
- ^ Подпрыгнуть до: а беременный в Edkins RP (1959). «Модификация продолжительности действия наркотиков». Журнал фармации и фармакологии . 11 (S1): 54t - 66t. doi : 10.1111/j.2042-7158.1959.tb10412.x . ISSN 0022-3573 . S2CID 78850713 .
- ^ Herrmann U (1958). «В зависимости от сноса кровотечения на размер зерна», вызванного кристаллами эстрогена и прогестерона ». Гинекологическое и оборудование . 146 (4): 318–323. Doi : 10.1159/000306607 . ISSN 1423-002X .
- ^ D'Arcangues C, Snow RC (1999). «Инъекционные контрацептивы». Управление фертильностью - обновление и тенденции . Спрингер. С. 121–149. doi : 10.1007/978-3-642-86696-8_6 . ISBN 978-3-642-86698-2 Полем
Химики из 12 стран по всему миру синтезировали 230 эфирных оксимов и сложных эфиров норетистерона и левоноргестрела и 72 сложных эфиров тестостерона. После очистки и состава эти соединения были протестированы у грызунов и у подчиненных приматов для наиболее перспективных. Из этих биологических исследований выяснилось, что эфиры левоноргестрела обычно действовали более длинные, чем эфиры норетистероне; Водные суспензии, как правило, были лучше, чем жирные растворы; и продолжительность действия самых длинных действующих агентов сильно зависела от размера кристаллов их водных суспензий.
- ^ Подпрыгнуть до: а беременный в дюймовый и Sang GW (апрель 1994 г.). «Фармакодинамические эффекты комбинированных инъекционных контрацептивов один раз в месяц». Контрацепция . 49 (4): 361–385. doi : 10.1016/0010-7824 (94) 90033-7 . PMID 8013220 .
DMPA представляет собой микрокристаллическую водную суспензию ацетата медроксипрогестерона, которая дается глубокой внутримышечной инъекцией. В результате очень низкой растворимости в водном растворе он обеспечивает очень длительное высвобождение с места депо. [...] Точная формулировка и размер микрокристаллов наиболее важны для продолжительности действия. Меньшие частицы быстрее растворяются, чем более крупные, и, следовательно, MPA появляется быстрее в циркуляции, с более быстрым исключением из организма. Это также верно для составы «Однажды в месяц», Cyclofem.
- ^ Подпрыгнуть до: а беременный в Фрейзер IS (1989). «Системная гормональная контрацепция по неральным маршрутам» . В Филши М, Guillebaud J (Eds.). Контрацепция: наука и практика . Elsevier Science. С. 109–125. ISBN 978-1-4831-6366-6 Полем
Более традиционные внутримышечные инъекционные методы состоят из стероидных ацетатов или эфиров, которые были сформулированы в маслянистых растворах или микрокристаллических суспензиях. Стероидные сложные эфиры в маслянистых растворе, по -видимому, распределяются на участки хранения в жировой ткани, из которой они медленно высвобождаются в кровообращение. Активный стероидный фрагмент затем расщепляется от эфира, после чего он способен оказывать его биологический эффект. Микрокристаллические суспензии остаются в качестве депо в месте инъекции, а активный стероид или эфир медленно высвобождается с поверхности кристаллов.
- ^ Браун мы, Брэдбери Дж.Т. (август 1949 г.). «Использование человеческого влагалищного мазода в анализе эстрогенов». Журнал клинической эндокринологии и метаболизма . 9 (8): 725–735. doi : 10.1210/JCEM-9-8-725 . PMID 18133489 .
- ^ Rappaport F, Lass N (август 1947 г.). «Инъекционные кристаллические гормоны». Лансет . 2 (6469): 296–297. doi : 10.1016/s0140-6736 (47) 92066-7 . PMID 20344499 .
- ^ Подпрыгнуть до: а беременный Llewellyn W (2011). Анаболики . Molecular Nutrition LLC. С. 314–322. ISBN 978-0-9828280-1-4 .
- ^ Подпрыгнуть до: а беременный Полдерман Дж (февраль 1962 г.). «Подвески в фармацевтической практике». Boll Chim Farm . 101 (12): 105–22. doi : 10.1093/ajhp/19.12.611 . PMID 14487508 .
- ^ Gordon D, Horwitt BN, Segaloff A, Murison PJ, Schlosser JV (март 1952 г.). «Гормональная терапия при раке молочной железы. III. Влияние прогестерона на клиническое курс и гормональную экскрецию» . Рак . 5 (2): 275–7. doi : 10.1002/1097-0142 (195203) 5: 2 <275 :: AID-CNCR2820050213> 3,0.CO; 2-H . PMID 14905411 .
- ^ Bradbury JT, Long RC, Durham WC (1953). «Требования к прогестерону и эстрогенам, чтобы вызвать и поддерживать Decidua». Фертил. Стерил . 4 (1): 63–75. doi : 10.1016/s0015-0282 (16) 31145-1 . PMID 13021207 .
- ^ Фрейзер IS (1998). Эстрогены и прогестогены в клинической практике . Черчилль Ливингстон. п. 13. ISBN 978-0-443-04706-0 .
- ^ Подпрыгнуть до: а беременный в Кар H (8 марта 2013 г.). Консервативная терапия женских заболеваний: реклама, ограничения и методы, включая рецепт . Springer Publishing House. С. ISBN 978-3-7091-5694-0 .
- ^ Киммиг Дж (14 марта 2013 г.). Терапия кожи и венерических заболеваний . Springer Publishing House. С. ISBN 978-3-642-94850-3 .
- ^ Overbeek CA (1952). «Некоторые данные об эмульсиях стероидных гормонов». Симпозиум Фонда CIBA - Администрация стероидных гормонов (Книга II Коллоквии по эндокринологии, том 3) . Симпозии Фонда Новартиса. Джон Уайли и сыновья. С. 254–262. doi : 10.1002/9780470715154.CH2 . ISBN 978-0-470-71515-4 Полем ISSN 1935-4657 .
- ^ Подпрыгнуть до: а беременный Миккола А., Рууту М., Аро Дж., Ранникко С., Сало Дж. (1999). «Роль парентерального полиэстрадиолфосфата в лечении прогрессируемого рака простатического рака на пороге нового тысячелетия». Энн Чир Джинакол . 88 (1): 18–21. PMID 10230677 .
- ^ Подпрыгнуть до: а беременный в «Все лекарства - Фармановия» . Архивировано с оригинала 29 марта 2019 года . Получено 28 апреля 2019 года .
- ^ Подпрыгнуть до: а беременный в дюймовый Stege R, Gunnarsson Po, Johansson CJ, Olsson P, Pousette A, Carlström K (май 1996 г.). «Фармакокинетика и подавление тестостерона однократной дозы полиэстрадиолфосфата (эстрадурин) у пациентов с раком простатического рака». Простата . 28 (5): 307–10. doi : 10.1002/(SICI) 1097-0045 (199605) 28: 5 <307 :: AID-Pros6> 3.0.co; 2-8 . PMID 8610057 . S2CID 33548251 .
- ^ «Полиэстрадиол фосфат» . Drugs.com .
- ^ Подпрыгнуть до: а беременный в дюймовый «Ювенам и (эстрадиол) - лекарства PLM» . ПЛМ лекарства . Архивировано из оригинала 18 сентября 2018 года . Получено 17 сентября 2018 года .
- ^ «Ювенам Э» . Drugs.com . Архивировано из оригинала 18 сентября 2018 года . Получено 20 декабря 2018 года .
- ^ Подпрыгнуть до: а беременный в Davis Me, Wiener M, Jacobson Hi, Jensen EV (декабрь 1963 г.). «Метаболизм эстрадиола у беременных и небеременных женщин». Являюсь. J. Obstet. Гинекол . 87 (8): 979–90. doi : 10.1016/0002-9378 (63) 90091-7 . PMID 14089314 .
- ^ Подпрыгнуть до: а беременный в Джонс Т.М., Фан против, Ландау Р.Л., Розенфилд Р. (декабрь 1978 г.). «Прямое ингибирование функции клеток Лейдига эстрадиолом». J. Clin. Эндокринол. Метаб . 47 (6): 1368–73. doi : 10.1210/jcem-47-6-1368 . PMID 122429 .
- ^ Подпрыгнуть до: а беременный Garza-Flores J (апрель 1994 г.). «Фармакокинетика однократных инъекционных контрацептивов». Контрацепция . 49 (4): 347–59. doi : 10.1016/0010-7824 (94) 90032-9 . PMID 8013219 .
- ^ Подпрыгнуть до: а беременный Schwartz MM, Soule SD (июль 1955 г.). «Эстрадиол 17-бета-циклопентилпропионат, долгожданный эстроген». Являюсь. J. Obstet. Гинекол . 70 (1): 44–50. doi : 10.1016/0002-9378 (55) 90286-6 . PMID 14388061 .
- ^ Подпрыгнуть до: а беременный Герхард Гепперт (1975). эстрадиола-17β, эстрадиол-бензоата, эстрадиола валерианата и эстрадиола почасовой цилат у женщин: курс концентрации östradiol-17β, östron, LH и FS Исследования фармакокинетики , Эстрадиол, эстрадиол, бензоат эстрадиола, эстрадиол валератов и эстрадиол ундецилат у женщин: прогрессирование концентрации сывороточного эстрадиола-17β, эстрона, LH и FSH ]. С. OCLC 632312599 .
- ^ Подпрыгнуть до: а беременный Вермейлен А (1975). «Длинные стероидные препараты». Acta Clin Belg . 30 (1): 48–55. doi : 10.1080/17843286.1975.11716973 . PMID 1231448 .
- ^ Подпрыгнуть до: а беременный Espino y Sosa, Сальвадор; Корантес, Мириам; Алехандро Гомес Рико, Джейкоб; Cortés Bonilla, Manuel (2019). Полем В Хане, Вахид Али (ред.). Строительный ISBN 978-1-83880-867-9 .
- ^ «Ювенам и (эстрадиол) - лекарства PLM» . ПЛМ лекарства . Архивировано из оригинала 18 сентября 2018 года . Получено 17 сентября 2018 года .
- ^ Подпрыгнуть до: а беременный Unger CA (декабрь 2016 г.). «Гормональная терапия для трансгендерных пациентов» . Трансляционная андрология и урология . 5 (6): 877–884. doi : 10.21037/tau.2016.09.04 . PMC 5182227 . PMID 28078219 .
- ^ Al-Futaisi AM, Al-Zakwani IS, Almahrezi Am, Morris D (декабрь 2006 г.). «Подкожное введение тестостерона. Отчет о пилотном исследовании» . Саудовский медицинский журнал . 27 (12): 1843–1846. PMID 17143361 .
- ^ Olson J, Schrager SM, Clark LF, Dunlap SL, Belzer M (сентябрь 2014 г.). «Подкожный тестостерон: эффективный механизм доставки для мужчин молодых трансгендеров». Здоровье ЛГБТ . 1 (3): 165–167. doi : 10.1089/lgbt.2014.0018 . PMID 26789709 .
- ^ Spratt Di, Stewart II, Savage C, Craig W, Spack NP, Chandler DW, et al. (Июль 2017). «Подкожная инъекция тестостерона является эффективной и предпочтительной альтернативой внутримышечной инъекции: демонстрация у пациентов с трансгендером женщины-мужчины» . Журнал клинической эндокринологии и метаболизма . 102 (7): 2349–2355. doi : 10.1210/jc.2017-00359 . PMID 28379417 . S2CID 3822101 .
- ^ McFarland J, Craig W, Clarke NJ, Spratt DI (август 2017 г.). «Концентрации тестостерона в сыворотке остаются стабильными между инъекциями у пациентов, получающих подкожный тестостерон» . Журнал эндокринного общества . 1 (8): 1095–1103. doi : 10.1210/js.2017-00148 . PMC 5686655 . PMID 29264562 .
- ^ Wilson DM, Kiang TK, Ensom MH (март 2018 г.). «Фармакокинетика, безопасность и приемлемость пациента подкожного и внутримышечного инъекции тестостерона для гендерной терапии: пилотное исследование». Американский журнал аптеки системы здравоохранения . 75 (6): 351–358. doi : 10.2146/ajhp170160 . PMID 29367424 . S2CID 3886536 .
- ^ Сингх Г.К., Тернер Л., Десаи Р., Хименес М., Хандсман Д.Джея (июль 2014 г.). «Фармакокинетическое фармакодинамическое исследование подкожной инъекции депо нандролона с использованием высушенных пятен в крови, в сочетании с анализами масс-спектрометрии в жидкой хроматографии ультрапресса» . Журнал клинической эндокринологии и метаболизма . 99 (7): 2592–2598. doi : 10.1210/jc.2014-1243 . PMID 24684468 .
- ^ Laurenzano SE, Newfield RS, Lee E, Marinkovic M (декабрь 2021 г.). «Подкожный тестостерон эффективен и безопасен в качестве гендерной гормональной терапии у подростков трансмаскулина и гендерных дивнимов и молодых людей: 8-летний опыт одного центра» . Трансгендерное здоровье . 6 (6): 343–352. doi : 10.1089/trgh.2020.0103 . PMC 8664110 . PMID 34988290 . S2CID 234034901 .
- ^ Подпрыгнуть до: а беременный Чан Во, Колвилл Дж., Персо Т., Бакли О., Гамильтон С., Торреггиани В.К. (июнь 2006 г.). «Внутримышечные инъекции в ягодицы: действительно ли они внутримышечно?». Европейский журнал радиологии . 58 (3): 480–484. doi : 10.1016/j.ejrad.2006.01.008 . PMID 16495027 .
- ^ Подпрыгнуть до: а беременный Palma S, Strohfus P (ноябрь 2013 г.). «У меня инъекции, страдающие ожирением, и женщины с избыточным весом? Исследование в области техники инъекций» . Прикладные исследования сестринского дела . 26 (4): E1 - E4. doi : 10.1016/j.apnr.2013.09.002 . PMID 24156877 .
- ^ Kuhl H, Taubert HD (1987). Климатическая - патофизиология, клиника, терапия [ Климаттерическая - патофизиология, клиника, терапия ] (на немецком языке). Штутгарт, Германия: Thieme Verlag . п. 108. ISBN 978-3-13-700801-9 .
- ^ Подпрыгнуть до: а беременный Шериф К (2013). «Значение гормональных маршрутов введения». Гормональная терапия . Спрингер. С. 57–61. doi : 10.1007/978-1-4614-6268-2_7 . ISBN 978-1-4614-6267-5 .
- ^ Подпрыгнуть до: а беременный в дюймовый Symonds IM, Arulkumaran S (3 августа 2013 г.). Основная акушерство и гинекология электронная книга . Elsevier Health Sciences. С. 258-. ISBN 978-0-7020-5475-4 .
- ^ Подпрыгнуть до: а беременный в дюймовый и фон глин час я Дж k л м не а п Q. ведущий Plouffe Jr L, Ravnikar VA, Speroff L, Watts NB (6 декабря 2012 г.). Комплексное управление менопаузой . Springer Science & Business Media. С. 271–. ISBN 978-1-4612-4330-4 .
- ^ Van Boxtel CJ, Santoso B, Edwards IR (2008). Преимущества лекарств и риски: Международный учебник по клинической фармакологии . Ios press. С. 769 -. ISBN 978-1-58603-880-9 .
- ^ Подпрыгнуть до: а беременный Birkhauser M, Barlow D, Notelovitz M, Rees M (12 августа 2005 г.). План здравоохранения для взрослой женщины: руководство по управлению . CRC Press. С. 27-. ISBN 978-0-203-49009-9 .
- ^ Индекс 2000: Международный каталог лекарств . Тейлор и Фрэнсис США. 2000. стр. 404-406. ISBN 978-3-88763-075-1 Полем Получено 13 сентября 2012 года .
- ^ Мелвилл С (22 сентября 2015 г.). Сексуальное и репродуктивное здоровье с первого взгляда . Уайли. С. 108–. ISBN 978-1-119-23516-3 .
- ^ "Эстрадиол" . Drugs.com .
- ^ Пинкертон СП (декабрь 2014 г.). «Каковы опасения по поводу индивидуальной« биоидентичной »гормональной терапии?». Менопауза . 21 (12): 1298–300. doi : 10.1097/gme.0000000000000376 . PMID 25387347 .
- ^ Pinkerton JV, Pickar JH (февраль 2016 г.). «Обновление медицинских и нормативных проблем, касающихся составных и одобренных FDA лекарств, включая гормональную терапию» . Менопауза . 23 (2): 215–23. doi : 10.1097/gme.0000000000000523 . PMC 4927324 . PMID 26418479 .
- ^ Санторо Н., Браунштейн Г.Д., Баттс К.Л., Мартин К.А., Макдермотт М., Пинкертон СП (апрель 2016 г.). «Состояние биоидентичных гормонов в практике эндокринологии: научное утверждение эндокринного общества» . Журнал клинической эндокринологии и метаболизма . 101 (4): 1318–43. doi : 10.1210/jc.2016-1271 . PMID 27032319 . S2CID 33802990 .
- ^ Хот А, Полмеар А (18 ноября 2011 г.). Практическая общая практика электронная книга: Руководство по эффективному клиническому лечению . Elsevier Health Sciences. С. 338–. ISBN 978-0-7020-4909-5 .
- ^ Крененберг Ф. (1990). «Горячие вспышки: эпидемиология и физиология». Энн. Нью -Йорк Акад. Наука 592 (1): 52–86, обсуждение 123–33. Bibcode : 1990nyasa.592 ... 52K . doi : 10.1111/j.1749-6632.1990.tb30316.x . PMID 2197954 . S2CID 86458927 .
- ^ Gearhart JP, Witherington R, Coleman CH (январь 1981 г.). «Подкожная имплантация пеллетов эстрадиола при лечении передовой простатической карциномы». Урология . 17 (1): 44–8. doi : 10.1016/0090-4295 (81) 90010-8 . ISSN 0090-4295 . PMID 6161467 .
- ^ Okie MV, Carden ML, McGee HJ, Tracey EM (март 1951 г.). «Имплантация пеллетов эстрадиола при раке простаты». NY State J Med . 51 (5): 637–40. ISSN 0028-7628 . PMID 14815766 .
- ^ Трейси Эм (июнь 1952 г.). «Использование пеллетов эстрадиола при лечении карциномы предстательной железы; ссылка на изменения в ответ на стероидную терапию». J Int Coll Surg . 17 (6): 849–52. ISSN 0096-557X . PMID 14938629 .
- ^ Kearns Wm (1942). «Лечение рака простаты с эстрогенами» . Висконсин Мед. J. (41): 575. ISSN 0043-6542 .
- ^ Kearns Wm (1942). «Пеллетная имплантация гормонов в урологии». Журнал урологии . 47 (5): 587–590. doi : 10.1016/s0022-5347 (17) 70847-6 . ISSN 0022-5347 .
- ^ Ufer J (1968). «Терапевтическое применение прогестаров у людей» [терапевтическое использование прогестагенов у людей]. Прогестогенный [ Pro -Stogen ]. Springer Publishing House. С. 1026–1124. Doi : 10.1007/978-3-642-99941-3_7 . ISBN 978-3-642-99941-3 Полем
Комбинация с внутриутробным лечением эстрогенами: чтобы достичь влияния роста на матку с относительно небольшими дозами эстрогенов, отдельные авторы [235,264] применяли внутриматочные или внутримотуральные кристаллические суспензии. Стремясь поддерживать регулярный цикл во время этого режима, Husslein и Gitsch [418] вводили 30 раз 10 мг прогестерона парентерально через 14 дней после актуального лечения с помощью суспензии кристаллов эстрадиола 3–10 мг. Таким образом, они считают, что достигли максимального развития матки с минимумом гормонов.
- ^ Husslein H, Gitsch E (1951). «О внутриутробном применении острогена в кристаллической суспензии» [внутриутробное применение кристаллов эстрогена в суспензии]. Centralbl Gynakol (на немецком языке). 73 (14): 1219–24. PMID 14867680 .
- ^ GoH HH, Chew PC, Karim SM, Ratnam SS (февраль 1980 г.). «Контроль секреции гонадотрофина стероидными гормонами у кастрированных мужских транссексуалов. I. Влияние инфузии эстрадиола на уровни плазмы на стимулирующих фолликулах гормона и лютеинизирующего гормона». Клин Эндокринол. (OXF) . 12 (2): 165–75. doi : 10.1111/j.1365-2265.1980.tb02131.x . PMID 6772356 . S2CID 5989414 .
- ^ Goh HH, Ratnam SS (октябрь 1990 г.). «Влияние эстрогенов на секрецию пролактина у транссексуальных субъектов». Arch Sex Behav . 19 (5): 507–16. doi : 10.1007/bf02442351 . PMID 2260915 . S2CID 39940587 .
- ^ Подпрыгнуть до: а беременный в Дюстерберг Б., Шмидт-Гольвицер М., Хюмпель М. (1985). «Фармакокинетика и биотрансформация эстрадиола Валерера у женщин в овариэктомии». Горм Резерв 21 (3): 145–54. doi : 10.1159/000180039 . PMID 2987096 .
- ^ Подпрыгнуть до: а беременный в дюймовый Gahart BL, Nazareno AR, Ortega M (9 мая 2018 г.). Внутривенные лекарства Gahart 2019 года - электронная книга: справочник для медсестер и медицинских работников . Elsevier Health Sciences. С. 361–. ISBN 978-0-323-61273-9 .
- ^ Bhavnani BR, Stanczyk FZ (июль 2014 г.). «Фармакология конъюгированных эстрогенов лошадей: эффективность, безопасность и механизм действия». J. Steroid Biochem. Мол Биол . 142 : 16–29. doi : 10.1016/j.jsbmb.2013.10.011 . PMID 24176763 . S2CID 1360563 .
- ^ Подпрыгнуть до: а беременный в «Премарин внутривенно (конъюгированные эстрогены, USP) для инъекции» (PDF) . Wyeth Pharmaceuticals, Inc. Управление по контролю за продуктами и лекарствами США. Ноябрь 2017 года.
- ^ Подпрыгнуть до: а беременный Бергенхайм в, Анрикссон Р. (февраль 1998 г.). «Фармакокинетика и фармакодинамика эстрамустинового фосфата». КЛИНАЯ ФАРМАКОКИНЕТ . 34 (2): 163–72. doi : 10.2165/00003088-199834020-00004 . PMID 9515186 . S2CID 1943973 .
- ^ Подпрыгнуть до: а беременный Scoccia B, Demir H, Elter K, Scommengna A (2009). «Успешное медицинское управление постгистероскопическим кровотечением метропластики с внутривенной терапией эстрогенами: отчет о двух случаях и обзоре литературы». J Минингвазивный гинекол . 16 (5): 639–42. doi : 10.1016/j.jmig.2009.05.012 . PMID 19835811 .
- ^ Подпрыгнуть до: а беременный в Gunnarsson Po, Forshell GP (июнь 1984 г.). «Клиническая фармакокинетика эстрамустинового фосфата». Урология . 23 (6 Suppl): 22–7. doi : 10.1016/s0090-4295 (84) 80093-x . PMID 6375076 .
- ^ Loeser AA (февраль 1948 г.). «Действие внутривенно введенных половых гормонов и других веществ на кровоток в человеческом эндометрии». J Obstet Gynaecol Br Emp . 55 (1): 17–22. doi : 10.1111/j.1471-0528.1948.tb07044.x . PMID 18902558 . S2CID 72219242 .
- ^ Герц Р., Туллнер WW (октябрь 1949). «Внутривенное введение массивных доз эстрогена к человеческому субъекту; уровень крови достигнут». Прокурор Соц Эксплуат Биол. Медик 72 (1): 187–91. doi : 10.3181/00379727-72-17373 . PMID 15391710 . S2CID 9223167 .
- ^ Туллнер WW, Young JP, Hertz R (1952). «Введение массивной дозы эстрогена для пациентов с раком молочной железы и простатического рака; уровни крови достигнуты». Симпозиум Фонда CIBA - стероидные гормоны и рост опухоли, Книга I Colleoquia по эндокринологии . Симпозии Фонда Новартиса. Тол. 1. Джон Вили и сыновья. С. 157–169. doi : 10.1002/9780470718759.ch13 . ISBN 978-0-470-71875-9 Полем ISSN 1935-4657 .
- ^ McManus JM, Bohn K, Alyamani M, Chung YM, Klein EA, Sharifi N (2019). «Быстрое и структурированное клеточное поглощение выбранных стероидов» . Plos один . 14 (10): E0224081. BIBCODE : 2019PLOSO..1424081M . doi : 10.1371/journal.pone.0224081 . PMC 6797172 . PMID 31622417 .
- ^ Грей Дж. М., Дадли С.Д., Уэйд Г.Н. (январь 1981 г.). «Ядерное связывание клеток in vivo 17 бета-[3H] эстрадиола в жировых тканях крысы». Являюсь. J. Physiol . 240 (1): E43–6. doi : 10.1152/ajpendo.1981.240.1.e43 . PMID 7457597 .
- ^ Мендель CM (август 1989). «Гипотеза свободного гормона: физиологически основанная на математической модели». Эндок. Преподобный 10 (3): 232–74. doi : 10.1210/edrv-10-3-232 . PMID 2673754 .
- ^ Подпрыгнуть до: а беременный в Дорфман Р.И. (1961). «Метаболизм стероидных гормонов». Радиоактивные изотопы в физиологической диагностике и терапии / искусственных радиоактивных изотопах в диагностике физиологии и терапии . Спрингер. С. Doi : 10.1007/978-3-642-49761-2_39 . ISBN 978-3-642-49477-2 .
- ^ Подпрыгнуть до: а беременный Сандберг А.А., Slaunwhite WR (август 1957 г.). «Исследования по фенольным стероидам у людей. II. Метаболическая судьба и гепато-билиарная циркуляция C14-ESTRONE и C14-ESTRADIOL у женщин» . J. Clin. Инвестировать 36 (8): 1266–78. doi : 10.1172/JCI103524 . PMC 1072719 . PMID 13463090 .
Дальнейшее чтение
[ редактировать ]- Вольф А.С., Шнайдер Х.П. (1989). Эстрогены в диагностике и терапии [ эстроген в диагностике и терапии ]. Springer Publishing House. С. ISBN 978-3-642-75101-1 .
- Кал Х (сентябрь 1990). «Фармакокинетика эстрогенов и прогестогенов». Нарушать . 12 (3): 171–97. doi : 10.1016/0378-5122 (90) 003- Y 2170822PMID
- Lobo RA, Cassidenti DL (январь 1992 г.). «Фармакокинетика Oral 17 бета-эстрадиола». J Reprod Med . 37 (1): 77–84. PMID 1548642 .
- О'Коннелл М.Б. (сентябрь 1995 г.). «Фармакокинетические и фармакологические различия между различными продуктами эстрогена». J Clin Pharmacol . 35 (9S): 18S - 24S. doi : 10.1002/j.1552-4604.1995.tb04143.x . PMID 8530713 . S2CID 10159196 .
- Oettel M, Schillinger E (1999). Эстрогены и антиэстрогены I: физиология и механизмы действия эстрогенов и антиэстрогенов . Springer Science & Business Media. ISBN 978-3-642-58616-3 .
- Oettel M, Schillinger E (1999). Эстрогены и антиэстрогены II: фармакология и клиническое применение эстрогенов и антиэстрогена . Springer Science & Business Media. ISBN 978-3-642-60107-1 .
- Куль Х (2000). «Фармакология эстрадиола и эстрала». Менопауза обзор . 5 : 23–44.
- Ruggiero RJ, Likis Fe (2002). «Эстроген: физиология, фармакология и составы для заместительной терапии». J Mid туалет женский здоровье . 47 (3): 130–8. doi : 10.1016/s1526-9523 (02) 00233-7 . PMID 12071379 .
- Куль Х (2005). «Фармакология эстрогенов и прогестогенов: влияние различных путей введения» (PDF) . Климактерий . 8 (Suppl 1): 3–63. doi : 10.1080/13697130500148875 . PMID 16112947 . S2CID 24616324 .
- Barnes RB, Levrant SG (2007). «Фармакология эстрогенов». Лечение женщины в постменопаузе . Академическая пресса. С. 767–777. doi : 10.1016/b978-0123694443-0/50066-1 . ISBN 978-0-12-369443-0 .
- Fruzzetti F, Tremollieres F, Bitzer J (2012). «Обзор разработки комбинированных оральных контрацептивов, содержащих эстрадиол: фокус на эстрадиол Валерат/Диеногест» . Гинекол. Эндокринол . 28 (5): 400–8. doi : 10.3109/09513590.2012.662547 . PMC 3399636 . PMID 22468839 .
- Stanczyk FZ, Archer DF, Bhavnani BR (2013). «Этинилэстрадиол и 17β-эстрадиол в комбинированных оральных контрацептивах: фармакокинетика, фармакодинамика и оценка риска». Контрацепция . 87 (6): 706–27. doi : 10.1016/j.contraception.2012.12.011 . PMID 23375353 .









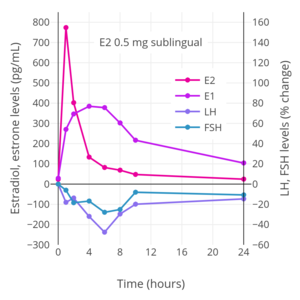





![Уровни эстрадиола в стационарном состоянии в течение 4 дней с различными дозами вивель-типа (Vivelle, Vivelle-Dot, Mylan Generic) дважды в неделю в постменопаузе. [226] [227] [228]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/d9/Estradiol_levels_with_different_dosages_of_transdermal_estradiol_patches_%28Vivelle-type%29_in_postmenopausal_women.png/300px-Estradiol_levels_with_different_dosages_of_transdermal_estradiol_patches_%28Vivelle-type%29_in_postmenopausal_women.png)
![Уровни эстрадиола в течение 7,5 дней после единого применения различных доз кульминационного типа (Climara, Menostar, Mylan generiar) один раз в неделю пятно матрицы эстрадиола в брюшную полость и удаленные на 7-й день в постменопаузе. [229 [229 [229. ] [230] [231]](http://upload.wikimedia.org/wikipedia/commons/thumb/4/43/Estradiol_levels_with_different_dosages_of_transdermal_estradiol_patches_%28Climara-type%29_in_postmenopausal_women.png/300px-Estradiol_levels_with_different_dosages_of_transdermal_estradiol_patches_%28Climara-type%29_in_postmenopausal_women.png)
![Уровни эстрадиола в течение 8 дней после единого применения 50 или 100 мкг/день кульминационного типа (Climara, Menostar, Mylan generic) один раз в неделю трансдермальный патч эстрадиола в брюшную полость и удален на 7-й день в постменопаузе. . [232]](http://upload.wikimedia.org/wikipedia/commons/thumb/c/c1/Estradiol_levels_with_a_50_or_100_%CE%BCg_per_day_transdermal_estradiol_patch_%28Climara-type%29_in_women.png/271px-Estradiol_levels_with_a_50_or_100_%CE%BCg_per_day_transdermal_estradiol_patch_%28Climara-type%29_in_women.png)
![Уровни эстрадиола и эстрона с применением одного 50 мкг/день трансдермального пласта эстрадиола (эстрадерма) у женщин в постменопаузе. [188]](http://upload.wikimedia.org/wikipedia/commons/thumb/5/5b/Estrogen_levels_with_a_50_%C2%B5g_per_day_estradiol_transdermal_patch_in_postmenopausal_women.png/300px-Estrogen_levels_with_a_50_%C2%B5g_per_day_estradiol_transdermal_patch_in_postmenopausal_women.png)
![Уровень эстрадиола с одним 100 мкг/день пластырь эстрадиола (эстрадерма) с и без этанола, добавленного у женщин в постменопаузе. [17] [233] Этот патч имеет продолжительность от 3 до 4 дней и предназначена для применения в два раза в неделю. В одной группе этанол вводили в область между пятном и кожей на 3 -й день. [17] [233] Это дало значительно более высокие и длительные уровни эстрадиола. [17] [233]](http://upload.wikimedia.org/wikipedia/commons/thumb/e/e1/Estradiol_levels_with_a_single_application_of_a_100_%C2%B5g_per_day_estradiol_reservoir_patch_%28Estraderm%29_with_and_without_an_ethanol_injection_in_postmenopausal_women.png/299px-thumbnail.png)
![Уровни эстрадиола и тестостерона с эстрадиолом с высокой дозовой в форме от двух до шести 100 мкг/день пятен эстрадиол (Progynova TS) у мужчин с раком простаты. [14] [214] [234]](http://upload.wikimedia.org/wikipedia/commons/thumb/a/ab/Estradiol_and_testosterone_levels_with_high-dose_estradiol_patches_in_men.png/300px-Estradiol_and_testosterone_levels_with_high-dose_estradiol_patches_in_men.png)
![Уровни эстрадиола с от 50 до 100 мкг/день трансдермальные пятно эстрадиол, применяемые к предплечью, и к мошонке в кроссовере у 2 мужчин с раком простаты. [204] У 35 мужчин непрерывно обработали одно 100 мкг/день пластыря эстрадиола, средний уровень эстрадиола составлял ~ 500 пг/мл (диапазон ~ 125–1,200 пг/мл). [204]](http://upload.wikimedia.org/wikipedia/commons/thumb/e/e9/Estradiol_levels_with_transdermal_estradiol_patches_applied_to_the_forearm_or_scrotum_in_men.png/300px-Estradiol_levels_with_transdermal_estradiol_patches_applied_to_the_forearm_or_scrotum_in_men.png)
![Уровни эстрадиола и эстрона с раз в день применения 1,25 г трансдермального эстрадиол геля (эстрогеля), содержащего 0,06% или 0,75 мг эстрадиола после 14 дней непрерывной терапии у женщин в постменопаузе. [194]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b9/Estrogen_levels_with_1.25_g_of_0.06%25_transdermal_estradiol_gel_%28EstroGel%29_per_day_in_postmenopausal_women.png/289px-Estrogen_levels_with_1.25_g_of_0.06%25_transdermal_estradiol_gel_%28EstroGel%29_per_day_in_postmenopausal_women.png)
![Уровни эстрадиола с раз в день применения трансдермального эстрадиол геля (эстрогеля), содержащего 1,5 или 3,0 мг эстрадиола в течение 3 дней введения у женщин в постменопаузе. [96] [249]](http://upload.wikimedia.org/wikipedia/commons/thumb/3/3c/Estradiol_levels_with_1.5_or_3.0_mg_per_day_transdermal_estradiol_gel_in_postmenopausal_women.png/299px-Estradiol_levels_with_1.5_or_3.0_mg_per_day_transdermal_estradiol_gel_in_postmenopausal_women.png)
![Уровни эстрадиола после последней дозы с трансдермальным гель -эстрадиолом 1 мг/день, применяемый к различным количеству области кожи (200 см2, 400 см2 или как можно большие) у женщин в постменопаузе. [250]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/19/Estradiol_levels_with_1_mg_per_day_transdermal_estradiol_gel_applied_to_different_amounts_of_area_in_postmenopausal_women.png/262px-Estradiol_levels_with_1_mg_per_day_transdermal_estradiol_gel_applied_to_different_amounts_of_area_in_postmenopausal_women.png)
![Уровни эстрогена с одним вагинальным применением 0,5 мг микронизированного эстрадиола у 2 мл раствора у женщин в постменопаузе. [257] [258] [259]](http://upload.wikimedia.org/wikipedia/commons/thumb/6/63/Estrogen_levels_with_a_single_vaginal_application_of_0.5_mg_estradiol_in_postmenopausal_women.png/300px-Estrogen_levels_with_a_single_vaginal_application_of_0.5_mg_estradiol_in_postmenopausal_women.png)
![Процентное изменение уровня эстрадиола, эстрона, LH и FSH с одним вагинальным применением 1 мг микронизированного эстрадиола у физиологического раствора у гипоэстрогенных женщин [260] [40] [111]](http://upload.wikimedia.org/wikipedia/commons/thumb/4/4d/Estrogen_and_gonadotropin_levels_with_1_mg_vaginal_estradiol_in_women.png/300px-Estrogen_and_gonadotropin_levels_with_1_mg_vaginal_estradiol_in_women.png)
![Тритированная радиоактивность эстрадиола в крови с одной внутримышечной инъекцией от 1,5 до 2,8 мкг тритированного эстрадиола в водном растворе у четырех женщин. [324] Пиковая радиоактивность крови произошла в течение 15 минут у трех женщин и у оставшейся женщины через 2 часа. [324] Источник: Davis et al. (1963). [324]](http://upload.wikimedia.org/wikipedia/commons/thumb/2/27/Tritiated_estradiol_blood_radioactivity_with_a_single_intramuscular_injection_of_1.5_to_2.8_mcg_tritiated_estradiol_in_aqueous_solution_in_women.png/296px-Tritiated_estradiol_blood_radioactivity_with_a_single_intramuscular_injection_of_1.5_to_2.8_mcg_tritiated_estradiol_in_aqueous_solution_in_women.png)
![Уровень эстрадиола и тестостерона с одной внутримышечной инъекцией 2 мг эстрадиола в водном препарате у здоровых молодых мужчин. [325] Тип водного препарата (раствор или суспензию) не был указан. [325] Источник: Jones et al. (1978). [325]](http://upload.wikimedia.org/wikipedia/commons/thumb/8/86/Estradiol_and_testosterone_levels_with_a_single_intramuscular_injection_of_2_mg_aqueous_estradiol_in_healthy_young_men.png/300px-Estradiol_and_testosterone_levels_with_a_single_intramuscular_injection_of_2_mg_aqueous_estradiol_in_healthy_young_men.png)
![Уровни эстрадиола после единой внутримышечной инъекции 5 мг бензоата эстрадиола, 5 мг эстрадиола Valerate или 5 мг эстрадиол ципионат у нефтяного раствора у женщин. [274] Источник: Oriowo et al. (1980). [274]](http://upload.wikimedia.org/wikipedia/commons/thumb/3/33/Estradiol_levels_after_a_single_5_mg_intramuscular_injection_of_estradiol_esters.png/300px-Estradiol_levels_after_a_single_5_mg_intramuscular_injection_of_estradiol_esters.png)
![Упрощенные кривые уровней эстрадиола после внутримышечной инъекции различных 5 мг бензоата эстрадиола, валеровного эстрадиола 5 мг, 5 мг эстрадиола ципионата или 10 мг эстрадиола энантата у раствора нефти у женщин. [326] Источник: Garza-Flores (1994). [326]](http://upload.wikimedia.org/wikipedia/commons/thumb/8/8c/Idealized_curves_of_estradiol_levels_after_injection_of_different_estradiol_esters_in_women.png/279px-Idealized_curves_of_estradiol_levels_after_injection_of_different_estradiol_esters_in_women.png)
![Вагинальная карнификация с одной внутримышечной инъекцией 5 мг бензоата эстрадиола, 5 мг дипропионата эстрадиола или от 5 до 25 мг эстрадиол ципионат у раствора нефти у женщин. [327] Источник: Schwartz & Soule (1955). [327]](http://upload.wikimedia.org/wikipedia/commons/thumb/2/23/Vaginal_cornification_with_a_single_intramuscular_injection_of_different_estradiol_esters_in_women.png/300px-Vaginal_cornification_with_a_single_intramuscular_injection_of_different_estradiol_esters_in_women.png)
![Уровни эстрадиола после короткой внутривенной инфузии 20 мг эстрадиола в водном растворе или внутримышечной инъекции эквимолярной дозы бензоата эстрадиола, эстрадиола Valerate или эстрадиола унмилат у растворов масла у женщин. [328] [280] или эстрадиол унделят у растворов масла у женщин. Источники: Geppert (1975) и Leyendecker et al. (1975). [328] [280]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b1/Estradiol_levels_after_injections_of_estradiol%2C_estradiol_benzoate%2C_estradiol_valerate%2C_and_estradiol_undecylate_in_women.png/300px-Estradiol_levels_after_injections_of_estradiol%2C_estradiol_benzoate%2C_estradiol_valerate%2C_and_estradiol_undecylate_in_women.png)
![Уровни эстрадиола после единой внутримышечной инъекции 10 мг эстрадиола Valerate или 100 мг эстрадиола ундецилата в растворе масла. [329] Источник: Vermeulen (1975). [329]](http://upload.wikimedia.org/wikipedia/commons/thumb/6/65/Estradiol_levels_after_a_single_intramuscular_injection_of_10_mg_estradiol_valerate_and_100_mg_estradiol_undecylate.png/300px-Estradiol_levels_after_a_single_intramuscular_injection_of_10_mg_estradiol_valerate_and_100_mg_estradiol_undecylate.png)
![Уровни эстрадиола и тестостерона после единой внутримышечной инъекции 320 мг полиэстрадиолфосфата в водном растворе у мужчин с раком предстательной железы. [320] Источник: Stege et al. (1996). [320]](http://upload.wikimedia.org/wikipedia/commons/thumb/7/7d/Estradiol_and_testosterone_levels_with_a_single_intramuscular_injection_of_320_mg_polyestradiol_phosphate_in_men.png/300px-Estradiol_and_testosterone_levels_with_a_single_intramuscular_injection_of_320_mg_polyestradiol_phosphate_in_men.png)
![Уровни эстрадиола после четвертой дозы во время непрерывной терапии с микросферами эстрадиола и прогестерона в водной суспензии с помощью внутримышечной инъекции один раз в месяц у женщин в менопаузе. [330] [331] Источник: Espino Y Sosa et al. (2019). [330]](http://upload.wikimedia.org/wikipedia/commons/thumb/4/42/Estradiol_levels_with_estradiol_and_progesterone_microspheres_by_intramuscular_injection_once_per_month_in_menopausal_women.png/268px-Estradiol_levels_with_estradiol_and_progesterone_microspheres_by_intramuscular_injection_once_per_month_in_menopausal_women.png)
![Исходные базовые уровни конъюгатов эстрадиола, эстрона и эстрона (например, эстронсульфат) после единой внутривенной инфузии 0,3 мг эстрадиола в водном растворе у женщин. [60]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/db/Estrogen_levels_after_a_single_intravenous_injection_of_0.3_mg_estradiol_in_premenopausal_women.png/331px-Estrogen_levels_after_a_single_intravenous_injection_of_0.3_mg_estradiol_in_premenopausal_women.png)
![Уровни эстрадиола после короткой внутривенной инфузии 20 мг эстрадиола в водном растворе или внутримышечной инъекции эквимолярной дозы бензоата эстрадиола, эстрадиола Valerate или эстрадиола унмилат у растворов масла у женщин. [281] [280] или эстрадиол унделят у раствора масла у женщин. [281] [280] или эстрадиол унделят у женщин. Более ранние моменты, чем через 12 часов после инфузии для внутривенного эстрадиола, не были измерены. [281] [280]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b1/Estradiol_levels_after_injections_of_estradiol%2C_estradiol_benzoate%2C_estradiol_valerate%2C_and_estradiol_undecylate_in_women.png/375px-Estradiol_levels_after_injections_of_estradiol%2C_estradiol_benzoate%2C_estradiol_valerate%2C_and_estradiol_undecylate_in_women.png)
