Транспортер дофамина
| SLC6A3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | SLC6A3 , семейство 6 растворенных переносчиков (переносчик нейротрансмиттеров), член 3, DAT, DAT1, PKDYS, член 3 семейства растворенных переносчиков 6, переносчик дофамина, PKDYS1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 126455 ; МГИ : 94862 ; Гомологен : 55547 ; Генные карты : SLC6A3 ; OMA : SLC6A3 — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Транспортер дофамина ( DAT , также натрий-зависимый транспортер дофамина ) представляет собой трансмембранный белок, кодируемый у человека геном ( SLC6A3 также известным как DAT1 ), который перекачивает нейротрансмиттер дофамин из синаптической щели обратно в цитозоль . В цитозоле другие транспортеры изолируют дофамин в пузырьках для хранения и последующего высвобождения. Обратный захват дофамина через DAT обеспечивает основной механизм, посредством которого дофамин выводится из синапсов , хотя может быть исключение в префронтальной коре , где данные указывают на возможно большую роль переносчика норадреналина . [5]
DAT вовлечен в ряд расстройств, связанных с дофамином, включая синдром дефицита внимания и гиперактивности , биполярное расстройство , клиническую депрессию , расстройства пищевого поведения и расстройства, связанные с употреблением психоактивных веществ . Ген, кодирующий белок DAT, расположен на хромосоме 5 , состоит из 15 кодирующих экзонов и имеет примерно 64 т.п.н. длину Доказательства связи между DAT и расстройствами, связанными с дофамином, получены из типа генетического полиморфизма , известного как тандемное повторение с переменным числом , в гене SLC6A3 , который влияет на количество экспрессируемого белка. [6]
Функция
[ редактировать ]DAT представляет собой интегральный мембранный белок , который удаляет дофамин из синаптической щели и откладывает его в окружающие клетки, тем самым прекращая передачу сигнала нейромедиатора. Дофамин лежит в основе нескольких аспектов познания, включая вознаграждение, а DAT облегчает регуляцию этого сигнала. [7]
Механизм
[ редактировать ]DAT представляет собой симпортер , который перемещает дофамин через клеточную мембрану, связывая это движение с энергетически выгодным движением ионов натрия, перемещающихся от высокой концентрации к низкой в клетку. Функция DAT требует последовательного связывания и совместного транспорта двух Na + ионы и один Cl − ион с субстратом дофамина. Движущей силой DAT-опосредованного обратного захвата дофамина является градиент концентрации ионов, генерируемый плазматической мембраной Na. + /К + АТФаза . [8]
В наиболее широко распространенной модели функции переносчика моноаминов ионы натрия должны связаться с внеклеточным доменом переносчика, прежде чем сможет связываться дофамин. Как только дофамин связывается, белок претерпевает конформационные изменения, которые позволяют натрию и дофамину отсоединиться на внутриклеточной стороне мембраны. [9]
Исследования с использованием электрофизиологии и радиоактивно меченного дофамина подтвердили, что переносчик дофамина аналогичен другим переносчикам моноаминов в том, что одна молекула нейромедиатора может транспортироваться через мембрану с помощью одного или двух ионов натрия. Ионы хлорида также необходимы для предотвращения накопления положительного заряда. Эти исследования также показали, что скорость и направление транспорта полностью зависят от градиента натрия. [10]
Из-за тесной связи мембранного потенциала и градиента натрия вызванные активностью изменения полярности мембраны могут существенно влиять на скорость транспорта. Кроме того, транспортер может способствовать высвобождению дофамина при деполяризации нейрона. [10]
DAT-Ca v Муфта
[ редактировать ]Предварительные данные свидетельствуют о том, что переносчик дофамина соединяется с потенциалзависимыми кальциевыми каналами L-типа (особенно Ca v 1.2 и Ca v 1.3 ), которые экспрессируются практически во всех дофаминовых нейронах. [11] В результате соединения DAT-Ca v субстраты DAT, которые производят деполяризующие токи через транспортер, способны открывать кальциевые каналы, связанные с транспортером, что приводит к притоку кальция в дофаминовые нейроны. [11] Считается, что этот приток кальция индуцирует CAMKII -опосредованное фосфорилирование переносчика дофамина как последующий эффект; [11] поскольку фосфорилирование DAT с помощью CAMKII приводит к оттоку дофамина in vivo , активация связанных с транспортером кальциевых каналов является потенциальным механизмом, с помощью которого некоторые лекарства (например, амфетамин ) запускают высвобождение нейромедиаторов. [11]
Структура белка
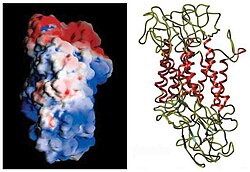
[ редактировать ]Первоначальное определение топологии мембраны DAT было основано на анализе гидрофобных последовательностей и сходстве последовательностей с транспортером ГАМК. Эти методы предсказали двенадцать трансмембранных доменов (TMD) с большой внеклеточной петлей между третьим и четвертым TMD. [12] Для дальнейшей характеристики этого белка использовались протеазы , которые расщепляют белки на более мелкие фрагменты, и гликозилирование , которое происходит только во внеклеточных петлях, и в значительной степени подтвердили первоначальные предсказания топологии мембраны. [13] Точная структура транспортера дофамина Drosophila melanogaster (dDAT) была выяснена в 2013 году с помощью рентгеновской кристаллографии . [14]
Местоположение и распространение
[ редактировать ]Фармакодинамика амфетамина в дофаминовом нейроне |
Региональное распределение DAT было обнаружено в областях мозга с установленной дофаминергической схемой, включая нигростриарный , мезолимбический и мезокортикальный пути. [22] Ядра , составляющие эти пути, имеют разные паттерны экспрессии. Паттерны экспрессии генов у взрослых мышей демонстрируют высокую экспрессию в черной субстанции . компактной части [23]
DAT в мезокортикальном пути Было обнаружено, что , меченный радиоактивными антителами, обогащен дендритами и телами клеток нейронов в компактной части черной субстанции и вентральной области покрышки . Эта закономерность имеет смысл для белка, который регулирует уровень дофамина в синапсе.
Окрашивание полосатого тела и прилежащего ядра мезолимбического пути было плотным и неоднородным. В стриатуме ДАТ локализуется в плазматической мембране окончаний аксонов. Двойная иммуноцитохимия продемонстрировала колокализацию DAT с двумя другими маркерами нигростриатных окончаний, тирозингидроксилазой и дофаминовыми рецепторами D2 . Таким образом, было продемонстрировано, что последний является ауторецептором клеток, выделяющих дофамин. TAAR1 представляет собой пресинаптический внутриклеточный рецептор, который также колокализуется с DAT и который при активации оказывает эффект, противоположный ауторецептору D2; [15] [24] т.е. он интернализует транспортеры дофамина и индуцирует отток посредством обратной функции транспортера посредством передачи сигналов PKA и PKC .
Удивительно, но DAT не был идентифицирован ни в каких синаптических активных зонах. Эти результаты позволяют предположить, что обратный захват дофамина в полосатом теле может происходить за пределами синаптической специализации, когда дофамин диффундирует из синаптической щели.
В черной субстанции DAT локализуется в аксональных и дендритных (т.е. пре- и постсинаптических) плазматических мембранах . [25]
В перикарии DAT нейронов компактной части локализуется преимущественно в шероховатой и гладкой эндоплазматической сети, комплексе Гольджи и мультивезикулярных тельцах, что определяет вероятные места синтеза, модификации, транспорта и деградации. [26]
Генетика и регуляция
[ редактировать ]Ген DAT1 DAT, известный как . , расположен на хромосоме 5p15 [6] Кодирующая белок область гена имеет длину более 64 т.п.н. и включает 15 кодирующих сегментов или экзонов . [27] Этот ген имеет тандемный повтор с переменным числом (VNTR) на 3'-конце ( rs28363170 ) и еще один в области интрона 8. [28] Было показано, что различия в VNTR влияют на базальный уровень экспрессии транспортера; следовательно, исследователи искали связи с расстройствами, связанными с дофамином. [29]
Nurr1 , ядерный рецептор , который регулирует многие гены, связанные с дофамином, может связываться с промоторной областью этого гена и индуцировать экспрессию. [30] Этот промотор также может быть мишенью транскрипционного фактора Sp-1 .
Хотя факторы транскрипции контролируют, какие клетки экспрессируют DAT, функциональная регуляция этого белка в основном осуществляется киназами . МАПК , [31] ЦАМКИ , [20] [21] ПКА , [15] и ПКС [21] [32] может модулировать скорость, с которой транспортер перемещает дофамин, или вызывать интернализацию DAT. Совместно локализованный TAAR1 является важным регулятором транспортера дофамина, который при активации фосфорилирует DAT посредством передачи сигналов протеинкиназы A (PKA) и протеинкиназы C (PKC). [15] [33] Фосфорилирование любой протеинкиназой может привести к интернализации DAT ( неконкурентное ингибирование обратного захвата), но само фосфорилирование, опосредованное PKC, индуцирует функцию обратного транспортера ( отток дофамина ). [15] [34] Дофаминовые ауторецепторы также регулируют DAT, напрямую противодействуя эффекту активации TAAR1. [15]
Транспортер дофамина человека (hDAT) содержит высокоаффинный внеклеточный цинка сайт связывания , который при связывании цинка ингибирует обратный захват дофамина и усиливает амфетамином индуцированный отток дофамина in vitro . [35] [36] [37] Напротив, человеческий переносчик серотонина (hSERT) и человеческий переносчик норэпинефрина (hNET) не содержат сайтов связывания цинка. [37] Добавки цинка могут снизить минимальную эффективную дозу амфетамина, когда он используется для лечения синдрома дефицита внимания и гиперактивности . [38]
Биологическая роль и нарушения
[ редактировать ]Скорость, с которой DAT удаляет дофамин из синапса, может иметь глубокое влияние на количество дофамина в клетке. Лучше всего об этом свидетельствуют тяжелые когнитивные нарушения, двигательные нарушения и гиперактивность у мышей, у которых нет переносчиков дофамина. [39] Эти характеристики имеют поразительное сходство с симптомами СДВГ .
Различия в функциональном VNTR были идентифицированы как факторы риска биполярного расстройства. [40] и СДВГ. [41] [42] Появились данные, которые позволяют предположить, что существует также связь с более сильными симптомами абстиненции от алкоголизма , хотя это и является спорным вопросом. [43] [44] Аллель гена DAT с нормальным уровнем белка связан с отказом от курения и легкостью отказа от курения. [45] Кроме того, подростки мужского пола, особенно из семей высокого риска (с отстраненной матерью и отсутствием материнской привязанности), несущие 10-аллельный повтор VNTR, демонстрируют статистически значимую близость к антисоциальным сверстникам. [46] [47]
Повышенная активность DAT связана с несколькими различными расстройствами, включая клиническую депрессию . [48]
Было показано, что мутации в DAT вызывают синдром дефицита транспортера дофамина , аутосомно-рецессивное двигательное расстройство , характеризующееся прогрессирующим ухудшением дистонии и паркинсонизма . [49]
Фармакология
[ редактировать ]Транспортер дофамина является мишенью субстратов , высвобождающих дофамина , ингибиторов транспорта и аллостерических модуляторов . [50] [51]
Кокаин блокирует DAT, связываясь непосредственно с транспортером и снижая скорость транспорта. [12] Напротив, амфетамин попадает в пресинаптический нейрон непосредственно через нейрональную мембрану или через DAT, конкурируя за обратный захват с дофамином. Оказавшись внутри, он связывается с TAAR1 или проникает в синаптические пузырьки через VMAT2 . Когда амфетамин связывается с TAAR1, он снижает частоту импульсов постсинаптического нейрона и запускает передачу сигналов протеинкиназы A и протеинкиназы C , что приводит к фосфорилированию DAT. Затем фосфорилированный DAT либо действует в обратном направлении, либо уходит в пресинаптический нейрон и прекращает транспорт. Когда амфетамин попадает в синаптические пузырьки через VMAT2, дофамин высвобождается в цитозоль. [15] [16] Амфетамин также вызывает отток дофамина посредством второго независимого от TAAR1 механизма, включающего CAMKIIα -опосредованное фосфорилирование транспортера, которое предположительно возникает в результате активации кальциевых каналов L-типа, связанных с DAT . амфетамином [11]
Считается, что дофаминергические механизмы каждого препарата лежат в основе приятных ощущений, вызываемых этими веществами. [7]
Взаимодействия
[ редактировать ]Было показано, что переносчик дофамина взаимодействует с:
Помимо этих врожденных белок-белковых взаимодействий, недавние исследования показали, что вирусные белки, такие как ВИЧ-1, белок Tat взаимодействуют с DAT. [56] [57] и это связывание может изменить гомеостаз дофамина у ВИЧ-положительных людей, что является фактором, способствующим ВИЧ-ассоциированным нейрокогнитивным расстройствам . [58]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с ENSG00000276996 GRCh38: выпуск Ensembl 89: ENSG00000142319, ENSG00000276996 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000021609 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Карбони Э., Танда Г.Л., Фрау Р., Ди Кьяра Дж. (сентябрь 1990 г.). «Блокада переносчика норадреналина увеличивает внеклеточную концентрацию дофамина в префронтальной коре: свидетельство того, что дофамин поглощается in vivo норадренергическими окончаниями». Журнал нейрохимии . 55 (3): 1067–70. дои : 10.1111/j.1471-4159.1990.tb04599.x . ПМИД 2117046 . S2CID 23682303 .
- ^ Jump up to: а б Ванденберг Д.Д., Персико А.М., Хокинс А.Л., Гриффин К.А., Ли Х, Джабс Э.В. и др. (декабрь 1992 г.). «Ген переносчика дофамина человека (DAT1) картируется на хромосоме 5p15.3 и отображает VNTR». Геномика . 14 (4): 1104–6. дои : 10.1016/S0888-7543(05)80138-7 . ПМИД 1478653 .
- ^ Jump up to: а б Шульц В. (июль 1998 г.). «Прогнозирующий сигнал вознаграждения дофаминовых нейронов» . Журнал нейрофизиологии . 80 (1): 1–27. дои : 10.1152/jn.1998.80.1.1 . ПМИД 9658025 . S2CID 52857162 .
- ^ Торрес Г.Е., Гайнетдинов Р.Р., Кэрон М.Г. (январь 2003 г.). «Переносчики моноаминов плазматической мембраны: структура, регуляция и функции». Обзоры природы. Нейронаука . 4 (1): 13–25. дои : 10.1038/nrn1008 . ПМИД 12511858 . S2CID 21545649 .
- ^ Сондерс М.С., Чжу С.Дж., Захнизер Н.Р., Кавано, член парламента, Амара С.Г. (февраль 1997 г.). «Множественная ионная проводимость человеческого переносчика дофамина: действие дофамина и психостимуляторов» . Журнал неврологии . 17 (3): 960–74. doi : 10.1523/JNEUROSCI.17-03-00960.1997 . ПМК 6573182 . ПМИД 8994051 .
- ^ Jump up to: а б Уилер Д.Д., Эдвардс А.М., Чепмен Б.М., Ондо Дж.Г. (август 1993 г.). «Модель натриевой зависимости поглощения дофамина в синаптосомах полосатого тела крысы». Нейрохимические исследования . 18 (8): 927–36. дои : 10.1007/BF00998279 . ПМИД 8371835 . S2CID 42196576 .
- ^ Jump up to: а б с д и Кэмерон К.Н., Солис Э., Ручала I, Де Феличе Л.Дж., Элтит Дж.М. (ноябрь 2015 г.). «Амфетамин активирует кальциевые каналы посредством деполяризации, опосредованной транспортером дофамина» . Клеточный кальций . 58 (5): 457–66. дои : 10.1016/j.ceca.2015.06.013 . ПМК 4631700 . ПМИД 26162812 .
Одним из интересных примеров является CaMKII, который хорошо охарактеризован как эффектор токов Ca2+ ниже Ca2+-каналов L-типа [21,22]. Интересно, что DAT является субстратом CaMKII, а фосфорилированный DAT способствует обратному транспорту дофамина [48,49], что представляет собой возможный механизм, с помощью которого электрическая активность и Ca2+-каналы L-типа могут модулировать состояния DAT и высвобождение дофамина. ... Таким образом, наши результаты показывают, что с фармакологической точки зрения S(+)AMPH более эффективен, чем DA, в активации деполяризующих токов, опосредованных hDAT, что приводит к активации Ca2+-канала L-типа, а ток, индуцированный S(+)AMPH, более тесно связан, чем DA, с открытием Ca2+-каналов L-типа.
- ^ Jump up to: а б Килти Дж.Э., Лоранг Д., Амара С.Г. (октябрь 1991 г.). «Клонирование и экспрессия чувствительного к кокаину крысиного переносчика дофамина». Наука . 254 (5031): 578–9. Бибкод : 1991Sci...254..578K . дои : 10.1126/science.1948035 . ПМИД 1948035 .
- ^ Воан Р.А., Кухар М.Дж. (август 1996 г.). «Домены, связывающие лиганд-переносчик дофамина. Структурные и функциональные свойства, выявленные с помощью ограниченного протеолиза» . Журнал биологической химии . 271 (35): 21672–80. дои : 10.1074/jbc.271.35.21672 . ПМИД 8702957 .
- ^ Пенматса А., Ван К.Х., Гуо Э. (ноябрь 2013 г.). «Рентгеновская структура транспортера дофамина объясняет механизм действия антидепрессанта» . Природа . 503 (7474): 85–90. Бибкод : 2013Natur.503...85P . дои : 10.1038/nature12533 . ПМЦ 3904663 . ПМИД 24037379 .
- ^ Jump up to: а б с д и ж г час я дж к Миллер GM (январь 2011 г.). «Новая роль рецептора 1, связанного с следами аминов, в функциональной регуляции переносчиков моноаминов и дофаминергической активности» . Журнал нейрохимии . 116 (2): 164–76. дои : 10.1111/j.1471-4159.2010.07109.x . ПМК 3005101 . ПМИД 21073468 .
- ^ Jump up to: а б с Эйден Л.Е., Вэйхэ Э. (январь 2011 г.). «VMAT2: динамический регулятор функции моноаминергических нейронов мозга, взаимодействующий с наркотиками» . Анналы Нью-Йоркской академии наук . 1216 (1): 86–98. Бибкод : 2011NYASA1216...86E . дои : 10.1111/j.1749-6632.2010.05906.x . ПМЦ 4183197 . ПМИД 21272013 .
- ^ Зульцер Д., Крэгг С.Дж., Райс М.Э. (август 2016 г.). «Нейротрансмиссия стриарного дофамина: регуляция высвобождения и поглощения» . Базальные ганглии . 6 (3): 123–148. дои : 10.1016/j.baga.2016.02.001 . ПМК 4850498 . ПМИД 27141430 .
Несмотря на трудности определения pH синаптических везикул, градиент протонов через мембрану везикул имеет фундаментальное значение для ее функции. Воздействие протонофоров на изолированные везикулы катехоламинов разрушает градиент pH и быстро перераспределяет медиатор изнутри пузырька наружу. ... Амфетамин и его производные, такие как метамфетамин, представляют собой слабоосновные соединения и являются единственным широко используемым классом наркотиков, которые, как известно, вызывают высвобождение медиатора по неэкзоцитическому механизму. В качестве субстратов как для DAT, так и для VMAT амфетамины могут переноситься в цитозоль, а затем изолироваться в везикулах, где они действуют, разрушая везикулярный градиент pH.
- ^ Ледонн А., Берретта Н., Даволи А., Риццо Г.Р., Бернарди Дж., Меркури Н.Б. (июль 2011 г.). «Электрофизиологические эффекты следовых аминов на мезэнцефальные дофаминергические нейроны» . Передний. Сист. Нейроски . 5 : 56. дои : 10.3389/fnsys.2011.00056 . ПМК 3131148 . ПМИД 21772817 .
Недавно появились три важных новых аспекта действия ТА: (а) ингибирование возбуждения из-за повышенного высвобождения дофамина; (б) снижение тормозных реакций, опосредованных рецепторами D2 и GABAB (возбуждающие эффекты вследствие растормаживания); и (c) прямая активация GIRK-каналов, опосредованная рецептором TA1, которая вызывает гиперполяризацию клеточной мембраны.
- ^ «ТААР1» . ГенАтлас . Парижский университет. 28 января 2012 года . Проверено 29 мая 2014 г.
• тонически активирует внутренние выпрямляющие K(+) каналы, что снижает базальную частоту импульсов дофаминовых (DA) нейронов вентральной покрышки (VTA)
- ^ Jump up to: а б Андерхилл С.М., Уилер Д.С., Ли М., Уоттс С.Д., Ингрэм С.Л., Амара С.Г. (июль 2014 г.). «Амфетамин модулирует возбуждающую нейротрансмиссию посредством эндоцитоза транспортера глутамата EAAT3 в дофаминовых нейронах» . Нейрон . 83 (2): 404–416. дои : 10.1016/j.neuron.2014.05.043 . ПМК 4159050 . ПМИД 25033183 .
AMPH также увеличивает внутриклеточный кальций (Gnegy et al., 2004), что связано с активацией кальмодулина/CamKII (Wei et al., 2007), а также модуляцией и транспортировкой DAT (Fog et al., 2006; Sakrikar et al., 2012). ).
- ^ Jump up to: а б с Воган Р.А., Фостер Дж.Д. (сентябрь 2013 г.). «Механизмы регуляции транспортера дофамина в норме и при заболеваниях» . Тенденции в фармакологических науках . 34 (9): 489–96. дои : 10.1016/j.tips.2013.07.005 . ПМЦ 3831354 . ПМИД 23968642 .
АМФ и МЕТН также стимулируют отток ДА, который считается решающим элементом их аддиктивных свойств [80], хотя механизмы, по-видимому, не идентичны для каждого препарата [81]. Эти процессы являются PKCβ- и CaMK-зависимыми [72, 82], а у мышей с нокаутом PKCβ наблюдается снижение индуцированного AMPH оттока, что коррелирует со снижением индуцированной AMPH локомоции [72].
- ^ Ciliax BJ, Drash GW, Staley JK, Haber S, Mobley CJ, Miller GW и др. (июнь 1999 г.). «Иммуноцитохимическая локализация транспортера дофамина в мозге человека». Журнал сравнительной неврологии . 409 (1): 38–56. doi : 10.1002/(SICI)1096-9861(19990621)409:1<38::AID-CNE4>3.0.CO;2-1 . ПМИД 10363710 . S2CID 46295607 .
- ^ Лю З, Ян С.Ф., Уокер Дж.Р., Цвинман Т.А., Цзян Т., Ли Дж. и др. (апрель 2007 г.). «Изучение функции генов на основе пространственной совместной экспрессии в атласе мозга мышей с высоким разрешением» . Системная биология BMC . 1:19 . дои : 10.1186/1752-0509-1-19 . ПМЦ 1863433 . ПМИД 17437647 .
- ^ Магуайр Джей-Джей, Davenport AP (19 июля 2016 г.). «Рецептор следовых аминов: рецептор ТА 1 » . Руководство IUPHAR/BPS по ФАРМАКОЛОГИИ . Международный союз фундаментальной и клинической фармакологии . Проверено 22 сентября 2016 г.
- ^ Ниренберг М.Дж., Воган Р.А., Уль Г.Р., Кухар М.Дж., Пикель В.М. (январь 1996 г.). «Переносчик дофамина локализован в дендритных и аксональных плазматических мембранах нигростриатных дофаминергических нейронов» . Журнал неврологии . 16 (2): 436–47. doi : 10.1523/JNEUROSCI.16-02-00436.1996 . ПМЦ 6578661 . ПМИД 8551328 .
- ^ Херш С.М., Йи Х., Хейлман С.Дж., Эдвардс Р.Х., Леви А.И. (ноябрь 1997 г.). «Субклеточная локализация и молекулярная топология транспортера дофамина в полосатом теле и черной субстанции». Журнал сравнительной неврологии . 388 (2): 211–27. doi : 10.1002/(SICI)1096-9861(19971117)388:2<211::AID-CNE3>3.0.CO;2-4 . ПМИД 9368838 . S2CID 21202901 .
- ^ Кавараи Т., Каваками Х., Ямамура Ю., Накамура С. (август 1997 г.). «Структура и организация гена, кодирующего транспортер дофамина человека». Джин . 195 (1): 11–8. дои : 10.1016/S0378-1119(97)00131-5 . ПМИД 9300814 .
- ^ Сано А., Кондо К., Какимото Ю., Кондо И. (май 1993 г.). «Полиморфизм 40-нуклеотидных повторов в гене переносчика дофамина человека». Генетика человека . 91 (4): 405–6. дои : 10.1007/BF00217369 . ПМИД 8500798 . S2CID 39416578 .
- ^ Миллер Г.М., Мадрас Б.К. (2002). «Полиморфизмы в 3'-нетранслируемой области генов-переносчиков дофамина человека и обезьяны влияют на экспрессию репортерного гена» . Молекулярная психиатрия . 7 (1): 44–55. дои : 10.1038/sj/mp/4000921 . ПМИД 11803445 .
- ^ Саккетти П., Митчелл Т.Р., Граннеман Дж.Г., Бэннон М.Дж. (март 2001 г.). «Nurr1 усиливает транскрипцию человеческого гена-переносчика дофамина посредством нового механизма» . Журнал нейрохимии . 76 (5): 1565–72. дои : 10.1046/j.1471-4159.2001.00181.x . ПМИД 11238740 . S2CID 19410051 .
- ^ Морон Дж.А., Захарова И., Феррер Ю.В., Меррилл Г.А., Хоуп Б., Лафер Э.М. и др. (сентябрь 2003 г.). «Митоген-активируемая протеинкиназа регулирует поверхностную экспрессию транспортера дофамина и способность транспорта дофамина» . Журнал неврологии . 23 (24): 8480–8. doi : 10.1523/JNEUROSCI.23-24-08480.2003 . ПМК 6740378 . ПМИД 13679416 .
- ^ Приступа З.Б., МакКонки Ф., Лю Ф., Ман Х.И., Ли Ф.Дж., Ван Ю.Т. и др. (сентябрь 1998 г.). «Двунаправленный транспорт, опосредованный протеинкиназой, и функциональная регуляция человеческого переносчика дофамина». Синапс . 30 (1): 79–87. doi : 10.1002/(SICI)1098-2396(199809)30:1<79::AID-SYN10>3.0.CO;2-K . ПМИД 9704884 . S2CID 20618165 .
- ^ Линдеманн Л., Эбелинг М., Краточвил Н.А., Бунцов Дж.Р., Гранди Д.К., Хёнер М.К. (март 2005 г.). «Рецепторы, связанные с следовыми аминами, образуют структурно и функционально различные подсемейства новых рецепторов, связанных с G-белком». Геномика . 85 (3): 372–85. дои : 10.1016/j.ygeno.2004.11.010 . ПМИД 15718104 .
- ^ Магуайр Дж.Дж., Паркер В.А., Фурд С.М., Боннер Т.И., Нойбиг Р.Р., Давенпорт А.П. (март 2009 г.). «Международный союз фармакологии. LXXII. Рекомендации по номенклатуре следовых аминных рецепторов» . Фармакологические обзоры . 61 (1): 1–8. дои : 10.1124/пр.109.001107 . ПМК 2830119 . ПМИД 19325074 .
- ^ Краузе Дж. (апрель 2008 г.). «ОФЭКТ и ПЭТ переносчика дофамина при синдроме дефицита внимания и гиперактивности». Экспертный обзор нейротерапии . 8 (4): 611–25. дои : 10.1586/14737175.8.4.611 . ПМИД 18416663 . S2CID 24589993 .
Цинк связывается с... внеклеточными сайтами DAT [103], выступая в качестве ингибитора DAT. В этом контексте представляют интерес контролируемые двойные слепые исследования на детях, которые показали положительное влияние добавок цинка на симптомы СДВГ [105,106]. Следует отметить, что в настоящее время [добавки] цинка не включены ни в один алгоритм лечения СДВГ.
- ^ Зульцер Д. (февраль 2011 г.). «Как наркотики, вызывающие привыкание, нарушают пресинаптическую дофаминовую нейротрансмиссию» . Нейрон . 69 (4): 628–49. дои : 10.1016/j.neuron.2011.02.010 . ПМК 3065181 . ПМИД 21338876 .
Они не подтвердили предсказанную прямую связь между поглощением и высвобождением, а скорее подтвердили то, что некоторые соединения, включая AMPH, были лучшими высвобождающими факторами, чем субстратами для поглощения. Более того, цинк стимулирует отток внутриклеточного [3H]DA, несмотря на сопутствующее ингибирование его захвата (Scholze et al., 2002).
- ^ Jump up to: а б Шольце П., Норрегаард Л., Сингер Э.А., Фрейссмут М., Гетер У., Ситте Х.Х. (июнь 2002 г.). «Роль ионов цинка в обратном транспорте, опосредованном переносчиками моноаминов» . Журнал биологической химии . 277 (24): 21505–13. дои : 10.1074/jbc.M112265200 . ПМИД 11940571 .
Транспортер дофамина человека (hDAT) содержит эндогенный цинк с высоким сродством. 2+ сайт связывания с тремя координирующими остатками на внеклеточной поверхности (His193, His375 и Glu396). ... Хотя Зн 2+ ингибированное поглощение, Zn 2+ облегчает высвобождение [3H]MPP+, индуцированное амфетамином, MPP+ или K+-индуцированной деполяризацией, особенно в hDAT, но не в человеческом серотонине и переносчике норадреналина (hNET).
- ^ Скасселлати С, Бонвичини С, Фараоне С.В., Дженнарелли М (октябрь 2012 г.). «Биомаркеры и синдром дефицита внимания/гиперактивности: систематический обзор и метаанализ». Журнал Американской академии детской и подростковой психиатрии . 51 (10): 1003–1019.e20. дои : 10.1016/j.jaac.2012.08.015 . ПМИД 23021477 .
Что касается добавок цинка, плацебо-контролируемое исследование показало, что дозы цинка до 30 мг/день были безопасны в течение как минимум 8 недель, но клинический эффект был сомнительным, за исключением обнаружения снижения на 37% оптимальной дозы амфетамина при приеме 30 мг цинка. мг в день цинка. 110
- ^ Гайнетдинов Р.Р., Ветсель В.К., Джонс С.Р., Левин Э.Д., Джабер М., Кэрон М.Г. (январь 1999 г.). «Роль серотонина в парадоксальном успокаивающем действии психостимуляторов на гиперактивность». Наука . 283 (5400): 397–401. Бибкод : 1999Sci...283..397G . дои : 10.1126/science.283.5400.397 . ПМИД 9888856 . S2CID 9629915 .
- ^ Гринвуд Т.А., Александр М., Кек П.Е., МакЭлрой С., Садовник А.Д., Ремик Р.А. и др. (март 2001 г.). «Доказательства неравновесия связи между транспортером дофамина и биполярным расстройством». Американский журнал медицинской генетики . 105 (2): 145–51. doi : 10.1002/1096-8628(2001)9999:9999<::AID-AJMG1161>3.0.CO;2-8 . ПМИД 11304827 .
- ^ Ян Б., Чан Р.К., Цзин Дж., Ли Т., Шам П., Чен Р.И. (июнь 2007 г.). «Метаанализ исследований ассоциации между 10-повторным аллелем полиморфизма VNTR в 3'-UTR гена переносчика дофамина и синдромом дефицита внимания с гиперактивностью». Американский журнал медицинской генетики. Часть B. Нейропсихиатрическая генетика . 144Б (4): 541–50. дои : 10.1002/ajmg.b.30453 . ПМИД 17440978 . S2CID 22881996 .
- ^ Сеймари А., Насе А., Резаи С., Салехи З., Куша М. (январь 2024 г.). «Связь между переменным числом тандемных повторов гена SLC6A3 (VNTR) и синдромом дефицита внимания/гиперактивности» . Иранский журнал психиатрии . 19 (1): 99–106. дои : 10.18502/ijps.v19i1.14345 . ПМЦ 10896761 . ПМИД 38420272 .
- ^ Сандер Т., Хармс Х., Подщус Дж., Финк У., Никель Б., Рольфс А. и др. (февраль 1997 г.). «Аллельная ассоциация полиморфизма гена транспортера дофамина при алкогольной зависимости с судорогами отмены или бредом». Биологическая психиатрия . 41 (3): 299–304. дои : 10.1016/S0006-3223(96)00044-3 . ПМИД 9024952 . S2CID 42947314 .
- ^ Уэно С., Накамура М., Миками М., Кондо К., Исигуро Х., Аринами Т. и др. (ноябрь 1999 г.). «Идентификация нового полиморфизма гена человеческого переносчика дофамина (DAT1) и значительная связь с алкоголизмом» . Молекулярная психиатрия . 4 (6): 552–7. дои : 10.1038/sj.mp.4000562 . ПМИД 10578237 .
- ^ Уэно С (февраль 2003 г.). «Генетические полиморфизмы переносчиков серотонина и дофамина при психических расстройствах». Журнал медицинских расследований . 50 (1–2): 25–31. ПМИД 12630565 .
- ^ Бивер К.М., Райт Дж.П., ДеЛизи М. (сентябрь 2008 г.). «Формирование группы сверстников-правонарушителей: свидетельства корреляции гена и окружающей среды». Журнал генетической психологии . 169 (3): 227–44. дои : 10.3200/GNTP.169.3.227-244 . ПМИД 18788325 . S2CID 46592146 .
- ^ Университет штата Флорида (2 октября 2008 г.). «Специфический ген обнаружен у мужчин-подростков, имеющих правонарушителей со сверстниками» . ScienceDaily . Проверено 8 октября 2008 г.
- ^ Лаасонен-Балк Т., Куикка Ю., Вийнамяки Х., Хуссо-Саастамойнен М., Лехтонен Ю., Тийхонен Ю. (июнь 1999 г.). «Плотность полосатого переносчика дофамина при большой депрессии». Психофармакология . 144 (3): 282–5. дои : 10.1007/s002130051005 . ПМИД 10435396 . S2CID 32882588 .
- ^ Нг Дж, Чжэнь Дж, Мейер Э, Эррегер К, Ли Ю, Какар Н и др. (апрель 2014 г.). «Синдром дефицита транспортера дофамина: фенотипический спектр от младенчества до взрослой жизни» . Мозг . 137 (Часть 4): 1107–19. дои : 10.1093/brain/awu022 . ПМЦ 3959557 . ПМИД 24613933 .
- ^ Ротман Р.Б., Анантхан С., Партилла Дж.С., Сайни С.К., Муха-Чафик О., Патхак В. и др. (июнь 2015 г.). «Исследование биогенных переносчиков аминов 15. Идентификация новых лигандов аллостерических переносчиков дофамина с наномолярной активностью» . Журнал фармакологии и экспериментальной терапии . 353 (3): 529–38. дои : 10.1124/jpet.114.222299 . ПМЦ 4429677 . ПМИД 25788711 .
- ^ Аггарвал С., Лю Х, Райс С., Менелл П., Кларк П.Дж., Папароидамис Н. и др. (2019). «Идентификация нового аллостерического модулятора человеческого переносчика дофамина» . ACS Chem Neurosci . 10 (8): 3718–3730. дои : 10.1021/acschemneuro.9b00262 . ПМК 6703927 . ПМИД 31184115 .
- ^ Версингер С., Сидху А (апрель 2003 г.). «Ослабление активности переносчика дофамина альфа-синуклеином». Письма по неврологии . 340 (3): 189–92. дои : 10.1016/S0304-3940(03)00097-1 . ПМИД 12672538 . S2CID 54381509 .
- ^ Ли Ф.Дж., Лю Ф., Приступа З.Б., Низник Х.Б. (апрель 2001 г.). «Прямое связывание и функциональное соединение альфа-синуклеина с переносчиками дофамина ускоряют апоптоз, индуцированный дофамином» . Журнал ФАСЭБ . 15 (6): 916–26. дои : 10.1096/fj.00-0334com . ПМИД 11292651 . S2CID 3406798 .
- ^ Торрес Г.Е., Яо В.Д., Мон А.Р., Куан Х., Ким К.М., Леви А.И. и др. (апрель 2001 г.). «Функциональное взаимодействие между переносчиками моноаминов плазматической мембраны и синаптическим белком PICK1, содержащим домен PDZ» . Нейрон . 30 (1): 121–34. дои : 10.1016/S0896-6273(01)00267-7 . ПМИД 11343649 . S2CID 17318937 .
- ^ Карнейро А.М., Ингрэм С.Л., Болье Дж.М., Суини А., Амара С.Г., Томас С.М. и др. (август 2002 г.). «Множественный LIM-домен, содержащий адаптерный белок Hic-5, синаптически колокализуется и взаимодействует с переносчиком дофамина» . Журнал неврологии . 22 (16): 7045–54. doi : 10.1523/JNEUROSCI.22-16-07045.2002 . ПМК 6757888 . ПМИД 12177201 .
- ^ Мидде Н.М., Юань Й., Кизон П.М., Сунь В.Л., Хуан Х., Чжан К.Г. и др. (март 2015 г.). «Мутации тирозина 88, лизина 92 и тирозина 470 человеческого переносчика дофамина приводят к ослаблению индуцированного ВИЧ-1 Tat ингибирования транспорта дофамина» . Журнал нейроиммунной фармакологии . 10 (1): 122–35. дои : 10.1007/s11481-015-9583-3 . ПМЦ 4388869 . ПМИД 25604666 .
- ^ Мидде Н.М., Хуан Икс, Гомес А.М., Буз Р.М., Чжан К.Г., Чжу Дж. (сентябрь 2013 г.). «Мутация тирозина 470 человеческого переносчика дофамина имеет решающее значение для Tat-индуцированного ингибирования транспорта дофамина и конформационных переходов транспортера» . Журнал нейроиммунной фармакологии . 8 (4): 975–87. дои : 10.1007/s11481-013-9464-6 . ПМК 3740080 . ПМИД 23645138 .
- ^ Пурохит В., Рапака Р., Шертлефф Д. (август 2011 г.). «Злоупотребление наркотиками, дофамин и ВИЧ-ассоциированные нейрокогнитивные расстройства/ВИЧ-ассоциированная деменция» . Молекулярная нейробиология . 44 (1): 102–10. дои : 10.1007/s12035-011-8195-z . ПМИД 21717292 . S2CID 13319355 .
Внешние ссылки
[ редактировать ]- Ассоциации, эксперименты, публикации и клинические испытания, связанные с транспортерами дофамина
- Дофамин + Транспортер в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- Обзор всей структурной информации, доступной в PDB для UniProt : Q7K4Y6 (Drosophila melanogaster Натрий-зависимый переносчик дофамина) на PDBe-KB .