МАФФ (ген)
| МАФФ | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | MAFF , U-MAF, hMafF, MAF bZIP транскрипционный фактор F | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 604877 ; МГИ : 96910 ; Гомологен : 7825 ; Генные карты : MAFF ; ОМА : МАФФ – ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Транскрипционный фактор MafF представляет собой bZip Maf транскрипционного фактора белок , который у человека кодируется MAFF геном . [5] [6]
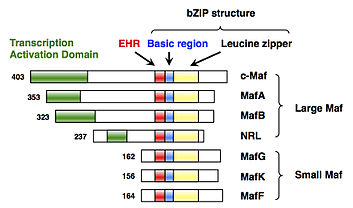
MafF является одним из небольших белков Maf , которые представляют собой факторы транскрипции типа основной области и лейциновой молнии (bZIP). Утвержденное Комитетом по генной номенклатуре HUGO название гена MAFF — «гомолог F онкогена онкогена птичьей мышечно-апоневротической фибросаркомы v-maf».
Открытие
[ редактировать ]MafF был впервые клонирован и идентифицирован у кур в 1993 году как член малого гена Maf (sMaf). [5] MAFF был идентифицирован у многих позвоночных, включая человека. [6] У позвоночных имеются три функционально избыточных белка sMaf: MafF, MafG и MafK .
Структура
[ редактировать ]MafF имеет структуру bZIP, которая состоит из основной области для связывания ДНК и структуры лейциновой застежки-молнии для образования димера. [5] Подобно другим sMafs, у MafF отсутствуют какие-либо канонические домены активации транскрипции. [5]
Выражение
[ редактировать ]MAFF широко, но по-разному экспрессируется в различных тканях. Экспрессия MAFF была обнаружена во всех 16 тканях, исследованных в рамках проекта BodyMap человека, но относительно широко распространена в тканях жировой ткани, толстой кишки, легких, простаты и скелетных мышц. [7] человека Ген MAFF индуцируется провоспалительными цитокинами, интерлейкином 1 бета и фактором некроза опухоли в клетках миометрия. [8]
Функция
[ редактировать ]Из-за сходства последовательностей между sMafs не наблюдалось функциональных различий с точки зрения их структур bZIP. sMafs сами по себе образуют гомодимеры и гетеродимеры с другими специфическими факторами транскрипции bZIP, такими как белки CNC (cap 'n' воротник) [p45 NF-E2 ( NFE2 ), Nrf1 ( NFE2L1 ), Nrf2 ( NFE2L2 ) и Nrf3 ( NFE2L3 )] [9] [10] [11] [12] и белки Баха ( BACH1 и BACH2 ). [13]
Целевые гены
[ редактировать ]sMafs регулируют различные гены-мишени в зависимости от своих партнеров. Например, гетеродимер p45-NF-E2-sMaf регулирует гены, ответственные за выработку тромбоцитов. [9] [14] [15] Гетеродимер Nrf2-sMaf регулирует ряд цитопротекторных генов, таких как гены ферментов, метаболизирующих антиоксиданты/ксенобиотики. [11] [16] Гетеродимер Bach1-sMaf регулирует ген гемоксигеназы-1. [13] В частности, сообщалось, что MafF регулирует ген рецептора окситоцина. [17] Вклад отдельных sMafs в регуляцию транскрипции их генов-мишеней еще недостаточно изучен.
Связь с болезнями
[ редактировать ]Потеря sMafs приводит к появлению болезнетворных фенотипов, как показано в таблице ниже. Мыши, у которых отсутствует MafF, в лабораторных условиях кажутся здоровыми. [18] Однако мыши, лишенные MafG, демонстрируют легкий нейрональный фенотип и легкую тромбоцитопению. [19] мыши, лишенные Mafg и одного аллеля Mafk ( Mafg −/− ::Мафк +/− ) демонстрируют прогрессирующую дегенерацию нейронов, тромбоцитопению и катаракту, [20] [21] и мыши, лишенные MafG и MafK ( Mafg −/− ::Мафк −/− ) демонстрируют более тяжелую дегенерацию нейронов и погибают на перинатальной стадии. [22] Мыши, у которых отсутствует MafF, MafG и MafK, являются эмбрионально летальными, что демонстрирует, что MafF незаменим для эмбрионального развития. [23] Эмбриональные фибробласты, происходящие из Maff −/− :: Мафг -/− ::Мафк −/− мыши не могут активировать Nrf2-зависимые цитопротекторные гены в ответ на стресс. [16]
| Генотип | Мышиный фенотип | ||
|---|---|---|---|
| Мафф | Производитель | Мфк | |
| −/− | Отсутствие явного фенотипа в лабораторных условиях [18] | ||
| −/− | Легкая моторная атаксия, легкая тромбоцитопения. [19] | ||
| −/− | +/− | Тяжелая моторная атаксия, прогрессирующая дегенерация нейронов, тяжелая тромбоцитопения и катаракта. [20] [21] | |
| −/− | −/− | Более тяжелые нейрональные фенотипы и перинатальная летальность. [22] | |
| −/− | +/− | −/− | Нет серьезных отклонений [23] (Плодородный) |
| −/− | −/− | −/− | Задержка роста, гипоплазия печени плода и летальность около эмбрионального дня, 13,5. [23] |
| +/- ( гетерозигота ), -/- ( гомозигота ), пустой (дикий тип) | |||
Кроме того, накапливающиеся данные свидетельствуют о том, что как партнеры белков CNC и Баха sMafs участвуют в возникновении и прогрессировании различных заболеваний человека, включая нейродегенерацию, атеросклероз и рак.
См. также
[ редактировать ]Примечания
[ редактировать ]Версия этой статьи 2016 года была обновлена внешним экспертом в рамках модели двойной публикации. Соответствующая академическая рецензируемая статья была опубликована в журнале Gene и может цитироваться как: Фумики Кацуока; Масаюки Ямамото (4 апреля 2016 г.). «Малые белки Maf (MafF, MafG, MafK): история, структура и функции» . Джин . Серия обзоров Gene Wiki. 586 (2): 197–205. дои : 10.1016/J.GENE.2016.03.058 . ISSN 0378-1119 . ПМЦ 4911266 . ПМИД 27058431 . Викиданные Q37014084 . |
Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000185022 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000042622 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Jump up to: а б с д Фудзивара К.Т., Катаока К., Нисидзава М. (сентябрь 1993 г.). «Два новых члена семейства онкогенов maf, mafK и mafF, кодируют ядерные белки b-Zip, в которых отсутствует предполагаемый транс-активаторный домен». Онкоген . 8 (9): 2371–80. ПМИД 8361754 .
- ^ Jump up to: а б «Ген Энтрез: гомолог F онкогена онкогена MAFF v-maf мышечно-апоневротической фибросаркомы (птичий)» .
- ^ Петришак Р., Бердетт Т., Фиорелли Б., Фонсека Н.А., Гонсалес-Порта М., Гастингс Е., Хубер В., Джапп С., Кейс М., Кривич Н., Макмерри Дж., Мариони Дж.С., Мэлоун Дж., Меги К., Рустичи Г., Тан А.Ю., Тауберт Дж., Уильямс Э., Маннион О., Паркинсон Х.Э., Бразма А. (январь 2014 г.). «Обновление Атласа экспрессии - база данных экспрессии генов и транскриптов, полученная в результате экспериментов по функциональной геномике на основе микрочипов и секвенирования» . Исследования нуклеиновых кислот . 42 (Проблема с базой данных): D926-32. дои : 10.1093/нар/gkt1270 . ПМЦ 3964963 . ПМИД 24304889 .
- ^ Массри В., Дерьюга А., Дуалла-Белл Ф., Ку С.И., Сэнборн Б.М., Бланк В. (апрель 2006 г.). «Регуляция транскрипционного фактора MAFF провоспалительными цитокинами в клетках миометрия» . Биология размножения . 74 (4): 699–705. дои : 10.1095/biolreprod.105.045450 . ПМИД 16371591 . S2CID 11823930 .
- ^ Jump up to: а б Игараси К., Катаока К., Ито К., Хаяси Н., Нисидзава М., Ямамото М. (февраль 1994 г.). «Регуляция транскрипции путем димеризации эритроидного фактора NF-E2 p45 с небольшими белками Maf». Природа . 367 (6463): 568–72. Бибкод : 1994Natur.367..568I . дои : 10.1038/367568a0 . ПМИД 8107826 . S2CID 4339431 .
- ^ Джонсен О., Мерфи П., Придз Х., Колсто А.Б. (январь 1998 г.). «Взаимодействие фактора CNC-bZIP TCF11/LCR-F1/Nrf1 с MafG: выбор сайта связывания и регуляция транскрипции» . Исследования нуклеиновых кислот . 26 (2): 512–20. дои : 10.1093/нар/26.2.512 . ПМК 147270 . ПМИД 9421508 .
- ^ Jump up to: а б Ито К., Тиба Т., Такахаси С., Исии Т., Игараси К., Като Ю., Ояке Т., Хаяси Н., Сато К., Хатаяма И., Ямамото М., Набешима Ю. (июль 1997 г.). «Гетеродимер Nrf2 / маленький Maf опосредует индукцию генов детоксифицирующего фермента фазы II через элементы антиоксидантного ответа». Связь с биохимическими и биофизическими исследованиями . 236 (2): 313–22. дои : 10.1006/bbrc.1997.6943 . ПМИД 9240432 .
- ^ Кобаяши А, Ито Э, Токи Т, Когаме К, Такахаси С, Игараси К, Хаяси Н, Ямамото М (март 1999 г.). «Молекулярное клонирование и функциональная характеристика нового транскрипционного фактора Nrf3 семейства Cap'n' Collar» . Журнал биологической химии . 274 (10): 6443–52. дои : 10.1074/jbc.274.10.6443 . ПМИД 10037736 .
- ^ Jump up to: а б Ояке Т., Ито К., Мотохаси Х., Хаяси Н., Хосино Х., Нисидзава М., Ямамото М., Игараси К. (ноябрь 1996 г.). «Белки Баха принадлежат к новому семейству BTB-основных факторов транскрипции лейциновой молнии, которые взаимодействуют с MafK и регулируют транскрипцию через сайт NF-E2» . Молекулярная и клеточная биология . 16 (11): 6083–95. дои : 10.1128/mcb.16.11.6083 . ПМК 231611 . ПМИД 8887638 .
- ^ Шавит Дж.А., Мотохаси Х., Онодера К., Акасака Дж., Ямамото М., Энгель Дж.Д. (июль 1998 г.). «Нарушение мегакариопоэза и поведенческие дефекты у mafG-нулевых мутантных мышей» . Гены и развитие . 12 (14): 2164–74. дои : 10.1101/gad.14.12.2164 . ПМК 317009 . ПМИД 9679061 .
- ^ Шивдасани Р.А., Розенблатт М.Ф., Цукер-Франклин Д., Джексон К.В., Хант П., Сарис К.Дж., Оркин С.Х. (июнь 1995 г.). «Фактор транскрипции NF-E2 необходим для образования тромбоцитов независимо от действия тромбопоэтина/MGDF на развитие мегакариоцитов» . Клетка . 81 (5): 695–704. дои : 10.1016/0092-8674(95)90531-6 . ПМИД 7774011 . S2CID 14195541 .
- ^ Jump up to: а б Кацуока Ф., Мотохаси Х., Исии Т., Абуратани Х., Энгель Дж.Д., Ямамото М. (сентябрь 2005 г.). «Генетические доказательства того, что небольшие белки maf необходимы для активации генов, зависимых от элементов антиоксидантного ответа» . Молекулярная и клеточная биология . 25 (18): 8044–51. дои : 10.1128/MCB.25.18.8044-8051.2005 . ПМЦ 1234339 . ПМИД 16135796 .
- ^ Кимура Т., Ивелл Р., Раст В., Мизумото Ю., Огита К., Кусуи С., Мацумура Ю., Адзума С., Мурата Ю. (октябрь 1999 г.). «Молекулярное клонирование гомолога MafF человека, который специфически связывается с геном рецептора окситоцина в терминальном миометрии». Связь с биохимическими и биофизическими исследованиями . 264 (1): 86–92. дои : 10.1006/bbrc.1999.1487 . ПМИД 10527846 .
- ^ Jump up to: а б Онодера К., Шавит Дж.А., Мотохаси Х., Кацуока Ф., Акасака Дж.Э., Энгель Дж.Д., Ямамото М. (июль 1999 г.). «Характеристика мышиного гена mafF» . Журнал биологической химии . 274 (30): 21162–9. дои : 10.1074/jbc.274.30.21162 . ПМИД 10409670 .
- ^ Jump up to: а б Шавит Дж.А., Мотохаси Х., Онодера К., Акасака Дж., Ямамото М., Энгель Дж.Д. (июль 1998 г.). «Нарушение мегакариопоэза и поведенческие дефекты у mafG-нулевых мутантных мышей» . Гены и развитие . 12 (14): 2164–74. дои : 10.1101/gad.14.12.2164 . ПМК 317009 . ПМИД 9679061 .
- ^ Jump up to: а б Кацуока Ф., Мотохаси Х., Тамагава Ю., Куре С., Игараси К., Энгель Дж.Д., Ямамото М. (февраль 2003 г.). «Маленькие мутанты соединения Maf демонстрируют дегенерацию нейронов центральной нервной системы, аберрантную транскрипцию и неправильную локализацию белка Баха, совпадающую с миоклонусом и аномальной реакцией испуга» . Молекулярная и клеточная биология . 23 (4): 1163–74. дои : 10.1128/mcb.23.4.1163-1174.2003 . ПМЦ 141134 . ПМИД 12556477 .
- ^ Jump up to: а б Агравал С.А., Ананд Д., Сиддам А.Д., Какрана А., Даш С., Шейблин Д.А., Данг К.А., Террелл А.М., Уотерс С.М., Сингх А., Мотохаши Х., Ямамото М., Лачке С.А. (июль 2015 г.). «Сложные мышиные мутанты транскрипционных факторов bZIP Mafg и Mafk обнаруживают регуляторную сеть некристаллиновых генов, связанных с катарактой» . Генетика человека . 134 (7): 717–35. дои : 10.1007/s00439-015-1554-5 . ПМЦ 4486474 . ПМИД 25896808 .
- ^ Jump up to: а б Онодера К., Шавит Дж.А., Мотохаши Х., Ямамото М., Энгель Дж.Д. (март 2000 г.). «Перинатальная синтетическая летальность и дефекты кроветворения у мышей, мутантных по соединению mafG::mafK» . Журнал ЭМБО . 19 (6): 1335–45. дои : 10.1093/emboj/19.6.1335 . ПМК 305674 . ПМИД 10716933 .
- ^ Jump up to: а б с Ямадзаки Х., Кацуока Ф., Мотохаси Х., Энгель Дж.Д., Ямамото М. (февраль 2012 г.). «Эмбриональная летальность и апоптоз печени плода у мышей, у которых отсутствуют все три малых белка Maf» . Молекулярная и клеточная биология . 32 (4): 808–16. дои : 10.1128/MCB.06543-11 . ПМК 3272985 . ПМИД 22158967 .
Дальнейшее чтение
[ редактировать ]- Е X, Ли Y, Хуан Q, Ю Y, Юань Х, Ван П, Ван Д, Гу Дж, Хо К, Ли YY, Лу Х (май 2006 г.). «Новый ген человека MIP действует как коактиватор hMafF». Архив биохимии и биофизики . 449 (1–2): 87–93. дои : 10.1016/j.abb.2006.02.011 . ПМИД 16549056 .
- Массри В., Дерьюга А., Дуалла-Белл Ф., Ку С.И., Сэнборн Б.М., Бланк В. (апрель 2006 г.). «Регуляция транскрипционного фактора MAFF провоспалительными цитокинами в клетках миометрия» . Биология размножения . 74 (4): 699–705. дои : 10.1095/biolreprod.105.045450 . ПМИД 16371591 . S2CID 11823930 .
- Марини М.Г., Асунис И., Чан К., Чан Дж.И., Кан Ю.В., Порку Л., Цао А., Мои П. (2003). «Клонирование MafF путем скрининга сайта узнавания с помощью тандемного повтора NFE2 HS2: анализ его роли в регуляции генов глобина и GCSI». Клетки крови, молекулы и болезни . 29 (2): 145–58. дои : 10.1006/bcmd.2002.0550 . ПМИД 12490281 .
- Моран Дж.А., Даль Э.Л., Малкахи RT (январь 2002 г.). «Дифференциальная индукция экспрессии mafF, mafG и mafK активаторами элементов электрофильного ответа» . Биохимический журнал . 361 (Часть 2): 371–7. дои : 10.1042/0264-6021:3610371 . ПМЦ 1222317 . ПМИД 11772409 .
- Катаока К., Ёситомо-Накагава К., Сиода С., Нисидзава М. (январь 2001 г.). «Набор белков Hox взаимодействует с онкобелком Maf, ингибируя его активность связывания ДНК, трансактивацию и трансформацию» . Журнал биологической химии . 276 (1): 819–26. дои : 10.1074/jbc.M007643200 . ПМИД 11036080 .
- Кимура Т., Ивелл Р., Раст В., Мизумото Ю., Огита К., Кусуи С., Мацумура Ю., Адзума С., Мурата Ю. (октябрь 1999 г.). «Молекулярное клонирование гомолога MafF человека, который специфически связывается с геном рецептора окситоцина в терминальном миометрии». Связь с биохимическими и биофизическими исследованиями . 264 (1): 86–92. дои : 10.1006/bbrc.1999.1487 . ПМИД 10527846 .
- Джонсен О., Скаммельсруд Н., Луна Л., Нишизава М., Придз Х., Колстё А.Б. (ноябрь 1996 г.). «Малые белки Maf взаимодействуют с человеческим фактором транскрипции TCF11/Nrf1/LCR-F1» . Исследования нуклеиновых кислот . 24 (21): 4289–97. дои : 10.1093/нар/24.21.4289 . ПМК 146217 . ПМИД 8932385 .
- Игараси К., Катаока К., Ито К., Хаяси Н., Нисидзава М., Ямамото М. (февраль 1994 г.). «Регуляция транскрипции путем димеризации эритроидного фактора NF-E2 p45 с небольшими белками Maf». Природа . 367 (6463): 568–72. Бибкод : 1994Natur.367..568I . дои : 10.1038/367568a0 . ПМИД 8107826 . S2CID 4339431 .
Внешние ссылки
[ редактировать ]- MAFF + белок, + человек в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- ФакторБук МафФ