Белок ретинобластомы
| RB1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | RB1 , PRB, RB, Retinoblastoma 1, OSRC, PPP1R130, P105-RB, PP110, белок ретинобластомы, транскрипционный корепсор RB, P110-RB1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Омим : 614041 ; MGI : 97874 ; Гомологен : 272 ; GeneCards : RB1 ; OMA : RB1 - ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викидид | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Белок ретинобластомы (название белка сокращено RB или PRB ; название гена Сокращено RB , RB или RB1 ) является -супрессором опухоли белком , который является дисфункциональным при нескольких основных раковых заболеваниях . [ 5 ] Одной из функций PRB является предотвращение чрезмерного роста клеток , ингибируя прогрессирование клеточного цикла до тех пор, пока клетка не будет готова к разделению. Когда клетка готова разделить, PRB фосфорилируется , инактивирует ее, и клеточный цикл разрешается прогрессировать. Это также рекрутер нескольких ферментов ремоделирования хроматина, таких как метилазы и ацетилазы . [ 6 ]
PRB принадлежит семейству карманных белков , члены которого имеют карман для функционального связывания других белков. [ 7 ] [ 8 ] Если онкогенный белок, такой как клетки, продуцируемые клетками, инфицированными типами папилломы человека высокого риска , связывают и инактивируют PRB, это может привести к раку. Ген RB , возможно, был ответственен за эволюцию многоклеточности в нескольких линиях жизни, включая животных. [ 9 ]
Имя и генетика
[ редактировать ]У людей белок кодируется геном RB1 , расположенным на хромосоме 13 -более 13 к14,1-Q14.2 . Если оба аллеля этого гена мутируют в клетке сетчатки, белок инактивируется, а клетки неконтролируют, что приводит к развитию рака ретинобластомы , следовательно, «RB» во имя «PRB». Таким образом, большинство нокаутов PRB встречаются в тканях сетчатки, когда мутации, вызванные ультрафиолетовым излучением, инактивируют все здоровые копии гена, но нокаут PRB также был задокументирован при определенных рака кожи у пациентов из Новой Зеландии, где количество ультрафиолетового излучения значительно является значительным выше.
Были замечены две формы ретинобластомы: двусторонняя, семейная форма и односторонняя, спорадическая форма. Страдающие первыми были более чем в шесть раз чаще развивать другие виды рака в более позднем возрасте, по сравнению с людьми со спорадической ретинобластомой. [ 10 ] Это подчеркнуло тот факт, что мутированный PRB может быть унаследован и одолжена поддержкой гипотезы с двумя ударами . только один работающий аллель гена -супрессора опухоли В этом говорится, что для его функции необходим (мутированный ген рецессив ), и поэтому оба должны быть мутированы до появления фенотипа рака. В семейной форме мутированный аллель унаследован вместе с нормальным аллелем. В этом случае, если клетка поддерживает только одну мутацию в другом гене Rb , весь PRB в этой клетке будет неэффективной при ингибировании прогрессирования клеточного цикла, что позволяет клеткам бесконтрольно делиться и в конечном итоге стать раковыми. Кроме того, поскольку один аллель уже мутирован во всех других соматических клетках, будущая частота рака у этих людей наблюдается с линейной кинетикой. [ 11 ] Рабочий аллель не должен подвергаться мутации как таковой, так как потеря гетерозиготности (LOH) часто наблюдается в таких опухолях.
Однако в спорадической форме оба аллеля должны были бы поддерживать мутацию, прежде чем клетка сможет стать раковой. Это объясняет, почему страдающие спорадической ретинобластомой не подвергаются повышенному риску рака в более позднем возрасте, так как оба аллеля функционируют во всех других их клетках. Будущая заболеваемость рака в случаях спорадических PRB наблюдается с полиномиальной кинетикой, не совсем квадратичной, как и ожидалось, потому что первая мутация должна возникать с помощью нормальных механизмов, а затем может быть продублирована LOH, чтобы привести к предшественнику опухоли .
RB1 ортологи [ 12 ] также были идентифицированы у большинства млекопитающих , для которых доступны полные данные генома.
RB / E2F Белки -семейная транскрипция подавляют транскрипцию . [ 13 ]
Структура обозначает функцию
[ редактировать ]PRB является многофункциональным белком со многими сайтами связывания и фосфорилированием. Хотя его общая функция рассматривается как связывание и подавление целей E2F , PRB, вероятно, является многофункциональным белком, поскольку он связывается как минимум 100 других белков. [ 14 ]
У PRB есть три основных структурных компонента: карбокси-конце, «карманная» субъединица и аминомин. В каждом домене существует множество сайтов связывания белка, а также в общей сложности 15 возможных сайтов фосфорилирования. PRB Как правило, фосфорилирование вызывает междоменную блокировку, что изменяет конформацию и предотвращает связывание с белками -мишенями. Различные участки могут быть фосфорилированы в разное время, что приводит к многим возможным конформациям и, вероятно, многим уровням функций/активности. [ 15 ]
Подавление клеточного цикла
[ редактировать ]
PRB ограничивает способность клетки реплицировать ДНК , предотвращая ее прогрессирование от фазы G1 ( первая фаза зазора ) до S ( фаза синтеза ) цикла деления клеток. [ 16 ] PRB связывает и ингибирует промотор-связывающий промотор-связывающий димеры-димеризацию (E2F-DP), которые являются факторами транскрипции семейства E2F , которые подталкивают клетку в фазу S. [ 17 ] [ 18 ] [ 19 ] [ 20 ] [ 21 ] [ 22 ] Поддерживая инактивированную E2F-DP, RB1 поддерживает клетку в фазе G1, предотвращая прогрессирование через клеточный цикл и действуя в качестве супрессора роста. [ 8 ] Комплекс PRB-E2F/DP также притягивает белок гистондеацетилазы (HDAC) к хроматину , снижая транскрипцию факторов, способствующих S-фазе, дополнительно подавляя синтез ДНК.
PRB ослабляет уровни белка известных мишеней E2F
[ редактировать ]PRB обладает способностью обратимо ингибировать репликацию ДНК посредством транскрипционной репрессии факторов репликации ДНК. PRB способен связываться с факторами транскрипции в семействе E2F и тем самым ингибирует их функцию. Когда PRB хронически активирован, это приводит к подавлению необходимых факторов репликации ДНК. В течение 72–96 часов после активной индукции PRB в клетках A2-4 белки коэффициента репликации ДНК-MCMS, RPA34, DBF4 , RFCP37 и RFCP140-все показали снижение уровня. Наряду со снижением уровня, в этих клетках наблюдалось одновременное и ожидаемое ингибирование репликации ДНК. Этот процесс, однако, обратимо. После индуцированного нокаут PRB клетки, обработанные цисплатином , агент, наносящий ДНК, способны продолжать пролиферировать без остановки клеточного цикла, что предполагает, что PRB играет важную роль в запусках хронической остановки S-фазы в ответ на генотоксический стресс.
Одним из таких примеров E2F-регулируемых генов, подавленных PRB, являются циклин E и циклин A. Оба этих циклинов способны связываться с CDK2 и облегчать вступление в S -фазу клеточного цикла. Благодаря репрессии экспрессии циклина E и циклина A, PRB способен ингибировать переход G1/S .
Репрессионные механизмы E2FS
[ редактировать ]Существует как минимум три различных механизма, в которых PRB может подавлять транскрипцию E2F-регулируемых промоторов . Хотя эти механизмы известны, неясно, которые наиболее важны для контроля клеточного цикла.
E2FS - это семейство белков, сайты связывания которых часто обнаруживаются в промоторных областях генов для пролиферации клеток или прогрессирования клеточного цикла. Известно, что от E2F1 до E2F5 ассоциируются с белками в семье PRB белков, в то время как E2F6 и E2F7 не зависят от PRB. В целом, E2FS разделены на Activator E2FS и Repressor E2FS, хотя их роль более гибкая, чем эта. Активатором E2FS являются E2F1, E2F2 и E2F3, в то время как репрессор E2FS являются E2F4 , E2F5 и E2F6. Активатор E2FS вместе с E2F4 связывается исключительно с PRB. PRB способен связываться с доменом активации активатора E2FS, который блокирует их активность, подавляя транскрипцию генов, контролируемых этим E2F-промотером.
Блокировка сборки комплекса предварительного инициализации
[ редактировать ]Предварительный комплекс (PIC) собирается пошагово на промоторе генов, чтобы инициировать транскрипцию. TFIID , набирая другие связывается с коробкой TATA , чтобы начать сборку TFIIA факторы транскрипции и компоненты, необходимые на картинке. Данные свидетельствуют о том, что PRB способен подавлять транскрипцию с помощью PRB, набираемого на промотор, а также наличие цели в TFIID.
Наличие PRB может изменить конформацию комплекса TFIIA/IID в менее активную версию с уменьшенной аффинностью связывания. PRB также может непосредственно влиять на их ассоциацию в качестве белков, предотвращая образование TFIIA/IID.
Модификация структуры хроматина
[ редактировать ]PRB действует как рекрутер, который позволяет связывать белки, которые изменяют структуру хроматина с промоторами, регулируемыми E2F. Доступ к этим E2F-регулируемым промоторам с помощью транскрипционных факторов блокируется образованием нуклеосом и их дальнейшей упаковкой в хроматин. Образование нуклеосом регулируется посттрансляционными модификациями в хвосты гистонов . Ацетилирование приводит к нарушению структуры нуклеосом. Белки, называемые гистон ацетилтрансферазы (HAT), ответственны за ацетилизирующие гистоны и, таким образом, способствуют ассоциации транскрипционных факторов с промоторами ДНК. Деацетилирование, с другой стороны, приводит к образованию нуклеосом и, таким образом, затрудняет сидеть транскрипционных факторов на промоутеров. Гистондеацетилазы (HDAC) являются белками, ответственными за облегчение образования нуклеосом, и поэтому связаны с белками транскрипционных репрессоров.
PRB взаимодействует с гистоновыми деацетилазами HDAC1 и HDAC3 . PRB связывается с HDAC1 в своем карманном домене в области, которая не зависит от его сайта связывания E2F. Рекрутирование PRB деацетилаз гистонов приводит к репрессии генов у E2F-регулируемых промоторов из-за образования нуклеосом. Некоторые гены, активируемые во время перехода G1/S, такие как циклин E, репрессируются HDAC во время фазы раннего и среднего G1. Это говорит о том, что HDAC с помощью репрессии генов прогрессирования клеточного цикла имеет решающее значение для способности PRB оставлять клетки в G1. Для дополнительно добавить к этому моменту, показано, что комплекс HDAC-PRB нарушен циклин D/CDK4, который увеличивается и пик в течение поздней фазы G1.
Старение, вызванное PRB
[ редактировать ]Старение в клетках - это состояние, в котором клетки являются метаболически активными, но больше не способны повторять. PRB является важным регулятором старения в клетках, и, поскольку это предотвращает пролиферацию, старение является важным противоопухолевым механизмом. PRB может занимать E2F-регулируемые промоутеры во время старения. Например, PRB был обнаружен на промоторах Cyclin A и PCNA в стареющих клетках.
S-фаза арест
[ редактировать ]Клетки реагируют на стресс в форме повреждения ДНК, активированных онкогенов или условий выращивания в подразделе, и могут попасть в покое состояние, называемое «преждевременным старением». Это позволяет клетке предотвратить дальнейшую репликацию в периоды поврежденной ДНК или общих неблагоприятных условий. Повреждение ДНК в клетке может вызвать активацию PRB. Роль PRB в подавлении транскрипции генов прогрессирования клеточного цикла приводит к остановке фазы S, который предотвращает репликацию поврежденной ДНК.
Активация и инактивация
[ редактировать ]Когда пришло время для клетки ввести S фазу S, комплексы циклин-зависимых киназ (CDK) и циклинов фосфорилирует PRB, позволяя E2F-DP диссоциации от PRB и становятся активными. [ 8 ] Когда E2F является свободным, он активирует такие факторы, как циклины (например, циклин E и циклин A), которые проталкивают клетку через клеточный цикл, активируя циклин-зависимые киназы, и молекула, называемая пролиферирующим ядерным антигеном клеток, или PCNA , которая ускоряет репликацию ДНК и восстановление, помогая прикрепить полимеразу к ДНК. [ 18 ] [ 21 ] [ 7 ] [ 8 ] [ 19 ] [ 23 ] [ 24 ]
Инактивация
[ редактировать ]С 1990 -х годов известно, что PRB инактивирован посредством фосфорилирования. До тех пор, пока преобладающая модель заключалась в том, что циклин D- CDK 4/6 постепенно фосфорилировал ее от нефосфорилированного до своего гиперфосфорилированного состояния (14+ фосфорилирований). Тем не менее, недавно было показано, что PRB существует только в трех состояниях: нефосфорилированный, монофосфорилированный и гиперфосфорилированный. Каждый имеет уникальную клеточную функцию. [ 25 ]
Перед разработкой 2D IEF только гиперфосфорилированный PRB был различим от всех других форм, т.е. UN-фосфорилированный PRB напоминал монофосфорилированный PRB на иммуноблотах. Поскольку PRB был либо в его активном «гипофосфорилированном» состоянии, либо неактивном «гиперфосфорилированном» состоянии. Однако с 2D IEF в настоящее время известно, что PRB не фосфорилируется в клетках G0 и монофосфорилируется в ранних клетках G1 до гиперфосфорилирования после точки ограничения в позднем G1. [ 25 ]
PRB Mono фосфорилирование
[ редактировать ]Когда ячейка входит в G1, циклин D- CDK4/6 фосфорилирует PRB в одном сайте фосфорилирования. Не происходит прогрессирующего фосфорилирования, потому что, когда клетки HFF подвергались воздействию устойчивой активности циклина D-CDK4/6 (и даже дерегулированной активности) в раннем G1, обнаружено только монофосфорилированный PRB. Кроме того, эксперименты с тройным нокаутом, добавлением P16 и ингибитором CDK 4/6 подтвердили, что Cyclin D- CDK 4/6 является единственным фосфорилятором PRB. [ 25 ]
На протяжении раннего G1 монофосфорилированный PRB существует как 14 различных изоформ (15-й сайт фосфорилирования не сохраняется у приматов, в которых эксперименты проводились). Вместе эти изоформы представляют собой «гипофосфорилированное» активное состояние PRB, которое, как считалось, существовало. Каждая изоформа имеет различные предпочтения, чтобы связать с различными экзогенными экспрессируемыми E2FS. [ 25 ]
Недавний отчет показал, что монофосфорилирование контролирует связь PRB с другими белками и генерирует функциональные различные формы PRB. [ 26 ] Все различные монофосфорилированные изоформы PRB ингибируют программу транскрипции E2F и способны оставлять клетки в G1-фазе. Важно отметить, что различные монофосфорилированные формы PRB имеют различные транскрипционные выходы, которые выходят за пределы регуляции E2F. [ 26 ]
Гиперфосфорилирование
[ редактировать ]После того, как клетка пропускает точку ограничения, циклин E-CDK 2 гиперфосфорилирует все монофосфорилированные изоформы. Хотя точный механизм неизвестен, одна гипотеза заключается в том, что связывание с хвостом C-конца открывает субъединицу кармана, позволяя доступа ко всем сайтам фосфорилирования. Этот процесс является гистеретичным и необратимым, и это мышление накопление монофосфорилированного PRB индуцирует процесс. Таким образом, бистабильный, переключающий поведение PRB может быть смоделирована как точка бифуркации: [ 25 ]

Контроль функции PRB путем фосфорилирования
[ редактировать ]Наличие нефосфорилированного PRB приводит к выходу на клеточный цикл и поддерживает старение. В конце митоза PP1 дефосфорилирует гиперфосфорилированный PRB непосредственно в его фосфорилированное состояние. Кроме того, при дифференцировке миобластов C2C12 (путем помещения в среду дифференцировки) присутствовал только фосфорилированный PRB. Кроме того, эти клетки имели заметно сниженную скорость роста и концентрацию факторов репликации ДНК (предполагая остановку G0). [ 25 ]
Эта функция UN-фосфорилированного PRB дает гипотезу о отсутствии контроля клеточного цикла в раковых клетках: дерегуляция циклина D-CDK 4/6 фосфорилирует нефосфорилированный PRB в стареющих клетках для монофосфорилированного PRB, вызывая их G1. Механизм переключателя для активации циклина не известен, но одна гипотеза заключается в том, что он является метаболическим датчиком. Монофосфорилированный PRB вызывает увеличение метаболизма, поэтому накопление монофосфорилированного PRB в ранее клетках G0 затем вызывает гиперфосфорилирование и митотическое проникновение. Поскольку любой нефосфорилированный PRB немедленно фосфорилируется, клетка затем не может выйти из клеточного цикла, что приводит к непрерывному делению. [ 25 ]
Повреждение ДНК клеток G0 активирует циклин D-CDK 4/6, что приводит к монофосфорилированию нефосфорилированного PRB. Затем активный монофосфорилированный PRB вызывает репрессию генов, нацеленных на E2F. Следовательно, считается, что монофосфорилированный PRB играет активную роль в ответе на повреждение ДНК, так что репрессия гена E2F возникает до фиксированного повреждения, а клетка может передавать точку ограничения. В качестве примечания, обнаружение, которое повреждает, вызывает активацию Cyclin D - CDK 4/6, даже в клетках G0, следует учитывать, когда пациенты получают как химиотерапией, повреждающей ДНК, так и циклин D - CDK 4/6. [ 25 ]
Активация
[ редактировать ]Во время перехода M-G1 PRB затем постепенно дефосфорилируется с помощью PP1 , возвращаясь к его гипофосфорилированному состоянию его гипофосфорилированного состояния. [ 8 ] [ 27 ]
Белки семейства PRB являются компонентами комплекса мечты , состоящих из DP, E2F4/5, RB-подобного (P130/P107) и MUVB (LIN9: LIN37: LIN52: RBABP4: LIN54). Комплекс мечты собирается в GO/G1 и поддерживает покоясь, собираясь у промоторов> 800 генов клеточного цикла и опосредующего транскрипционного репрессии. Сборка мечты требует, чтобы DYRK1A (SER/THR -киназа) зависимого фосфорилирования компонента CORE MUVB, LIN52 в Serine28. Этот механизм имеет решающее значение для рекрутирования P130/P107 в ядро MUVB и, следовательно, сборку снов.
Последствия потери PRB
[ редактировать ]Последствия потери функции PRB зависят от типа клеток и статуса клеточного цикла, так как роль подавляющей опухоли PRB изменяется в зависимости от состояния и текущей идентичности клетки.
В g0 покоящихся стволовых клетках предлагается поддерживать остановку G0, хотя механизм остается в значительной степени неизвестным. Потеря PRB приводит к выходу из -за поколения и увеличению количества ячеек без потери мощности обновления клеток. В клетках -предшественниках на велосипеде PRB играет роль на контрольно -пропускных пунктах G1, S и G2 и способствует дифференцировке. В дифференцированных клетках, которые составляют большинство клеток в организме и предполагается, что они находятся в необратимом G0, PRB поддерживает как остановку, так и дифференцировку. [ 28 ]
Поэтому потеря PRB демонстрирует множество различных ответов в разных клетках, которые в конечном итоге могут привести к фенотипам рака. Для инициации рака потеря PRB может вызвать повторное вступление клеточного цикла как в Devestent, так и в постмитотических дифференцированных клетках посредством дедифференцировки. При прогрессировании рака потеря PRB снижает дифференцирующий потенциал циклических клеток, увеличивает хромосомную нестабильность, предотвращает индукцию клеточного старения, способствует ангиогенезу и увеличивает метастатический потенциал. [ 28 ]
Хотя большинство видов рака полагаются на гликолиз для производства энергии ( эффект Варбурга ), [ 29 ] Рак из -за потери PRB, как правило, усиливает окислительное фосфорилирование . [ 30 ] Повышенное окислительное фосфорилирование может увеличить стволование , метастазирование и (когда достаточно кислорода) клеточная энергия для анаболизма . [ 30 ]
In vivo до сих пор не совсем ясно, как и какие типы клеток происходят только с потерей PRB, но ясно, что путь PRB изменяется при большом количестве рака человека. [110] У мышей потери PRB достаточны для инициирования опухолей гипофиза и щитовидной железы, и в настоящее время исследуются механизмы инициации для этой гиперплазии. [ 31 ]
Неканонические роли
[ редактировать ]Классический взгляд на роль PRB как супрессора опухоли и регулятора клеточного цикла разработал посредством исследований, исследующих механизмы взаимодействия с белками членов семейства E2F. Тем не менее, больше данных, полученных в результате биохимических экспериментов и клинических испытаний, показывают другие функции PRB в клетках, не связанных (или косвенно связаны) с подавлением опухоли. [ 32 ]
Функциональный гиперфосфорилированный PRB
[ редактировать ]В пролиферирующих клетках определенные конформации PRB (когда RXL мотив, если связаны белковой фосфатазой 1 или когда он ацетилирован или метилирован), устойчивы к фосфорилированию CDK и сохраняют другие функции на протяжении всего прогрессирования клеточного цикла, предполагая, что не все PRB в клетке предназначены для охраны Переход G1/S. [ 32 ]
Исследования также продемонстрировали, что гиперфосфорилированный PRB может специфически связывать E2F1 и формировать стабильные комплексы во всем клеточном цикле для выполнения уникальных неисследованных функций, что является удивительным контрастом из классического взгляда на факторы E2F, высвобождающую PRB при фосфорилировании. [ 32 ]
Таким образом, многие новые выводы о устойчивости PRB фосфорилированию CDK появляются в исследованиях PRB и проливают свет на новые роли PRB за пределами регуляции клеточного цикла.
Стабильность генома
[ редактировать ]PRB может быть локализуется на участках разрывов ДНК во время процесса восстановления и помогает в не-гомологичном соединении и гомологичной рекомбинации посредством комплекса с E2F1. Оказавшись на перерывах, PRB способен рекрутировать регуляторы структуры хроматина, таких как активатор транскрипции ДНК геликазы BRG1. Было показано, что PRB также способен рекрутировать белковые комплексы, такие как конденсин и когезин, чтобы помочь в структурном поддержании хроматина. [ 32 ]
Такие данные свидетельствуют о том, что в дополнение к его супрессивной роли опухоли с помощью E2F, PRB также распределяется по всему геному, чтобы помочь в важных процессах поддержания генома, таких как повторная репрессия ДНК, репликация ДНК, конденсация хромосом и образование гетерохроматина. [ 32 ]
Регуляция метаболизма
[ редактировать ]PRB также участвует в регуляции метаболизма посредством взаимодействия с компонентами клеточных метаболических путей. Мутации RB1 могут вызывать изменения в метаболизме, включая снижение митохондриального дыхания, снижение активности в цепи электронов и изменения потока глюкозы и/или глутамина. Было обнаружено, что конкретные формы PRB локализуются во внешней митохондриальной мембране и непосредственно взаимодействуют с BAX, чтобы способствовать апоптозу. [ 33 ]
Как цель наркотиков
[ редактировать ]Реактивация PRB
[ редактировать ]В то время как частота изменений гена Rb является существенной для многих типов рака человека, включая в качестве легких, пищевода и печени, изменения в регуляторных компонентах PRB, таких как CDK4 и CDK6, являются основными мишенями для потенциальных терапевтических средств для лечения рака с дисрегуляцией в пути RB. [ 34 ] Этот фокус привел к недавнему развитию и клиническому одобрению FDA трех малых молекул CDK4/6 (Palbociclib (Ibrance, Pfizer Inc. 2015), рибоциклиб (Kisquali, Novartis. 2017) и Abemaciclib (Verzenio, Eli Lilly. 2017). ) для лечения специфических подтипов рака молочной железы. Однако недавние клинические исследования обнаруживают ограниченную эффективность, высокую токсичность и приобретенную резистентность [ 35 ] [ 36 ] Из этих ингибиторов предполагает необходимость дальнейшего выяснения механизмов, которые влияют на активность CDK4/6, а также изучение других потенциальных мишеней вниз по течению в пути PRB для реактивации подавляющих опухоль функций PRB. Обработка рака ингибиторами CDK4/6 зависит от присутствия PRB в клетке для терапевтического эффекта, ограничивая их использование только до рака, где RB не мутировал, а уровни белка PRB существенно не истощаются. [ 34 ]
Прямая реактивация PRB у людей не была достигнута. Однако в мышиных моделях новые генетические методы позволили экспериментам по реактивации PRB in vivo. Потеря PRB, индуцированная у мышей с онкогенными KRAS, управляемыми опухолями аденокарциномы легких, сводит на нет потребность в амплификации сигнала MAPK для прогрессирования карциномы и способствует потере приверженности линии, а также ускоряет приобретение метастатической компетентности. Реактивация PRB у этих мышей спасает опухоли в сторону менее метастатического состояния, но не полностью останавливает рост опухоли из-за предлагаемой переводки передачи сигналов пути MAPK, которая подавляет PRB через CDK-зависимый механизм. [ 37 ]
Проапоптотические эффекты потери PRB
[ редактировать ]Помимо попытки повторно активировать функцию подавления опухоли PRB, еще один отдельный подход к лечению рака нерегулируемого пути PRB заключается в том, чтобы воспользоваться некоторыми клеточными последствиями, вызванными потерей PRB. Было показано, что E2F стимулирует экспрессию проапоптотических генов в дополнение к генам перехода G1/S, однако раковые клетки разработали защитные сигнальные пути, которые защищают себя от смерти путем дерегулированной активности E2F. Таким образом, развитие ингибиторов этих защитных путей может быть синтетически летальным методом для убийства раковых клеток с помощью гиперактивных E2F. [ 34 ]
Кроме того, было показано, что проапоптотическая активность p53 ограничена путем PRB, так что опухолевые клетки с дефицитом PRB становятся чувствительными к P53-опосредованной гибели клеток. Это открывает дверь для исследований соединений, которые могут активировать активность p53 в этих раковых клетках, и вызывать апоптоз и уменьшить пролиферацию клеток. [ 34 ]
Регенерация
[ редактировать ]Хотя потеря опухолевого супрессора, такого как PRB, приводящая к неконтролируемой пролиферации клеток, является вредной в контексте рака, он может быть полезен для истощения или ингибирования подавляющих функций PRB в контексте клеточной регенерации. [ 38 ] Сбор пролиферативных способностей клеток, вызванных контролируемым раком, подобным », может помочь в восстановлении поврежденных тканей и задержать фенотипы старения. Эта идея еще предстоит тщательно изучить как потенциальное клеточное повреждение и антивозрастное лечение.
Cochlea
[ редактировать ]Белок ретинобластомы участвует в росте и развитии волосковых клеток млекопитающих в улитке и, по -видимому, связан с неспособностью клеток регенерации. Эмбриональные волосковые клетки требуют, чтобы PRB, среди других важных белков, для выхода из клеточного цикла и прекращения деления, что позволяет созревать слуховую систему. Как только млекопитающие дикого типа достигли взрослой жизни, их кохлеарные волосковые клетки становятся неспособными к пролиферации. В исследованиях, где ген для PRB удаляется у Cochlea мышей, волосковые клетки продолжают пролиферироваться в раннем взрослом возрасте. Хотя это может показаться положительным развитием, у мышей PRB-нокдауна, как правило, развивается серьезная потеря слуха из-за дегенерации органа Корти . По этой причине PRB, по -видимому, сыграет важную роль для завершения развития волос млекопитающих и поддержания их живыми. [ 39 ] [ 40 ] Тем не менее, ясно, что без PRB волосовые клетки обладают способностью пролиферировать, поэтому PRB известен как супрессор опухоли . Временно и точно отключение PRB у взрослых млекопитающих с поврежденными волосами может привести к распространению и, следовательно, успешной регенерации . Было обнаружено, что подавление функции белка ретинобластомы у взрослой крысы вызывает пролиферацию опорных клеток и волосковых клеток . PRB может быть подавлен путем активации пути Sonic Hedgehog , который фосфорилирует белки и снижает транскрипцию генов. [ 41 ]
Нейроны
[ редактировать ]Разрушив экспрессию PRB in vitro, либо удалением генов, либо нокдауном короткого мешающего РНК PRB , вызывает дендриты разветвлять дальше. Кроме того, клетки Шванна , которые обеспечивают важную поддержку для выживания нейронов, перемещаются с нейритами , простирающиеся дальше, чем обычно. Ингибирование PRB поддерживает продолжающийся рост нервных клеток. [ 42 ]
Взаимодействия
[ редактировать ]Известно, что PRB взаимодействует с более чем 300 белками, некоторые из которых перечислены ниже:
- ABL Gene [ 43 ] [ 44 ]
- Андрогенный рецептор [ 45 ] [ 46 ]
- Апоптоз-антагоновый транскрипционный фактор [ 47 ] [ 48 ]
- Arid4a [ 49 ]
- Ариловой углеводородной рецептор [ 50 ]
- KRCA1 [ 51 ] [ 52 ] [ 53 ]
- BRF1 [ 54 ] [ 55 ]
- C-Jun [ 56 ]
- C-raf [ 57 ] [ 58 ]
- CDK9 [ 59 ]
- Cutl1 [ 60 ]
- Циклин A1 [ 61 ]
- Циклин D1 [ 62 ] [ 63 ]
- Циклин Т2 [ 59 ]
- DNMT1 [ 64 ]
- E2F1 [ 65 ] [ 66 ] [ 67 ] [ 68 ] [ 69 ] [ 17 ] [ 70 ]
- E2f2 , [ 71 ]
- E4F1 [ 68 ]
- Eid1 [ 72 ] [ 73 ]
- Enc1 [ 74 ]
- Скучать [ 75 ]
- HBP1 [ 76 ]
- HDAC1 [ 49 ] [ 77 ] [ 78 ] [ 79 ] [ 80 ] [ 81 ] [ 82 ]
- HDAC3 [ 49 ] [ 83 ]
- Гистон деацетилаза 2 [ 49 ]
- Инсулин [ 84 ]
- Газета [ 85 ] [ 86 ]
- Большой опухоль антиген [ 87 ] [ 88 ]
- Lin9 [ 89 ]
- McM7 [ 90 ]
- MORF4L1 [ 66 ] [ 91 ]
- MRFAP1 , [ 66 ] [ 91 ]
- Myod [ 92 ] [ 93 ]
- Missa6 [ 94 ]
- PA2G4 [ 95 ]
- Пероксисом, активируемый пролифератором гамма [ 83 ]
- PK3R3 [ 96 ]
- Ингибитор активатора плазминогена-2 [ 97 ]
- Полимераза (направленная ДНК), альфа 1 [ 98 ]
- PRDM2 [ 99 ]
- Prkra [ 100 ]
- Прогибитин [ 58 ] [ 101 ]
- Промиелоцитарный лейкоз белок [ 102 ]
- RBBP4 [ 65 ] [ 103 ]
- RBBP7 [ 53 ] [ 103 ]
- RBBP8 [ 77 ] [ 104 ]
- RBBP9 [ 105 ]
- Snapc1 [ 106 ]
- SKP2 [ 107 ] [ 108 ]
- Snapc3 [ 106 ]
- SNW1 [ 109 ]
- SUV39H1 [ 110 ] [ 111 ]
- TAF1 [ 62 ] [ 112 ] [ 113 ] [ 114 ]
- Thoc1 [ 115 ]
- Ловушка [ 116 ]
- Поездка11 [ 117 ]
- UBTF [ 118 ]
- USP4 . [ 119 ]
Обнаружение
[ редактировать ]Было разработано несколько методов обнаружения мутаций гена RB1 [ 120 ] включая метод, который может обнаружить большие делеции, которые коррелируют с передовой стадии ретинобластомы. [ 121 ]
Смотрите также
[ редактировать ]- P53 - участвует в функции поддержки репарации ДНК PRB
- Целью транскрипции
- Ретинобластома
Ссылки
[ редактировать ]- ^ Jump up to: а беременный в GRCH38: Ensembl Release 89: ENSG00000139687 - ENSEMBL , май 2017 г.
- ^ Jump up to: а беременный в GRCM38: Ensembl Release 89: Ensmusg00000022105 - Ensembl , май 2017 г.
- ^ «Человеческая PubMed ссылка:» . Национальный центр информации о биотехнологии, Национальная медицина США .
- ^ «Мышь Pubmed ссылка:» . Национальный центр информации о биотехнологии, Национальная медицина США .
- ^ Мерфри Ал, Бенедикт В.Ф. (март 1984 г.). «Ретинобластома: подсказки к онкогенезу человека». Наука . 223 (4640): 1028–33. Bibcode : 1984sci ... 223.1028L . doi : 10.1126/science.6320372 . PMID 6320372 .
- ^ Shao Z, Robbins PD (январь 1995 г.). «Дифференциальная регуляция E2F и SP1-опосредованной транскрипции циклинами G1». Онкоген . 10 (2): 221–8. PMID 7838522 .
- ^ Jump up to: а беременный Коренжак М., Брем А (октябрь 2005 г.). «Комплексы E2F-RB, регулирующие транскрипцию генов, важных для дифференциации и развития». Текущее мнение в области генетики и развития . 15 (5): 520–7. doi : 10.1016/j.gde.2005.07.001 . PMID 16081278 .
- ^ Jump up to: а беременный в дюймовый и Мюнгер К., Хоули Прем (ноябрь 2002 г.). «Человеческий папилломавирус бессмертный и трансформации функции». Исследование вируса . 89 (2): 213–28. doi : 10.1016/s0168-1702 (02) 00190-9 . PMID 12445661 .
- ^ Gallego J (май 2016 г.). «Многокулеточная жизнь была вызвана тем же геном, который подавляет рак» . Канзасский государственный университет.
- ^ Кляйнерман Р.А., Такер М.А., Тароне Р.Е., Абрамсон Д.Х., Семеддон Дж. М., Стовалл М. и др. (Апрель 2005 г.). «Риск новых видов рака после лучевой терапии у долгосрочных выживших ретинобластомы: расширенное наблюдение » Журнал клинической онкологии 23 (10): 2272–9 Doi : 10.1200/ jco.2005.05.0 15800318PMID
- ^ Knudson AG (апрель 1971 г.). «Мутация и рак: статистическое исследование ретинобластомы» . Труды Национальной академии наук Соединенных Штатов Америки . 68 (4): 820–3. Bibcode : 1971pnas ... 68..820K . doi : 10.1073/pnas.68.4.820 . PMC 389051 . PMID 5279523 .
- ^ «Ортомам филогенетический маркер: кодирующая последовательность RB1» . Архивировано с оригинала 2015-09-24 . Получено 2009-12-02 .
- ^ Фролов М.В., Дайсон Н.Дж. (май 2004 г.). «Молекулярные механизмы E2F-зависимой активации и PRB-опосредованной репрессии» . Журнал сотовой науки . 117 (Pt 11): 2173–81. doi : 10.1242/jcs.01227 . PMID 15126619 .
- ^ Моррис Э.Дж., Дайсон Н.Дж. (2001). «Партнеры по белке ретинобластомы» . Достижения в области исследований рака . 82 : 1–54 . doi : 10.1016/s0065-230x (01) 82001-7 . ISBN 9780120066827 Полем PMID 11447760 .
- ^ Дик Фа, Рубин С.М. (май 2013). «Молекулярные механизмы, лежащие в основе функции белка PRB» . Природные обзоры. Молекулярная клеточная биология . 14 (5): 297–306. doi : 10.1038/nrm3567 . PMC 4754300 . PMID 23594950 .
- ^ Гудрич Д.В., Ван Н.П., Цянь Ю.В., Ли Эй , Ли В.Х. (октябрь 1991). «Продукт гена ретинобластомы регулирует прогрессирование через фазу G1 клеточного цикла». Клетка . 67 (2): 293–302. doi : 10.1016/0092-8674 (91) 90181-W . PMID 1655277 . S2CID 12990398 .
- ^ Jump up to: а беременный Wu CL, Zukerberg LR, Ngwu C, Harlow E, Lees JA (май 1995). «Ассоциация in vivo белков семейства E2F и DP» . Молекулярная и клеточная биология . 15 (5): 2536–46. doi : 10.1128/mcb.15.5.2536 . PMC 230484 . PMID 7739537 .
- ^ Jump up to: а беременный Funk Jo, Waga S, Harry JB, Espling E, Stillman B, Galloway DA (август 1997 г.). «Ингибирование активности CDK и PCNA-зависимая репликация ДНК с помощью p21 блокируется взаимодействием с онкопротеином HPV-16 E7» . Гены и развитие . 11 (16): 2090–100. doi : 10.1016/0168-9525 (97) 90029-9 . PMC 316456 . PMID 9284048 .
- ^ Jump up to: а беременный De Veylder L, Joubès J, Inzé D (декабрь 2003 г.). «Переходы клеточного цикла растений» . Современное мнение о биологии растений . 6 (6): 536–43. Bibcode : 2003copb .... 6..536V . doi : 10.1016/j.pbi.2003.09.001 . PMID 14611951 .
- ^ De Jager SM, Maughan S, Dewitte W, Scofield S, Murray JA (июнь 2005 г.). «Контекст развития контроля клеточного цикла у растений». Семинары в биологии клеток и развития . 16 (3): 385–96. doi : 10.1016/j.semcdb.2005.02.004 . PMID 15840447 .
- ^ Jump up to: а беременный Greenblatt RJ (2005). «Человеческие папилломавирусы: заболевания, диагноз и возможная вакцина». Клинический микробиологический информационный бюллетень . 27 (18): 139–45. doi : 10.1016/j.clinmicnews.2005.09.001 .
- ^ Sinal SH, Woods CR (октябрь 2005 г.). «Человеческие папилломавирусные инфекции генитальных и дыхательных путей у маленьких детей». Семинары по педиатрическим инфекционным заболеваниям . 16 (4): 306–16. doi : 10.1053/j.spid.2005.06.010 . PMID 16210110 .
- ^ Das SK, Hashimoto T, Shimizu K, Yoshida T, Sakai T, Sowa Y, et al. (Ноябрь 2005 г.). «Фукомсантин индуцирует остановку клеточного цикла при фазе G0/G1 в клетках карциномы толстой кишки человека посредством активации P21WAF1/CIP1». Biochimica et Biophysica Acta (BBA) - Общие субъекты . 1726 (3): 328–35. doi : 10.1016/j.bbagen.2005.09.007 . PMID 16236452 .
- ^ Bartkova J, Grøn B, Dabelsteen E, Bartek J (февраль 2003 г.). «Регуляторные белки клеточного цикла при заживлении раны человека». Архивы пероральной биологии . 48 (2): 125–32. doi : 10.1016/s0003-9969 (02) 00202-9 . PMID 12642231 .
- ^ Jump up to: а беременный в дюймовый и фон глин час Нарасимха А.М., Каулич М., Шапиро Г.С., Чой Й.Дж., Сисински П., Доуди С.Ф. (июнь 2014 г.). «Циклин D активирует супрессор опухоли RB с помощью монофосфорилирования» . элиф . 3 doi : 10.7554/elife.02872 . PMC 4076869 . PMID 24876129 .
- ^ Jump up to: а беременный Sanidas I, Morris R, Fella Ka, Rumde PH, Boukhali M, Tai EC, et al. (Март 2019). «Код монофосфорилирования модулирует функцию RB» . Молекулярная клетка . 73 (5): 985–1000.e6. doi : 10.1016/j.molcel.2019.01.004 . PMC 6424368 . PMID 30711375 .
- ^ Витри М., Бьянчи М., Лудлоу Дж.В., Миттнахт С., Вилла-Моруцци Е (февраль 2006 г.). «Прямое взаимодействие между каталитической субъединицей белковой фосфатазы 1 и PRB» . Раковая клетка International . 6 : 3. DOI : 10.1186/1475-2867-6-3 . PMC 1382259 . PMID 16466572 .
- ^ Jump up to: а беременный Burkhart DL, Sage J (сентябрь 2008 г.). «Клеточные механизмы подавления опухоли геном ретинобластомы» . Природные обзоры. Рак . 8 (9): 671–82. doi : 10.1038/nrc2399 . PMC 6996492 . PMID 18650841 .
- ^ Сейфрид Т.Н., Шелтон Л.М. (2010). «Рак как метаболическое заболевание» . Питание и метаболизм . 7 : 7. doi : 10.1186/1743-7075-7-7 . PMC 2845135 . PMID 20181022 .
- ^ Jump up to: а беременный Zacksenhaus E, Shresta M, Liu JC, Jiang Z (2017). «Митохондриальные Oxphos, вызванные дефицитом RB1 при раке молочной железы: последствия для анаболического метаболизма, стебля и метастазирования». Тенденции в раке . 3 (11): 768–779. doi : 10.1016/j.trecan.2017.09.002 . PMID 29120753 .
- ^ Sage J (июль 2012 г.). «Ретинобластома опухоль и биология стволовых клеток» . Гены и развитие . 26 (13): 1409–20. doi : 10.1101/gad.193730.112 . PMC 3403009 . PMID 22751497 .
- ^ Jump up to: а беременный в дюймовый и Дик Ф.А., Гудрич Д.В., Мудрец Дж., Дайсон Нью -Джерси (июль 2018 г.). «Неканонические функции белка RB при раке» . Природные обзоры. Рак . 18 (7): 442–451. doi : 10.1038/s41568-018-0008-5 . PMC 6693677 . PMID 29692417 .
- ^ Дайсон Нью -Джерси (июль 2016 г.). «RB1: прототип опухоль -супрессор и загадка» . Гены и развитие . 30 (13): 1492–502. doi : 10.1101/gad.282145.116 . PMC 4949322 . PMID 27401552 .
- ^ Jump up to: а беременный в дюймовый Knudsen ES, Wang Jy (февраль 2010 г.). «Нацеливание на RB-пути в терапии рака» . Клиническое исследование рака . 16 (4): 1094–9. doi : 10.1158/1078-0432.ccr-09-0787 . PMC 2822892 . PMID 20145169 .
- ^ Bui TB, Burgers DM, Agterof MJ, Van De Garde EM (2019). «Реальная эффективность palbociclib в сравнении с клиническими исследованиями приводит к пациентам с усовершенствованным/метастатическим раком молочной железы, которые прогрессировали на предыдущей эндокринной терапии» . Рак молочной железы . 13 : 1178223418823238. DOI : 10.1177/1178223418823238 . PMC 6330732 . PMID 30675102 .
- ^ Patnaik A, Rosen LS, Tolaney SM, Tolcher AW, Goldman JW, Gandhi L, et al. (Июль 2016 г.). «Эффективность и безопасность Abemaciclib, ингибитора CDK4 и CDK6, для пациентов с раком молочной железы, немелкоклеточным раком легких и других солидных опухолей» . Открытие рака . 6 (7): 740–53. doi : 10.1158/2159-8290.cd-16-0095 . PMID 27217383 .
- ^ Уолтер Д.М., Йейтс Т.Дж., Руис-Торрес М., Ким-Кизелак С., Гудиэль А.А., Дешпанде С. и др. (Май 2019). «RB ограничивает точность линии и множественные стадии прогрессирования опухоли и метастазирования» . Природа . 569 (7756): 423–427. Bibcode : 2019natur.569..423W . doi : 10.1038/s41586-019-1172-9 . PMC 6522292 . PMID 31043741 .
- ^ Pomerantz JH, Blau HM (июнь 2013 г.). "Опухолевые супрессоры: усилители или подавители регенерации?" Полем Разработка . 140 (12): 2502–12. doi : 10.1242/dev.084210 . PMC 3666379 . PMID 23715544 .
- ^ Sage C, Huang M, Vollrath MA, Brown MC, Hinds PW, Corey DP, et al. (Май 2006 г.). «Основная роль белка ретинобластомы в развитии и слуха для волос млекопитающих» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (19): 7345–50. Bibcode : 2006pnas..103.7345S . doi : 10.1073/pnas.0510631103 . PMC 1450112 . PMID 16648263 .
- ^ Вебер Т., Корбетт М.К., Чоу Л.М., Валентин М.Б., Бейкер С.Дж., Зуо Дж. (Январь 2008 г.). «Быстрое возвращение клеточного цикла и гибель клеток после острой инактивации гена ретинобластомы в постнатальных кохлеарных волосковых клетках» . Труды Национальной академии наук Соединенных Штатов Америки . 105 (2): 781–5. Bibcode : 2008pnas..105..781w . doi : 10.1073/pnas.0708061105 . PMC 2206613 . PMID 18178626 .
- ^ Lu N, Chen Y, Wang Z, Chen G, Lin Q, Chen Zy, Li H (январь 2013 г.). «Sonic Hedgehog инициирует регенерацию кохлеарных волосков посредством подавления белка ретинобластомы» . Биохимическая и биофизическая исследовательская коммуникация . 430 (2): 700–5. doi : 10.1016/j.bbrc.2012.11.088 . PMC 3579567 . PMID 23211596 .
- ^ Кристи К.Дж., Кришнан А., Мартинес Дж.А., Перди К, Сингх Б., Итон С., Зоходн Д. (апрель 2014 г.). «Увеличение регенерации нерва взрослых посредством нокдауна белка ретинобластомы» . Природная связь . 5 : 3670. Bibcode : 2014natco ... 5.3670c . doi : 10.1038/ncomms4670 . PMC 5028199 . PMID 24752312 .
- ^ Miyamura T, Nishimura J, Yufu Y, Nawata H (февраль 1997 г.). «Взаимодействие BCR-ABL с белком ретинобластомы в филадельфийских хромосом-позитивных клеточных линиях». Международный журнал гематологии . 65 (2): 115–21. doi : 10.1016/s0925-5710 (96) 00539-7 . PMID 9071815 .
- ^ Уэлч П.Дж., Ван Джи (ноябрь 1993 г.). «С-концевой белок-связывающий домен в белке ретинобластомы регулирует ядерную тирозинкиназу C-ABL в клеточном цикле» . Клетка . 75 (4): 779–90. doi : 10.1016/0092-8674 (93) 90497-e . PMID 8242749 .
- ^ Lu J, Danielsen M (ноябрь 1998 г.). «Дифференциальная регуляция андрогенов и глюкокортикоидных рецепторов с помощью белка ретинобластомы» . Журнал биологической химии . 273 (47): 31528–33. doi : 10.1074/jbc.273.47.31528 . PMID 9813067 .
- ^ Yeh S, Miyamoto H, Nishimura K, Kang H, Ludlow J, Hsiao P, et al. (Июль 1998 г.). «Ретинобластома, супрессор опухолей, является коактиватором рецептора андрогена в клетках рака простаты человека DU145» . Биохимическая и биофизическая исследовательская коммуникация . 248 (2): 361–7. doi : 10.1006/bbrc.1998.8974 . PMID 9675141 .
- ^ Bruno T, De Angelis R, De Nicola F, Barbato C, Di Padova M, Corbi N, et al. (Ноябрь 2002). «CHE-1 влияет на рост клеток, вмешиваясь в рекрутирование HDAC1 с помощью RB» . Раковая клетка . 2 (5): 387–99. doi : 10.1016/s1535-6108 (02) 00182-4 . PMID 12450794 .
- ^ M, Bruno T, Di Padova M, Depdova M, Iezzi S, Iacobini C, et al. (Май 2000). «Идентификация нового партнера РНК-полимеразы II субъединицы 11, CHE-1, которая взаимодействует с и влияет на функцию Suppession Rost RB » FASEB Journal 14 (7): 904–1 Doi : 10.1096/ fasebj.14.7.9 10783144PMID 43175069S2CID
- ^ Jump up to: а беременный в дюймовый Lai A, Lee JM, Yang WM, Decaprio JA, Kaelin WG, Seto E, Branton PE (октябрь 1999 г.). «RBP1 рекрутирует как гистон -деацетилаззависимую, так и -независимую репрессивную активность в белки семейства ретинобластомы» . Молекулярная и клеточная биология . 19 (10): 6632–41. doi : 10.1128/mcb.19.10.6632 . PMC 84642 . PMID 10490602 .
- ^ GE NL, Elferink CJ (август 1998 г.). «Прямое взаимодействие между рецептором ариловой углеводороды и белком ретинобластомы. Связывание передачи сигналов диоксина с клеточным циклом» . Журнал биологической химии . 273 (35): 22708–13. doi : 10.1074/jbc.273.35.22708 . PMID 9712901 .
- ^ Aprelikova ON, Fang BS, Meissner EG, Cotter S, Campbell M, Kuthiala A, et al. (Октябрь 1999). «BRCA1-ассоциированная остановка роста зависит от RB» . Труды Национальной академии наук Соединенных Штатов Америки . 96 (21): 11866–71. Bibcode : 1999pnas ... 9611866a . doi : 10.1073/pnas.96.21.11866 . PMC 18378 . PMID 10518542 .
- ^ Fan S, Yuan R, Ma YX, Xiong J, Meng Q, Erdos M, et al. (Август 2001 г.). «Разрушение мотива LXCXE BRCA1 изменяет функциональную активность BRCA1 и регуляцию семейства RB, но не связывания белка RB» . Онкоген . 20 (35): 4827–41. doi : 10.1038/sj.onc.1204666 . PMID 11521194 .
- ^ Jump up to: а беременный Ярден Р.И., Броди Л.К. (апрель 1999 г.). «BRCA1 взаимодействует с компонентами комплекса гистондеацетилазы» . Труды Национальной академии наук Соединенных Штатов Америки . 96 (9): 4983–8. Bibcode : 1999pnas ... 96.4983y . doi : 10.1073/pnas.96.9.4983 . PMC 21803 . PMID 10220405 .
- ^ Джонстон И.М., Эллисон С.Дж., Мортон Дж.П., Шрамм Л., Скотт П.Х., Уайт Р.Дж. (июнь 2002 г.). «CK2 образует стабильный комплекс с TFIIIB и активирует транскрипцию РНК -полимеразы III в клетках человека» . Молекулярная и клеточная биология . 22 (11): 3757–68. doi : 10.1128/mcb.22.11.3757-3768.2002 . PMC 133823 . PMID 11997511 .
- ^ Sutcliffe JE, Cairns CA, McLees A, Allison SJ, Tosh K, White RJ (июнь 1999 г.). «РНК -полимераза III Фактор IIIB является мишенью для репрессии карманными белками P107 и P130» . Молекулярная и клеточная биология . 19 (6): 4255–61. doi : 10.1128/mcb.19.6.4255 . PMC 104385 . PMID 10330166 .
- ^ Nishitani J, Nishinaka T, Cheng CH, Rong W, Yokoyama KK, Chiu R (февраль 1999 г.). «Рекрутирование белка ретинобластомы в C-Jun усиливает транскрипционную активность, опосредованную через сайт связывания AP-1» . Журнал биологической химии . 274 (9): 5454–61. doi : 10.1074/jbc.274.9.5454 . PMID 10026157 .
- ^ Wang S, Ghosh RN, Chellappan SP (декабрь 1998 г.). «RAF-1 физически взаимодействует с RB и регулирует его функцию: связь между митогенной передачей сигналов и регуляцией клеточного цикла» . Молекулярная и клеточная биология . 18 (12): 7487–98. doi : 10.1128/mcb.18.12.7487 . PMC 109329 . PMID 9819434 .
- ^ Jump up to: а беременный Wang S, Nath N, Fusaro G, Chellappan S (ноябрь 1999). «RB и ProhiTin нацелены на различные области E2F1 для репрессий и реагируют на различные сигналы вверх по течению» . Молекулярная и клеточная биология . 19 (11): 7447–60. doi : 10.1128/mcb.19.11.7447 . PMC 84738 . PMID 10523633 .
- ^ Jump up to: а беременный Симона С., Багилла Л., Беллан С., Гиордано А (июнь 2002 г.). «Физическое взаимодействие между комплексом PRB и CDK9/Cyclint2» . Онкоген . 21 (26): 4158–65. doi : 10.1038/sj.onc.1205511 . PMID 12037672 .
- ^ Gupta S, Luong MX, Bleuming SA, Miele A, Luong M, Young D, et al. (Сентябрь 2003 г.). «PRB-супрессор опухоли функционирует как ко-репрессор белка смещения CCAAAT (CDP/CUT) для регулирования транскрипции гистона H4, контролируемого клеточным циклом». Журнал клеточной физиологии . 196 (3): 541–56. doi : 10.1002/jcp.10335 . PMID 12891711 . S2CID 2287673 .
- ^ Yang R, Müller C, Huynh V, Fung YK, Yee As, Koeffler HP (март 1999 г.). «Функции циклина A1 в клеточном цикле и его взаимодействия с фактором транскрипции E2F-1 и семейством RB белков» . Молекулярная и клеточная биология . 19 (3): 2400–7. doi : 10.1128/mcb.19.3.2400 . PMC 84032 . PMID 10022926 .
- ^ Jump up to: а беременный Siegert JL, Rushton JJ, Sellers WR, Kaelin WG, Robbins PD (ноябрь 2000 г.). «Циклин D1 подавляет белок-ретинобластома, опосредованное ингибированием активности киназы TAFII250» . Онкоген . 19 (50): 5703–11. doi : 10.1038/sj.onc.1203966 . PMID 11126356 .
- ^ Dowdy SF, Hinds PW, Louie K, Reed Si, Arnold A, Weinberg RA (май 1993). «Физическое взаимодействие белка ретинобластомы с человеческими циклинами». Клетка . 73 (3): 499–511. doi : 10.1016/0092-8674 (93) 90137-f . PMID 8490963 . S2CID 24708871 .
- ^ Робертсон К.Д., Айт-Си-Али С., Йокочи Т., Уэйд П.А., Джонс П.Л., Вольфф А.П. (июль 2000 г.). «DNMT1 образует комплекс с RB, E2F1 и HDAC1 и подавляет транскрипцию от E2F-чувствительных промоторов». Природа генетика . 25 (3): 338–42. doi : 10.1038/77124 . PMID 10888886 . S2CID 10983932 .
- ^ Jump up to: а беременный Николас Э., Айт-Си-Али С., Труш Д (август 2001 г.). «Гистондеацетилаза HDAC3 нацелена на RBAP48 для белка ретинобластомы» . Исследование нуклеиновых кислот . 29 (15): 3131–6. doi : 10.1093/nar/29.15.3131 . PMC 55834 . PMID 11470869 .
- ^ Jump up to: а беременный в Pardo PS, Leung JK, Lucchesi JC, Pereira-Smith OM (декабрь 2002 г.). «MRG15, новый белок хромодомена, присутствует в двух различных мультипротеиновых комплексах, участвующих в активации транскрипции» . Журнал биологической химии . 277 (52): 50860–6. doi : 10.1074/jbc.m203839200 . PMID 12397079 .
- ^ Choubey D, Li SJ, Datta B, Gutterman Ju, Lengyel P (октябрь 1996 г.). «Ингибирование E2F-опосредованной транскрипции с помощью P202» . Embo Journal . 15 (20): 5668–78. doi : 10.1002/j.1460-2075.1996.tb00951.x . PMC 452311 . PMID 8896460 .
- ^ Jump up to: а беременный Fajas L, Paul C, Zugasti O, Le Cam L, Polanowska J, Fabbrizio E, et al. (Июль 2000 г.). «PRB связывается и модулирует транспремонтирующую активность транскрипционного фактора транскрипции E1A P120E4F» . Труды Национальной академии наук Соединенных Штатов Америки . 97 (14): 7738–43. Bibcode : 2000pnas ... 97.7738f . doi : 10.1073/pnas.130198397 . PMC 16614 . PMID 10869426 .
- ^ Dyson N, Dembski M, Fattaey A, Ngwu C, Ewen M, Helin K (декабрь 1993 г.). «Анализ P107-ассоциированных белков: P107 ассоциируется с формой E2F, которая отличается от PRB-ассоциированной E2F-1» . Журнал вирусологии . 67 (12): 7641–7. doi : 10.1128/jvi.67.12.7641-7647.1993 . PMC 238233 . PMID 8230483 .
- ^ Taniura H, Taniguchi N, Hara M, Yoshikawa K (январь 1998 г.). «Necdin, постмитотический нейрон-специфический супрессор роста, взаимодействует с вирусными трансформирующими белками и клеточным транскрипционным фактором E2F1» . Журнал биологической химии . 273 (2): 720–8. doi : 10.1074/jbc.273.2.720 . PMID 9422723 .
- ^ Lee C, Chang JH, Lee HS, CHO Y (декабрь 2002 г.). «Структурная основа для распознавания трансактивационного домена E2F с помощью супрессора опухоли ретинобластомы» . Гены и развитие . 16 (24): 3199–212. doi : 10.1101/gad.1046102 . PMC 187509 . PMID 12502741 .
- ^ Miyake S, Sellers WR, Safran M, Li X, Zhao W, Grossman SR, et al. (Декабрь 2000 г.). «Клетки разлагают новый ингибитор дифференцировки с E1A-подобными свойствами при выходе из клеточного цикла» . Молекулярная и клеточная биология . 20 (23): 8889–902. doi : 10.1128/mcb.20.23.8889-8902.2000 . PMC 86544 . PMID 11073989 .
- ^ Maclellan WR, Xiao G, Abdellatif M, Schneider MD (декабрь 2000 г.). «Новый RB- и P300-связывающий белок ингибирует трансактивацию MYOD» . Молекулярная и клеточная биология . 20 (23): 8903–15. doi : 10.1128/mcb.20.23.8903-8915.2000 . PMC 86545 . PMID 11073990 .
- ^ Ким Т.А., Лим Дж, Ота С., Раджа С., Роджерс Р., Ривнай Б. и др. (Май 1998). «NRP/B, новый белок ядерного матрикса, ассоциируется с p110 (RB) и участвует в дифференцировке нейронов» . Журнал клеточной биологии . 141 (3): 553–66. doi : 10.1083/jcb.141.3.553 . PMC 2132755 . PMID 9566959 .
- ^ Craven RJ, Cance WG, Liu ET (сентябрь 1995 г.). «Ядерная тирозинкиназа Rak ассоциируется с PRB белка ретинобластомы». РАНКА . 55 (18): 3969–72. PMID 7664264 .
- ^ Lavender P, Vandel L, Bannister AJ, Kouzarides T (июнь 1997 г.). «Транскрипционный фактор HMG-BOX HBP1 нацелен на карманные белки и E1A» . Онкоген . 14 (22): 2721–8. doi : 10.1038/sj.onc.1201243 . PMID 9178770 .
- ^ Jump up to: а беременный Дик Ф.А., Паульхамер Э., Дайсон Н.Дж. (май 2000). «Мутагенез кармана PRB показывает, что функции остановки клеточного цикла отделяются от связывания с вирусными онкопротеинами» . Молекулярная и клеточная биология . 20 (10): 3715–27. doi : 10.1128/mcb.20.10.3715-3727.2000 . PMC 85672 . PMID 10779361 .
- ^ Fuks F, Burgers WA, Brehm A, Hughes-Davies L, Kouzarides T (январь 2000 г.). «ДНК метилтрансфераза DNMT1 связывает с активностью гистондеацетилазы». Природа генетика . 24 (1): 88–91. doi : 10.1038/71750 . PMID 10615135 . S2CID 20428600 .
- ^ Puri PL, Iezzi S, Stiegler P, Chen TT, Schiltz RL, Muscat GE и др. (Октябрь 2001 г.). «Гистоновые деацетилазы класса I последовательно взаимодействуют с MYOD и PRB во время скелетного миогенеза» . Молекулярная клетка . 8 (4): 885–97. doi : 10.1016/s1097-2765 (01) 00373-2 . PMID 11684023 .
- ^ Wang S, Fusaro G, Padmanabhan J, Chellappan SP (декабрь 2002 г.). «Прогибитин совместно с RB в ядре и рекрутирует N-COR и HDAC1 для репрессии транскрипции» . Онкоген . 21 (55): 8388–96. doi : 10.1038/sj.onc.1205944 . PMID 12466959 .
- ^ Luo RX, Postigo AA, Dean DC (февраль 1998 г.). «RB взаимодействует с гистондеацетилазой для подавления транскрипции» . Клетка . 92 (4): 463–73. doi : 10.1016/s0092-8674 (00) 80940-x . PMID 9491888 . S2CID 18857544 .
- ^ Ferreira R, Magnaghi-Jaulin L, Robin P, Harel-Bellan A, Trouche D (сентябрь 1998 г.). «Три члена семейства Pocket Proteins имеют способность репрессировать активность E2F посредством рекрутирования гистондеацетилазы» . Труды Национальной академии наук Соединенных Штатов Америки . 95 (18): 10493–8. Bibcode : 1998pnas ... 9510493f . doi : 10.1073/pnas.95.18.10493 . PMC 27922 . PMID 9724731 .
- ^ Jump up to: а беременный Fajas L, Egler V, Reiter R, Hansen J, Kristiansen K, Debril MB, et al. (Декабрь 2002 г.). «Комплекс ретинобластомы-гистона деацетилазы 3 ингибирует дифференцировку PPARGAMMA и адипоцитов» . Ячейка развития . 3 (6): 903–10. doi : 10.1016/s1534-5807 (02) 00360-x . PMID 12479814 .
- ^ Радулеску Р.Т., Беллитти М.Р., Руво М., Кассани Г., Фассина Г. (январь 1995 г.). «Связывание мотива инсулина LXCXE с гексапептидом, полученным из белка ретинобластомы». Биохимическая и биофизическая исследовательская коммуникация . 206 (1): 97–102. doi : 10.1006/bbrc.1995.1014 . PMID 7818556 .
- ^ Chan SW, Hong W (июль 2001 г.). «Ретинобластома-связывающий белок 2 (RBP2) потенцирует транскрипцию, опосредованную рецептором ядерного гормона» . Журнал биологической химии . 276 (30): 28402–12. doi : 10.1074/jbc.m100313200 . PMID 11358960 .
- ^ Ким Ю.В., Оттерсон Г.А., Кратцке Р.А., Коксон А.Б., Кей Ф.Дж. (ноябрь 1994). «Дифференциальная специфичность связывания ретинобластомы, связывающего белок 2 с RB, P107 и TATA-связывающим белком» . Молекулярная и клеточная биология . 14 (11): 7256–64. doi : 10.1128/mcb.14.11.7256 . PMC 359260 . PMID 7935440 .
- ^ A P, Sáenz Robles Mt, Pipas JM (13 октября 2012 г.). «Большие Т -антигены полиомавирусов: удивительные молекулярные машины». Ежегодный обзор микробиологии . 66 (1): 213–236. doi : 10.1146/annurev-micro-092611-150154 . PMID 22994493 .
- ^ Arora R, Chang Y, Moore PS (август 2012 г.). «MCV и Merkel Cell Carcinoma: история молекулярного успеха» . Текущее мнение о вирусологии . 2 (4): 489–498. doi : 10.1016/j.coviro.2012.05.007 . PMC 3422445 . PMID 22710026 .
- ^ Gagrica S, Hauser S, Kolfschoten I, Osterloh L, Agami R, Gaubatz S (ноябрь 2004 г.). «Ингибирование онкогенной трансформации млекопитающим LIN-9, PRB-ассоциированным белком» . Embo Journal . 23 (23): 4627–38. doi : 10.1038/sj.emboj.7600470 . PMC 533054 . PMID 15538385 .
- ^ Sterner JM, Dew-Night S, Musahl C, Kornbluth S, Horowitz JM (май 1998). «Негативная регуляция репликации ДНК белком ретинобластомы опосредуется его связи с MCM7» . Молекулярная и клеточная биология . 18 (5): 2748–57. doi : 10.1128/mcb.18.5.2748 . PMC 110654 . PMID 9566894 .
- ^ Jump up to: а беременный Leung JK, Berube N, Venable S, Ahmed S, Timchenko N, Pereira-Smith OM (октябрь 2001 г.). «MRG15 активирует промотор B-MYB посредством образования ядерного комплекса с белком ретинобластомы и новым белком PAM14» . Журнал биологической химии . 276 (42): 39171–8. doi : 10.1074/jbc.m103435200 . PMID 11500496 .
- ^ Mal A, Sturniolo M, Schiltz RL, Ghosh Mk, Harter ML (апрель 2001 г.). «Роль гистондеацетилазы HDAC1 в модуляции транскрипционной активности MYOD: ингибирование миогенной программы» . Embo Journal . 20 (7): 1739–53. doi : 10.1093/emboj/20.7.1739 . PMC 145490 . PMID 11285237 .
- ^ Gu W, Schneider JW, Condorelli G, Kaushal S, Mahdavi V, Nadal-Ganard B (февраль 1993 г.). «Взаимодействие миогенных факторов и белка ретинобластомы опосредует приверженность и дифференцировку мышечных клеток». Клетка . 72 (3): 309–24. doi : 10.1016/0092-8674 (93) 90110-c . PMID 8381715 . S2CID 21581966 .
- ^ Goo Yh, Na Sy, Zhang H, Xu J, Hong S, Cheong J, et al. (Февраль 2004 г.). «Взаимодействие между активацией сигнального коинтегратора-2 и ретинобластомой опухоли в трансактивации рецепторов андрогена» . Журнал биологической химии . 279 (8): 7131–5. doi : 10.1074/jbc.m312563200 . PMID 14645241 .
- ^ Xia X, Cheng A, Rendor T, Zhang Y, Hamburger AW (май 2001 г.). «EBP1, белок, связывающий ERBB-3, взаимодействует с RB и влияет на регуляцию транскрипции RB». Журнал клеточной физиологии . 187 (2): 209–17. doi : 10.1002/jcp.1075 . PMID 11268000 . S2CID 42721280 .
- ^ Xia X, Cheng A, Akinmade D, Hamburger AW (март 2003 г.). «N-концевые 24 аминокислоты гамма-регуляторной субъединицы p55 фосфоинозитид-3-киназы связывают Rb и индуцируют остановку клеточного цикла» . Молекулярная и клеточная биология . 23 (5): 1717–25. doi : 10.1128/mcb.23.5.1717-1725.2003 . PMC 151709 . PMID 12588990 .
- ^ Darnell GA, Antalis TM, Johnstonne RW, Stringer BW, Ogbourne SM, Harrich D, Suhrbier A (сентябрь 2003 г.). «Ингибирование деградации белка ретинобластомы путем взаимодействия с плазминогеном Serpin активирует ингибитор 2 через новый консенсус -моти ». Молекулярная биология 23 (18): 6520–32. Doi : 10.1128/ mcb.23.18.6520-6532.2 193706PMC 12944478PMID
- ^ Takemura M, Kitagawa T, Izuta S, Wasa J, Takai A, Akiyama T, Yoshida S (ноябрь 1997 г.). «Фосфорилированный белок ретинобластомы стимулирует ДНК -полимеразу альфа » Онкоген 15 (20): 2483–9 Doi : 10.1038/ sj.1 PMID 9395244
- ^ Buyse IM, Shao G, Huang S (май 1995). «Белок ретинобластомы связывается с RIZ, белком цинкового пальца, который разделяет эпитоп с аденовирусным белком E1A» . Труды Национальной академии наук Соединенных Штатов Америки . 92 (10): 4467–71. Bibcode : 1995pnas ... 92.4467b . doi : 10.1073/pnas.92.10.4467 . PMC 41965 . PMID 7538672 .
- ^ Саймонс А., Меламед-Бессудо С., Волкович Р., Сперлинг Дж., Сперлинг Р., Эйзенбах Л., Роттер В. (январь 1997 г.). «Пакт: клонирование и характеристика клеточного связывающего белка p53, который взаимодействует с RB» . Онкоген . 14 (2): 145–55. doi : 10.1038/sj.onc.1200825 . PMID 9010216 .
- ^ Wang S, Nath N, Adlam M, Chellappan S (июнь 1999 г.). «Прогибитин, потенциальный супрессор опухоли, взаимодействует с RB и регулирует функцию E2F» . Онкоген . 18 (23): 3501–10. doi : 10.1038/sj.onc.1202684 . PMID 10376528 .
- ^ Alcalay M, Tomassoni L, Colombo E, Stoldt S, Grignani F, Fagioli M, et al. (Февраль 1998 г.). «Продукт гена промилоцитарного лейкоза (PML) образует стабильные комплексы с белком ретинобластомы» . Молекулярная и клеточная биология . 18 (2): 1084–93. doi : 10.1128/mcb.18.2.1084 . PMC 108821 . PMID 9448006 .
- ^ Jump up to: а беременный Цянь Ю.В., Ли Эй (октябрь 1995). «Двойные ретинобластомы связывающих белки со свойствами, связанными с негативным регулятором Ras в дрожжах» . Журнал биологической химии . 270 (43): 25507–13. doi : 10.1074/jbc.270.43.25507 . PMID 7503932 .
- ^ Fusco C, Reymond A, Zervos As (август 1998 г.). «Молекулярное клонирование и характеристика нового белка-связывающего ретинобластомы». Геномика . 51 (3): 351–8. doi : 10.1006/geno.1998.5368 . PMID 9721205 .
- ^ Woitach JT, Zhang M, Niu CH, Thorgeirsson SS (август 1998 г.). «Ретинобластома-связывающий белок, который влияет на контроль клеточного цикла и дает трансформирующую способность». Природа генетика . 19 (4): 371–4. doi : 10.1038/1258 . PMID 9697699 . S2CID 11374970 .
- ^ Jump up to: а беременный Hirsch Ha, Gu L, Генри RW (декабрь 2000 г.). «Белок супрессора опухоли ретинобластомы нацелен на различные общие факторы транскрипции для регуляции экспрессии гена РНК -полимеразы III» . Молекулярная и клеточная биология . 20 (24): 9182–91. doi : 10.1128/mcb.20.24.9182-9191.2000 . PMC 102176 . PMID 11094070 .
- ^ Ji P, Jiang H, Rekhtman K, Bloom J, Ichetovkin M, Pagano M, Zhu L (октябрь 2004 г.). «Путь RB-SKP2-P27 опосредует острый ингибирование клеточного цикла RB и сохраняется у мутанта RB с частичной путем» . Молекулярная клетка . 16 (1): 47–58. doi : 10.1016/j.molcel.2004.09.029 . PMID 15469821 .
- ^ Wang H, Bauzon F, Ji P, Xu X, Sun D, Locker J, et al. (Январь 2010). «SKP2 необходим для выживания аберрантно пролиферирующих RB1-дефицитных клеток и для онкогенеза у мышей RB1 +/-» . Природа генетика . 42 (1): 83–8. doi : 10.1038/ng.498 . PMC 2990528 . PMID 19966802 .
- ^ Prathapam T, Kühne C, Banks L (декабрь 2002 г.). «SKIP взаимодействует с супрессором опухоли ретинобластомы и ингибирует его транскрипционную репрессионную активность» . Исследование нуклеиновых кислот . 30 (23): 5261–8. doi : 10.1093/nar/gkf658 . PMC 137971 . PMID 12466551 .
- ^ Нильсен С.Дж., Шнайдер Р., Бауэр Ум, Баннистер А.Дж., Моррисон А., О'Карролл Д. и др. (Август 2001 г.). «RB нацелен на гистон H3 метилирование и HP1 на промоторов». Природа . 412 (6846): 561–5. Bibcode : 2001natur.412..561n . doi : 10.1038/35087620 . PMID 11484059 . S2CID 4378296 .
- ^ Вандель Л., Николас Э., Воуте О, Феррейра Р., Айт-Си-Али С., Труш Д (октябрь 2001 г.). «Транскрипционная репрессия белка ретинобластомы посредством рекрутирования гистонметилтрансферазы» . Молекулярная и клеточная биология . 21 (19): 6484–94. doi : 10.1128/mcb.21.19.6484-6494.2001 . PMC 99795 . PMID 11533237 .
- ^ Shao Z, Ruppert S, Robbins PD (апрель 1995 г.). «Продукт гена ретинобластомы, восприимчиво, связывается непосредственно с TATA-связывающим белком человека фактором TAFII250» . Труды Национальной академии наук Соединенных Штатов Америки . 92 (8): 3115–9. Bibcode : 1995pnas ... 92.3115S . doi : 10.1073/pnas.92.8.3115 . PMC 42115 . PMID 7724524 .
- ^ Siegert JL, Robbins PD (январь 1999 г.). «RB ингибирует внутреннюю киназную активность тата-связывающего белка фактора Tafii250» . Молекулярная и клеточная биология . 19 (1): 846–54. doi : 10.1128/mcb.19.1.846 . PMC 83941 . PMID 9858607 .
- ^ Shao Z, Siegert JL, Ruppert S, Robbins PD (июль 1997 г.). «RB взаимодействует с TAF (II) 250/TFIID через несколько доменов» . Онкоген . 15 (4): 385–92. doi : 10.1038/sj.onc.1201204 . PMID 9242374 .
- ^ Дурфи Т., Манчини М.А., Джонс Д., Элледж С.Дж., Ли В.Х. (ноябрь 1994 г.). «Аминоконцевая область продукта гена ретинобластомы связывает новый белок ядерного матрикса, который совместно локализуется в центрах для обработки РНК» . Журнал клеточной биологии . 127 (3): 609–22. doi : 10.1083/jcb.127.3.609 . PMC 2120229 . PMID 7525595 .
- ^ Chen CF, Chen Y, Dai K, Chen PL, Riley DJ, Lee WH (сентябрь 1996 г.). «Новый член семейства молекулярных шаперонов HSP90 взаимодействует с белком ретинобластомы во время митоза и после теплового шока» . Молекулярная и клеточная биология . 16 (9): 4691–9. doi : 10.1128/mcb.16.9.4691 . PMC 231469 . PMID 8756626 .
- ^ Чанг К.Х., Чен Й., Чен Т.Т., Чоу В.Х., Чен П.Л., Ма Юй и др. (Август 1997). «Коактиватор рецептора гормонов щитовидной железы отрицательно регулируется белком ретинобластомы» . Труды Национальной академии наук Соединенных Штатов Америки . 94 (17): 9040–5. Bibcode : 1997pnas ... 94.9040c . doi : 10.1073/pnas.94.17.9040 . PMC 23019 . PMID 9256431 .
- ^ Ханнан К.М., Ханнан Р.Д., Смит С.Д., Джефферсон Л.С., Лун М., Ротблум Ли (октябрь 2000 г.). «RB и P130 регулируют транскрипцию РНК-полимеразы I: RB нарушает взаимодействие между UBF и SL-1» . Онкоген . 19 (43): 4988–99. doi : 10.1038/sj.onc.1203875 . PMID 11042686 .
- ^ Blanchette P, Gilchrist CA, Baker RT, Grey DA (сентябрь 2001 г.). «Ассоциация UNP, убиквитин-специфическая протеаза, с карманными белками PRB, P107 и P130» . Онкоген . 20 (39): 5533–7. doi : 10.1038/sj.onc.1204823 . PMID 11571651 .
- ^ Парсам В.Л., Каннабиран С., Хонавар С., Вемуганти Г.К., Али М.Дж. (декабрь 2009 г.). «Комплексный, чувствительный и экономичный подход к обнаружению мутаций в гене RB1 при ретинобластоме» (PDF) . Журнал генетики . 88 (4): 517–27. doi : 10.1007/s12041-009-0069-z . PMID 20090211 . S2CID 10723496 .
- ^ Али М.Дж., Парсам В.Л., Хонавар С.Г., Канабир С., Вьюминь Г.К., Редди В.А. (октябрь 2010 г.). «Мутации гена RB1 при ретинобластоме и ее клинической корреляции » Саудовский журнал офтальмологии 24 (4): 119–2 Doi : 10.1016/ j.sjopt.2010.05.0 3729507PMC 23960888PMID
Дальнейшее чтение
[ редактировать ]- Momand J, Wu HH, Dasgupta G (январь 2000 г.). «MDM2-Master Регулятор белка-супрессора P53». Ген . 242 (1–2): 15–29. doi : 10.1016/s0378-1119 (99) 00487-4 . PMID 10721693 .
- Zheng L, Lee WH (2003). «Ретинобластома опухоль -супрессор и стабильность генома». Достижения в области исследований рака. Том 85 . Тол. 85. С. 13–50. doi : 10.1016/s0065-230x (02) 85002-3 . ISBN 978-0-12-006685-8 Полем PMID 12374284 .
- Классон М, Харлоу Е (декабрь 2002 г.). «Подавитель опухоли ретинобластомы в развитии и раке». Природные обзоры. Рак . 2 (12): 910–7. doi : 10.1038/nrc950 . PMID 12459729 . S2CID 22937378 .
- Lai H, Ma F, Lai S (январь 2003 г.). «Идентификация новой роли PRB в раке глаз». Журнал сотовой биохимии . 88 (1): 121–7. doi : 10.1002/jcb.10283 . PMID 12461781 . S2CID 34538683 .
- Simin K, Wu H, Lu L, Pinkel D, Albertson D, Cardiff RD, Van Dyke T (февраль 2004 г.). «Инактивация PRB в клетках молочной железы выявляет общие механизмы инициации опухоли и прогрессирования в расходящемся эпителии» . PLOS Биология . 2 (2): E22. doi : 10.1371/journal.pbio.0020022 . PMC 340938 . PMID 14966529 .
- Lohmann Dr, Gallie BL (август 2004 г.). «Ретинобластома: пересмотр модельного прототипа наследственного рака». Американский журнал медицинской генетики. Часть C, семинары в медицинской генетике . 129c (1): 23–8. doi : 10.1002/ajmg.c.30024 . PMID 15264269 . S2CID 41922148 .
- Клемо Н.К., Архель Н.Дж., Барнс Дж. Д., Бейкер Дж., Мурхен М., Пакхэм Г.К. и др. (Август 2005 г.). «Роль белка ретинобластомы (RB) в ядерной локализации BAG-1: последствия для выживания колоректальных опухолевых клеток». Биохимическое общество транзакций . 33 (Pt 4): 676–8. doi : 10.1042/bst0330676 . PMID 16042572 .
- Rodríguez-Cruz M, Del Prado M, Salcedo M (2006). «Перспективы геномной ретинобластомы: последствия гена супрессора [ sic ] гена RB1]». Журнал клинических исследований . 57 (4): 572–81. PMID 16315642 .
- Knudsen ES, Knudsen Ke (июль 2006 г.). «Ретинобластома опухоль супрессор: где рак встречается в клеточном цикле». Экспериментальная биология и медицина . 231 (7): 1271–81. doi : 10.1177/153537020623100713 . PMID 16816134 . S2CID 29078799 .
Внешние ссылки
[ редактировать ]- RB1+белок,+человек в Национальной библиотеке медицины Медицинской библиотеки США (Mesh)
- Ретинобластома+гены в Национальной медицинской библиотеке Медицинской библиотеки США (Mesh)
- Generons/NIH/NCBI/Ваша запись на ретинобластому
- Генетика ретинобластомы
- Дрозофила -ретинобластома -семейный белок - интерактивная муха
- Drosophila Retinoblastoma -Family Protein 2 - интерактивная муха
- Эволюционные гомологи ретинобластомы -семьи - интерактивная муха
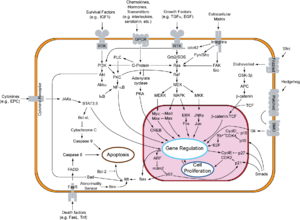
- есть диаграмма взаимодействия PRB-E2F Здесь [ Постоянная мертвая ссылка ] .
Эта статья включает в себя текст из Национальной медицины Соединенных Штатов , которая находится в общественном достоянии .