Тирозин
 Скелетная формула L - тирозина
| |||
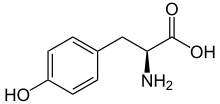
 L -тирозин при физиологическом pH
| |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК
( S )-Тирозин
| |||
| Другие имена
L -2-амино-3-(4-гидроксифенил)пропановая кислота
| |||
| Идентификаторы | |||
| |||
3D model ( JSmol )
|
|||
| КЭБ | |||
| ХЭМБЛ | |||
| ХимическийПаук | |||
| Лекарственный Банк | |||
| Информационная карта ECHA | 100.000.419 | ||
| КЕГГ | |||
ПабХим CID
|
|||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA )
|
|||
| Характеристики | |||
| C9H11NOC9H11NO3 | |||
| Молярная масса | 181.191 g·mol −1 | ||
| Появление | белое твердое вещество | ||
| 0,0453 г/100 мл | |||
| -105.3·10 −6 см 3 /моль | |||
| Опасности | |||
| NFPA 704 (огненный алмаз) | |||
| Страница дополнительных данных | |||
| Тирозин (страница данных) | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |||
L -Тирозин или тирозин (символ Tyr или Y ) [ 2 ] или 4-гидроксифенилаланин — одна из 20 стандартных аминокислот , которые используются клетками для синтеза белков . Это незаменимая аминокислота с полярной боковой группой . Слово «тирозин» происходит от греческого tyros , что означает сыр , поскольку он был впервые обнаружен в 1846 году немецким химиком Юстусом фон Либихом в белке казеина сыра. [ 3 ] [ 4 ] Его называют тирозилом , когда его называют функциональной группой или боковой цепью. Хотя тирозин обычно классифицируется как гидрофобная аминокислота, он более гидрофильен, чем фенилаланин . [ 5 ] Он кодируется кодонами UAC и UAU в информационной РНК .
Однобуквенный символ Y был присвоен тирозину как ближайший по алфавиту из имеющихся букв. Обратите внимание, что T был отнесен к структурно более простому треонину, U избегался из-за его сходства с V для валина, W был отнесен к триптофану, а X был зарезервирован для неопределенных или атипичных аминокислот. [ 6 ] Также была предложена мнемоника t Y rosine. [ 7 ]
Функции
[ редактировать ]Помимо того, что тирозин является протеиногенной аминокислотой , он играет особую роль благодаря фенольной функциональности. Его гидроксильная группа способна образовывать сложноэфирную связь , в частности с фосфатом. Фосфатные группы передаются на тирозиновые остатки с помощью протеинкиназ . Это одна из посттрансляционных модификаций . Фосфорилированный тирозин встречается в белках, которые участвуют в процессах передачи сигнала .
Аналогичная функциональность присутствует также у серина и треонина , боковые цепи которых имеют гидроксильную группу, но являются спиртами . Фосфорилирование фрагментов этих трех аминокислот (включая тирозин) создает на их концах отрицательный заряд, который превышает отрицательный заряд единственных отрицательно заряженных аспарагиновой и глутаминовой кислот. Фосфорилированные белки сохраняют те же свойства, которые полезны для более надежных белок-белковых взаимодействий, благодаря фосфотирозину, фосфосерину и фосфотреонину. [ 8 ]
Сайты связывания сигнального фосфопротеина могут быть разнообразными по своей химической структуре. [ 9 ]
Фосфорилирование гидроксильной группы может изменить активность целевого белка или может стать частью сигнального каскада посредством связывания домена SH2 . [ 10 ]
Остаток тирозина также играет важную роль в фотосинтезе . В хлоропластах ( фотосистема II ) он выступает донором электронов при восстановлении окисленного хлорофилла . В этом процессе он теряет атом водорода своей фенольной ОН-группы. Этот радикал впоследствии восстанавливается в фотосистеме II четырьмя основными кластерами марганца . [ 11 ]
Диетические потребности и источники
[ редактировать ]Рекомендуемая норма потребления тирозина с пищей обычно рассчитывается вместе с фенилаланином . Оно варьируется в зависимости от метода расчета, однако идеальным соотношением этих двух аминокислот считается 60:40 (фенилаланин:тирозин), поскольку именно такой состав имеет организм человека. [ 12 ] Тирозин, который также может синтезироваться в организме из фенилаланина, содержится во многих продуктах питания с высоким содержанием белка, таких как мясо , рыба , сыр , творог , молоко , йогурт , арахис , миндаль , семена тыквы , семена кунжута , соевый белок и Лимская фасоль . [ 13 ] [ 14 ] Например, в яичном белке содержится около 250 мг на яйцо. [ 15 ] в то время как говядина, баранина, свинина, тунец, лосось, курица и индейка содержат около 500–1000 мг на порцию 3 унции (85 г). [ 15 ] [ 16 ]
Биосинтез
[ редактировать ]
В растениях и большинстве микроорганизмов тирозин вырабатывается через префенат , промежуточный продукт шикиматного пути . Префенат подвергается окислительному декарбоксилированию с сохранением гидроксильной группы с образованием п- гидроксифенилпирувата, который переаминируется с использованием глутамата в качестве источника азота с образованием тирозина и α-кетоглутарата .
Млекопитающие синтезируют тирозин из незаменимой аминокислоты фенилаланина (Phe), которая поступает с пищей. Превращение Phe в Tyr катализируется ферментом фенилаланингидроксилазой , монооксигеназой. Этот фермент катализирует реакцию, вызывающую добавление гидроксильной группы к концу 6-углеродного ароматического кольца фенилаланина , в результате чего он становится тирозином.
Метаболизм
[ редактировать ]
Фосфорилирование и сульфатирование
[ редактировать ]Некоторые остатки тирозина могут быть помечены (по гидроксильной группе) фосфатной группой ( фосфорилированы ) протеинкиназами . В своей фосфорилированной форме тирозин называется фосфотирозином . Фосфорилирование тирозина считается одним из ключевых этапов передачи сигнала и регуляции ферментативной активности. Фосфотирозин можно обнаружить с помощью специфических антител . Остатки тирозина также могут быть модифицированы путем добавления сульфатной группы — процесс, известный как сульфатирование тирозина . [ 17 ] Сульфатирование тирозина катализируется тирозилпротеинсульфотрансферазой (TPST). Подобно упомянутым выше антителам к фосфотирозину, недавно были описаны антитела, которые специфически обнаруживают сульфотирозин. [ 18 ]
Предшественник нейромедиаторов и гормонов
[ редактировать ]В дофаминергических клетках головного мозга тирозин превращается в L-ДОФА с помощью фермента тирозингидроксилазы (ТГ). ТГ — фермент, ограничивающий скорость , участвующий в синтезе нейромедиатора дофамина . Затем дофамин может превращаться в другие катехоламины , такие как норадреналин (норадреналин) и адреналин (адреналин).
Гормоны щитовидной железы трийодтиронин ( Т 3 ) и тироксин (Т 4 ) в коллоиде щитовидной железы также происходят из тирозина.
Прекурсор других соединений
[ редактировать ]латекс Papaver somniferum Было показано, что , опийного мака, превращает тирозин в алкалоид морфин , и был установлен путь биосинтеза от тирозина к морфину с использованием тирозина, меченного радиоактивным изотопом углерода-14, для отслеживания пути синтеза in vivo. . [ 22 ] Тирозин-аммиачная лиаза (TAL) представляет собой фермент, участвующий в пути биосинтеза природных фенолов. Он превращает L-тирозин в п-кумаровую кислоту . Тирозин также является предшественником пигмента меланина . Тирозин (или его предшественник фенилаланин) необходим для синтеза структуры бензохинона, которая является частью кофермента Q10 . [ 23 ] [ 24 ]
Деградация
[ редактировать ]
[ нужна ссылка ]
Разложение L-тирозина (син. пара -гидроксифенилаланин) начинается с α-кетоглутарат-зависимого трансаминирования через тирозинтрансаминазу до пара -гидроксифенилпирувата . Позиционное описание para , сокращенно p , означает, что гидроксильная группа и боковая цепь фенильного кольца расположены напротив друг друга (см. иллюстрацию ниже).
Следующий этап окисления катализирует п- гидроксифенилпируватдиоксигеназа и отщепление CO 2 гомогентизата (2,5-дигидроксифенил-1-ацетат). [ 25 ] Чтобы расщепить ароматическое кольцо гомогентизата, дополнительная диоксигеназа, гомогентизат-1,2-диоксигеназа необходима . Таким образом, за счет включения дополнительной O 2 молекулы малеилацетоацетат создается .
Фумарилацетоацетат создается малеилацетоацетат -цис - транс -изомеразой путем вращения карбоксильной группы, созданной из гидроксильной группы путем окисления. Эта цис-транс -изомераза содержит глутатион в качестве кофермента . Фумарилацетоацетат окончательно расщепляется ферментом фумарилацетоацетатгидролазой за счет добавления молекулы воды.
При этом фумарат (также метаболит цикла лимонной кислоты) и ацетоацетат высвобождаются (3-кетобутироат). Ацетоацетат представляет собой кетоновое тело , которое активируется сукцинил-КоА, после чего может превращаться в ацетил-КоА , который, в свою очередь, может окисляться в цикле лимонной кислоты или использоваться для синтеза жирных кислот .
Флоретовая кислота также является метаболитом тирозина в моче у крыс. [ 26 ]
Орто- и мета-тирозин
[ редактировать ]
три структурных изомера Известны L-тирозина. Помимо обычной аминокислоты L-тирозина, которая является пара-изомером ( пара- тир, п -тир или 4-гидроксифенилаланин), существуют два дополнительных региоизомера, а именно мета -тирозин (также известный как 3-гидроксифенилаланин , L-тирозин). м -тирозин и м -тир) и орто -тирозин ( о -тир или 2-гидроксифенилаланин), встречающиеся в природе. Редкие изомеры м -тир и о -тир возникают в результате неферментативного свободнорадикального гидроксилирования фенилаланина в условиях окислительного стресса . [ 27 ] [ 28 ]
Медицинское использование
[ редактировать ]Тирозин является предшественником нейротрансмиттеров и повышает уровень нейротрансмиттеров в плазме (особенно дофамина и норадреналина). [ 29 ] но практически не влияет на настроение у нормальных людей. [ 30 ] [ 31 ] [ 32 ]
2015 года Систематический обзор показал, что «нагрузка тирозином резко противодействует ухудшению рабочей памяти и обработки информации, вызванному сложными ситуационными условиями, такими как экстремальная погода или когнитивная нагрузка », и, следовательно, «тирозин может принести пользу здоровым людям, подвергающимся суровым ситуационным условиям». [ 33 ]
Промышленный синтез
[ редактировать ]L-тирозин используется в фармацевтических препаратах , пищевых добавках и пищевых добавках . Раньше для производства L-тирозина использовались два метода. Первый предполагает экстракцию нужной аминокислоты из белковых гидролизатов с использованием химического подхода. Второй использует ферментативный синтез из фенольных соединений, пирувата и аммиака с помощью тирозинфеноллиазы . [ 34 ] Достижения в области генной инженерии и появление промышленной ферментации привели к тому, что синтез L-тирозина перешел на использование специально разработанных штаммов кишечной палочки . [ 35 ] [ 34 ]
См. также
[ редактировать ]- Альбинизм
- Алкаптонурия
- Беталайн
- Йодированные производные тирозина
- Поли реакция
- Тирамин
- Сульфатирование тирозина
- Тирозинемия
Ссылки
[ редактировать ]- ^ Перейти обратно: а б Фрей М.Н., Кетцле Т.Ф., Леманн М.С., Гамильтон В.К. (1973). «Прецизионное нейтронографическое определение структуры компонентов белка и нуклеиновых кислот. X. Сравнение кристаллической и молекулярной структур L-тирозина и гидрохлорида L-тирозина». Дж. Хим. Физ. 58 (6): 2547–2556. Бибкод : 1973JChPh..58.2547F . дои : 10.1063/1.1679537 .
- ^ «Номенклатура и символика аминокислот и пептидов» . Совместная комиссия IUPAC-IUB по биохимической номенклатуре. 1983. Архивировано из оригинала 9 октября 2008 года . Проверено 5 марта 2018 г.
- ^ «Тирозин» . Электронная энциклопедия Колумбии, 6-е изд . Infoplease.com — Издательство Колумбийского университета. 2007 . Проверено 20 апреля 2008 г.
- ^ Харпер Д. (2001). «Тирозин» . Интернет-словарь этимологии . Проверено 20 апреля 2008 г.
- ^ «Аминокислоты – Тирозин» . www.biology.arizona.edu . Проверено 31 января 2018 г.
- ^ «Комиссия IUPAC-IUB по биохимической номенклатуре. Однобуквенное обозначение аминокислотных последовательностей» . Журнал биологической химии . 243 (13): 3557–3559. 10 июля 1968 г. doi : 10.1016/S0021-9258(19)34176-6 .
- ^ Шафран М. (апрель 1998 г.). «Названия аминокислот и комнатные игры: от тривиальных названий до однобуквенного кода, названия аминокислот напрягают память студентов. Возможна ли более рациональная номенклатура?» . Биохимическое образование . 26 (2): 116–118. дои : 10.1016/S0307-4412(97)00167-2 .
- ^ Хантер Т. (19 сентября 2012 г.). «Почему природа выбрала фосфат для модификации белков» . Философские труды Королевского общества B: Биологические науки . 367 (1602): 2513–2516. дои : 10.1098/rstb.2012.0013 . ISSN 0962-8436 . ПМЦ 3415839 . ПМИД 22889903 .
- ^ Лу ЦзК, Цзян Ф, Ву Ю.Д. (11 декабря 2021 г.). «Предсказание сайтов связывания фосфатов в белок-белковых взаимодействиях, зависимых от фосфорилирования» . Биоинформатика . 37 (24): 4712–4718. doi : 10.1093/биоинформатика/btab525 . ISSN 1367-4811 . ПМИД 34270697 .
- ^ Лю Б.А., Нэш ПД (19 сентября 2012 г.). «Эволюция доменов SH2 и сигнальных сетей фосфотирозина» . Философские труды Королевского общества B: Биологические науки . 367 (1602): 2556–2573. дои : 10.1098/rstb.2012.0107 . ISSN 0962-8436 . ПМЦ 3415846 . ПМИД 22889907 .
- ^ Барри Б.А. (январь 2015 г.). «Динамика реакции и протон-связанный перенос электронов: исследования переноса заряда на основе тирозина в природных и биомиметических системах» . Biochimica et Biophysica Acta (BBA) — Биоэнергетика . 1847 (1): 46–54. дои : 10.1016/j.bbabio.2014.09.003 . ISSN 0006-3002 . ПМИД 25260243 .
- ^ Пенчарц П.Б., Сюй Дж.В., Болл Р.О. (июнь 2007 г.). «Потребность в ароматических аминокислотах у здоровых людей» . Журнал питания . 137 (6 Suppl 1): 1576S–1578S, обсуждение 1597S–1598S. дои : 10.1093/jn/137.6.1576S . ПМИД 17513429 .
- ^ Инструмент ранжирования питательных веществ. MyFoodData.com. https://tools.myfooddata.com/nutrient-ranking-tool/tyrosine/all/highest
- ^ «Тирозин» . Медицинский центр Университета Мэриленда . Архивировано из оригинала 4 июня 2013 г. Проверено 17 марта 2011 г.
- ^ Перейти обратно: а б Топ-10 продуктов с самым высоким содержанием тирозина
- ^ Инструмент ранжирования питательных веществ. MyFoodData.com. https://tools.myfooddata.com https://tools.myfooddata.com/nutrient-ranking-tool/tyrosine/meats/highest/ounces/common/no
- ^ Хоффайнс А.Дж., Дамок Э., Бриджес К.Г., Лири Дж.А., Мур К.Л. (декабрь 2006 г.). «Обнаружение и очистка тирозинсульфатированных белков с использованием нового моноклонального антитела против сульфотирозина» . Журнал биологической химии . 281 (49): 37877–87. дои : 10.1074/jbc.M609398200 . ПМК 1764208 . ПМИД 17046811 .
- ^ Кэнан Ю., Гамильтон Р.А., Шерри Д.М., Аль-Убайди М.Р. (декабрь 2012 г.). «Сосредоточьтесь на молекулах: сульфотирозин» . Экспериментальное исследование глаз . 105 : 85–6. дои : 10.1016/j.exer.2012.02.014 . ПМЦ 3629733 . ПМИД 22406006 .
- ^ Бродли К.Дж. (март 2010 г.). «Сосудистые эффекты следовых аминов и амфетаминов». Фармакология и терапия . 125 (3): 363–375. doi : 10.1016/j.pharmthera.2009.11.005 . ПМИД 19948186 .
- ^ Линдеманн Л., Хонер MC (май 2005 г.). «Ренессанс следовых аминов, вдохновленный новым семейством GPCR». Тенденции в фармакологических науках . 26 (5): 274–281. дои : 10.1016/j.tips.2005.03.007 . ПМИД 15860375 .
- ^ Ван X, Ли Дж, Донг Дж, Юэ Дж (февраль 2014 г.). «Эндогенные субстраты CYP2D мозга». Европейский журнал фармакологии . 724 : 211–218. дои : 10.1016/j.ejphar.2013.12.025 . ПМИД 24374199 .
- ^ Баттерсби А.Р., Бинкс Р., Харпер Б.Дж. (1 января 1962 г.). «692. Биосинтез алкалоидов. Часть II. Биосинтез морфина» . Журнал Химического общества : 3534–3544. дои : 10.1039/JR9620003534 . ISSN 0368-1769 .
- ^ Бентингер М., Текле М., Даллнер Г. (май 2010 г.). «Коэнзим Q - биосинтез и функции». Связь с биохимическими и биофизическими исследованиями . 396 (1): 74–9. дои : 10.1016/j.bbrc.2010.02.147 . ПМИД 20494114 .
- ^ Акоста М.Дж., Васкес Фонсека Л., Десбатс М.А., Серкуа С., Зордан Р., Тревиссон Е. и др. (2016). «Биосинтез коэнзима Q в здоровье и болезни» . Biochimica et Biophysica Acta (BBA) — Биоэнергетика . 1857 (8): 1079–1085. дои : 10.1016/j.bbabio.2016.03.036 . ПМИД 27060254 .
- ^ Зеа-Рей А.В., Крус-Камино Х., Васкес-Канту Д.Л., Гутьеррес-Гарсия В.М., Сантос-Гусман Х., Канту-Рейна К. (27 ноября 2017 г.). «Заболеваемость транзиторной неонатальной тирозинемией среди населения Мексики» . Журнал врожденных ошибок метаболизма и скрининга . 5 : 232640981774423. doi : 10.1177/2326409817744230 .
- ^ Бут А.Н., Масри М.С., Роббинс Д.Д., Эмерсон О.Г., Джонс Ф.Т., ДеЭдс Ф. (1960). «Метаболизм тирозина фенольной кислоты в моче» . Журнал биологической химии . 235 (9): 2649–2652. дои : 10.1016/S0021-9258(19)76930-0 .
- ^ Мольнар Г.А., Вагнер З., Марко Л., Сеги Ко Т., Мохас М., Кочис Б. и др. (ноябрь 2005 г.). «Экскреция орто-тирозина с мочой при сахарном диабете и почечной недостаточности: данные о выработке гидроксильных радикалов» . Почки Интернешнл . 68 (5): 2281–7. дои : 10.1111/j.1523-1755.2005.00687.x . ПМИД 16221230 .
- ^ Мольнар Г.А., Немеш В., Биро З., Лудани А., Вагнер З., Виттманн И. (декабрь 2005 г.). «Накопление гидроксильных свободнорадикальных маркеров мета-, орто-тирозина и ДОФА в катарактальных хрусталиках сопровождается снижением содержания белка и фенилаланина в водорастворимой фазе». Свободные радикальные исследования . 39 (12): 1359–66. дои : 10.1080/10715760500307107 . ПМИД 16298866 . S2CID 31154432 .
- ^ Расмуссен Д.Д., Ишизука Б., Куигли М.Э., Йен С.С. (октябрь 1983 г.). «Влияние приема тирозина и триптофана на концентрацию катехоламинов в плазме и 3,4-дигидроксифенилуксусной кислоты». Журнал клинической эндокринологии и метаболизма . 57 (4): 760–3. doi : 10.1210/jcem-57-4-760 . ПМИД 6885965 .
- ^ Литвуд П.Д., Поллет П. (1982). «Изменения настроения, вызванные диетой, у нормального населения». Журнал психиатрических исследований . 17 (2): 147–54. дои : 10.1016/0022-3956(82)90016-4 . ПМИД 6764931 .
- ^ Дейен Дж.Б., Орлебеке Дж.Ф. (1994). «Влияние тирозина на когнитивные функции и артериальное давление при стрессе». Бюллетень исследований мозга . 33 (3): 319–23. дои : 10.1016/0361-9230(94)90200-3 . ПМИД 8293316 . S2CID 33823121 .
- ^ Либерман Х.Р., Коркин С., Спринг Б.Дж., Вуртман Р.Дж., Гроудон Дж.Х. (август 1985 г.). «Влияние пищевых предшественников нейромедиаторов на поведение человека». Американский журнал клинического питания . 42 (2): 366–70. дои : 10.1093/ajcn/42.2.366 . ПМИД 4025206 .
- ^ Юнг С.Е., Хасе А., Анн Хет Рот М. (2015). «Поведенческие и когнитивные эффекты потребления тирозина у здоровых взрослых людей» . Фармакология Биохимия и поведение . 133 : 1–6. дои : 10.1016/j.pbb.2015.03.008 . ПМИД 25797188 . S2CID 30331663 .
- ^ Перейти обратно: а б Лютке-Эверсло Т., Сантос К.Н., Стефанопулос Г. (декабрь 2007 г.). «Перспективы биотехнологического производства L-тирозина и его применения». Прикладная микробиология и биотехнология . 77 (4): 751–62. дои : 10.1007/s00253-007-1243-y . ПМИД 17968539 . S2CID 23088822 .
- ^ Чавес-Бехар М., Баес-Виверос Дж., Мартинес А., Боливар Ф., Госсет Г. (2012). «Биотехнологическое производство L-тирозина и производных соединений». Технологическая биохимия . 47 (7): 1017–1026. дои : 10.1016/j.procbio.2012.04.005 .