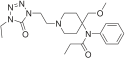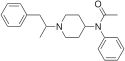Опиоид
| Опиоид | |
|---|---|
| Класс наркотиков | |
 | |
| Идентификаторы класса | |
| Использовать | Облегчение боли |
| Код ATC | N02A |
| Способ действия | Опиоидный рецептор |
| External links | |
| MeSH | D000701 |
| Legal status | |
| In Wikidata | |
Опиоиды представляют собой класс лекарств , которые происходят или имитируют природные вещества, обнаруженные в опиуме мака . Опиоиды работают в мозге, чтобы обеспечить различные эффекты, включая облегчение боли. Как класс веществ, они действуют на опиоидных рецепторах , чтобы продуцировать эффекты, подобные морфину . [ 2 ] [ 3 ]
Термины «опиоид» и «опиат» иногда используются взаимозаменяемо, но существуют ключевые различия, основанные на производственных процессах этих лекарств. [ 4 ]
С медицинской точки зрения они в основном используются для облегчения боли , включая анестезию . [ 5 ] Другие медицинские применения включают подавление диареи , заместительную терапию при расстройстве употребления опиоидов , обратную передозировку опиоидов и подавление кашля . [ 5 ] Чрезвычайно мощные опиоиды, такие как Carfentanil, утверждены только для ветеринарного использования. [ 6 ] [ 7 ] [ 8 ] Опиоиды также часто используются рекреально для их эйфорических эффектов или для предотвращения снятия средств . [ 9 ] Опиоиды могут вызвать смерть и использовались для казней в Соединенных Штатах .
Side effects of opioids may include itchiness, sedation, nausea, respiratory depression, constipation, and euphoria. Long-term use can cause tolerance, meaning that increased doses are required to achieve the same effect, and physical dependence, meaning that abruptly discontinuing the drug leads to unpleasant withdrawal symptoms.[10] The euphoria attracts recreational use, and frequent, escalating recreational use of opioids typically results in addiction. An overdose or concurrent use with other depressant drugs like benzodiazepines commonly results in death from respiratory depression.[11]
Opioids act by binding to opioid receptors, which are found principally in the central and peripheral nervous system and the gastrointestinal tract. These receptors mediate both the psychoactive and the somatic effects of opioids. Opioid drugs include partial agonists, like the anti-diarrhea drug loperamide and antagonists like naloxegol for opioid-induced constipation, which do not cross the blood–brain barrier, but can displace other opioids from binding to those receptors in the myenteric plexus.
Because opioids are addictive and may result in fatal overdose, most are controlled substances. In 2013, between 28 and 38 million people used opioids illicitly (0.6% to 0.8% of the global population between the ages of 15 and 65).[12] In 2011, an estimated 4 million people in the United States used opioids recreationally or were dependent on them.[13] As of 2015, increased rates of recreational use and addiction are attributed to over-prescription of opioid medications and inexpensive illicit heroin.[14][15][16] Conversely, fears about overprescribing, exaggerated side effects, and addiction from opioids are similarly blamed for under-treatment of pain.[17][18]
Terminology
[edit]
Opioids include opiates, an older term that refers to such drugs derived from opium, including morphine itself.[19] Other opioids are semi-synthetic and synthetic drugs such as hydrocodone, oxycodone and fentanyl; antagonist drugs such as naloxone; and endogenous peptides such as endorphins.[20] The terms opiate and narcotic are sometimes encountered as synonyms for opioid. Opiate is properly limited to the natural alkaloids found in the resin of the opium poppy although some include semi-synthetic derivatives.[19][21] Narcotic, derived from words meaning 'numbness' or 'sleep', as an American legal term, refers to cocaine and opioids, and their source materials; it is also loosely applied to any illegal or controlled psychoactive drug.[22][23] In some jurisdictions all controlled drugs are legally classified as narcotics. The term can have pejorative connotations and its use is generally discouraged where that is the case.[24][25]
Medical uses
[edit]Pain
[edit]The weak opioid codeine, in low doses and combined with one or more other drugs, is commonly available in prescription medicines and without a prescription to treat mild pain.[26][27][28] Other opioids are usually reserved for the relief of moderate to severe pain.[27]
Acute pain
[edit]Opioids are effective for the treatment of acute pain (such as pain following surgery).[29] For immediate relief of moderate to severe acute pain, opioids are frequently the treatment of choice due to their rapid onset, efficacy and reduced risk of dependence. However, a new report showed a clear risk of prolonged opioid use when opioid analgesics are initiated for an acute pain management following surgery or trauma.[30] They have also been found to be important in palliative care to help with the severe, chronic, disabling pain that may occur in some terminal conditions such as cancer, and degenerative conditions such as rheumatoid arthritis. In many cases opioids are a successful long-term care strategy for those with chronic cancer pain.
Just over half of all states in the US have enacted laws that restrict the prescribing or dispensing of opioids for acute pain.[31]
Chronic non-cancer pain
[edit]Guidelines have suggested that the risk of opioids is likely greater than their benefits when used for most non-cancer chronic conditions including headaches, back pain, and fibromyalgia.[32] Thus they should be used cautiously in chronic non-cancer pain.[33] If used the benefits and harms should be reassessed at least every three months.[34]
In treating chronic pain, opioids are an option to be tried after other less risky pain relievers have been considered, including paracetamol/acetaminophen or NSAIDs like ibuprofen or naproxen.[35] Some types of chronic pain, including the pain caused by fibromyalgia or migraine, are preferentially treated with drugs other than opioids.[36][37] The efficacy of using opioids to lessen chronic neuropathic pain is uncertain.[38]
Opioids are contraindicated as a first-line treatment for headache because they impair alertness, bring risk of dependence, and increase the risk that episodic headaches will become chronic.[39] Opioids can also cause heightened sensitivity to headache pain.[39] When other treatments fail or are unavailable, opioids may be appropriate for treating headache if the patient can be monitored to prevent the development of chronic headache.[39]
Opioids are being used more frequently in the management of non-malignant chronic pain.[40][41][42] This practice has now led to a new and growing problem with addiction and misuse of opioids.[33][43] Because of various negative effects the use of opioids for long-term management of chronic pain is not indicated unless other less risky pain relievers have been found ineffective. Chronic pain which occurs only periodically, such as that from nerve pain, migraines, and fibromyalgia, frequently is better treated with medications other than opioids.[36] Paracetamol/Tylenol/Acetaminophen and nonsteroidal anti-inflammatory drugs including ibuprofen and naproxen are considered safer alternatives.[44] They are frequently used combined with opioids, such as paracetamol combined with oxycodone (Percocet) and ibuprofen combined with hydrocodone (Vicoprofen), which boosts the pain relief but is also intended to deter recreational use.[45][46]
Other
[edit]Cough
[edit]Codeine was once viewed as the "gold standard" in cough suppressants, but this position is now questioned.[47] Some recent placebo-controlled trials have found that it may be no better than a placebo for some causes including acute cough in children.[48][49] As a consequence, it is not recommended for children.[49] Additionally, there is no evidence that hydrocodone is useful in children.[50] Similarly, a 2012 Dutch guideline regarding the treatment of acute cough does not recommend its use.[51] (The opioid analogue dextromethorphan, long claimed to be as effective a cough suppressant as codeine,[52] has similarly demonstrated little benefit in several recent studies.[53])
Low dose morphine may help chronic cough but its use is limited by side effects.[54]
Diarrhea
[edit]In cases of diarrhea-predominate irritable bowel syndrome, opioids may be used to suppress diarrhea. Loperamide is a peripherally selective opioid available without a prescription used to suppress diarrhea.
The ability to suppress diarrhea also produces constipation when opioids are used beyond several weeks.[55] Naloxegol, a peripherally-selective opioid antagonist is now available to treat opioid induced constipation.[56]
Shortness of breath
[edit]Opioids may help with shortness of breath particularly in advanced diseases such as cancer and COPD among others.[57][58] However, findings from two recent systematic reviews of the literature found that opioids were not necessarily more effective in treating shortness of breath in patients who have advanced cancer.[59][60]
Restless legs syndrome
[edit]Though not typically a first line of treatment, opioids, such as oxycodone and methadone, are sometimes used in the treatment of severe and refractory restless legs syndrome.[61]
Hyperalgesia
Opioid-induced hyperalgesia (OIH) has been evident in patients after chronic opioid exposure.[62][63]
Adverse effects
[edit]Common and short term
Other
- Cognitive effects
- Opioid dependence
- Dizziness
- Loss of appetite
- Delayed gastric emptying
- Decreased sex drive
- Impaired sexual function
- Decreased testosterone levels
- Depression
- Immunodeficiency
- Increased pain sensitivity
- Irregular menstruation
- Increased risk of falls
- Slowed breathing
- Coma
Each year 69,000 people worldwide die of opioid overdose, and 15 million people have an opioid addiction.[65]
In older adults, opioid use is associated with increased adverse effects such as "sedation, nausea, vomiting, constipation, urinary retention, and falls".[66] As a result, older adults taking opioids are at greater risk for injury.[67] Opioids do not cause any specific organ toxicity, unlike many other drugs, such as aspirin and paracetamol. They are not associated with upper gastrointestinal bleeding and kidney toxicity.[68]
Prescription of opioids for acute low back pain and management of osteoarthritis seem to have long-term adverse effects[69][70]
According to the USCDC, methadone was involved in 31% of opioid related deaths in the US between 1999–2010 and 40% as the sole drug involved, far higher than other opioids.[71] Studies of long term opioids have found that many stop them, and that minor side effects were common.[72] Addiction occurred in about 0.3%.[72] In the United States in 2016 opioid overdose resulted in the death of 1.7 in 10,000 people.[73]
Reinforcement disorders
[edit]Tolerance
[edit]Tolerance is a process characterized by neuroadaptations that result in reduced drug effects. While receptor upregulation may often play an important role other mechanisms are also known.[74] Tolerance is more pronounced for some effects than for others; tolerance occurs slowly to the effects on mood, itching, urinary retention, and respiratory depression, but occurs more quickly to the analgesia and other physical side effects. However, tolerance does not develop to constipation or miosis (the constriction of the pupil of the eye to less than or equal to two millimeters). This idea has been challenged, however, with some authors arguing that tolerance does develop to miosis.[75]
Tolerance to opioids is attenuated by a number of substances, including:
- calcium channel blockers[76][77][78]
- intrathecal magnesium[79][80] and zinc[81]
- NMDA antagonists, such as dextromethorphan, ketamine,[82] and memantine.[83]
- cholecystokinin antagonists, such as proglumide[84][85][86]
- Newer agents such as the phosphodiesterase inhibitor ibudilast have also been researched for this application.[87]
Tolerance is a physiologic process where the body adjusts to a medication that is frequently present, usually requiring higher doses of the same medication over time to achieve the same effect. It is a common occurrence in individuals taking high doses of opioids for extended periods, but does not predict any relationship to misuse or addiction.
Physical dependence
[edit]Physical dependence is the physiological adaptation of the body to the presence of a substance, in this case opioid medication. It is defined by the development of withdrawal symptoms when the substance is discontinued, when the dose is reduced abruptly or, specifically in the case of opioids, when an antagonist (e.g., naloxone) or an agonist-antagonist (e.g., pentazocine) is administered. Physical dependence is a normal and expected aspect of certain medications and does not necessarily imply that the patient is addicted.
The withdrawal symptoms for opiates may include severe dysphoria, craving for another opiate dose, irritability, sweating, nausea, rhinorrea, tremor, vomiting and myalgia. Slowly reducing the intake of opioids over days and weeks can reduce or eliminate the withdrawal symptoms.[88] The speed and severity of withdrawal depends on the half-life of the opioid; heroin and morphine withdrawal occur more quickly than methadone withdrawal. The acute withdrawal phase is often followed by a protracted phase of depression and insomnia that can last for months. The symptoms of opioid withdrawal can be treated with other medications, such as clonidine.[89] Physical dependence does not predict drug misuse or true addiction, and is closely related to the same mechanism as tolerance. While there is anecdotal claims of benefit with ibogaine, data to support its use in substance dependence is poor.[90]
Critical patients who received regular doses of opioids experience iatrogenic withdrawal as a frequent syndrome.[91]
Addiction
[edit]Drug addiction is a complex set of behaviors typically associated with misuse of certain drugs, developing over time and with higher drug dosages. Addiction includes psychological compulsion, to the extent that the affected person persists in actions leading to dangerous or unhealthy outcomes. Opioid addiction includes insufflation or injection, rather than taking opioids orally as prescribed for medical reasons.[88]
In European nations such as Austria, Bulgaria, and Slovakia, slow-release oral morphine formulations are used in opiate substitution therapy (OST) for patients who do not well tolerate the side effects of buprenorphine or methadone. Buprenorphine can also be used together with naloxone for a longer treatment of addiction. In other European countries including the UK, this is also legally used for OST although on a varying scale of acceptance.
Slow-release formulations of medications are intended to curb misuse and lower addiction rates while trying to still provide legitimate pain relief and ease of use to pain patients. Questions remain, however, about the efficacy and safety of these types of preparations. Further tamper resistant medications are currently under consideration with trials for market approval by the FDA.[92][93]
The amount of evidence available only permits making a weak conclusion, but it suggests that a physician properly managing opioid use in patients with no history of substance use disorder can give long-term pain relief with little risk of developing addiction, or other serious side effects.[72]
Problems with opioids include the following:
- Some people find that opioids do not relieve all of their pain.[94]
- Some people find that opioids side effects cause problems which outweigh the therapy's benefit.[72]
- Some people build tolerance to opioids over time. This requires them to increase their drug dosage to maintain the benefit, and that in turn also increases the unwanted side effects.[72]
- Long-term opioid use can cause opioid-induced hyperalgesia, which is a condition in which the patient has increased sensitivity to pain.[95]
All of the opioids can cause side effects.[64] Common adverse reactions in patients taking opioids for pain relief include nausea and vomiting, drowsiness, itching, dry mouth, dizziness, and constipation.[64][88]
Nausea and vomiting
[edit]Tolerance to nausea occurs within 7–10 days, during which antiemetics (e.g. low dose haloperidol once at night) are very effective.[citation needed] Due to severe side effects such as tardive dyskinesia, haloperidol is now rarely used. A related drug, prochlorperazine is more often used, although it has similar risks. Stronger antiemetics such as ondansetron or tropisetron are sometimes used when nausea is severe or continuous and disturbing, despite their greater cost. A less expensive alternative is dopamine antagonists such as domperidone and metoclopramide. Domperidone does not cross the blood–brain barrier and produce adverse central antidopaminergic effects, but blocks opioid emetic action in the chemoreceptor trigger zone. This drug is not available in the U.S.
Some antihistamines with anticholinergic properties (e.g. orphenadrine, diphenhydramine) may also be effective. The first-generation antihistamine hydroxyzine is very commonly used, with the added advantages of not causing movement disorders, and also possessing analgesic-sparing properties. Δ9-tetrahydrocannabinol relieves nausea and vomiting;[96][97] it also produces analgesia that may allow lower doses of opioids with reduced nausea and vomiting.[98][99]
- 5-HT3 antagonists (e.g. ondansetron)
- Dopamine antagonists (e.g. domperidone)
- Anti-cholinergic antihistamines (e.g. diphenhydramine)
- Δ9-tetrahydrocannabinol (e.g. dronabinol)
Vomiting is due to gastric stasis (large volume vomiting, brief nausea relieved by vomiting, oesophageal reflux, epigastric fullness, early satiation), besides direct action on the chemoreceptor trigger zone of the area postrema, the vomiting centre of the brain. Vomiting can thus be prevented by prokinetic agents (e.g. domperidone or metoclopramide). If vomiting has already started, these drugs need to be administered by a non-oral route (e.g. subcutaneous for metoclopramide, rectally for domperidone).
- Prokinetic agents (e.g. domperidone)
- Anti-cholinergic agents (e.g. orphenadrine)
Evidence suggests that opioid-inclusive anaesthesia is associated with postoperative nausea and vomiting.[100]
Patients with chronic pain using opioids had small improvements in pain and physically functioning and increased risk of vomiting.[101]
Drowsiness
[edit]Tolerance to drowsiness usually develops over 5–7 days, but if troublesome, switching to an alternative opioid often helps. Certain opioids such as fentanyl, morphine and diamorphine (heroin) tend to be particularly sedating, while others such as oxycodone, tilidine and meperidine (pethidine) tend to produce comparatively less sedation, but individual patients responses can vary markedly and some degree of trial and error may be needed to find the most suitable drug for a particular patient. Otherwise, treatment with CNS stimulants is generally effective.[102][103]
- Stimulants (e.g. caffeine, modafinil, amphetamine, methylphenidate)
Itching
[edit]Itching tends not to be a severe problem when opioids are used for pain relief, but antihistamines are useful for counteracting itching when it occurs. Non-sedating antihistamines such as fexofenadine are often preferred as they avoid increasing opioid induced drowsiness. However, some sedating antihistamines such as orphenadrine can produce a synergistic pain relieving effect permitting smaller doses of opioids be used. Consequently, several opioid/antihistamine combination products have been marketed, such as Meprozine (meperidine/promethazine) and Diconal (dipipanone/cyclizine), and these may also reduce opioid induced nausea.
- Antihistamines (e.g. fexofenadine)
Constipation
[edit]Opioid-induced constipation (OIC) develops in 90 to 95% of people taking opioids long-term.[104] Since tolerance to this problem does not generally develop, most people on long-term opioids need to take a laxative or enemas.[105]
Treatment of OIC is successional and dependent on severity.[106] The first mode of treatment is non-pharmacological, and includes lifestyle modifications like increasing dietary fiber, fluid intake (around 1.5 L (51 US fl oz) per day), and physical activity.[106] If non-pharmacological measures are ineffective, laxatives, including stool softeners (e.g., polyethylene glycol), bulk-forming laxatives (e.g., fiber supplements), stimulant laxatives (e.g., bisacodyl, senna), and/or enemas, may be used.[106] A common laxative regimen for OIC is the combination of docusate and bisacodyl.[106][107][108][needs update] Osmotic laxatives, including lactulose, polyethylene glycol, and milk of magnesia (magnesium hydroxide), as well as mineral oil (a lubricant laxative), are also commonly used for OIC.[107][108]
If laxatives are insufficiently effective (which is often the case),[109] opioid formulations or regimens that include a peripherally-selective opioid antagonist, such as methylnaltrexone bromide, naloxegol, alvimopan, or naloxone (as in oxycodone/naloxone), may be tried.[106][108][110] A 2018 (updated in 2022) Cochrane review found that the evidence was moderate for alvimopan, naloxone, or methylnaltrexone bromide but with increased risk of adverse events.[111] Naloxone by mouth appears to be the most effective.[112] A daily 0.2 mg dose of naldemedine has been shown to significantly improve symptoms in patients with OIC.[113]
Opioid rotation is one method suggested to minimise the impact of constipation in long-term users.[114] While all opioids cause constipation, there are some differences between drugs, with studies suggesting tramadol, tapentadol, methadone and fentanyl may cause relatively less constipation, while with codeine, morphine, oxycodone or hydromorphone constipation may be comparatively more severe.
Respiratory depression
[edit]Respiratory depression is the most serious adverse reaction associated with opioid use, but it usually is seen with the use of a single, intravenous dose in an opioid-naïve patient. In patients taking opioids regularly for pain relief, tolerance to respiratory depression occurs rapidly, so that it is not a clinical problem. Several drugs have been developed which can partially block respiratory depression, although the only respiratory stimulant currently approved for this purpose is doxapram, which has only limited efficacy in this application.[115][116] Newer drugs such as BIMU-8 and CX-546 may be much more effective.[117][118][119][non-primary source needed]
- Respiratory stimulants: carotid chemoreceptor agonists (e.g. doxapram), 5-HT4 agonists (e.g. BIMU8), δ-opioid agonists (e.g. BW373U86) and AMPAkines (e.g. CX717) can all reduce respiratory depression caused by opioids without affecting analgesia, but most of these drugs are only moderately effective or have side effects which preclude use in humans. 5-HT1A agonists such as 8-OH-DPAT and repinotan also counteract opioid-induced respiratory depression, but at the same time reduce analgesia, which limits their usefulness for this application.
- Opioid antagonists (e.g. naloxone, nalmefene, diprenorphine)
The initial 24 hours after opioid administration appear to be the most critical with regard to life-threatening OIRD, but may be preventable with a more cautious approach to opioid use.[120]
Patients with cardiac, respiratory disease and/or obstructive sleep apnoea are at increased risk for OIRD.[121]
Increased pain sensitivity
[edit]Opioid-induced hyperalgesia – where individuals using opioids to relieve pain paradoxically experience more pain as a result of that medication – has been observed in some people. This phenomenon, although uncommon, is seen in some people receiving palliative care, most often when dose is increased rapidly.[122][123] If encountered, rotation between several different opioid pain medications may decrease the development of increased pain.[124][125] Opioid induced hyperalgesia more commonly occurs with chronic use or brief high doses but some research suggests that it may also occur with very low doses.[126][127]
Side effects such as hyperalgesia and allodynia, sometimes accompanied by a worsening of neuropathic pain, may be consequences of long-term treatment with opioid analgesics, especially when increasing tolerance has resulted in loss of efficacy and consequent progressive dose escalation over time. This appears to largely be a result of actions of opioid drugs at targets other than the three classic opioid receptors, including the nociceptin receptor, sigma receptor and Toll-like receptor 4, and can be counteracted in animal models by antagonists at these targets such as J-113,397, BD-1047 or (+)-naloxone respectively.[128] No drugs are currently approved specifically for counteracting opioid-induced hyperalgesia in humans and in severe cases the only solution may be to discontinue use of opioid analgesics and replace them with non-opioid analgesic drugs. However, since individual sensitivity to the development of this side effect is highly dose dependent and may vary depending which opioid analgesic is used, many patients can avoid this side effect simply through dose reduction of the opioid drug (usually accompanied by the addition of a supplemental non-opioid analgesic), rotating between different opioid drugs, or by switching to a milder opioid with a mixed mode of action that also counteracts neuropathic pain, particularly tramadol or tapentadol.[129][130][131]
- NMDA receptor antagonists such as ketamine
- SNRIs such as milnacipran
- Anticonvulsants such as gabapentin or pregabalin
Other adverse effects
[edit]Low sex hormone levels
[edit]Clinical studies have consistently associated medical and recreational opioid use with hypogonadism (low sex hormone levels) in different sexes. The effect is dose-dependent. Most studies suggest that the majority (perhaps as much as 90%) of chronic opioid users develop hypogonadism. A 2015 systematic review and meta-analysis found that opioid therapy suppressed testosterone levels in men by about 165 ng/dL (5.7 nmol/L) on average, which was a reduction in testosterone level of almost 50%.[132] Conversely, opioid therapy did not significantly affect testosterone levels in women.[132] However, opioids can also interfere with menstruation in women by limiting the production of luteinizing hormone (LH). Opioid-induced hypogonadism likely causes the strong association of opioid use with osteoporosis and bone fracture, due to deficiency in estradiol. It also may increase pain and thereby interfere with the intended clinical effect of opioid treatment. Opioid-induced hypogonadism is likely caused by their agonism of opioid receptors in the hypothalamus and the pituitary gland.[133] One study found that the depressed testosterone levels of heroin addicts returned to normal within one month of abstinence, suggesting that the effect is readily reversible and is not permanent.[citation needed] As of 2013[update], the effect of low-dose or acute opioid use on the endocrine system is unclear.[134][135][136][137] Long-term use of opioids can affect the other hormonal systems as well.[134]
Disruption of work
[edit]Use of opioids may be a risk factor for failing to return to work.[138][139]
Persons performing any safety-sensitive task should not use opioids.[140] Health care providers should not recommend that workers who drive or use heavy equipment including cranes or forklifts treat chronic or acute pain with opioids.[140] Workplaces which manage workers who perform safety-sensitive operations should assign workers to less sensitive duties for so long as those workers are treated by their physician with opioids.[140]
People who take opioids long term have increased likelihood of being unemployed.[141] Taking opioids may further disrupt the patient's life and the adverse effects of opioids themselves can become a significant barrier to patients having an active life, gaining employment, and sustaining a career.
In addition, lack of employment may be a predictor of aberrant use of prescription opioids.[142]
Increased accident-proneness
[edit]Opioid use may increase accident-proneness. Opioids may increase risk of traffic accidents[143][144] and accidental falls.[145]
Reduced Attention
Opioids have been shown to reduce attention, more so when used with antidepressants and/or anticonvulsants.[146]
Rare side effects
[edit]Infrequent adverse reactions in patients taking opioids for pain relief include: dose-related respiratory depression (especially with more potent opioids), confusion, hallucinations, delirium, urticaria, hypothermia, bradycardia/tachycardia, orthostatic hypotension, dizziness, headache, urinary retention, ureteric or biliary spasm, muscle rigidity, myoclonus (with high doses), and flushing (due to histamine release, except fentanyl and remifentanil).[88] Both therapeutic and chronic use of opioids can compromise the function of the immune system. Opioids decrease the proliferation of macrophage progenitor cells and lymphocytes, and affect cell differentiation (Roy & Loh, 1996). Opioids may also inhibit leukocyte migration. However the relevance of this in the context of pain relief is not known.
Pregnancy
[edit]Opioid use during pregnancy can have significant implications for both the mother and the developing fetus.
Opioids are a class of drugs that include prescription painkillers (e.g., oxycodone, hydrocodone) and illicit substances like heroin. Opioid use during pregnancy is associated with an increased risk of complications, including an elevated risk of preterm birth, low birth weight, intrauterine growth restriction, and stillbirth. Opioids are substances that can cross the placenta, exposing the developing fetus to the drugs. This exposure can potentially lead to various adverse effects on fetal development, including an increased risk of birth defects. One of the most well-known consequences of maternal opioid use during pregnancy is the risk of neonatal abstinence syndrome (NAS). NAS occurs when the newborn experiences withdrawal symptoms after birth due to exposure to opioids in the womb. Maternal opioid use during pregnancy can also have long-term effects on the child's development. These effects may include cognitive and behavioral problems, as well as an increased risk of substance use disorders later in life.Interactions
[edit]Physicians treating patients using opioids in combination with other drugs keep continual documentation that further treatment is indicated and remain aware of opportunities to adjust treatment if the patient's condition changes to merit less risky therapy.[147]
With other depressant drugs
[edit]The concurrent use of opioids with other depressant drugs such as benzodiazepines or ethanol increases the rates of adverse events and overdose.[147] Despite this, opioids and benzodiazepines are concurrently dispensed in many settings.[148][149] As with an overdose of opioid alone, the combination of an opioid and another depressant may precipitate respiratory depression often leading to death.[150] These risks are lessened with close monitoring by a physician, who may conduct ongoing screening for changes in patient behavior and treatment compliance.[147]
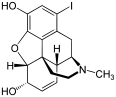
Opioid antagonist
[edit]Opioid effects (adverse or otherwise) can be reversed with an opioid antagonist such as naloxone or naltrexone.[151] These competitive antagonists bind to the opioid receptors with higher affinity than agonists but do not activate the receptors. This displaces the agonist, attenuating or reversing the agonist effects. However, the elimination half-life of naloxone can be shorter than that of the opioid itself, so repeat dosing or continuous infusion may be required, or a longer acting antagonist such as nalmefene may be used. In patients taking opioids regularly it is essential that the opioid is only partially reversed to avoid a severe and distressing reaction of waking in excruciating pain. This is achieved by not giving a full dose but giving this in small doses until the respiratory rate has improved. An infusion is then started to keep the reversal at that level, while maintaining pain relief. Opioid antagonists remain the standard treatment for respiratory depression following opioid overdose, with naloxone being by far the most commonly used, although the longer acting antagonist nalmefene may be used for treating overdoses of long-acting opioids such as methadone, and diprenorphine is used for reversing the effects of extremely potent opioids used in veterinary medicine such as etorphine and carfentanil. However, since opioid antagonists also block the beneficial effects of opioid analgesics, they are generally useful only for treating overdose, with use of opioid antagonists alongside opioid analgesics to reduce side effects, requiring careful dose titration and often being poorly effective at doses low enough to allow analgesia to be maintained.
Naltrexone does not appear to increase risk of serious adverse events, which confirms the safety of oral naltrexone.[152] Mortality or serious adverse events due to rebound toxicity in patients with naloxone were rare.[153]
Pharmacology
[edit]| Drug | Relative Potency [154] |
Nonionized Fraction |
Protein Binding |
Lipid Solubility [155][156][157] |
|---|---|---|---|---|
| Morphine | 1 | ++ | ++ | ++ |
| Pethidine (meperidine) | 0.1 | + | +++ | +++ |
| Hydromorphone | 10 | + | +++ | |
| Alfentanil | 10–25 | ++++ | ++++ | +++ |
| Fentanyl | 50–100[158][159][160] | + | +++ | ++++ |
| Remifentanil | 250[citation needed] | +++ | +++ | ++ |
| Sufentanil | 500–1000 | ++ | ++++ | ++++ |
| Etorphine | 1000–3000 | |||
| Carfentanil | 10000 |
Opioids bind to specific opioid receptors in the nervous system and other tissues. There are three principal classes of opioid receptors, μ, κ, δ (mu, kappa, and delta), although up to seventeen have been reported, and include the ε, ι, λ, and ζ (Epsilon, Iota, Lambda and Zeta) receptors. Conversely, σ (Sigma) receptors are no longer considered to be opioid receptors because their activation is not reversed by the opioid inverse-agonist naloxone, they do not exhibit high-affinity binding for classical opioids, and they are stereoselective for dextro-rotatory isomers while the other opioid receptors are stereo-selective for levo-rotatory isomers. In addition, there are three subtypes of μ-receptor: μ1 and μ2, and the newly discovered μ3. Another receptor of clinical importance is the opioid-receptor-like receptor 1 (ORL1), which is involved in pain responses as well as having a major role in the development of tolerance to μ-opioid agonists used as analgesics. These are all G-protein coupled receptors acting on GABAergic neurotransmission.
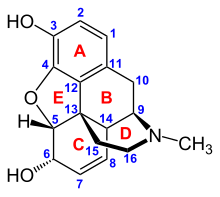
The pharmacodynamic response to an opioid depends upon the receptor to which it binds, its affinity for that receptor, and whether the opioid is an agonist or an antagonist. For example, the supraspinal analgesic properties of the opioid agonist morphine are mediated by activation of the μ1 receptor; respiratory depression and physical dependence by the μ2 receptor; and sedation and spinal analgesia by the κ receptor[citation needed]. Each group of opioid receptors elicits a distinct set of neurological responses, with the receptor subtypes (such as μ1 and μ2 for example) providing even more [measurably] specific responses. Unique to each opioid is its distinct binding affinity to the various classes of opioid receptors (e.g. the μ, κ, and δ opioid receptors are activated at different magnitudes according to the specific receptor binding affinities of the opioid). For example, the opiate alkaloid morphine exhibits high-affinity binding to the μ-opioid receptor, while ketazocine exhibits high affinity to ĸ receptors. It is this combinatorial mechanism that allows for such a wide class of opioids and molecular designs to exist, each with its own unique effect profile. Their individual molecular structure is also responsible for their different duration of action, whereby metabolic breakdown (such as N-dealkylation) is responsible for opioid metabolism.

Functional selectivity
[edit]A new strategy of drug development takes receptor signal transduction into consideration. This strategy strives to increase the activation of desirable signalling pathways while reducing the impact on undesirable pathways. This differential strategy has been given several names, including functional selectivity and biased agonism. The first opioid that was intentionally designed as a biased agonist and placed into clinical evaluation is the drug oliceridine. It displays analgesic activity and reduced adverse effects.[162]
Opioid comparison
[edit]Extensive research has been conducted to determine equivalence ratios comparing the relative potency of opioids. Given a dose of an opioid, an equianalgesic table is used to find the equivalent dosage of another. Such tables are used in opioid rotation practices, and to describe an opioid by comparison to morphine, the reference opioid. Equianalgesic tables typically list drug half-lives, and sometimes equianalgesic doses of the same drug by means of administration, such as morphine: oral and intravenous.
Binding profiles
[edit]Usage
[edit]| Substance | Best estimate |
Low estimate |
High estimate |
|---|---|---|---|
| Amphetamine- type stimulants |
34.16 | 13.42 | 55.24 |
| Cannabis | 192.15 | 165.76 | 234.06 |
| Cocaine | 18.20 | 13.87 | 22.85 |
| Ecstasy | 20.57 | 8.99 | 32.34 |
| Opiates | 19.38 | 13.80 | 26.15 |
| Opioids | 34.26 | 27.01 | 44.54 |
Opioid prescriptions in the US increased from 76 million in 1991 to 207 million in 2013.[185]
In the 1990s, opioid prescribing increased significantly. Once used almost exclusively for the treatment of acute pain or pain due to cancer, opioids are now prescribed liberally for people experiencing chronic pain. This has been accompanied by rising rates of accidental addiction and accidental overdoses leading to death. According to the International Narcotics Control Board, the United States and Canada lead the per capita consumption of prescription opioids.[186] The number of opioid prescriptions per capita in the United States and Canada is double the consumption in the European Union, Australia, and New Zealand.[187] Certain populations have been affected by the opioid addiction crisis more than others, including First World communities[188] and low-income populations.[189] Public health specialists say that this may result from the unavailability or high cost of alternative methods for addressing chronic pain.[190] Opioids have been described as a cost-effective treatment for chronic pain, but the impact of the opioid epidemic and deaths caused by opioid overdoses should be considered in assessing their cost-effectiveness.[191] Data from 2017 suggest that in the U.S. about 3.4 percent of the U.S. population are prescribed opioids for daily pain management.[192] Calls for opioid deprescribing have led to broad scale opioid tapering practices with little scientific evidence to support the safety or benefit for patients with chronic pain.
History
[edit]Naturally occurring opioids
[edit]
Opioids are among the world's oldest known drugs.[193] The earliest known evidence of Papaver somniferum in a human archaeological site dates to the Neolithic period around 5,700–5,500 BCE. Its seeds have been found at Cueva de los Murciélagos in the Iberian Peninsula and La Marmotta in the Italian Peninsula.[194][195][196]
Use of the opium poppy for medical, recreational, and religious purposes can be traced to the fourth century BC, when ideograms on Sumerians clay tablets mention the use of "Hul Gil", a "plant of joy".[197][198][199] Opium was known to the Egyptians, and is mentioned in the Ebers Papyrus as an ingredient in a mixture for the soothing of children,[200][199] and for the treatment of breast abscesses.[201]
Opium was also known to the Greeks.[200] It was valued by Hippocrates (c. 460 – c. 370 BC) and his students for its sleep-inducing properties, and used for the treatment of pain.[202] The Latin saying "Sedare dolorem opus divinum est", trans. "Alleviating pain is the work of the divine", has been variously ascribed to Hippocrates and to Galen of Pergamum.[203] The medical use of opium is later discussed by Pedanius Dioscorides (c. 40 – 90 AD), a Greek physician serving in the Roman army, in his five-volume work, De Materia Medica.[204]
During the Islamic Golden Age, the use of opium was discussed in detail by Avicenna (c. 980 – June 1037 AD) in The Canon of Medicine. The book's five volumes include information on opium's preparation, an array of physical effects, its use to treat a variety of illness, contraindications for its use, its potential danger as a poison and its potential for addiction. Avicenna discouraged opium's use except as a last resort, preferring to address the causes of pain rather than trying to minimize it with analgesics. Many of Avicenna's observations have been supported by modern medical research.[205][200]
Exactly when the world became aware of opium in India and China is uncertain, but opium was mentioned in the Chinese medical work K'ai-pao-pen-tsdo (973 AD)[199] By 1590 AD, opium poppies were a staple spring crop in the Subahs of Agra region.[206]
The physician Paracelsus (c. 1493–1541) is often credited with reintroducing opium into medical use in Western Europe, during the German Renaissance. He extolled opium's benefits for medical use. He also claimed to have an "arcanum", a pill which he called laudanum, that was superior to all others, particularly when death was to be cheated. ("Ich hab' ein Arcanum – heiss' ich Laudanum, ist über das Alles, wo es zum Tode reichen will.")[207] Later writers have asserted that Paracelsus' recipe for laudanum contained opium, but its composition remains unknown.[207]
Laudanum
[edit]The term laudanum was used generically for a useful medicine until the 17th century. After Thomas Sydenham introduced the first liquid tincture of opium, "laudanum" came to mean a mixture of both opium and alcohol.[207] Sydenham's 1669 recipe for laudanum mixed opium with wine, saffron, clove and cinnamon.[208] Sydenham's laudanum was used widely in both Europe and the Americas until the 20th century.[200][208] Other popular medicines, based on opium, included Paregoric, a much milder liquid preparation for children; Black-drop, a stronger preparation; and Dover's powder.[208]
The opium trade
[edit]Opium became a major colonial commodity, moving legally and illegally through trade networks involving India, the Portuguese, the Dutch, the British and China, among others.[209] The British East India Company saw the opium trade as an investment opportunity in 1683 AD.[206] In 1773 the Governor of Bengal established a monopoly on the production of Bengal opium, on behalf of the East India Company. The cultivation and manufacture of Indian opium was further centralized and controlled through a series of acts, between 1797 and 1949.[206][210] The British balanced an economic deficit from the importation of Chinese tea by selling Indian opium which was smuggled into China in defiance of Chinese government bans. This led to the First (1839–1842) and Second Opium Wars (1856–1860) between China and Britain.[211][210][209][212]
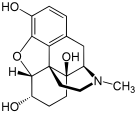
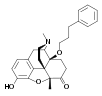
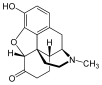
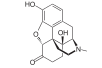
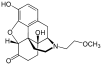
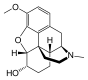
Morphine
[edit]In the 19th century, two major scientific advances were made that had far-reaching effects. Around 1804, German pharmacist Friedrich Sertürner isolated morphine from opium. He described its crystallization, structure, and pharmacological properties in a well-received paper in 1817.[211][213][208][214] Morphine was the first alkaloid to be isolated from any medicinal plant, the beginning of modern scientific drug discovery.[211][215]
The second advance, nearly fifty years later, was the refinement of the hypodermic needle by Alexander Wood and others. Development of a glass syringe with a subcutaneous needle made it possible to easily administer controlled measurable doses of a primary active compound.[216][208][199][217][218]
Morphine was initially hailed as a wonder drug for its ability to ease pain.[219] It could help people sleep,[211] and had other useful side effects, including control of coughing and diarrhea.[220] It was widely prescribed by doctors, and dispensed without restriction by pharmacists. During the American Civil War, opium and laudanum were used extensively to treat soldiers.[221][219] It was also prescribed frequently for women, for menstrual pain and diseases of a "nervous character".[222]: 85 At first it was assumed (wrongly) that this new method of application would not be addictive.[211][222]
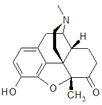
Codeine
[edit]Codeine was discovered in 1832 by Pierre Jean Robiquet. Robiquet was reviewing a method for morphine extraction, described by Scottish chemist William Gregory (1803–1858). Processing the residue left from Gregory's procedure, Robiquet isolated a crystalline substance from the other active components of opium. He wrote of his discovery: "Here is a new substance found in opium ... We know that morphine, which so far has been thought to be the only active principle of opium, does not account for all the effects and for a long time the physiologists are claiming that there is a gap that has to be filled."[223] His discovery of the alkaloid led to the development of a generation of antitussive and antidiarrheal medicines based on codeine.[224]
Semisynthetic and synthetic opioids
[edit]Synthetic opioids were invented, and biological mechanisms for their actions discovered, in the 20th century.[199] Scientists have searched for non-addictive forms of opioids, but have created stronger ones instead. In England Charles Romley Alder Wright developed hundreds of opiate compounds in his search for a nonaddictive opium derivative. In 1874 he became the first person to synthesize diamorphine (heroin), using a process called acetylation which involved boiling morphine with acetic anhydride for several hours.[211]
Heroin received little attention until it was independently synthesized by Felix Hoffmann (1868–1946), working for Heinrich Dreser (1860–1924) at Bayer Laboratories.[225] Dreser brought the new drug to market as an analgesic and a cough treatment for tuberculosis, bronchitis, and asthma in 1898. Bayer ceased production in 1913, after heroin's addictive potential was recognized.[211][226][227]
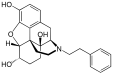
Several semi-synthetic opioids were developed in Germany in the 1910s. The first, oxymorphone, was synthesized from thebaine, an opioid alkaloid in opium poppies, in 1914.[228] Next, Martin Freund and Edmund Speyer developed oxycodone, also from thebaine, at the University of Frankfurt in 1916.[229] In 1920, hydrocodone was prepared by Carl Mannich and Helene Löwenheim, deriving it from codeine. In 1924, hydromorphone was synthesized by adding hydrogen to morphine. Etorphine was synthesized in 1960, from the oripavine in opium poppy straw. Buprenorphine was discovered in 1972.[228]
The first fully synthetic opioid was meperidine (later demerol), found serendipitously by German chemist Otto Eisleb (or Eislib) at IG Farben in 1932.[228] Meperidine was the first opiate to have a structure unrelated to morphine, but with opiate-like properties.[199] Its analgesic effects were discovered by Otto Schaumann in 1939.[228] Gustav Ehrhart and Max Bockmühl, also at IG Farben, built on the work of Eisleb and Schaumann. They developed "Hoechst 10820" (later methadone) around 1937.[230] In 1959 the Belgian physician Paul Janssen developed fentanyl, a synthetic drug with 30 to 50 times the potency of heroin.[211][231] Nearly 150 synthetic opioids are now known.[228]
Criminalization and medical use
[edit]Non-clinical use of opium was criminalized in the United States by the Harrison Narcotics Tax Act of 1914, and by many other laws.[232][233] The use of opioids was stigmatized, and it was seen as a dangerous substance, to be prescribed only as a last resort for dying patients.[211] The Controlled Substances Act of 1970 eventually relaxed the harshness of the Harrison Act.[citation needed]
In the United Kingdom the 1926 report of the Departmental Committee on Morphine and Heroin Addiction under the Chairmanship of the President of the Royal College of Physicians reasserted medical control and established the "British system" of control—which lasted until the 1960s.[234]
In the 1980s the World Health Organization published guidelines for prescribing drugs, including opioids, for different levels of pain. In the U.S., Kathleen Foley and Russell Portenoy became leading advocates for the liberal use of opioids as painkillers for cases of "intractable non-malignant pain".[235][236] With little or no scientific evidence to support their claims, industry scientists and advocates suggested that people with chronic pain would be resistant to addiction.[211][237][235]
The release of OxyContin in 1996 was accompanied by an aggressive marketing campaign promoting the use of opioids for pain relief. Increasing prescription of opioids fueled a growing black market for heroin. Between 2000 and 2014 there was an "alarming increase in heroin use across the country and an epidemic of drug overdose deaths".[237][211][238]
As a result, health care organizations and public health groups, such as Physicians for Responsible Opioid Prescribing, have called for decreases in the prescription of opioids.[237] In 2016, the Centers for Disease Control and Prevention (CDC) issued a new set of guidelines for the prescription of opioids "for chronic pain outside of active cancer treatment, palliative care, and end-of-life care" and the increase of opioid tapering.[239]
"Remove the Risk"
[edit]In April 2019 the U.S. Food and Drug Administration announced the launch of a new education campaign to help Americans understand the important role they play in removing and properly disposing of unused prescription opioids from their homes. This new initiative is part of the FDA's continued efforts to address the nationwide opioid crisis (see below) and aims to help decrease unnecessary exposure to opioids and prevent new addiction. The "Remove the Risk" campaign is targeting women ages 35–64, who are most likely to oversee household health care decisions and often serve as the gatekeepers to opioids and other prescription medications in the home.[240]
Society and culture
[edit]Definition
[edit]The term "opioid" originated in the 1950s.[241] It combines "opium" + "-oid" meaning "opiate-like" ("opiates" being morphine and similar drugs derived from opium). The first scientific publication to use it, in 1963, included a footnote stating, "In this paper, the term, 'opioid', is used in the sense originally proposed by George H. Acheson (personal communication) to refer to any chemical compound with morphine-like activities".[242] By the late 1960s, research found that opiate effects are mediated by activation of specific molecular receptors in the nervous system, which were termed "opioid receptors".[243] The definition of "opioid" was later refined to refer to substances that have morphine-like activities that are mediated by the activation of opioid receptors. One modern pharmacology textbook states: "the term opioid applies to all agonists and antagonists with morphine-like activity, and also the naturally occurring and synthetic opioid peptides".[244] Another pharmacology reference eliminates the morphine-like requirement: "Opioid, a more modern term, is used to designate all substances, both natural and synthetic, that bind to opioid receptors (including antagonists)".[2] Some sources define the term opioid to exclude opiates, and others use opiate comprehensively instead of opioid, but opioid used inclusively is considered modern, preferred and is in wide use.[19]
Efforts to reduce recreational use in the US
[edit]In 2011, the Obama administration released a white paper describing the administration's plan to deal with the opioid crisis. The administration's concerns about addiction and accidental overdosing have been echoed by numerous other medical and government advisory groups around the world.[190][245][246][247]
As of 2015, prescription drug monitoring programs exist in every state, except for Missouri.[248] These programs allow pharmacists and prescribers to access patients' prescription histories in order to identify suspicious use. However, a survey of US physicians published in 2015 found that only 53% of doctors used these programs, while 22% were not aware that the programs were available to them.[249] The Centers for Disease Control and Prevention was tasked with establishing and publishing a new guideline, and was heavily lobbied.[250] In 2016, the United States Centers for Disease Control and Prevention published its Guideline for Prescribing Opioids for Chronic Pain, recommending that opioids only be used when benefits for pain and function are expected to outweigh risks, and then used at the lowest effective dosage, with avoidance of concurrent opioid and benzodiazepine use whenever possible.[34] Research suggests that the prescription of high doses of opioids related to chronic opioid therapy (COT) can at times be prevented through state legislative guidelines and efforts by health plans that devote resources and establish shared expectations for reducing higher doses.[251]
On 10 August 2017, Donald Trump declared the opioid crisis a (non-FEMA) national public health emergency.[252]
Global shortages
[edit]Morphine and other poppy-based medicines have been identified by the World Health Organization as essential in the treatment of severe pain. As of 2002, seven countries (USA, UK, Italy, Australia, France, Spain and Japan) use 77% of the world's morphine supplies, leaving many emerging countries lacking in pain relief medication.[253] The current system of supply of raw poppy materials to make poppy-based medicines is regulated by the International Narcotics Control Board under the provision of the 1961 Single Convention on Narcotic Drugs. The amount of raw poppy materials that each country can demand annually based on these provisions must correspond to an estimate of the country's needs taken from the national consumption within the preceding two years. In many countries, underprescription of morphine is rampant because of the high prices and the lack of training in the prescription of poppy-based drugs. The World Health Organization is now working with administrations from various countries to train healthworkers and to develop national regulations regarding drug prescription to facilitate a greater prescription of poppy-based medicines.[254]
Another idea to increase morphine availability is proposed by the Senlis Council, who suggest, through their proposal for Afghan Morphine, that Afghanistan could provide cheap pain relief solutions to emerging countries as part of a second-tier system of supply that would complement the current INCB regulated system by maintaining the balance and closed system that it establishes while providing finished product morphine to those in severe pain and unable to access poppy-based drugs under the current system.
Recreational use
[edit]
Opioids can produce strong feelings of euphoria[255] and are frequently used recreationally. Traditionally associated with illicit opioids such as heroin, prescription opioids are misused recreationally.
Drug misuse and non-medical use include the use of drugs for reasons or at doses other than prescribed. Opioid misuse can also include providing medications to persons for whom it was not prescribed. Such diversion may be treated as crimes, punishable by imprisonment in many countries.[256][257] In 2014, almost 2 million Americans abused or were dependent on prescription opioids.[258][259]
Classification
[edit]There are a number of broad classes of opioids:[260]
- Natural opiates: alkaloids contained in the resin of the opium poppy, primarily morphine, codeine, and thebaine, but not papaverine and noscapine which have a different mechanism of action
- Esters of morphine opiates: slightly chemically altered but more natural than the semi-synthetics, as most are morphine prodrugs, diacetylmorphine (morphine diacetate; heroin), nicomorphine (morphine dinicotinate), dipropanoylmorphine (morphine dipropionate), desomorphine, acetylpropionylmorphine, dibenzoylmorphine, diacetyldihydromorphine;[261][262]
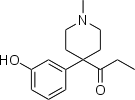
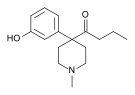
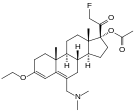
- Semi-synthetic opioids: created from either the natural opiates or morphine esters, such as hydromorphone, hydrocodone, oxycodone, oxymorphone, ethylmorphine and buprenorphine;
- Fully synthetic opioids: such as fentanyl, pethidine, levorphanol, methadone, tramadol, tapentadol, and dextropropoxyphene;
- Endogenous opioid peptides, produced naturally in the body, such as endorphins, enkephalins, dynorphins, and endomorphins.
- Endogenous opioids, non-peptide: Morphine, and some other opioids, which are produced in small amounts in the body, are included in this category.
- Natural opioids, non-animal, non-opiate: the leaves from Mitragyna speciosa (kratom) contain a few naturally-occurring opioids, active via Mu- and Delta receptors. Salvinorin A, found naturally in the Salvia divinorum plant, is a kappa-opioid receptor agonist.[263]
Tramadol and tapentadol, which act as monoamine uptake inhibitors also act as mild and potent agonists (respectively) of the μ-opioid receptor.[264] Both drugs produce analgesia even when naloxone, an opioid antagonist, is administered.[265]
Some minor opium alkaloids and various substances with opioid action are also found elsewhere, including molecules present in kratom, Corydalis, and Salvia divinorum plants and some species of poppy aside from Papaver somniferum. There are also strains which produce copious amounts of thebaine, an important raw material for making many semi-synthetic and synthetic opioids. Of all of the more than 120 poppy species, only two produce morphine.
Amongst analgesics there are a small number of agents which act on the central nervous system but not on the opioid receptor system and therefore have none of the other (narcotic) qualities of opioids although they may produce euphoria by relieving pain—a euphoria that, because of the way it is produced, does not form the basis of habituation, physical dependence, or addiction. Foremost amongst these are nefopam, orphenadrine, and perhaps phenyltoloxamine or some other antihistamines. Tricyclic antidepressants have painkilling effect as well, but they're thought to do so by indirectly activating the endogenous opioid system. Paracetamol is predominantly a centrally acting analgesic (non-narcotic) which mediates its effect by action on descending serotoninergic (5-hydroxy triptaminergic) pathways, to increase 5-HT release (which inhibits release of pain mediators). It also decreases cyclo-oxygenase activity. It has recently been discovered that most or all of the therapeutic efficacy of paracetamol is due to a metabolite, AM404, which enhances the release of serotonin and inhibits the uptake of anandamide.[citation needed]
Other analgesics work peripherally (i.e., not on the brain or spinal cord). Research is starting to show that morphine and related drugs may indeed have peripheral effects as well, such as morphine gel working on burns. Recent investigations discovered opioid receptors on peripheral sensory neurons.[266] A significant fraction (up to 60%) of opioid analgesia can be mediated by such peripheral opioid receptors, particularly in inflammatory conditions such as arthritis, traumatic or surgical pain.[267] Inflammatory pain is also blunted by endogenous opioid peptides activating peripheral opioid receptors.[268]
It was discovered in 1953,[citation needed] that humans and some animals naturally produce minute amounts of morphine, codeine, and possibly some of their simpler derivatives like heroin and dihydromorphine, in addition to endogenous opioid peptides. Some bacteria are capable of producing some semi-synthetic opioids such as hydromorphone and hydrocodone when living in a solution containing morphine or codeine respectively.
Many of the alkaloids and other derivatives of the opium poppy are not opioids or narcotics; the best example is the smooth-muscle relaxant papaverine. Noscapine is a marginal case as it does have CNS effects but not necessarily similar to morphine, and it is probably in a category all its own.
Dextromethorphan (the stereoisomer of levomethorphan, a semi-synthetic opioid agonist) and its metabolite dextrorphan have no opioid analgesic effect at all despite their structural similarity to other opioids; instead they are potent NMDA antagonists and sigma 1 and 2-receptor agonists and are used in many over-the-counter cough suppressants.
Salvinorin A is a unique selective, powerful ĸ-opioid receptor agonist. It is not properly considered an opioid nevertheless, because:
- chemically, it is not an alkaloid; and
- it has no typical opioid properties: absolutely no anxiolytic or cough-suppressant effects. It is instead a powerful hallucinogen.
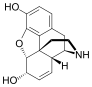
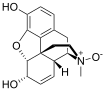
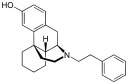
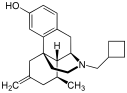
| Opioid peptides | Skeletal molecular images |
|---|---|
| Adrenorphin | 
|
| Amidorphin | 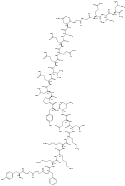
|
| Casomorphin | |
| DADLE | |
| DAMGO | 
|
| Dermorphin | |
| Endomorphin | 
|
| Morphiceptin | 
|
| Nociceptin | 
|
| Octreotide | 
|
| Opiorphin | 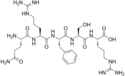
|
| TRIMU 5 | 
|
Endogenous opioids
[edit]Opioid-peptides that are produced in the body include:
β-endorphin is expressed in Pro-opiomelanocortin (POMC) cells in the arcuate nucleus, in the brainstem and in immune cells, and acts through μ-opioid receptors. β-endorphin has many effects, including on sexual behavior and appetite. β-endorphin is also secreted into the circulation from pituitary corticotropes and melanotropes. α-neoendorphin is also expressed in POMC cells in the arcuate nucleus.
Met-enkephalin is widely distributed in the CNS and in immune cells; [met]-enkephalin is a product of the proenkephalin gene, and acts through μ and δ-opioid receptors. leu-enkephalin, also a product of the proenkephalin gene, acts through δ-opioid receptors.
Dynorphin acts through κ-opioid receptors, and is widely distributed in the CNS, including in the spinal cord and hypothalamus, including in particular the arcuate nucleus and in both oxytocin and vasopressin neurons in the supraoptic nucleus.
Endomorphin acts through μ-opioid receptors, and is more potent than other endogenous opioids at these receptors.
Opium alkaloids and derivatives
[edit]Opium alkaloids
[edit]Phenanthrenes naturally occurring in (opium):
Preparations of mixed opium alkaloids, including papaveretum, are still occasionally used.
Esters of morphine
[edit]- Diacetylmorphine (morphine diacetate; heroin)
- Nicomorphine (morphine dinicotinate)
- Dipropanoylmorphine (morphine dipropionate)
- Diacetyldihydromorphine
- Acetylpropionylmorphine
- Desomorphine
- Methyldesorphine
- Dibenzoylmorphine
Ethers of morphine
[edit]Semi-synthetic alkaloid derivatives
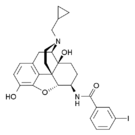
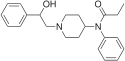
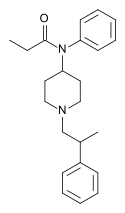
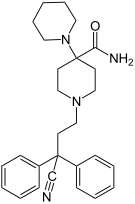
[edit]- Buprenorphine
- Etorphine
- Hydrocodone
- Hydromorphone
- Oxycodone (sold as OxyContin)
- Oxymorphone
Synthetic opioids
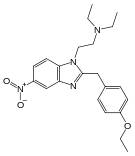
[edit]Anilidopiperidines
[edit]Benzimidazoles
[edit]Benzimidazoles opioids are also known as nitazenes.
- Metodesnitazene (Metazene)
- Etodesnitazene (Etazene)
- Metonitazene
- Etonitazene
- Etonitazepyne
- Etonitazepipne
- Isotonitazene
- Clonitazene
Phenylpiperidines
[edit]- Pethidine (meperidine)
- Ketobemidone
- MPPP
- Allylprodine
- Prodine
- PEPAP
- Promedol
Diphenylpropylamine derivatives
[edit]- Propoxyphene
- Dextropropoxyphene
- Dextromoramide
- Bezitramide
- Piritramide
- Methadone
- Dipipanone
- Levomethadyl acetate (LAAM)
- Difenoxin
- Diphenoxylate
- Loperamide (does cross the blood–brain barrier but is quickly pumped into the non-central nervous system by P-Glycoprotein. Mild opiate withdrawal in animal models exhibits this action after sustained and prolonged use including rhesus monkeys, mice, and rats.)
Benzomorphan derivatives
[edit]- Dezocine—agonist/antagonist
- Pentazocine—agonist/antagonist
- Phenazocine
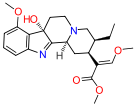
Oripavine derivatives
[edit]- Buprenorphine—partial agonist
- Dihydroetorphine
- Etorphine
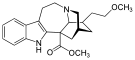
Morphinan derivatives
[edit]- Butorphanol—agonist/antagonist
- Nalbuphine—agonist/antagonist
- Levorphanol
- Levomethorphan
- Racemethorphan
Others
[edit]Allosteric modulators
[edit]Plain allosteric modulators do not belong to the opioids, instead they are classified as opioidergics.
- Nalmefene
- Naloxone
- Naltrexone
- Methylnaltrexone (Methylnaltrexone is only peripherally active as it does not cross the blood–brain barrier in sufficient quantities to be centrally active. As such, it can be considered the antithesis of loperamide.)
- Naloxegol (Naloxegol is only peripherally active as it does not cross the blood–brain barrier in sufficient quantities to be centrally active. As such, it can be considered the antitheses of loperamide.)
Tables of opioids
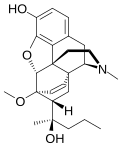
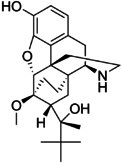
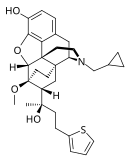
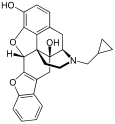
[edit]Table of morphinan opioids
[edit]| Table of morphinan opioids: click to |
|---|
Table of non-morphinan opioids
[edit]| Table of non-morphinan opioids: click to |
|---|
See also
[edit]References
[edit]- ^ Ogura T, Egan TD (2013). "Chapter 15 – Opioid Agonists and Antagonists". Pharmacology and physiology for anesthesia : foundations and clinical application. Philadelphia, PA: Elsevier/Saunders. ISBN 978-1-4377-1679-5. Archived from the original on 26 March 2019. Retrieved 19 July 2017.
- ^ Jump up to: a b Hemmings HC, Egan TD (2013). Pharmacology and Physiology for Anesthesia: Foundations and Clinical Application: Expert Consult – Online and Print. Elsevier Health Sciences. p. 253. ISBN 978-1-4377-1679-5.
Opiate is the older term classically used in pharmacology to mean a drug derived from opium. Opioid, a more modern term, is used to designate all substances, both natural and synthetic, that bind to opioid receptors (including antagonists).
- ^ "Opioids". www.hopkinsmedicine.org. 11 May 2023. Archived from the original on 2 November 2023. Retrieved 2 November 2023.
- ^ "Alcohol and Drug Policy Commission : Opiates or Opioids — What's the difference? : State of Oregon". www.oregon.gov. Archived from the original on 2 November 2023. Retrieved 2 November 2023.
- ^ Jump up to: a b Stromgaard K, Krogsgaard-Larsen P, Madsen U (2009). Textbook of Drug Design and Discovery, Fourth Edition. CRC Press. ISBN 978-1-4398-8240-5.
- ^ Walzer C (2014). "52 Nondomestic Equids". In West G, Heard D, Caulkett N (eds.). Zoo Animal and Wildlife Immobilization and Anesthesia. Vol. 51 (2nd ed.). Ames, USA: John Wiley & Sons. pp. 723, 727. doi:10.1002/9781118792919. ISBN 978-1-118-79291-9. PMC 2871358. Retrieved 8 July 2019.
{{cite book}}:|journal=ignored (help) - ^ "Carfentanil". www.drugbank.ca. Archived from the original on 6 August 2020. Retrieved 8 July 2019.
- ^ Sterken J, Troubleyn J, Gasthuys F, Maes V, Diltoer M, Verborgh C (October 2004). "Intentional overdose of Large Animal Immobilon". European Journal of Emergency Medicine. 11 (5): 298–301. doi:10.1097/00063110-200410000-00013. PMID 15359207.
- ^ Lembke A (2016). Drug Dealer, MD: How Doctors Were Duped, Patients Got Hooked, and Why It's So Hard to Stop. Johns Hopkins University Press. ISBN 978-1-4214-2140-7.
- ^ "Drug Facts: Prescription Opioids". NIDA. June 2019. Archived from the original on 12 June 2019. Retrieved 5 July 2019.
- ^ "FDA requires strong warnings for opioid analgesics, prescription opioid cough products, and benzodiazepine labeling related to serious risks and death from combined use". FDA. 31 August 2016. Archived from the original on 23 April 2019. Retrieved 1 September 2016.
- ^ "Status and Trend Analysis of Illict [sic] Drug Markets" (PDF). World Drug Report 2015. Archived (PDF) from the original on 27 June 2015. Retrieved 26 June 2015.
- ^ "Report III: FDA Approved Medications for the Treatment of Opiate Dependence: Literature Reviews on Effectiveness & Cost- Effectiveness, Treatment Research Institute". Advancing Access to Addiction Medications: Implications for Opioid Addiction Treatment. p. 41. Archived from the original on 24 February 2021. Retrieved 14 February 2016.
- ^ Tetrault JM, Butner JL (September 2015). "Non-Medical Prescription Opioid Use and Prescription Opioid Use Disorder: A Review". The Yale Journal of Biology and Medicine. 88 (3): 227–33. PMC 4553642. PMID 26339205.
- ^ Tarabar AF, Nelson LS (April 2003). "The resurgence and abuse of heroin by children in the United States". Current Opinion in Pediatrics. 15 (2): 210–5. doi:10.1097/00008480-200304000-00013. PMID 12640281. S2CID 21900231.
- ^ Gray E (4 February 2014). "Heroin Gains Popularity as Cheap Doses Flood the U.S". TIME.com. Archived from the original on 2 December 2020. Retrieved 12 February 2016.
- ^ Maltoni M (January 2008). "Opioids, pain, and fear". Annals of Oncology. 19 (1): 5–7. doi:10.1093/annonc/mdm555. PMID 18073220. Archived from the original on 10 September 2015. Retrieved 14 February 2016.
[A] number of studies, however, have also reported inadequate pain control in 40%–70% of patients, resulting in the emergence of a new type of epidemiology, that of 'failed pain control', caused by a series of obstacles preventing adequate cancer pain management.... The cancer patient runs the risk of becoming an innocent victim of a war waged against opioid abuse and addiction if the norms regarding the two kinds of use (therapeutic or nontherapeutic) are not clearly distinct. Furthermore, health professionals may be worried about regulatory scrutiny and may opt not to use opioid therapy for this reason.
- ^ McCarberg BH (March 2011). "Pain management in primary care: strategies to mitigate opioid misuse, abuse, and diversion". Postgraduate Medicine. 123 (2): 119–30. doi:10.3810/pgm.2011.03.2270. PMID 21474900. S2CID 25935364.
- ^ Jump up to: a b c Offermanns S (2008). Encyclopedia of Molecular Pharmacology. Vol. 1 (2 ed.). Springer Science & Business Media. p. 903. ISBN 978-3-540-38916-3.
In the strict sense, opiates are drugs derived from opium and include the natural products morphine, codeine, thebaine and many semi-synthetic congeners derived from them. In the wider sense, opiates are morphine-like drugs with non-peptidic structures. The older term opiates is now more and more replaced by the term opioids which applies to any substance, whether endogenous or synthetic, peptidic or non-peptidic, that produces morphine-like effects through action on opioid receptors.
- ^ Freye E (2008). "Part II. Mechanism of action of opioids and clinical effects". Opioids in Medicine: A Comprehensive Review on the Mode of Action and the Use of Analgesics in Different Clinical Pain States. Springer Science & Business Media. p. 85. ISBN 978-1-4020-5947-6.
Opiate is a specific term that is used to describe drugs (natural and semi-synthetic) derived from the juice of the opium poppy. For example morphine is an opiate but methadone (a completely synthetic drug) is not. Opioid is a general term that includes naturally occurring, semi-synthetic, and synthetic drugs, which produce their effects by combining with opioid receptors and are competitively antagonized by nalaxone. In this context the term opioid refers to opioid agonists, opioid antagonists, opioid peptides, and opioid receptors.
- ^ Davies PS, D'Arcy YM (26 September 2012). Compact Clinical Guide to Cancer Pain Management: An Evidence-Based Approach for Nurses. Springer Publishing Company. ISBN 978-0-8261-0974-3.
- ^ "21 U.S. Code § 802 – Definitions". LII / Legal Information Institute. Archived from the original on 25 January 2021. Retrieved 12 February 2016.
- ^ "Definition of NARCOTIC". www.merriam-webster.com. Archived from the original on 14 November 2020. Retrieved 12 February 2016.
- ^ Сатоскар Р.С., Реге Н., Бхандаркар С.Д. (2015). Фармакология и фармакотерапевтическая . Elsevier Health Sciences. ISBN 978-81-312-4371-8 .
- ^ Эберт М.Х., Кернс Р.Д. (2010). Поведенческое и психофармакологическое лечение боли . Издательство Кембриджского университета. ISBN 978-1-139-49354-3 .
- ^ Мур Р.А., Виффен П.Дж., Дерри С., Магуайр Т., Рой Ю.М., Тиррелл Л. (ноябрь 2015). «Непрерывные (OTC) пероральные анальгетики для острой боли - обзор кокрановских обзоров» . Кокрановская база данных систематических обзоров . 11 (11): CD010794. doi : 10.1002/14651858.cd010794.pub2 . PMC 6485506 . PMID 26544675 .
- ^ Jump up to: а беременный Fleisher GR, Ludwig S (2010). Учебник педиатрической неотложной медицины . Липпинкотт Уильямс и Уилкинс. п. 61. ISBN 978-1-60547-159-4 .
- ^ "Кодеин" . Drugs.com. 15 мая 2022 года. Архивировано из оригинала 16 июля 2017 года . Получено 31 января 2023 года .
- ^ Александр GC, Krussewski SP, Webster DW (ноябрь 2012 г.). «Переосмысление опиоидов назначения для защиты безопасности пациентов и здравоохранения». Джама . 308 (18): 1865–6. doi : 10.1001/Jama.2012.14282 . PMID 23150006 .
- ^ Мохамади А., Чан Дж.Дж., Лиан Дж., Райт К.Л., Марин А.М., Родригес Е.К. и др. (Август 2018). «Факторы риска и объединенная частота длительного употребления опиоидов после травмы или хирургии: систематический обзор и мета- (регрессия)». Журнал хирургии костей и суставов. Американский том . 100 (15): 1332–1340. doi : 10.2106/jbjs.17.01239 . PMID 30063596 . S2CID 51891341 .
- ^ Дэвис К.С., Либерман А.Дж., Эрнандес-дельгадо Х, Суба С (1 января 2019 г.). «Законы, ограничивающие назначение или распределение опиоидов на острую боль в Соединенных Штатах: национальный систематический юридический обзор». Наркотики и алкогольная зависимость . 194 : 166–172. doi : 10.1016/j.drugalcdep.2018.09.022 . ISSN 1879-0046 . PMID 30445274 . S2CID 53567522 .
- ^ Франклин GM (сентябрь 2014 г.). «Опиоиды на хроническую нераковую боль: позиционный документ Американской академии неврологии» . Неврология . 83 (14): 1277–84. doi : 10.1212/wnl.0000000000000839 . PMID 25267983 .
- ^ Jump up to: а беременный Okie S (ноябрь 2010). «Поток опиоидов, восходящий прилив смерти» . Новая Англия Журнал медицины . 363 (21): 1981–5. doi : 10.1056/nejmp1011512 . PMID 21083382 . S2CID 7092234 .
Ответы на перспективу Оки: Rich JD, Green TC, McKenzie MS (февраль 2011 г.). «Опиоиды и смерти» . Новая Англия Журнал медицины . 364 (7): 686–687. doi : 10.1056/nejmc1014490 . PMC 10347760 . PMID 21323559 . - ^ Jump up to: а беременный Dowell D, Haegerich TM, Chou R (апрель 2016 г.). «Руководство CDC для назначения опиоидов на хроническую боль-United States, 2016» . Джама . 315 (15): 1624–45. doi : 10.1001/Jama.2016.1464 . PMC 6390846 . PMID 26977696 .
- ^ Ян Дж, Бауэр Б.А., Вахнер-Родлер Д.Л., Чон Тай, Сяо Л (17 февраля 2020 года). «Модифицированная, кто анальгетическая лестница: подходит ли это для хронической неразовой боли?» Полем Журнал исследований боли . 13 : 411–417. doi : 10.2147/jpr.s244173 . PMC 7038776 . PMID 32110089 .
- ^ Jump up to: а беременный Для получения информации об использовании и чрезмерном использовании опиоидов для лечения мигрени, см. Американская академия неврологии (февраль 2013 г.), «Пять вещей, которые врачи и пациенты должны подвергать сомнению» , выбирая мудро : инициатива Фонда Абим , Американской академии неврологии, архивировав из оригинала 1 сентября 2013 года , полученная августа 2013 1
- Silberstein SD (сентябрь 2000 г.). «Параметр практики: основанные на фактических данных руководящие принципы для головной боли мигрени (обзор, основанный на фактических данных): отчет подкомитета по стандартам качества Американской академии неврологии» . Неврология . 55 (6): 754–62. doi : 10.1212/wnl.55.6.754 . PMID 10993991 .
- Evers S, Afra J, Frese A, Goadsby PJ, Linde M, May A, et al. (Сентябрь 2009 г.). «Руководство EFNS по лечению медикаментозного лечения мигрени-отчет о целевой группе EFNS» . Европейский журнал неврологии . 16 (9): 968–81. doi : 10.1111/j.1468-1331.2009.02748.x . PMID 19708964 . S2CID 9204782 .
- Институт улучшения клинических систем (2011 г.), головная боль, диагностика и лечение , Институт улучшения клинических систем, архивировав с оригинала 29 октября 2013 года , извлечен 18 декабря 2013 г.
- ^ Художник JT, Crofford LJ (март 2013 г.). «Хроническое употребление опиоидов при синдроме фибромиалгии: клинический обзор». Журнал клинической ревматологии . 19 (2): 72–7. doi : 10.1097/rhu.0b013e3182863447 . PMID 23364665 .
- ^ McNicol ED, Midbari A, Eisenberg E (август 2013 г.). «Опиоиды на невропатическую боль» . Кокрановская база данных систематических обзоров . 8 (8): CD006146. doi : 10.1002/14651858.cd006146.pub2 . PMC 6353125 . PMID 23986501 .
- ^ Jump up to: а беременный в Американское общество головной боли (сентябрь 2013 г.), «Пять вещей, которые врачи и пациенты должны подвергать сомнению» , выбирая мудрое : инициатива Фонда Абим , Американское общество головной боли , архивируемое из оригинала 3 декабря 2013 года , получена 10 декабря 2013 года , которое цитирует
- Bigal Me, Lipton RB (апрель 2009 г.). «Чрезмерное использование опиоидов и развитие хронической мигрени». Боль . 142 (3): 179–82. doi : 10.1016/j.pain.2009.01.013 . PMID 19232469 . S2CID 27949021 .
- Bigal Me, Serrano D, Buse D, Scher A, Stewart WF, Lipton RB (сентябрь 2008 г.). «Острые лекарства от мигрени и эволюция от эпизодической к хронической мигрени: продольное население» . Головная боль . 48 (8): 1157–68. doi : 10.1111/j.1526-4610.2008.01217.x . PMID 18808500 .
- Scher AI, Stewart WF, Ricci JA, Lipton RB (ноябрь 2003 г.). «Факторы, связанные с появлением и ремиссией хронической ежедневной головной боли в популяционном исследовании» . Боль . 106 (1–2): 81–9. doi : 10.1016/s0304-3959 (03) 00293-8 . PMID 14581114 . S2CID 29000302 .
- Katsarava Z, Schneeweass S, Kurth T, Kroener U, Fritche G, Eikermann A, et al. (Март 2004 г.). «Заболеваемость и предикторы хроничности головной боли у пациентов с эпизодической мигрени». Неврология . 62 (5): 788–90. doi : 10.1212/01.wnl.0000113747.18760.d2 . PMID 15007133 . S2CID 20759425 .
- ^ Manchikanti L, Helm S, Fellows B, Janata JW, Pampati V, Grider JS и др. (Июль 2012 г.). «Эпидемия опиоидов в Соединенных Штатах» . Обезболивающий врач . 15 (3 Suppl): ES9-38. doi : 10.36076/ppj.2012/15/es9 . PMID 22786464 .
- ^ Chou R, Ballantyne JC, Fanciullo GJ, Fine PG, Miaskowski C (февраль 2009 г.). «Исследования пробелов по использованию опиоидов при хронической нераковой боли: результаты обзора доказательств Американского общества боли и Американской академии обезболивающей медицины Клинической практики» . Журнал боли . 10 (2): 147–59. doi : 10.1016/j.jpain.2008.10.007 . PMID 19187891 .
- ^ "БОЛЬ" . Painjournalonline.com. 1 сентября 2015 года. Архивировано с оригинала 6 августа 2020 года . Получено 7 января 2016 года .
- ^ Kissin I (28 сентября 2015 г.). «Долгосрочное опиоидное лечение хронической незлокачественной боли: недоказанная эффективность и пренебрежение безопасности?» Полем Журнал исследований боли . 6 : 513–29. doi : 10.2147/jpr.s47182 . PMC 3712997 . PMID 23874119 .
- ^ Dhalla IA, Gomes T, Mamdani MM, Juurlink DN (январь 2012 г.). «Опиоиды в сравнении с нестероидными противовоспалительными препаратами при боли в нераковите» . Канадский семейный врач . 58 (1): 30. PMC 3264005 . PMID 22267615 .
- ^ Маррет Э., Беллоил Х, Лежус С (март 2009 г.). опиоидный опиоид?] " Французские анналы анестезии и возобновления 28 (3): E135-5 два 10.1016/j.annfar.2009.01.006: 19304445PMID
- ^ Franceschi F, Iacomini P, Marsiliani D, Cordischi C, Antonini EF, Alesi A, et al. (Август 2013). «Безопасность и эффективность комбинации ацетаминофен-кодеина при лечении боли различного происхождения» (PDF) . Европейский обзор медицинских и фармакологических наук . 17 (16): 2129–35. PMID 23893177 . Архивировано (PDF) из оригинала 26 октября 2020 года . Получено 26 февраля 2016 года .
- ^ Chung KF, Widdicombe J (2008). Фармакология и терапия кашля . Берлин: Спрингер. п. 248. ISBN 978-3-540-79842-2 .
- ^ Болсер, округ Колумбия, Давенпорт PW (февраль 2007 г.). «Кодеин и кашель: неэффективный золотой стандарт» . Современное мнение об аллергии и клинической иммунологии . 7 (1): 32–6. doi : 10.1097/aci.0b013e3280115145 . PMC 2921574 . PMID 17218808 .
- ^ Jump up to: а беременный Goldman Rd (декабрь 2010 г.). «Кодеин для острого кашля у детей» . Канадский семейный врач . 56 (12): 1293–4. PMC 3001921 . PMID 21156892 .
- ^ Пол Им (февраль 2012 г.). «Терапевтические варианты острого кашля из -за верхних дыхательных инфекций у детей». Легкое . 190 (1): 41–4. doi : 10.1007/s00408-011-9319-y . PMID 21892785 . S2CID 23865647 .
- ^ Следующее L, Ответчик TJ, Hopstate RM, Prince JM, Salomé PL, Bidels PJ (2012). «[Лето или практическая линия NHG Guid« Острый кашель »». Голландские покупки для Genestic . 156 : A4188. PMID 22917039 .
- ^ Matthys H, Bleicher B, Bleicher U (1983). «Декстрометорфан и кодеин: объективная оценка противотуируемой активности у пациентов с хроническим кашлем». Журнал международных медицинских исследований . 11 (2): 92–100. doi : 10.1177/030006058301100206 . PMID 6852361 . S2CID 30521239 .
- ^ Ван Амбург JA. "Работают ли лекарства от кашля?" Полем Medscape . Архивировано с оригинала 31 марта 2019 года . Получено 10 апреля 2016 года .
- ^ Болсер, округ Колумбия (февраль 2010 г.). «Фармакологическое управление кашлем» . Отоларингологические клиники Северной Америки . 43 (1): 147–55, xi. doi : 10.1016/j.otc.2009.11.008 . PMC 2827356 . PMID 20172264 .
- ^ Webster LR (октябрь 2015 г.). «Опиоид-индуцированные запоры» . Обезболивающее лекарство . 16 (Suppl 1): S16-21. doi : 10.1111/pme.12911 . PMID 26461071 .
- ^ «Пресс -объявления - FDA одобряет Movantik для индуцированного опиоидом запорами» . www.fda.gov . Архивировано из оригинала 16 февраля 2017 года . Получено 18 февраля 2016 года .
- ^ Галлахер R (июль 2011 г.). «Использование опиоидов для одышки при прогрессирующем заболевании» . CMAJ . 183 (10): 1170. doi : 10.1503/cmaj.110024 . PMC 3134725 . PMID 21746829 .
- ^ Wiseman R, Rowett D, Allcroft P, Abernethy A, Currow DC (март 2013 г.). «Хроническая рефрактерная одышка-управление на основе воздействия». Австралийский семейный врач . 42 (3): 137–40. PMID 23529525 .
- ^ Dy SM, Gupta A, Waldfogel JM, Sharma R, Zhang A, Feliano JL, et al. (19 ноября 2020 г.). «Вмешательства для одышки у пациентов с ускоренным раком» . Джама Онкология . doi : 10.23970/ahrqepccer232 . PMID 33289989 .
- ^ Фелисиано Дж.Л., Вальдфогель Дж. М., Шарма Р., Чжан А., Гупта А., Седхом Р. и др. (Февраль 2021 г.). «Фармакологические вмешательства для одышки у пациентов с распространенным раком: систематический обзор и метаанализ» . Джама сеть открыта . 4 (2): E2037632. doi : 10.1001/jamanetworkopen.2020.37632 . PMC 7907959 . PMID 33630086 .
- ^ «Синдром беспокойных ног | Бэйлор лекарство» . www.bcm.edu . Архивировано из оригинала 5 ноября 2023 года . Получено 6 ноября 2023 года .
- ^ Хиггинс С., Смит Б.Х., Мэтьюз К (июнь 2019 г.). «Свидетельство индуцированной опиоидами гипералгезии в клинических популяциях после хронического воздействия опиоидов: систематический обзор и метаанализ» (PDF) . Британский журнал анестезии . 122 (6): E114 - E126. doi : 10.1016/j.bja.2018.09.019 . PMID 30915985 . S2CID 81293413 . Архивировано (PDF) от оригинала 18 сентября 2020 года . Получено 24 апреля 2020 года .
- ^ Ян Д.З., Син Б., Бекхусен Дж., Ся Д., Хаймова Р., Ильев I (май - июнь 2019). «Индуцированная опиоидами гипералгезия в нехирургической обстановке: систематический обзор». Американский журнал терапии . 26 (3): E397 - E405. doi : 10.1097/mjt.0000000000000734 . ISSN 1536-3686 . PMID 29726847 . S2CID 19181545 .
- ^ Jump up to: а беременный в дюймовый и фон глин час Фурлан А.Д., Сандовал Дж.А., Мейлис-Ганьон А., Тункс Е (май 2006 г.). «Опиоиды на хроническую нераковую боль: метаанализ эффективности и побочных эффектов» . CMAJ . 174 (11): 1589–94. doi : 10.1503/cmaj.051528 . PMC 1459894 . PMID 16717269 .
- ^ Parthvi R, Agrawal A, Khanijo S, Tsegaye A, Talwar A (май -июнь 2019). «Острая передозировка опиатов: обновление стратегий управления в отделении неотложной помощи и подразделением интенсивной терапии». Американский журнал терапии . 26 (3): E380 - E387. doi : 10.1097/mjt.0000000000000681 . PMID 28952972 . S2CID 24720660 .
- ^ Бауманн С. (2009). «Сестринский подход к боли у пожилых людей». Медсург сестринский уход . 18 (2): 77–82, викторина 83. PMID 19489204 .
- ^ Buckeridge D, Huang A, Hanley J, Kelome A, Reidel K, Verma A, et al. (Сентябрь 2010). «Риск травм, связанный с употреблением опиоидов у пожилых людей». Журнал Американского общества гериатрии . 58 (9): 1664–70. doi : 10.1111/j.1532-5415.2010.03015.x . PMID 20863326 . S2CID 25941322 .
- ^ Schneider JP (2010). «Рациональное использование опиоидных анальгетиков при хронической опорно -двигательной боли» . J Musculoskel Med . 27 : 142–148. Архивировано из оригинала 3 марта 2012 года . Получено 14 апреля 2010 года .
- ^ Sanger N, Bhatt M, Singhal N, Ramsden K, Baptist-Mohseni N, Panesar B, et al. (Март 2019). «Неблагоприятные результаты, связанные с рецептурными опиоидами для острой боли в пояснице: систематический обзор и метаанализ». Обезболивающий врач . 22 (2): 119–138. PMID 30921976 .
- ^ Fuggle N, Curtis E, Shaw S, Spooner L, Bruyère O, Ntani G, et al. (Апрель 2019). «Безопасность опиоидов при остеоартрите: результаты систематического обзора и мета-анализа» . Наркотики и старение . 36 (Suppl 1): 129–143. doi : 10.1007/s40266-019-00666-9 . PMC 6509215 . PMID 31073926 .
- ^ Стивенс Е (23 ноября 2015 г.). «Опиоидная токсичность» . Medscape . Архивировано из оригинала 4 декабря 2020 года . Получено 24 февраля 2016 года .
CDC сообщил, что метадон способствовал 31,4% смертей, связанных с опиоидами, в Соединенных Штатах в 1999–2010 годах. Метадон также составлял 39,8% всех смертей, связанных с опиоидом с одним лекарством. Уровень смертности от передозировки, связанный с метадоном, был значительно выше, чем связан с другими смертями, связанными с опиоидами, среди смертей с множественной лекарственной и одной лекарственной средой.
- ^ Jump up to: а беременный в дюймовый и Noble M, Treadwell JR, Tregear SJ, Coates VH, Wiffen PJ, Akafomo C, et al. (Январь 2010). Noble M (ред.). «Долгосрочное лечение опиоидов для хронической нераковой боли» . Кокрановская база данных систематических обзоров . 2018 (1): CD006605. doi : 10.1002/14651858.cd006605.pub2 . PMC 6494200 . PMID 20091598 .
- ^ «Смертность от передозировки наркотиков в Соединенных Штатах, 1999–2016» (PDF) . CDC . Архивировано (PDF) из оригинала 16 января 2021 года . Получено 23 декабря 2017 года .
- ^ Прадхан А.А., Уолвин В., Носаки С., Филлиол Д., Эрбс Е., Матифас А. и др. (Декабрь 2010). «Лиганд-направленный перенос Δ-опиоидного рецептора in vivo: два пути к анальгетической толерантности» . Журнал нейробиологии . 30 (49): 16459–68. doi : 10.1523/jneurosci.3748-10.2010 . PMC 3086517 . PMID 21147985 .
- ^ Kollars JP, Larson MD (март 2005 г.). «Толерантность к миотическим эффектам опиоидов» . Анестезиология . 102 (3): 701. DOI : 10.1097/00000542-200503000-00047 . PMID 15731628 .
- ^ Santillán R, Maestre JM, Hurlé MA, Flórez J (июль 1994 г.). «Усиление опиатной анальгезии нимодипином у больных раком хронически лечилось морфином: предварительный отчет». Боль . 58 (1): 129–32. doi : 10.1016/0304-3959 (94) 90192-9 . PMID 7970835 . S2CID 35138704 .
- ^ Santillán R, Hurlé MA, Armijo JA, De Los Mozos R, Flórez J (май 1998). «Опиатная анальгезия, усиленная нимодипином, у пациентов с раком, требующей эскалации дозы морфина: двойное слепое, плацебо-контролируемое исследование». Боль . 76 (1–2): 17–26. doi : 10.1016/s0304-3959 (98) 00019-0 . PMID 9696455 . S2CID 30963675 .
- ^ Смит Ф.Л., Домбровский Д.С., Дьюи В.Л. (февраль 1999 г.). «Участие внутриклеточного кальция в толерантности к морфину у мышей». Фармакология, биохимия и поведение . 62 (2): 381–8. doi : 10.1016/s0091-3057 (98) 00168-3 . PMID 9972707 . S2CID 37434490 .
- ^ McCarthy RJ, Kroin JS, Tuman KJ, Penn Rd, Ivankovich AD (апрель 1998 г.). «Антиноцицептивное потенцирование и ослабление толерантности путем интратекальной совместной инфузии сульфата и морфина магния у крыс» . Анестезия и анальгезия . 86 (4): 830–6. doi : 10.1097/00000539-199804000-00028 . PMID 9539610 . Архивировано из оригинала 11 февраля 2010 года . Получено 12 ноября 2007 года .
- ^ Morrison AP, Hunter JM, Halpern SH, Banerjee A (май 2013). «Влияние интратекального магния в присутствие или отсутствие локального анестетика с липофильными опиоидами и без него: систематический обзор и метаанализ» . Британский журнал анестезии . 110 (5): 702–12. doi : 10.1093/bja/aet064 . PMID 23533255 .
- ^ Ларсон А.А., Ковачс К.Дж., Спарц А.К. (ноябрь 2000 г.). «Интратекальный Zn2+ ослабляет морфиновую антиноцицепцию и развитие острой толерантности». Европейский журнал фармакологии . 407 (3): 267–72. doi : 10.1016/s0014-2999 (00) 00715-9 . PMID 11068022 .
- ^ Wong CS, Cherng CH, Luk HN, Ho St, Tung CS (февраль 1996 г.). «Влияние антагонистов рецепторов NMDA на ингибирование толерантности к морфину у крыс: связывание при рецепторах MU-опиоидов». Европейский журнал фармакологии . 297 (1–2): 27–33. doi : 10.1016/0014-2999 (95) 00728-8 . PMID 8851162 .
- ^ Малек Д., Мандрик М., Фидека С (март -апрель 2008). «Взаимодействие мемантина и кетамина у антиноцицепции, вызванной морфином и пентазоцином, у мышей» (PDF) . Фармакологические отчеты . 60 (2): 149–55. PMID 18443375 . Архивировано (PDF) из оригинала 30 сентября 2020 года . Получено 17 сентября 2011 года .
- ^ McCleane GJ (2003). «Проглумид антагониста холецистокинина усиливает анальгетический эффект дигидрокодеина». Клинический журнал боли . 19 (3): 200–1. doi : 10.1097/00002508-200305000-00008 . PMID 12792559 . S2CID 29229782 .
- ^ Watkins LR, Kinscheck IB, Mayer DJ (апрель 1984). «Потенциал опиатной анальгезии и очевидное изменение толерантности к морфину проглумидом». Наука . 224 (4647): 395–6. Bibcode : 1984sci ... 224..395W . doi : 10.1126/science.6546809 . PMID 6546809 .
- ^ Tang J, Chou J, Iadarola M, Yang Hy, Costa E (июнь 1984 г.). «Прожлюмид предотвращает и ограничивает острую устойчивость к морфину у крыс». Нейрофармакология . 23 (6): 715–8. doi : 10.1016/0028-3908 (84) 90171-0 . PMID 6462377 . S2CID 33168040 .
- ^ ЛЕДБОЕР А., Хатчинсон М.Р., Уоткинс Л.Р., Джонсон К.В. (июль 2007 г.). «Ибудиласт (AV-411). Новый классный терапевтический кандидат на невропатическую боль и синдромы отмены опиоидов». Экспертное мнение по расследованию лекарств . 16 (7): 935–50. doi : 10.1517/13543784.16.7.935 . PMID 17594181 . S2CID 22321634 .
- ^ Jump up to: а беременный в дюймовый Дойл Д., Хэнкс Г., Черни И., Калман К, ред. (2004). Оксфордский учебник паллиативной медицины (3 -е изд.). Издательство Оксфордского университета. ISBN 978-0-19-856698-4 .
- ^ Hermann D, Klages E, Welzel H, Mann K, Croissant B (июнь 2005 г.). «Низкая эффективность неооооооооооооооооооооооооооооооооооооооооооооооооооно из симптомов отмены опиоидов». Биология зависимости . 10 (2): 165–9. doi : 10.1080/13556210500123514 . PMID 16191669 . S2CID 8017503 .
- ^ Браун Т.К. (март 2013 г.). «Ибогаин в лечении зависимости от психоактивных веществ». Современные обзоры злоупотребления наркотиками . 6 (1): 3–16. doi : 10.2174/1567205050113109990001 . PMID 23627782 .
- ^ Duceppe MA, Perreault MM, Frenette AJ, Burry LD, Rico P, Lavoie A, et al. (Апрель 2019). «Частота, факторы риска и симптоматология ятрогенного снятия опиоидов и бензодиазепинов у критически больных новорожденных, детей и взрослых: систематический обзор клинических исследований» . Журнал клинической аптеки и терапии . 44 (2): 148–156. doi : 10.1111/jcpt.12787 . ISSN 1365-2710 . PMID 30569508 .
- ^ Bannwarth B (сентябрь 2012 г.). «Будут ли успешны в достижении своей цели, не определяющие союзы опиоидных анальгетиков в достижении своей цели?». Наркотики . 72 (13): 1713–23. doi : 10.2165/116358860-000000000-00000 . PMID 22931520 . S2CID 26082561 .
- ^ Schneider JP, Matthews M, Jamison RN (октябрь 2010 г.). «Злоупотребление злоупотреблением и устойчивыми опиоидными составами опиоидов: какова их роль в решении рецепта злоупотребления опиоидами?». ЦНС лекарства . 24 (10): 805–10. doi : 10.2165/11584260-000000000-00000 . PMID 20839893 . S2CID 17830622 .
- ^ Сюй Y, Джонсон А (2013). «Фармакогеномика опиоидной терапии при боли в неканье: эффективность, неблагоприятные события и затраты» . Исследование боли и лечение . 2013 : 943014. DOI : 10.1155/2013/943014 . PMC 3791560 . PMID 24167729 .
- ^ Brush DE (декабрь 2012 г.). «Осложнения долгосрочной опиоидной терапии для лечения хронической боли: парадокс гипералгезии, вызванной опиоидами» . Журнал медицинской токсикологии . 8 (4): 387–92. doi : 10.1007/s13181-012-0260-0 . PMC 3550256 . PMID 22983894 .
- ^ Малик З, Байк Д., Шей Р (февраль 2015 г.). «Роль каннабиноидов в регуляции тошноты и рвоты, а также висцеральной боли». Текущие гастроэнтерологические отчеты . 17 (2): 429. DOI : 10.1007/S11894-015-0429-1 . PMID 25715910 . S2CID 32705478 .
- ^ Абрамс Ди, Гусман М (июнь 2015 г.). «Каннабис при лечении рака». Клиническая фармакология и терапия . 97 (6): 575–86. doi : 10.1002/cpt.108 . PMID 25777363 . S2CID 2488112 .
- ^ «Исследование UCSF обнаруживает, что медицинская марихуана может помочь пациентам уменьшить боль с помощью опиатов» . UC Сан -Франциско . 6 декабря 2011 года. Архивировано с оригинала 17 декабря 2020 года . Получено 4 марта 2016 года .
- ^ Abrams DI, Couey P, Shade SB, Kelly ME, Benowitz NL (декабрь 2011 г.). «Каннабиноид-опиоидное взаимодействие при хронической боли». Клиническая фармакология и терапия . 90 (6): 844–51. doi : 10.1038/clpt.2011.188 . PMID 22048225 . S2CID 4823659 .
- ^ Frauenknecht J, Kirkham KR, Jacot-Guillarmod A, Albrecht E (май 2019). «Анальгетическое влияние внутриоперационных опиоидов в сравнении с употреблением анестезии: систематический обзор и метаанализ» . Анестезия . 74 (5): 651–662. doi : 10.1111/anae.14582 . PMID 30802933 . S2CID 73469631 . Архивировано из оригинала 15 декабря 2023 года . Получено 15 сентября 2022 года .
- ^ Бусс Дж.В., Ван Л., Камалельдин М., Крейги С., Рива Дж.Дж., Монтойя Л. и др. (18 декабря 2018 г.). «Опиоиды на хроническую нераковую боль: систематический обзор и метаанализ» . Джама . 320 (23): 2448–2460. doi : 10.1001/Jama.2018.18472 . ISSN 0098-7484 . PMC 6583638 . PMID 30561481 .
- ^ Reissig JE, Rybarczyk Am (апрель 2005 г.). «Фармакологическое лечение опиоид-индуцированной седации при хронической боли». Анналы фармакотерапии . 39 (4): 727–31. doi : 10.1345/aph.1e309 . PMID 15755795 . S2CID 39058371 .
- ^ Кори П.Дж., Хек А.М., Уэтермон Р.А. (декабрь 1999 г.). «Амфетамины для противодействия седации, вызванной опиоидами». Анналы фармакотерапии . 33 (12): 1362–6. doi : 10.1345/aph.19024 . PMID 10630837 . S2CID 23733242 .
- ^ Канадское агентство по лекарствам и технологиям в области здравоохранения (26 июня 2014 г.). «Диоктил сульфозукцинатный или документальный (кальций или натрий) для профилактики или лечения запоров: обзор клинической эффективности». PMID 25520993 .
- ^ Маккарберг BH (июль 2013 г.). «Обзор и обработка запоров, вызванных опиоидами». Аспирантура . 125 (4): 7–17. doi : 10.3810/pgm.2013.07.2651 . PMID 23782897 . S2CID 42872181 .
- ^ Jump up to: а беременный в дюймовый и Кумар Л., Баркер С., Эммануэль А. (2014). «Индуцированные опиоидами запор: патофизиология, клинические последствия и лечение» . Гастроэнтерологические исследования и практика . 2014 : 141737. DOI : 10.1155/2014/141737 . PMC 4027019 . PMID 24883055 .
- ^ Jump up to: а беременный Alguire PC, Американский колледж врачей, директора клерка по внутренней медицине (2009). Основы внутренней медицины для студентов клерка 2 . ACP Press. С. 272 -. ISBN 978-1-934465-13-4 .
- ^ Jump up to: а беременный в Elliott JA, Smith HS (19 апреля 2016 г.). Справочник по острой боли . CRC Press. С. 89–. ISBN 978-1-4665-9635-1 .
- ^ Poulsen JL, Brock C, Olesen AE, Nilsson M, Drewes AM (ноябрь 2015 г.). «Развивающиеся парадигмы в лечении опиоид-индуцированной дисфункции кишечника» . Терапевтические достижения в области гастроэнтерологии . 8 (6): 360–72. doi : 10.1177/1756283x15589526 . PMC 4622283 . PMID 26557892 .
- ^ Дэвис MP, GoForth HW (2016). «Оксикодон с антагонистом опиоидного рецептора: обзор». Журнал управления опиоидами . 12 (1): 67–85. doi : 10.5055/jom.2016.0313 . PMID 26908305 .
- ^ Candy B, Jones L, Vickerstaff V, Larkin PJ, Stone P (15 сентября 2022 года). «Мутоидные антагонисты для дисфункции кишечника, вызванной опиоидом у людей с раком, и людей, получающих паллиативную помощь» . Кокрановская база данных систематических обзоров . 2022 (9): CD006332. doi : 10.1002/14651858.cd006332.pub4 . ISSN 1469-493X . PMC 9476137 . PMID 36106667 .
- ^ Luthra P, Burr NE, Brenner DM, Ford AC (май 2018). «Эффективность фармакологической терапии для лечения опиоид-индуцированных запоров: систематический обзор и метаанализ сети» (PDF) . Кишечник 68 (3): 434–444. doi : 10.1136/gutjnl-2018-316001 . PMID 29730600 . S2CID 13677764 . Архивировано из оригинала 6 августа 2020 года . Получено 23 сентября 2019 года .
- ^ Эсмади М., Ахмад Д., Хьюлетт А (март 2019 г.). «Эффективность налдемуедина для лечения опиоид-индуцированных запоров: метаанализ» . Журнал желудочно -кишечных и печени . 28 (1): 41–46. doi : 10.15403/jgld.2014.1121.281 . PMID 30851171 .
- ^ Дорн С., Лембо А., Кремонни Ф. (сентябрь 2014 г.). «Дисфункция кишечника, индуцированная опиоидом: эпидемиология, патофизиология, диагностика и начальный терапевтический подход». Американский журнал гастроэнтерологических добавок . 2 (1): 31–7. doi : 10.1038/ajgsup.2014.7 . PMID 25207610 .
- ^ Yost CS (2006). «Новый взгляд на дыхательный стимулятор доксапрам» . Обзоры лекарств ЦНС . 12 (3–4): 236–49. doi : 10.1111/j.1527-3458.2006.00236.x . PMC 6506195 . PMID 17227289 .
- ^ Тан Зм, Лю Дж.Х., Донг Т., Ли Дж. (Август 2006 г.). «[Клиническое наблюдение за инфузией ремифентанила, контролируемой цели, в сочетании с пропофолом и доксапрамом при безболезненных искусственных абортах]». NAN FANG YI KE DA DA XUE XUE BAO = Журнал Южного медицинского университета . 26 (8): 1206–8. PMID 16939923 .
- ^ Манцке Т., Гюнтер У, Понимаскин Э.Г., Халлер М., Датшманн М., Шварзахер С. и др. (Июль 2003 г.). «Рецепторы 5-HT4 (а) предотвращают индуцированную опиоидом депрессию дыхания без потери анальгезии». Наука . 301 (5630): 226–9. Bibcode : 2003sci ... 301..226M . doi : 10.1126/science.1084674 . PMID 12855812 . S2CID 13641423 .
- ^ Ван Х, Дергачева О., Каменди Х, Горини С., Менделовиц Д. (август 2007 г.). «Рецепторы 5-гидрокситриптамина 1A/7 и 4ALPHA по-разному предотвращают индуцированное опиоидом ингибирование кардиореспираторной функции ствола головного мозга» . Гипертония . 50 (2): 368–76. doi : 10.1161/hypertensionaha.107.091033 . PMID 17576856 .
- ^ Рен Дж., Пун Б., Тан Й., Фанк Г.Д., Грир Дж.Дж. (декабрь 2006 г.). «Ампакины облегчают респираторную депрессию у крыс». Американский журнал респираторной медицины и медицины интенсивной терапии . 174 (12): 1384–91. doi : 10.1164/rccm.200606-778oc . PMID 16973981 .
- ^ Cozowicz C, Chung F, Doufas AG, Nagappa M, Memtsoudis SG (октябрь 2018 г.). «Опиоиды на острую боль у пациентов с обструктивным апноэ воном: систематический обзор». Анестезия и анальгезия . 127 (4): 988–1001. doi : 10.1213/ane.0000000000003549 . ISSN 1526-7598 . PMID 29958218 . S2CID 49614405 .
- ^ Гупта К., Нагаппа М., Прасад А., Абрахамьян Л., Вонг Дж., Вейнгартен Т.Н. и др. (14 декабря 2018 г.). «Факторы риска развития опиоидов респираторной депрессии у пациентов с хирургическим путем: систематический обзор и метаанализ» . BMJ Open . 8 (12): E024086. doi : 10.1136/bmjopen-2018-024086 . ISSN 2044-6055 . PMC 6303633 . PMID 30552274 .
- ^ Wilson GR, Reisfield GM (2003). «Гиралгезия морфина: отчет о случаях». Американский журнал хосписа и паллиативной помощи . 20 (6): 459–61. doi : 10.1177/104990910302000608 . PMID 14649563 . S2CID 22690630 .
- ^ Vella-Brincat J, Macleod AD (2007). «Неблагоприятные эффекты опиоидов на центральную нервную систему пациентов с паллиативной помощи». Журнал Pain & Palliateive Care Pharmacotherapy . 21 (1): 15–25. doi : 10.1080/j354v21n01_05 . PMID 17430825 . S2CID 17757207 .
- ^ Mercadante S, Arcuri E (2005). «Гипералгезия и переключение опиоидов». Американский журнал хосписа и паллиативной помощи . 22 (4): 291–4. doi : 10.1177/104990910502200411 . PMID 16082916 . S2CID 39647898 .
- ^ Fine PG (2004). «Опиоидные понимания: индуцированная опиоидом гипералгезия и вращение опиоидов». Журнал Pain & Palliateive Care Pharmacotherapy . 18 (3): 75–9. doi : 10.1080/j354v18n03_08 . PMID 15364634 . S2CID 45555785 .
- ^ Ли М., Сильверман С.М., Хансен Х., Патель В.Б., Манчиканти Л. (2011). «Комплексный обзор индуцированной опиоидами гипералгезии» . Обезболивающий врач . 14 (2): 145–61. doi : 10.36076/ppj.2011/14/145 . PMID 21412369 . Архивировано из оригинала 14 декабря 2020 года . Получено 11 ноября 2016 года .
- ^ Tompkins DA, Campbell CM (апрель 2011 г.). «Индуцированная опиоидами гипералгезия: клинически значимое или постороннее исследование феномен?» Полем Текущая боль и головная боль отчетов . 15 (2): 129–36. doi : 10.1007/s11916-010-0171-1 . PMC 3165032 . PMID 21225380 .
- ^ Díaz JL, Zamanillo D, Corbera J, Baeyens JM, Maldonado R, Pericàs MA, et al. (Сентябрь 2009 г.). «Селективные антагонисты рецепторов Sigma-1 (Sigma1): появляющаяся мишень для лечения невропатической боли». Центральная нервная система агентов в лекарственной химии . 9 (3): 172–83. doi : 10.2174/1871524910909030172 . PMID 20021351 .
- ^ Митра С. (2018). «Индуцированная опиоидами гипералгезия: патофизиология и клинические последствия». Журнал управления опиоидами . 4 (3): 123–30. doi : 10.5055/jom.2008.0017 . PMID 18717507 .
- ^ Барон Р. (2009). «Невропатическая боль: клиническая перспектива». Сенсорные нервы . Справочник по экспериментальной фармакологии. Тол. 194. С. 3–30. doi : 10.1007/978-3-540-79090-7_1 . ISBN 978-3-540-79089-1 Полем PMID 19655103 .
- ^ Candiotti Ka, Gitlin MC (июль 2010 г.). «Обзор влияния побочных эффектов, связанных с опиоидами, на недостаточное лечение хронической неканковой боли от умеренной до тяжелой, тапентадола, шаг к решению?». Текущие медицинские исследования и мнение . 26 (7): 1677–84. doi : 10.1185/03007995.2010.483941 . PMID 20465361 . S2CID 9713245 .
- ^ Jump up to: а беременный Bavor M, Bami H, Dennis BB, Plater C, Worster A, Varenbut M, et al. (Апрель 2015). «Подавление тестостерона у пользователей опиоидов: систематический обзор и метаанализ» . Наркоманов зависит . 149 : 1–9. doi : 10.1016/j.drugalcdep.2015.01.038 . PMID 25702934 .
- ^ Coluzzi F, Billeci D, Maggi M, Corona G (декабрь 2018 г.). «Дефицит тестостерона у пациентов, получавших опиоиды, не обработанные опиоидами» . Журнал эндокринологического исследования . 41 (12): 1377–1388. doi : 10.1007/s40618-018-0964-3 . PMC 6244554 . PMID 30343356 .
- ^ Jump up to: а беременный Fountas A, Chai St, Kourkouti C, Charcotaki N (октябрь 2018 г.). «Механизмы эндокриологии: эндокридология опиоидов » Европейский журнал энокронологии 179 (4): R183 - R1 Doi : 10.1530/eje-18-0270 . PMID 30299887
- ^ Бреннан М.Дж. (март 2013 г.). «Влияние опиоидной терапии на эндокринную функцию». Американский журнал медицины . 126 (3 Suppl 1): S12-8. doi : 10.1016/j.amjmed.2012.12.001 . PMID 23414717 .
- ^ Colameco S, Coren JS (январь 2009 г.). «Индуцированная опиоидом эндокринопатия». Журнал Американской остеопатической ассоциации . 109 (1): 20–5. PMID 19193821 .
- ^ Смит Х.С., Эллиотт Дж.А. (июль 2012 г.). «Индуцированный опиоид дефицит андрогенов (Опиад)». Обезболивающий врач . 15 (3 Suppl): ES145-56. PMID 22786453 .
- ^ Brede E, Mayer TG, Gatchel RJ (февраль 2012 г.). «Прогнозирование неспособности сохранить работу через 1 год после междисциплинарного функционального реставрации при трудоустройстве». Архив физической медицины и реабилитации . 93 (2): 268–74. doi : 10.1016/j.apmr.2011.08.029 . PMID 22289236 .
- ^ ВОЛИНН Е, ФАРГО JD, Fine PG (апрель 2009 г.). «Опиоидная терапия при неспецифической боли в пояснице и результат хронической потери работы». Боль . 142 (3): 194–201. doi : 10.1016/j.pain.2008.12.017 . PMID 19181448 .
- ^ Jump up to: а беременный в Американский колледж профессиональной и экологической медицины (февраль 2014 г.), «Пять вещей, которые врачи и пациенты должны подвергать сомнению» , выбирая мудро : инициатива Фонда Абима , Американского колледжа профессиональной и экологической медицины, архивирована из оригинала 11 сентября 2014 г. 24 февраля 2014 года , который цитирует
- Weiss MS, Bowden K, Branco F, et al. (2011). «Руководство по опиоидам». В Hegmann KT (ред.). Руководящие принципы практики профессиональной медицины: оценка и управление общими проблемами со здоровьем и функциональным восстановлением у работников (онлайн март 2014 г.) (3 -е изд.). Elk Grove Village, IL: Американский колледж профессиональной и экологической медицины. п. 11. ISBN 978-0-615-45227-2 .
- ^ Cherubino P, Sarzi-Puttini P, Zuccaro SM, Labianca R (февраль 2012 г.). «Лечение хронической боли в важных подгруппах пациентов». Клиническое исследование лекарств . 32 (Suppl 1): 35–44. doi : 10.2165/11630060-000000000-00000 . PMID 23389874 . S2CID 47576095 .
- ^ White KT, Dillingham TR, González-Fernández M, Rothfield L (декабрь 2009 г.). «Опиаты на хронические незлокачественные болеутоляющие синдромы: можно ли определить соответствующие кандидаты для лечения амбулаторной клиники?». Американский журнал физической медицины и реабилитации . 88 (12): 995–1001. doi : 10.1097/phm.0b013e3181bc006e . PMID 19789432 . S2CID 43241757 .
- ^ Кэй А.М., Кей А.Д., Лофтон Е.К. (2013). «Основные понятия в назначении опиоидов и текущих концепциях опиоид-опосредованных воздействий на вождение» . Журнал Ochsner . 13 (4): 525–32. PMC 3865831 . PMID 24358001 .
- ^ Орриолс Л., Делорме Б., Гадегбеку Б., Трикотель А., Контрад Б., Ламон Б. и др. (Ноябрь 2010). Pirmohamed M (ред.). «Рецептурные лекарства и риск дорожно-транспортных происшествий: исследование на основе французского реестра» . PLOS Medicine . 7 (11): E1000366. doi : 10.1371/journal.pmed.1000366 . PMC 2981588 . PMID 21125020 .
- ^ Миллер М., Стюрмер Т., Азраэль Д., Левин Р., Соломон Д.Х. (март 2011 г.). «Опиоидные анальгетики и риск переломов у пожилых людей с артритом» . Журнал Американского общества гериатрии . 59 (3): 430–8. doi : 10.1111/j.1532-5415.2011.03318.x . PMC 3371661 . PMID 21391934 .
- ^ Аллегри Н., Меннуни С., Рулли Е., Ванакор Н., Корли О., Флориани И. и др. (Март 2019). «Систематический обзор и метаанализ на нейропсихологические эффекты долгосрочного использования опиоидов у пациентов с хронической болью, не являющейся раковиной». Практика боли . 19 (3): 328–343. doi : 10.1111/papr.12741 . PMID 30354006 . S2CID 53023743 .
- ^ Jump up to: а беременный в Гудин Дж.А., Могали С., Джонс Д.Д., Комер С.Д. (июль 2013). «Риски, управление и мониторинг комбинированного опиоида, бензодиазепинов и/или употребления алкоголя» . Аспирантура . 125 (4): 115–30. doi : 10.3810/pgm.2013.07.2684 . PMC 4057040 . PMID 23933900 .
- ^ Ислам М.М., Воллерсхайм Д. (2019). «Сравнение опиоидов и бензодиазепинов, добывающихся в Австралии» . Plos один . 14 (8): E0221438. BIBCODE : 2019PLOSO..1421438I . doi : 10.1371/journal.pone.0221438 . PMC 6699700 . PMID 31425552 .
- ^ Ислам М.М., Воллерсхайм Д (2020). «Тенденции и различия в одновременном распределении опиоидов и бензодиазепинов в Австралии: ретроспективный анализ». Современные проблемы с наркотиками . 47 (2): 136–148. doi : 10.1177/0091450920919443 . S2CID 218780209 .
- ^ Stuth EA, Stuckke AG, Zuperku EJ (2012). «Влияние анестетиков, седативных средств и опиоидов на вентиляционное контроль». Комплексная физиология . 2 (4): 2281–2367. doi : 10.1002/cphy.c100061 . ISBN 978-0-470-65071-4 Полем PMID 23720250 .
- ^ Going L, Ali R, White JM (май 2017). «Опиоидные антагонисты с минимальной седацией для снятия опиоидов» . Кокрановская база данных систематических обзоров . 2017 (5): CD002021. doi : 10.1002/14651858.cd002021.pub4 . PMC 6481395 . PMID 28553701 .
- ^ Bolton M, Hodkinson A, Boda S, Mold A, Panagioti M, Rhodes S, et al. (15 января 2019 г.). «Серьезные нежелательные явления, зарегистрированные в плацебо-рандомизированных контролируемых исследованиях перорального налтрексона: систематический обзор и метаанализ» . BMC Medicine . 17 (1): 10. doi : 10.1186/s12916-018-1242-0 . ISSN 1741-7015 . PMC 6332608 . PMID 30642329 .
- ^ Greene JA, Deveau BJ, Dol JS, Butler MB (апрель 2019). «Частота смертности из -за токсичности восстановления после« лечения и высвобождения »практики в догоспитальной передозировке опиоидов: систематический обзор» . Журнал экстренной медицины . 36 (4): 219–224. doi : 10.1136/emermed-2018-207534 . ISSN 1472-0213 . PMID 30580317 .
- ^ Miller Rd (2010). Анестезия Миллера (7 -е изд.). Elsevier Health Sciences. ISBN 978-0-443-06959-8 .
- ^ Morgan GE, Mikhail MS, Murray MJ (2006). Клиническая анестезиология (4 -е изд.). МакГроу Хилл. ISBN 978-0-07-110515-6 .
- ^ Каштан Д.Х., Вонг К.А., Цен Л.К., Ки В.Д., Бейлин Й., Мхир Дж. (2014). Акушерская анестезия каштана: принципы и практика . Elsevier Health Sciences. п. 468. ISBN 978-0-323-11374-8 Полем
Растворимость липидов гидроморфона лежит между морфином и фентанилом, но ближе к морозированию морфина.
- ^ Musazzi UM, Matera C, Dallanoce C, Vacondio F, De Amici M, Vistoli G, et al. (Июль 2015). «При выборе опиоидов для местной анальгезии кожи: отношения проницаемости структуры» ». Международный журнал фармацевтики . 489 (1–2): 177–85. doi : 10.1016/j.ijpharm.2015.04.071 . PMID 25934430 .
- ^ Comer SD, Cahill CM (ноябрь 2019 г.). «Фентанил: рецепторная фармакология, потенциал злоупотреблений и последствия для лечения» . Нейробиологии и биобиоэвиральные обзоры . 106 : 49–57. doi : 10.1016/j.neubiorev.2018.12.005 . ISSN 1873-7528 . PMC 72333332 . PMID 30528374 .
- ^ Волпе Д.А., МакМахон Тобин Г.А., Меллон Р.Д., Катки А.Г., Паркер Р.Дж., Колатски Т. и др. (Апрель 2011). «Единая оценка и ранжирование констант связывания рецепторов опиоида μ для выбранных опиоидных препаратов» . Регуляторная токсикология и фармакология . 59 (3): 385–390. doi : 10.1016/j.yrtph.2010.12.007 . ISSN 1096-0295 . PMID 21215785 . Архивировано из оригинала 4 декабря 2023 года . Получено 4 декабря 2023 года .
- ^ Higashikawa Y, Suzuki S (1 июня 2008 г.). «Исследования 1- (2-фенэтил) -4- (N-пропиониланилино) пиперидина (фентанил) и связанных с ним соединений. VI. Структурная активность активности для фентанила, метилзаметованных фентанилов и других аналогов» . Судебная токсикология . 26 (1): 1–5. doi : 10.1007/s11419-007-0039-1 . ISSN 1860-8973 . S2CID 22092512 . Архивировано из оригинала 15 декабря 2023 года . Получено 4 декабря 2023 года .
- ^ Le Naour M, Lunzer MM, Powers MD, Kalyuzhny AE, Benneyworth MA, Thomas MJ, et al. (Август 2014). «Предполагаемые каппа опиоидные гетеромеры в качестве целей для развития анальгетиков, свободных от неблагоприятных эффектов» . Журнал лекарственной химии . 57 (15): 6383–92. doi : 10.1021/jm500159d . PMC 4136663 . PMID 24978316 .
- ^ Dewire SM, Yamashita DS, Rominger DH, Liu G, Cowan CL, Graczyk TM, et al. (Март 2013). «Аг-белок-смещенный лиганд в μ-опиоидном рецепторе является мощным анальгетическим при пониженной желудочно-кишечной и дыхательной дисфункции по сравнению с морфином». Журнал фармакологии и экспериментальной терапии . 344 (3): 708–17. doi : 10.1124/jpet.112.201616 . PMID 23300227 . S2CID 8785003 .
- ^ Джонсон Н., Ицхак Y, Pasternak GW (июнь 1984 г.). «Взаимодействие двух фенкоклидина-опиатных производных с сайтами связывания 3H-опиоидов». Европейский журнал фармакологии . 101 (3–4): 281–284. doi : 10.1016/0014-2999 (84) 90171-7 . PMID 6088255 .
- ^ Jump up to: а беременный в Takayama H, Ishikawa H, Kurihara M, Kitajima M, Aimi N, Ponglux D, et al. (Апрель 2002 г.). «Исследования синтеза и опиоидной агонистической активности индольных алкалоидов, связанных с митрагинином: обнаружение опиоидных агонистов, структурно отличающихся от других опиоидных лигандов». Журнал лекарственной химии . 45 (9): 1949–56. doi : 10.1021/jm010576e . PMID 11960505 .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k л м не а п Q. ведущий с Т в v В х и С аа Аб и объявление Но из в нравиться это к и ал являюсь анонца Raynor K, KN, Chen Y, Yusuda K, Yu L, Bell Gi, et. (Февраль 1994 г.). и управлять рецепторами " Молекулярная аптека 45 (2): 330–4. PMID 8114680 .
- ^ Олджес М.Е. (1992). «Использование анализа радиорецептора для анализа аналогов фентанила в моче» . J Анальный токсикол . 16 (1): 36–41. doi : 10.1093/jat/16.1.36 . PMID 1322477 . Архивировано из оригинала 21 ноября 2023 года . Получено 21 ноября 2023 года .
- ^ Jump up to: а беременный в дюймовый и фон глин Филизола М., Вильяр Хо, Лоус Г.Х. Молекулярные определения рецепторов LAN и каппаида " Биоорганическая и лекарственная химия . 9 (1): 69–7 doi : s 10.1016 / PMID 11197347 .
- ^ Jump up to: а беременный в дюймовый и фон глин час TAM SW (февраль 1985 г.). «(+)-[3H] SKF 10,047, (+)-[3H] сайты связывания с фондоклидинами в мембранах мозга морских свинок». Европейский журнал фармакологии . 109 (1): 33–41. doi : 10.1016/0014-2999 (85) 90536-9 . PMID 2986989 .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Corbett AD, Paterson SJ, Kosterlitz HW (1993). «Селективность лигандов для опиоидных рецепторов». Опиоиды . Справочник по экспериментальной фармакологии. Тол. 104/1. С. 645–679. doi : 10.1007/978-3-642-77460-7_26 . ISBN 978-3-642-77462-1 Полем ISSN 0171-2004 .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k л м не а п Q. ведущий с Codd EE, Shank RP, Schupsky JJ, Raffa RB (сентябрь 1995 г.). «Поглощение серотонина и норэпинефрина, ингибирующая активность центрально действующих анальгетиков: структурные детерминанты и роль в антиноцицепции». Журнал фармакологии и экспериментальной терапии . 274 (3): 1263–70. PMID 7562497 .
- ^ Линц К., Кристоф Т., Цшенке Т.М., Кох Т, Шиен К., Гаутро М. и др. (Июнь 2014 г.). «Себранопадол: новый мощный анальгетический ноцицептин/пептид -пептид -пептид и опиоидный рецептор». Журнал фармакологии и экспериментальной терапии . 349 (3): 535–548. doi : 10.1124/jpet.114.213694 . PMID 24713140 . S2CID 6942770 .
- ^ Frink MC, Hennies HH, Englberger W, Haurand M, Wilffert B (ноябрь 1996 г.). «Влияние трамадол на нейротрансмиттерные системы мозга крысы». Исследование лекарств . 46 (11): 1029–36. PMID 8955860 .
- ^ Потшка Х., Фридерихс Е., Лёшер В (сентябрь 2000 г.). «Противосудорожные и проконсультные эффекты трамадола, его энантиомеров и его метаболита M1 в модели эпилепсии крысы» . Британский журнал фармакологии . 131 (2): 203–12. doi : 10.1038/sj.bjp.0703562 . PMC 1572317 . PMID 10991912 .
- ^ Katsumata S, Minami M, Nakagawa T, Iwamura T, Satoh M (ноябрь 1995 г.). «Фармакологическое исследование дигидроторфина в клонированных му-, дельта- и каппа-опиоидных рецепторах». Европейский журнал фармакологии . 291 (3): 367–73. doi : 10.1016/0922-4106 (95) 90078-0 . PMID 8719422 .
- ^ Antkiewicz-Michaluk L, Vetulani J, Havemann U, Kuschinsky K (1982). «3H-дигидроморфиновые сайты связывания в субклеточных фракциях стриатума крысы». POL J Pharmacol Pharm . 34 (1–3): 73–78. PMID 6300816 .
- ^ Bart G, Schluger JH, Borg L, Ho A, Bidlack JM, Kreek MJ (декабрь 2005 г.). «Налмефен индуцировал повышение в сыворотке пролактина у нормальных человеческих добровольцев: частичная агонистская активность каппа?» Полем Нейропсихофармакология . 30 (12): 2254–62. doi : 10.1038/sj.npp.1300811 . PMID 15988468 .
- ^ MP Wenland MP, Lou R, Lu Q, Bu Y, Vanalstine MA, Cohen DJ, et al. (Январь 2009 г.). «Синтезы и свойства связывания опиоидных рецепторов картаксидо-замещенных опиоидов». Биоорганические и лекарственные химические письма . 19 (1): 203–8. doi : 10.1016/j.bmcl.2008.10.134 . PMID 19027293 .
- ^ Jump up to: а беременный Gharagozlou P, Demirci H, David Clark J, Lameh J (январь 2003 г.). «Активность опиоидных лигандов в клетках, экспрессирующих клонированные MU опиоидные рецепторы» . BMC Pharmacology . 3 : 1. DOI : 10.1186/1471-2210-3-1 . PMC 140036 . PMID 12513698 . Gharagozlou P, Demirci H, Clark JD, Lameh J (ноябрь 2002 г.). «Профили активации опиоидных лигандов в клетках HEK, экспрессирующих дельта -опиоидные рецепторы» . BMC Neuroscience . 3 : 19. DOI : 10.1186/1471-2202-3-19 . PMC 137588 . PMID 12437765 . Gharagozlou P, Hashemi E, Delorey TM, Clark JD, Lameh J (январь 2006 г.). «Фармакологические профили опиоидных лигандов в опиоидных рецепторах каппа» . BMC Pharmacology . 6 : 3. DOI : 10.1186/1471-2210-6-3 . PMC 1403760 . PMID 16433932 .
- ^ Roth BL , Baner K, Westkaemper R, Siebert D, Rice KC, Steinberg S, et al. (Сентябрь 2002 г.). «Сальвинорин А: мощный природный нетрогенный селективный агонист каппа» . Труды Национальной академии наук Соединенных Штатов Америки . 99 (18): 11934–9. Bibcode : 2002pnas ... 9911934R . doi : 10.1073/pnas.182234399 . PMC 129372 . PMID 12192085 .
- ^ MP WENDLAND, Лу Р., Лу К., Бу Й, Денхардт С., Джин Дж. И др. (Апрель 2009 г.). «Синтез новых аффинных лигандов для опиоидных рецепторов» . Биоорганические и лекарственные химические письма . 19 (8): 2289–94. doi : 10.1016/j.bmcl.2009.02.078 . PMC 2791460 . PMID 19282177 .
- ^ Gassaway MM, Rives ML, Kruegel AC, Javitch JA, Sames D (июль 2014 г.). «Атипичный антидепрессант и нейрорезоточный агент тианептин представляет собой агонист μ-опиоидного рецептора» . Переводная психиатрия . 4 (7): E411. doi : 10.1038/tp.2014.30 . PMC 4119213 . PMID 25026323 .
- ^ Truver MT, Smith CR, Garibay N, Kopajtic TA, Swortwood MJ, Baumann MH (2020). «Фармакодинамика и фармакокинетика нового синтетического опиоида, U-47700, у мужских крыс» . Нейрофармакология . 177 . doi : 10.1016/j.neuropharm.2020.108195 . PMC 7554234 . PMID 32533977 .
- ^ Fujimoto RA, Boxer J, Jackson RH, Simke JP, Neale RF, Snowhill EW, et al. (Июнь 1989 г.). «Синтез, профиль связывания опиоидных рецепторов и антиноцицептивная активность 1-азаспиро [4.5] декан-10-ил амидов». Журнал лекарственной химии . 32 (6): 1259–65. doi : 10.1021/jm00126a019 . PMID 2542556 .
- ^ «Ежегодная распространенность употребления наркотиков по региону и во всем мире, 2016» . World Drug Report 2018 . Управление Организации Объединенных Наций по наркотикам и преступности. 2018 . Получено 7 июля 2018 года .
- ^ Volkow nd. «Американская зависимость от опиоидов: злоупотребление героином и отпускаемыми по рецепту» . DrugAbuse.gov . Национальный институт злоупотребления наркотиками. Архивировано из оригинала 25 мая 2018 года . Получено 30 апреля 2017 года .
- ^ «Наркотические препараты Tourséfiants estupefacientes» (PDF) . Международный совет по борьбе с наркотиками. 2012. Архивировал (PDF) из оригинала 21 октября 2020 года . Получено 6 марта 2017 года .
- ^ «Данные по потреблению опиоидов | Группа исследований боли и политики» . Painpolicy.wisc.edu. Архивировано с оригинала 30 января 2019 года . Получено 7 января 2016 года .
- ^ Dell CA, Roberts G, Kilty J, Taylor K, Daschuk M, Hopkins C, et al. (2012). «Исследование неправильного использования лекарств по рецепту среди первых наций в Канаде: начиная с рамки укрепления здоровья» . Злоупотребление психоактивными веществами . 6 : 23–31. doi : 10.4137/sart.s9247 . PMC 3411531 . PMID 22879752 .
- ^ «Социально обездоленные онтарианцы назначают опиоиды на постоянной основе и в дозах, которые намного превышают канадские руководящие принципы» . Eces.on.ca. 25 января 2011 года. Архивировано с оригинала 12 ноября 2019 года . Получено 7 января 2016 года .
- ^ Jump up to: а беременный «Избегая злоупотребления, достижение баланса: борьба с опиоидным кризисом общественного здравоохранения» (PDF) . Колледж врачей и хирурги Онтарио. 8 сентября 2010 года. Архивировано из оригинала (PDF) 7 июня 2016 года . Получено 6 марта 2017 года .
- ^ Backhaus I, Mannocci A, La Torre G (2019). «Систематический обзор исследований экономической оценки незлокачественного лечения хронической боли на основе лекарств». Текущая фармацевтическая биотехнология . 20 (11): 910–919. doi : 10.2174/1389201020666190717095443 . PMID 31322067 . S2CID 197664630 .
- ^ Mojtabai R (май 2018). «Национальные тенденции в долгосрочном использовании опиоидов по рецепту» . Фармакоэпидемиология и безопасность лекарств . 27 (5): 526–534. doi : 10.1002/pds.4278 . PMID 28879660 . S2CID 19047621 .
- ^ Manglik A, Kruse AC, Kobilka TS, Thian FS, Mathiesen JM, Sunahara RK, et al. (Март 2012 г.). «Кристаллическая структура µ-опиоидного рецептора, связанного с антагонистом морфинана» . Природа . 485 (7398): 321–6. Bibcode : 2012natur.485..321M . doi : 10.1038/nature10954 . PMC 3523197 . PMID 22437502 .
Опиум является одним из старейших препаратов в мире, а его производные морфин и кодеин являются одними из наиболее используемых клинических препаратов для облегчения сильной боли.
- ^ Colledge S, Conolly J (10 августа 2007 г.). Происхождение и распространение внутренних растений в Юго -Западной Азии и Европе . Уолнат -Крик, Калифорния: Left Coast Press. С. 179–181. ISBN 978-1-59874-988-5 Полем Архивировано из оригинала 15 декабря 2023 года . Получено 28 августа 2018 года .
- ^ Kunzig R, Tzar J (1 ноября 2002 г.). "La Marmotta" . Обнаружить . Архивировано с оригинала 22 января 2019 года . Получено 28 августа 2018 года .
- ^ Chevalier A, Marinova E, Pena-Chocarro L (1 апреля 2014 года). Растения и люди: выбор и разнообразие во времени . Книги Oxbow. С. 97–99. ISBN 978-1-84217-514-9 Полем Архивировано из оригинала 15 декабря 2023 года . Получено 28 августа 2018 года .
- ^ Kritikos PG, Papadaki SP (1967). «История мака и опиума и их расширение в древности в восточном средиземноморском районе» . Бюллетень на наркотики . Xix (4). Архивировано из оригинала 16 декабря 2020 года . Получено 23 августа 2018 года .
- ^ Sonnedecker G (1962). «Появление концепции опиатной зависимости». Журнал Mondial de Pharmacie . 3 : 275–290.
- ^ Jump up to: а беременный в дюймовый и фон Brownstein MJ (июнь 1993 г.). «Краткая история опиатов, опиоидных пептидов и опиоидных рецепторов» . Труды Национальной академии наук Соединенных Штатов Америки . 90 (12): 5391–3. Bibcode : 1993pnas ... 90.5391b . doi : 10.1073/pnas.90.12.5391 . PMC 46725 . PMID 8390660 .
- ^ Jump up to: а беременный в дюймовый Дуарте Д.Ф. (февраль 2005 г.). «Краткая история опиума и опиоидов» (PDF) . Бразильский журнал анестезиологии . 55 (1). Doi : 10.1590/s0034-70942005000100015 . Архивировано (PDF) из оригинала 10 января 2021 года . Получено 13 сентября 2019 года .
- ^ Россо А.М. (2010). «Поп и опиум в древние времена: лекарство или наркотик?». Biomedicine International . 1 : 81–87. Citeseerx 10.1.1.846.221 .
- ^ Astyrakaki E, Papaioannou A, Askitopoulou H (январь 2010 г.). «Ссылки на анестезию, боль и анальгезию в коллекции Гиппократа» . Анестезия и анальгезия . 110 (1): 188–94. doi : 10.1213/ane.0b013e3181b188c2 . PMID 19861359 . S2CID 25919738 .
- ^ Türe H, Türe U, Gögüs FY, Valavanis A, Yasargil MG (сентябрь 2006 г.). «987 Искусство облегчения боли в греческой мифологии». Европейский журнал боли . 10 (S1): S255B - S255. doi : 10.1016/s1090-3801 (06) 60990-7 . S2CID 26539333 .
Sedare Dolorem Opus Divinum EST - старая латинская надпись - означает «облегчение боли - это работа божественного». Эта надпись часто связана с гиппократом KOS или Galen of Pergamum, но это, скорее всего, анонимная пословица
- ^ Окбальдестон Т.А. (2000). Диоскориды (перевод ) Йоханнесбург, Южная Африка: Господь Пресс. Стр. 607–611. ISBN 978-0-620-23435-1 .
- ^ Хейдари М., Хашимур М.Х., Заргаран А (2013). Канона из пушки канона Действовать в Medicontorica Adria 11 (1): 101–1 PMID 23883087 . 13 февраля 28 2018августа
- ^ Jump up to: а беременный в Астана С.Н. (1954). «Выращивание опиума мака в Индии» . Бюллетень на наркотики (3). Архивировано из оригинала 6 августа 2020 года . Получено 5 сентября 2018 года .
- ^ Jump up to: а беременный в Сигерист он (1941). «Лауданум в работах Парацельса» (PDF) . Бык Хвост Медик 9 : 530–544. Архивировано (PDF) из оригинала 9 октября 2022 года . Получено 5 сентября 2018 года .
- ^ Jump up to: а беременный в дюймовый и Гамильтон Г.Р., Баскетт Т.Ф. (апрель 2000 г.). «В руках Морфеуса развитие морфина для послеоперационного облегчения боли» . Канадский журнал анестезии . 47 (4): 367–74. doi : 10.1007/bf03020955 . PMID 10764185 .
- ^ Jump up to: а беременный Фаруки А (декабрь 2016 г.). «Глобальная карьера индийского опиума и местных судьей» (PDF) . Альманак (14): 52–73. doi : 10.1590/2236-463320161404 . Архивировано (PDF) из оригинала 27 июля 2018 года . Получено 5 сентября 2018 года .
- ^ Jump up to: а беременный Деминг С. (2011). «Экономическое значение индийского опия и торговли с Китаем в экономике Британии, 1843–1890» . Экономические рабочие документы . 25 (весна). Архивировано из оригинала (PDF) 12 ноября 2020 года . Получено 5 сентября 2018 года .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k Ринде М (2018). «Расшипное возвращение опиоидов» . Дистилляции . 4 (2): 12–23. Архивировано из оригинала 5 сентября 2018 года . Получено 23 августа 2018 года .
- ^ Mills JH (2016). Обзор «Опиум и империю в Юго -Восточной Азии: регулирование потребления в Британской Бирме» . Кембриджская имперская и постколониальная серия исследований. Palgrave Macmillan. doi : 10.14296/rih/2014/2010 . ISBN 978-0-230-29646-6 Полем Архивировано из оригинала 1 октября 2020 года . Получено 5 сентября 2018 года .
{{cite book}}:|journal=игнорируется ( помощь ) - ^ Кришнамурти С., Рао С.К. (ноябрь 2016 г.). «Выделение морфина от Сертурнера» . Индийский журнал анестезии . 60 (11): 861–862. doi : 10.4103/0019-5049.193696 . PMC 5125194 . PMID 27942064 .
- ^ Courtwright DT (2009). Силы привычных наркотиков и создание современного мира (1 изд.). Кембридж, штат Массачусетс: издательство Гарвардского университета. С. 36–37. ISBN 978-0-674-02990-3 .
- ^ Atanasov AG, Waltenberger B, Pferschy-Wenzig EM, Linder T, Wawrosch C, Uhrin P, et al. (Декабрь 2015). «Открытие и пополнение запасов фармакологически активных натуральных продуктов, полученных из растений: обзор» . Биотехнологические достижения . 33 (8): 1582–1614. doi : 10.1016/j.biotechadv.2015.08.001 . PMC 4748402 . PMID 26281720 .
- ^ Котвал А (март 2005 г.). «Инновации, распространение и безопасность медицинских технологий: обзор литературы по практике инъекций». Социальная наука и медицина . 60 (5): 1133–47. doi : 10.1016/j.socscimed.2004.06.044 . PMID 15589680 .
- ^ Mosher CJ (2013). Препараты и наркотики: контроль изменения сознания . SAGE Publications. п. 123. ISBN 978-1-4833-2188-2 .
- ^ Фишер Г.Л. (2009). Энциклопедия профилактики, лечения и выздоровления . Лос -Анджелес: Мудрец. п. 564. ISBN 978-1-4522-6601-5 .
- ^ Jump up to: а беременный Trickey E (4 января 2018 г.). «В истории Америки от опиатной зависимости Америки 19-го века» . Смитсоновский институт . Архивировано из оригинала 23 декабря 2020 года . Получено 6 сентября 2018 года .
- ^ Шехтер Н.Л. (1993). Боль у младенцев, детей и подростков . Уильямс и Уилкинс. ISBN 978-0-683-07588-5 Полем Архивировано из оригинала 15 декабря 2023 года . Получено 6 сентября 2018 года .
- ^ Хикс Р.Д. (2011). «Фронтовые аптеки» . Журнал химического наследия . Фонд химического наследия . Архивировано из оригинала 30 сентября 2020 года . Получено 29 октября 2018 года .
- ^ Jump up to: а беременный Стенд М (12 июня 1999 г.). Опиум: история (1 -е издание США). Пресса Святого Мартина. ISBN 978-0-312-20667-3 .
- ^ Wisniak J (март 2013 г.). "Пьер-Жан Робикет" . Educación Química . 24 : 139–149. Doi : 10.1016/s0187-893x (13) 72507-2 .
- ^ Филан К (2011). Сила мака: использует самый опасный союзник растений природы . Парк -стрит Пресс. п. 69. ISBN 978-1-59477-399-0 Полем Архивировано из оригинала 15 декабря 2023 года . Получено 30 октября 2018 года .
- ^ "Феликс Хоффманн" . Институт истории науки . Июнь 2016 года. Архивировано с оригинала 21 марта 2018 года . Получено 21 марта 2018 года .
- ^ Купер Р., Дикин Дж.Дж. (22 февраля 2016 г.). Ботанические чудеса: химия растений, которые изменили мир . CRC Press. п. 137. ISBN 978-1-4987-0428-1 Полем Архивировано из оригинала 15 декабря 2023 года . Получено 30 октября 2018 года .
- ^ Sneader W (ноябрь 1998). «Открытие героина» (PDF) . Лансет . 352 (9141): 1697–9. doi : 10.1016/s0140-6736 (98) 07115-3 . PMID 9853457 . S2CID 1819676 . Архивировано из оригинала 17 декабря 2020 года . Получено 30 октября 2018 года .
Байер зарегистрировал имя героин в июне 1898 года.
- ^ Jump up to: а беременный в дюймовый и Ньютон де (2016). Злоупотребление психоактивными веществами: справочный справочник . Санта-Барбара, Калифорния: ABC-Clio. С. 41–60. ISBN 978-1-4408-3983-2 Полем Архивировано из оригинала 15 декабря 2023 года . Получено 30 октября 2018 года .
- ^ Crow JM (3 января 2017 г.). «Пристрастился к лечению» . Мир химии . Архивировано из оригинала 7 ноября 2020 года . Получено 30 октября 2018 года .
- ^ Метадон имеет значение: развитие сообщества метадонового лечения опиатной зависимостью . CRC Press. 2003. с. 13. ISBN 978-0-203-63309-0 Полем Архивировано с оригинала 23 декабря 2015 года.
- ^ «Информационный бюллетень: фентанил и синтетические опиоиды» (PDF) . Альянс по борьбе с наркотиками . Сентябрь 2016 года. Архивировано из оригинала (PDF) 29 августа 2020 года . Получено 30 октября 2018 года .
- ^ «Законы узнают о законах, касающихся опиоидов, с 1800 -х годов до сегодняшнего дня» . Национальный альянс защитников лечения бупренорфином . Архивировано из оригинала 22 декабря 2020 года . Получено 30 октября 2018 года .
- ^ Белый wl. «Ранняя криминализация наркотической зависимости» (PDF) . Уильям Белые бумаги . Архивировано из оригинала (PDF) 26 октября 2020 года . Получено 30 октября 2018 года .
- ^ Марс С. (2003). «Давление со стороны сверстников и навязанный консенсус: создание рекомендаций 1984 года о хорошей клинической практике при лечении неправильного использования наркотиков». Создание политики здравоохранения . Clio Medica. Тол. 75. С. 149–83. doi : 10.1163/9789004333109_009 . ISBN 978-90-04-33310-9 Полем PMID 16212730 .
- ^ Jump up to: а беременный Джейкобс H (26 мая 2016 г.). «Это письмо с одним параграфом, возможно, запустило опиоидную эпидемию» . Бизнес -инсайдер . Архивировано из оригинала 6 августа 2020 года . Получено 30 октября 2018 года .
- ^ Portenoy RK, Foley KM (май 1986 г.). «Хроническое использование опиоидных анальгетиков при незлокачественной боли: отчет о 38 случаях». Боль . 25 (2): 171–86. doi : 10.1016/0304-3959 (86) 90091-6 . PMID 2873550 . S2CID 23959703 .
- ^ Jump up to: а беременный в Meldrum ML (август 2016 г.). «Продолжающаяся эпидемия рецепта опиоидов: исторический контекст» . Американский журнал общественного здравоохранения . 106 (8): 1365–6. doi : 10.2105/ajph.2016.303297 . PMC 4940677 . PMID 27400351 .
- ^ Хиноны С. (2015). Страна мечты: настоящая история об опиатной эпидемии Америки . Bloomsbury Press. ISBN 978-1-62040-251-1 .
- ^ Dowell D, Haegerich TM, Chou R (март 2016 г.). «Руководство CDC для назначения опиоидов на хроническую боль - Соединенные Штаты, 2016» . Ммвр. Рекомендации и отчеты . 65 (1): 1–49. doi : 10.15585/mmwr.rr6501e1 . PMC 6390846 . PMID 26987082 .
- ^ «FDA запускает кампанию государственного образования, чтобы поощрять безопасное удаление неиспользованных опиоидных обезболивающих лекарств из домов» . FDA . 24 марта 2020 года. Архивировано с оригинала 2 декабря 2020 года . Получено 15 декабря 2023 года .
- ^ «Опиоид: определение опиоида в Оксфордском словаре (американский английский) (США)» . www.oxforddictionary.com . Архивировано с оригинала 27 июня 2014 года . Получено 14 февраля 2016 года .
Опиоид: 1950 -е годы: от опиума + -оида.
- ^ Wikler A, Martin WR, Percor Ft, Eades CG (октябрь 1963). «Факторы, регулирующие устное потребление опиоида (этонитазена) крысами, связанным с морфином». Психофармакологии . 5 : 55–76. doi : 10.1007/bf00405575 . PMID 14082382 . S2CID 38073529 .
В этой статье термин «опиоид» используется в том смысле, что первоначально предложено DR. Джордж Х. Ачесон (личное общение) для обозначения любого химического соединения с морфиноподобными действиями.
- ^ Мартин В.Р. (декабрь 1967 г.). «Опиоидные антагонисты». Фармакологические обзоры . 19 (4): 463–521. PMID 4867058 .
- ^ Мехди Б. (2008). «Опиоидные анальгетики и антагонисты». В Seth SD, Seth V (Eds.). Учебник фармакологии . Elsevier India. п. III.137. ISBN 978-81-312-1158-8 .
- ^ «Эпидемия: реагирование на кризис по вопросам злоупотребления лекарствами в Америке» (PDF) . Белый дом. 2011. Архивировано из оригинала (PDF) 3 марта 2012 года.
- ^ «Сначала не причиняйте вреда: реагировать на кризис отпускаемых по рецепту лекарств в Канаде» (PDF) . Март 2013 года. Архивировано с оригинала 2 марта 2019 года . Получено 8 марта 2017 года .
- ^ «Великобритания: Целевая группа предлагает идеи для решений опиоидной зависимости» . Delhidailynews.com. 11 июня 2014 года. Архивировано с оригинала 6 июня 2017 года . Получено 7 января 2016 года .
- ^ Кайт А (29 апреля 2018 г.). «В каждом штате, кроме Миссури отслеживание опиоидных наркотиков. Почему сенаторы против этого?» Полем Звезда Канзас -Сити . Архивировано из оригинала 27 декабря 2020 года . Получено 5 ноября 2018 года .
- ^ Рутков Л., Тернер Л., Лукас Э., Хван С., Александр Г.С. (март 2015). «Большинство врачей первичной медицинской помощи знают о программах мониторинга рецептурных лекарств, но многие считают, что данные трудно получить доступ» . Дела в области здравоохранения . 34 (3): 484–92. doi : 10.1377/hlthaff.2014.1085 . PMID 25732500 .
- ^ Перроне М (20 декабря 2015 г.). «Политика обезболивающих: усилия по обузданию назначения под огнем» . Philly.com. Ассошиэйтед Пресс. Архивировано из оригинала 22 декабря 2018 года . Получено 7 января 2016 года .
- ^ Фон Корфф М., Дублин С., Уокер Р.Л., Парчман М., Шортрид С.М., Хансен Р.Н. и др. (Январь 2016). «Влияние инициатив по снижению риска опиоидов на назначение опиоидов высокой дозы для пациентов на хроническую опиоидную терапию» . Журнал боли . 17 (1): 101–10. doi : 10.1016/j.jpain.2015.10.002 . PMC 4698093 . PMID 26476264 .
- ^ Achenbach J, Wagner J, Bernstein L. «Трамп говорит, что опиоидный кризис - это национальная чрезвычайная ситуация, обещает больше денег и внимания» . Вашингтон пост . Архивировано с оригинала 24 ноября 2020 года . Получено 11 августа 2017 года .
- ^ «Технико -экономическое обоснование лицензирования опия в Афганистане для производства морфина и других необходимых лекарств» . ICOS Сентябрь 2005 года. Архивировано с оригинала 3 марта 2016 года . Получено 3 марта 2015 года .
- ^ «Обеспечение наличия опиоидных анальгетиков» (PDF) . Всемирная организация здравоохранения. Архивировано из оригинала (PDF) 1 декабря 2009 года.
- ^ Ghelardini C, Di Cesare Mannelli L, Bianchi E (2015). «Фармакологическая основа опиоидов» . Клинические случаи в метаболизме минералов и костей . 12 (3): 219–21. doi : 10.11138/ccmbm/2015.12.3.219 . PMC 4708964 . PMID 26811699 .
Опиоидные эффекты, трансцентральные анальгезии, включают седацию, респираторную депрессию, запоры и сильное чувство эйфории.
- ^ Barrett SP, Meisner Jr, Stewart SH (ноябрь 2008 г.). «Что представляет собой неправильное использование лекарств по рецепту? Проблемы и подводные камни текущих концептуализаций» (PDF) . Современные обзоры злоупотребления наркотиками . 1 (3): 255–62. doi : 10.2174/18744473710801030255 . PMID 19630724 . Архивировано из оригинала (PDF) 15 июня 2010 года.
- ^ McCabe SE, Boyd CJ, Teter CJ (июнь 2009 г.). «Подтипы немедицинского злоупотребления лекарственными средствами» . Наркотики и алкогольная зависимость . 102 (1–3): 63–70. doi : 10.1016/j.drugalcdep.2009.01.007 . PMC 2975029 . PMID 19278795 .
- ^ «Рецептурные данные передозировки опиоидов | передозировка лекарств | Центр травм CDC» . www.cdc.gov . 31 августа 2018 года. Архивировано с оригинала 24 августа 2019 года . Получено 17 января 2017 года .
- ^ «Хроническое лечение боли и злоупотребление опиоидами: проблема общественного здравоохранения (позиционная статья)» . Американская академия семейных врачей . Архивировано из оригинала 4 октября 2023 года . Получено 9 сентября 2023 года .
- ^ «Опиоидный препарат» . Наука ежедневно . Архивировано из оригинала 19 апреля 2021 года . Получено 25 июня 2021 года .
- ^ «Эфиры морфина» . Управление Организации Объединенных Наций по наркотикам и преступности . 1953. Архивировано с оригинала 24 декабря 2018 года . Получено 10 марта 2012 года .
- ^ «Эфирные эфиры морфиновых опиоидов» . Eopiates . 28 мая 2014 года . Получено 12 февраля 2016 года . [ Постоянная мертвая ссылка ]
- ^ Roth BL, Baner K, Westkaemper R, Siebert D, Rice KC, Steinberg S, et al. (3 сентября 2002 г.). «Сальвинорин А: мощный природный нетрогенный селективный агонист κ -опиоид» . Труды Национальной академии наук Соединенных Штатов Америки . 99 (18): 11934–11939. Bibcode : 2002pnas ... 9911934R . doi : 10.1073/pnas.182234399 . ISSN 0027-8424 . PMC 129372 . PMID 12192085 .
- ^ Raffa RB, Buschmann H, Christoph T, Eichenbaum G, Englberger W, Flores CM, et al. (Июль 2012 г.). «Механистическая и функциональная дифференциация тапентадол и трамадол». Экспертное мнение о фармакотерапии . 13 (10): 1437–49. doi : 10.1517/14656566.2012.696097 . PMID 22698264 . S2CID 24226747 .
- ^ Reds-Corrals MO, Gibert-Rahola J, Mico JA (1998). «Трамадол индуцирует эффекты антидепрессантного типа в микрофоне» Жизненные науки 63 (12): PL175-8 два 10.1016/S0024-3205(98)00369-5: 9749830PMID
- ^ Stein C, Schäfer M, Machelska H (август 2003 г.). «Атака боли на его источник: новые перспективы на опиоиды». Природная медицина . 9 (8): 1003–8. doi : 10.1038/nm908 . PMID 12894165 . S2CID 25453057 .
- ^ Stein C, Lang LJ (февраль 2009 г.). «Периферические механизмы опиоидной анальгезии». Современное мнение о фармакологии . 9 (1): 3–8. doi : 10.1016/j.coph.2008.12.009 . PMID 19157985 .
- ^ Busch-Dienstfertig M, Stein C (июль 2010 г.). «Опиоидные рецепторы и опиоидные пептидные лейкоциты в воспалительной боли-базовые и терапевтические аспекты». Мозг, поведение и иммунитет . 24 (5): 683–94. doi : 10.1016/j.bbi.2009.10.013 . PMID 19879349 . S2CID 40205179 .
- ^ Odell LR, Skopec J, McCluskey A (март 2008 г.). «Выделение и идентификация уникальных маркерных соединений от тасманского мака Папавера Somniferum N. Последствия для идентификации незаконного героина тасманского происхождения». Forensic Science International . 175 (2–3): 202–8. doi : 10.1016/j.forsciint.2007.07.002 . PMID 17765420 .
Внешние ссылки
[ редактировать ]- Симптомы отмены опиоидов архивировали 10 августа 2018 года на машине Wayback - в информировании по вопросам снятия опиоидов и опиатов.
- Руководящие принципы Всемирной организации здравоохранения для доступности и доступности контролируемых веществ
- Руководство CDC для назначения опиоидов на хроническую боль - Соединенные Штаты, 2016
- Список ссылок на предыдущую публикацию
- Ссылки на все языковые версии предыдущей публикации
- Видео: опиоидные побочные эффекты (Vimeo) (YouTube) - короткий образовательный фильм о практическом управлении опиоидными побочными эффектами.