p53
| TP53 | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Identifiers | |||||||||||||||||||||||||||||||||||||||||||||||||
| Aliases | TP53, BCC7, LFS1, P53, TRP53, tumor protein p53, BMFS5, Genes, p53 | ||||||||||||||||||||||||||||||||||||||||||||||||
| External IDs | OMIM: 191170; MGI: 98834; HomoloGene: 460; GeneCards: TP53; OMA:TP53 - orthologs | ||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
p53, also known as Tumor protein P53, cellular tumor antigen p53 (UniProt name), or transformation-related protein 53 (TRP53) is a regulatory protein that is often mutated in human cancers. The p53 proteins (originally thought to be, and often spoken of as, a single protein) are crucial in vertebrates, where they prevent cancer formation.[5] As such, p53 has been described as "the guardian of the genome" because of its role in conserving stability by preventing genome mutation.[6] Hence TP53[note 1] is classified as a tumor suppressor gene.[7][8][9][10][11]
The TP53 gene is the most frequently mutated gene (>50%) in human cancer, indicating that the TP53 gene plays a crucial role in preventing cancer formation.[5] TP53 gene encodes proteins that bind to DNA and regulate gene expression to prevent mutations of the genome.[12] In addition to the full-length protein, the human TP53 gene encodes at least 12 protein isoforms.[13]
Gene
[edit]In humans, the TP53 gene is located on the short arm of chromosome 17 (17p13.1).[7][8][9][10] The gene spans 20 kb, with a non-coding exon 1 and a very long first intron of 10 kb, overlapping the Hp53int1 gene. The coding sequence contains five regions showing a high degree of conservation in vertebrates, predominantly in exons 2, 5, 6, 7 and 8, but the sequences found in invertebrates show only distant resemblance to mammalian TP53.[14] TP53 orthologs[15] have been identified in most mammals for which complete genome data are available.
Human TP53 gene
[edit]In humans, a common polymorphism involves the substitution of an arginine for a proline at codon position 72 of exon 4. Many studies have investigated a genetic link between this variation and cancer susceptibility; however, the results have been controversial. For instance, a meta-analysis from 2009 failed to show a link for cervical cancer.[16] A 2011 study found that the TP53 proline mutation did have a profound effect on pancreatic cancer risk among males.[17] A study of Arab women found that proline homozygosity at TP53 codon 72 is associated with a decreased risk for breast cancer.[18] One study suggested that TP53 codon 72 polymorphisms, MDM2 SNP309, and A2164G may collectively be associated with non-oropharyngeal cancer susceptibility and that MDM2 SNP309 in combination with TP53 codon 72 may accelerate the development of non-oropharyngeal cancer in women.[19] A 2011 study found that TP53 codon 72 polymorphism was associated with an increased risk of lung cancer.[20]
Meta-analyses from 2011 found no significant associations between TP53 codon 72 polymorphisms and both colorectal cancer risk[21] and endometrial cancer risk.[22] A 2011 study of a Brazilian birth cohort found an association between the non-mutant arginine TP53 and individuals without a family history of cancer.[23] Another 2011 study found that the p53 homozygous (Pro/Pro) genotype was associated with a significantly increased risk for renal cell carcinoma.[24]
Function
[edit]DNA damage and repair
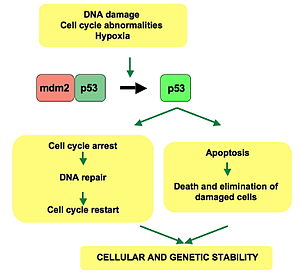
[edit]p53 plays a role in regulation or progression through the cell cycle, apoptosis, and genomic stability by means of several mechanisms:
- It can activate DNA repair proteins when DNA has sustained damage. Thus, it may be an important factor in aging.[25]
- It can arrest growth by holding the cell cycle at the G1/S regulation point on DNA damage recognition—if it holds the cell here for long enough, the DNA repair proteins will have time to fix the damage and the cell will be allowed to continue the cell cycle.
- It can initiate apoptosis (i.e., programmed cell death) if DNA damage proves to be irreparable.
- It is essential for the senescence response to short telomeres.
WAF1/CIP1 encodes for p21 and hundreds of other down-stream genes. p21 (WAF1) binds to the G1-S/CDK (CDK4/CDK6, CDK2, and CDK1) complexes (molecules important for the G1/S transition in the cell cycle) inhibiting their activity.
When p21(WAF1) is complexed with CDK2, the cell cannot continue to the next stage of cell division. A mutant p53 will no longer bind DNA in an effective way, and, as a consequence, the p21 protein will not be available to act as the "stop signal" for cell division.[26] Studies of human embryonic stem cells (hESCs) commonly describe the nonfunctional p53-p21 axis of the G1/S checkpoint pathway with subsequent relevance for cell cycle regulation and the DNA damage response (DDR). Importantly, p21 mRNA is clearly present and upregulated after the DDR in hESCs, but p21 protein is not detectable. In this cell type, p53 activates numerous microRNAs (like miR-302a, miR-302b, miR-302c, and miR-302d) that directly inhibit the p21 expression in hESCs.
The p21 protein binds directly to cyclin-CDK complexes that drive forward the cell cycle and inhibits their kinase activity, thereby causing cell cycle arrest to allow repair to take place. p21 can also mediate growth arrest associated with differentiation and a more permanent growth arrest associated with cellular senescence. The p21 gene contains several p53 response elements that mediate direct binding of the p53 protein, resulting in transcriptional activation of the gene encoding the p21 protein.
The p53 and RB1 pathways are linked via p14ARF, raising the possibility that the pathways may regulate each other.[27]
p53 expression can be stimulated by UV light, which also causes DNA damage. In this case, p53 can initiate events leading to tanning.[28][29]
Stem cells
[edit]Levels of p53 play an important role in the maintenance of stem cells throughout development and the rest of human life.
In human embryonic stem cells (hESCs)s, p53 is maintained at low inactive levels.[30] This is because activation of p53 leads to rapid differentiation of hESCs.[31] Studies have shown that knocking out p53 delays differentiation and that adding p53 causes spontaneous differentiation, showing how p53 promotes differentiation of hESCs and plays a key role in cell cycle as a differentiation regulator. When p53 becomes stabilized and activated in hESCs, it increases p21 to establish a longer G1. This typically leads to abolition of S-phase entry, which stops the cell cycle in G1, leading to differentiation. Work in mouse embryonic stem cells has recently shown however that the expression of P53 does not necessarily lead to differentiation.[32] p53 also activates miR-34a and miR-145, which then repress the hESCs pluripotency factors, further instigating differentiation.[30]
In adult stem cells, p53 regulation is important for maintenance of stemness in adult stem cell niches. Mechanical signals such as hypoxia affect levels of p53 in these niche cells through the hypoxia inducible factors, HIF-1α and HIF-2α. While HIF-1α stabilizes p53, HIF-2α suppresses it.[33] Suppression of p53 plays important roles in cancer stem cell phenotype, induced pluripotent stem cells and other stem cell roles and behaviors, such as blastema formation. Cells with decreased levels of p53 have been shown to reprogram into stem cells with a much greater efficiency than normal cells.[34][35] Papers suggest that the lack of cell cycle arrest and apoptosis gives more cells the chance to be reprogrammed. Decreased levels of p53 were also shown to be a crucial aspect of blastema formation in the legs of salamanders.[36] p53 regulation is very important in acting as a barrier between stem cells and a differentiated stem cell state, as well as a barrier between stem cells being functional and being cancerous.[37]
Other
[edit]
Apart from the cellular and molecular effects above, p53 has a tissue-level anticancer effect that works by inhibiting angiogenesis.[38] As tumors grow they need to recruit new blood vessels to supply them, and p53 inhibits that by (i) interfering with regulators of tumor hypoxia that also affect angiogenesis, such as HIF1 and HIF2, (ii) inhibiting the production of angiogenic promoting factors, and (iii) directly increasing the production of angiogenesis inhibitors, such as arresten.[39][40]
p53 by regulating Leukemia Inhibitory Factor has been shown to facilitate implantation in the mouse and possibly human reproduction.[41]
The immune response to infection also involves p53 and NF-κB. Checkpoint control of the cell cycle and of apoptosis by p53 is inhibited by some infections such as Mycoplasma bacteria,[42] raising the specter of oncogenic infection.
Regulation
[edit]p53 acts as a cellular stress sensor. It is normally kept at low levels by being constantly marked for degradation by the E3 ubiquitin ligase protein MDM2.[43] p53 is activated in response to myriad stressors – including DNA damage (induced by either UV, IR, or chemical agents such as hydrogen peroxide), oxidative stress,[44] osmotic shock, ribonucleotide depletion, viral lung infections[45] and deregulated oncogene expression. This activation is marked by two major events. First, the half-life of the p53 protein is increased drastically, leading to a quick accumulation of p53 in stressed cells. Second, a conformational change forces p53 to be activated as a transcription regulator in these cells. The critical event leading to the activation of p53 is the phosphorylation of its N-terminal domain. The N-terminal transcriptional activation domain contains a large number of phosphorylation sites and can be considered as the primary target for protein kinases transducing stress signals.
The protein kinases that are known to target this transcriptional activation domain of p53 can be roughly divided into two groups. A first group of protein kinases belongs to the MAPK family (JNK1-3, ERK1-2, p38 MAPK), which is known to respond to several types of stress, such as membrane damage, oxidative stress, osmotic shock, heat shock, etc. A second group of protein kinases (ATR, ATM, CHK1 and CHK2, DNA-PK, CAK, TP53RK) is implicated in the genome integrity checkpoint, a molecular cascade that detects and responds to several forms of DNA damage caused by genotoxic stress. Oncogenes also stimulate p53 activation, mediated by the protein p14ARF.
In unstressed cells, p53 levels are kept low through a continuous degradation of p53. A protein called Mdm2 (also called HDM2 in humans), binds to p53, preventing its action and transports it from the nucleus to the cytosol. Mdm2 also acts as an ubiquitin ligase and covalently attaches ubiquitin to p53 and thus marks p53 for degradation by the proteasome. However, ubiquitylation of p53 is reversible. On activation of p53, Mdm2 is also activated, setting up a feedback loop. p53 levels can show oscillations (or repeated pulses) in response to certain stresses, and these pulses can be important in determining whether the cells survive the stress, or die.[46]
MI-63 binds to MDM2, reactivating p53 in situations where p53's function has become inhibited.[47]
A ubiquitin specific protease, USP7 (or HAUSP), can cleave ubiquitin off p53, thereby protecting it from proteasome-dependent degradation via the ubiquitin ligase pathway. This is one means by which p53 is stabilized in response to oncogenic insults. USP42 has also been shown to deubiquitinate p53 and may be required for the ability of p53 to respond to stress.[48]
Recent research has shown that HAUSP is mainly localized in the nucleus, though a fraction of it can be found in the cytoplasm and mitochondria. Overexpression of HAUSP results in p53 stabilization. However, depletion of HAUSP does not result in a decrease in p53 levels but rather increases p53 levels due to the fact that HAUSP binds and deubiquitinates Mdm2. It has been shown that HAUSP is a better binding partner to Mdm2 than p53 in unstressed cells.
USP10, however, has been shown to be located in the cytoplasm in unstressed cells and deubiquitinates cytoplasmic p53, reversing Mdm2 ubiquitination. Following DNA damage, USP10 translocates to the nucleus and contributes to p53 stability. Also USP10 does not interact with Mdm2.[49]
Phosphorylation of the N-terminal end of p53 by the above-mentioned protein kinases disrupts Mdm2-binding. Other proteins, such as Pin1, are then recruited to p53 and induce a conformational change in p53, which prevents Mdm2-binding even more. Phosphorylation also allows for binding of transcriptional coactivators, like p300 and PCAF, which then acetylate the C-terminal end of p53, exposing the DNA binding domain of p53, allowing it to activate or repress specific genes. Deacetylase enzymes, such as Sirt1 and Sirt7, can deacetylate p53, leading to an inhibition of apoptosis.[50] Some oncogenes can also stimulate the transcription of proteins that bind to MDM2 and inhibit its activity.
Epigenetic marks like histone methylation can also regulate p53, for example, p53 interacts directly with a repressive Trim24 cofactor that binds histones in regions of the genome that are epigenetically repressed.[51] Trim24 prevents p53 from activating its targets, but only in these regions, effectively giving p53 the ability to 'read out' the histone profile at key target genes and act in a gene-specific manner.
Role in disease
[edit]

If the TP53 gene is damaged, tumor suppression is severely compromised. People who inherit only one functional copy of the TP53 gene will most likely develop tumors in early adulthood, a disorder known as Li–Fraumeni syndrome.
The TP53 gene can also be modified by mutagens (chemicals, radiation, or viruses), increasing the likelihood for uncontrolled cell division. More than 50 percent of human tumors contain a mutation or deletion of the TP53 gene.[52] Loss of p53 creates genomic instability that most often results in an aneuploidy phenotype.[53]
Increasing the amount of p53 may seem a solution for treatment of tumors or prevention of their spreading. This, however, is not a usable method of treatment, since it can cause premature aging.[54] Restoring endogenous normal p53 function holds some promise. Research has shown that this restoration can lead to regression of certain cancer cells without damaging other cells in the process. The ways by which tumor regression occurs depends mainly on the tumor type. For example, restoration of endogenous p53 function in lymphomas may induce apoptosis, while cell growth may be reduced to normal levels. Thus, pharmacological reactivation of p53 presents itself as a viable cancer treatment option.[55][56] The first commercial gene therapy, Gendicine, was approved in China in 2003 for the treatment of head and neck squamous cell carcinoma. It delivers a functional copy of the p53 gene using an engineered adenovirus.[57]
Certain pathogens can also affect the p53 protein that the TP53 gene expresses. One such example, human papillomavirus (HPV), encodes a protein, E6, which binds to the p53 protein and inactivates it. This mechanism, in synergy with the inactivation of the cell cycle regulator pRb by the HPV protein E7, allows for repeated cell division manifested clinically as warts. Certain HPV types, in particular types 16 and 18, can also lead to progression from a benign wart to low or high-grade cervical dysplasia, which are reversible forms of precancerous lesions. Persistent infection of the cervix over the years can cause irreversible changes leading to carcinoma in situ and eventually invasive cervical cancer. This results from the effects of HPV genes, particularly those encoding E6 and E7, which are the two viral oncoproteins that are preferentially retained and expressed in cervical cancers by integration of the viral DNA into the host genome.[58]
The p53 protein is continually produced and degraded in cells of healthy people, resulting in damped oscillation (see a stochastic model of this process in [59]). The degradation of the p53 protein is associated with binding of MDM2. In a negative feedback loop, MDM2 itself is induced by the p53 protein. Mutant p53 proteins often fail to induce MDM2, causing p53 to accumulate at very high levels. Moreover, the mutant p53 protein itself can inhibit normal p53 protein levels. In some cases, single missense mutations in p53 have been shown to disrupt p53 stability and function.[60]
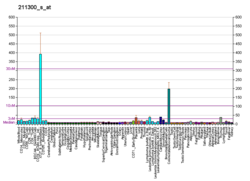
 This image shows different patterns of p53 expression in endometrial cancers on chromogenic immunohistochemistry, whereof all except wild-type are variably termed abnormal/aberrant/mutation-type and are strongly predictive of an underlying TP53 mutation:[61]
|

Suppression of p53 in human breast cancer cells is shown to lead to increased CXCR5 chemokine receptor gene expression and activated cell migration in response to chemokine CXCL13.[64]
One study found that p53 and Myc proteins were key to the survival of Chronic Myeloid Leukaemia (CML) cells. Targeting p53 and Myc proteins with drugs gave positive results on mice with CML.[65][66]
Experimental analysis of p53 mutations
[edit]Most p53 mutations are detected by DNA sequencing. However, it is known that single missense mutations can have a large spectrum from rather mild to very severe functional effects.[60]
The large spectrum of cancer phenotypes due to mutations in the TP53 gene is also supported by the fact that different isoforms of p53 proteins have different cellular mechanisms for prevention against cancer. Mutations in TP53 can give rise to different isoforms, preventing their overall functionality in different cellular mechanisms and thereby extending the cancer phenotype from mild to severe. Recent studies show that p53 isoforms are differentially expressed in different human tissues, and the loss-of-function or gain-of-function mutations within the isoforms can cause tissue-specific cancer or provide cancer stem cell potential in different tissues.[11][67][68][69] TP53 mutation also hits energy metabolism and increases glycolysis in breast cancer cells.[70]
The dynamics of p53 proteins, along with its antagonist Mdm2, indicate that the levels of p53, in units of concentration, oscillate as a function of time. This "damped" oscillation is both clinically documented [71] and mathematically modelled.[72][73] Mathematical models also indicate that the p53 concentration oscillates much faster once teratogens, such as double-stranded breaks (DSB) or UV radiation, are introduced to the system. This supports and models the current understanding of p53 dynamics, where DNA damage induces p53 activation (see p53 regulation for more information). Current models can also be useful for modelling the mutations in p53 isoforms and their effects on p53 oscillation, thereby promoting de novo tissue-specific pharmacological drug discovery.
Discovery
[edit]p53 was identified in 1979 by Lionel Crawford, David P. Lane, Arnold Levine, and Lloyd Old, working at Imperial Cancer Research Fund (UK) Princeton University/UMDNJ (Cancer Institute of New Jersey), and Memorial Sloan Kettering Cancer Center, respectively. It had been hypothesized to exist before as the target of the SV40 virus, a strain that induced development of tumors. The name p53 was given in 1979 describing the apparent molecular mass.
The TP53 gene from the mouse was first cloned by Peter Chumakov of The Academy of Sciences of the USSR in 1982,[74] and independently in 1983 by Moshe Oren in collaboration with David Givol (Weizmann Institute of Science).[75][76] The human TP53 gene was cloned in 1984[7] and the full length clone in 1985.[77]
It was initially presumed to be an oncogene due to the use of mutated cDNA following purification of tumor cell mRNA. Its role as a tumor suppressor gene was revealed in 1989 by Bert Vogelstein at the Johns Hopkins School of Medicine and Arnold Levine at Princeton University.[78][79] p53 went on to be identified as a transcription factor by Guillermina Lozano working at MD Anderson Cancer Center.[80]
Warren Maltzman, of the Waksman Institute of Rutgers University first demonstrated that TP53 was responsive to DNA damage in the form of ultraviolet radiation.[81] In a series of publications in 1991–92, Michael Kastan of Johns Hopkins University, reported that TP53 was a critical part of a signal transduction pathway that helped cells respond to DNA damage.[82]
In 1993, p53 was voted molecule of the year by Science magazine.[83]
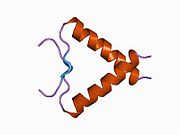
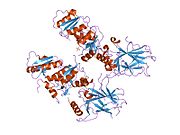
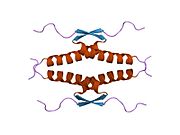
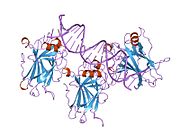
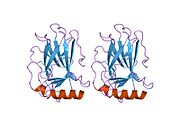
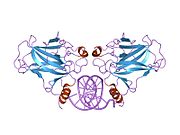
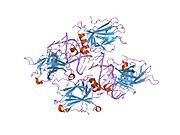
Structure
[edit]

p53 has seven domains:
- an acidic N-terminus transcription-activation domain (TAD), also known as activation domain 1 (AD1), which activates transcription factors. The N-terminus contains two complementary transcriptional activation domains, with a major one at residues 1–42 and a minor one at residues 55–75, specifically involved in the regulation of several pro-apoptotic genes.[84]
- activation domain 2 (AD2) important for apoptotic activity: residues 43–63.
- proline rich domain important for the apoptotic activity of p53 by nuclear exportation via MAPK: residues 64–92.
- central DNA-binding core domain (DBD). Contains one zinc atom and several arginine amino acids: residues 102–292. This region is responsible for binding the p53 co-repressor LMO3.[85]
- Nuclear Localization Signaling (NLS) domain, residues 316–325.
- homo-oligomerisation domain (OD): residues 307–355. Tetramerization is essential for the activity of p53 in vivo.
- C-terminal involved in downregulation of DNA binding of the central domain: residues 356–393.[86]
Mutations that deactivate p53 in cancer usually occur in the DBD. Most of these mutations destroy the ability of the protein to bind to its target DNA sequences, and thus prevents transcriptional activation of these genes. As such, mutations in the DBD are recessive loss-of-function mutations. Molecules of p53 with mutations in the OD dimerise with wild-type p53, and prevent them from activating transcription. Therefore, OD mutations have a dominant negative effect on the function of p53.
Wild-type p53 is a labile protein, comprising folded and unstructured regions that function in a synergistic manner.[87]
SDS-PAGE analysis indicates that p53 is a 53-kilodalton (kDa) protein. However, the actual mass of the full-length p53 protein (p53α) based on the sum of masses of the amino acid residues is only 43.7 kDa. This difference is due to the high number of proline residues in the protein, which slow its migration on SDS-PAGE, thus making it appear heavier than it actually is.[88]
Isoforms
[edit]As with 95% of human genes, TP53 encodes more than one protein. All these p53 proteins are called the p53 isoforms.[5] These proteins range in size from 3.5 to 43.7 kDa. Several isoforms were discovered in 2005, and so far 12 human p53 isoforms have been identified (p53α, p53β, p53γ, ∆40p53α, ∆40p53β, ∆40p53γ, ∆133p53α, ∆133p53β, ∆133p53γ, ∆160p53α, ∆160p53β, ∆160p53γ). Furthermore, p53 isoforms are expressed in a tissue dependent manner and p53α is never expressed alone.[11]
The full length p53 isoform proteins can be subdivided into different protein domains. Starting from the N-terminus, there are first the amino-terminal transcription-activation domains (TAD 1, TAD 2), which are needed to induce a subset of p53 target genes. This domain is followed by the proline rich domain (PXXP), whereby the motif PXXP is repeated (P is a proline and X can be any amino acid). It is required among others for p53 mediated apoptosis.[89] Some isoforms lack the proline rich domain, such as Δ133p53β,γ and Δ160p53α,β,γ; hence some isoforms of p53 are not mediating apoptosis, emphasizing the diversifying roles of the TP53 gene.[67] Afterwards there is the DNA binding domain (DBD), which enables the proteins to sequence specific binding. The C-terminus domain completes the protein. It includes the nuclear localization signal (NLS), the nuclear export signal (NES) and the oligomerisation domain (OD). The NLS and NES are responsible for the subcellular regulation of p53. Through the OD, p53 can form a tetramer and then bind to DNA. Among the isoforms, some domains can be missing, but all of them share most of the highly conserved DNA-binding domain.
The isoforms are formed by different mechanisms. The beta and the gamma isoforms are generated by multiple splicing of intron 9, which leads to a different C-terminus. Furthermore, the usage of an internal promoter in intron 4 causes the ∆133 and ∆160 isoforms, which lack the TAD domain and a part of the DBD. Moreover, alternative initiation of translation at codon 40 or 160 bear the ∆40p53 and ∆160p53 isoforms.[11]
Due to the isoformic nature of p53 proteins, there have been several sources of evidence showing that mutations within the TP53 gene giving rise to mutated isoforms are causative agents of various cancer phenotypes, from mild to severe, due to single mutation in the TP53 gene (refer to section Experimental analysis of p53 mutations for more details).
Interactions
[edit]p53 has been shown to interact with:
- AIMP2,[90]
- ANKRD2,[91]
- APTX,[92]
- ATM,[93][94][95][96][97]
- ATR,[93][94]
- ATF3,[98][99]
- AURKA,[100]
- BAK1,[101]
- BARD1,[102]
- BLM,[103][104][105][106]
- BRCA1,[102][107][108][109][110]
- BRCA2,[102][111]
- BRCC3,[102]
- BRE,[102]
- CEBPZ,[112]
- CDC14A,[113]
- Cdk1,[114][115]
- CFLAR,[116]
- CHEK1,[103][117][118]
- CCNG1,[119]
- CREBBP,[120][121][122]
- CREB1,[122]
- Cyclin H,[123]
- CDK7,[123][124]
- DNA-PKcs,[94][117][125]
- E4F1,[126][127]
- EFEMP2,[128]
- EIF2AK2,[129]
- ELL,[130]
- EP300,[121][131][132][133]
- ERCC6,[134][135]
- GNL3,[136]
- GPS2,[137]
- GSK3B,[138]
- HSP90AA1,[139][140][141]
- Hif1a , [142][143][144][145]
- Hipk1 , [ 146 ]
- Hipk2 , [ 147 ] [ 148 ]
- HMGB1 , [ 149 ] [ 150 ]
- HSPA9 , [ 151 ]
- Хантингтин , [ 152 ]
- Ing1 , [ 153 ] [ 154 ]
- Ing4 , [ 155 ] [ 156 ]
- Ing5 , [ 155 ]
- IκBα , [ 157 ]
- Kpnb1 , [ 139 ]
- LMO3 , [ 85 ]
- MDM2 , [ 120 ] [ 158 ] [ 159 ] [ 160 ]
- MDM4 , [ 161 ] [ 162 ]
- Med1 , [ 163 ] [ 164 ]
- MAPK9 , [ 165 ] [ 166 ]
- Mnat1 , [ 124 ]
- НДН , [ 167 ]
- Ncl , [ 168 ]
- ОНЕМЕВШИЙ , [ 169 ]
- NF-κB,[170]
- P16,[126][160][171]
- PARC,[172]
- PARP1,[92][173]
- PIAS1,[128][174]
- CDC14B,[113]
- PIN1,[175][176]
- PLAGL1,[177]
- PLK3,[178][179]
- PRKRA,[180]
- PHB,[181]
- PML,[158][182][183]
- PSME3,[184]
- PTEN,[159]
- PTK2,[185]
- PTTG1,[186]
- RAD51,[102][187][188]
- RCHY1,[189][190]
- RELA,[170]
- Reprimo[citation needed]
- RPA1,[191][192]
- RPL11,[171]
- S100B,[193]
- SUMO1,[194][195]
- SMARCA4,[196]
- SMARCB1,[196]
- SMN1,[197]
- STAT3,[170]
- TBP,[198][199]
- TFAP2A,[200]
- TFDP1,[201]
- TIGAR,[202]
- TOP1,[203][204]
- TOP2A,[205]
- TP53BP1,[103][206][207][208][209][210][211]
- TP53BP2 , [211][212]
- Top2b , [ 205 ]
- TP53inp1 , [ 213 ] [ 214 ]
- TSG101 , [ 215 ]
- B2A , [ 216 ]
- Be2i , [ 128 ] [ 194 ] [ 217 ] [ 218 ]
- UBC , [ 90 ] [ 184 ] [ 195 ] [ 219 ] [ 220 ] [ 221 ] [ 222 ] [ 223 ]
- USP7 , [ 224 ]
- USP10 , [ 49 ]
- WRN , [ 106 ] [ 225 ]
- WWOX , [ 226 ]
- XPB , [ 134 ]
- YBX1 , [ 91 ] [ 227 ]
- Yel3 , [ 228 ]
- Да , [ 229 ]
- Zif268 , [ 230 ]
- Znf148 , [ 231 ]
- Sirt1 , [ 232 ]
- circrna_014511. [ 233 ]
Смотрите также
[ редактировать ]- Пифитрин , ингибитор p53
Примечания
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а беременный в GRCH38: Ensembl Release 89: ENSG00000141510 - Ensembl , май 2017 г.
- ^ Jump up to: а беременный в GRCM38: Ensembl Release 89: Ensmusg0000000059552 - Ensembl , май 2017 г.
- ^ «Человеческая PubMed ссылка:» . Национальный центр информации о биотехнологии, Национальная медицина США .
- ^ «Мышь Pubmed ссылка:» . Национальный центр информации о биотехнологии, Национальная медицина США .
- ^ Jump up to: а беременный в Surget S, Khoury MP, Bourdon JC (декабрь 2013 г.). «Раскрытие роли вариантов сплайсинга p53 в злокачественных новообразованиях человека: клиническая перспектива» . Онкотарги и терапия . 7 : 57–68. doi : 10.2147/Ott.S53876 . PMC 3872270 . PMID 24379683 .
- ^ Toufektchan E, Toledo F (май 2018). «Страж генома пересмотрен: P53 подавляет гены, необходимые для поддержания теломер, восстановления ДНК и структуры центромеры» . Рак . 10 (5): 135. doi : 10.3390/cancers10050135 . PMC 5977108 . PMID 29734785 .
- ^ Jump up to: а беременный в Matlashewski G, Lamb P, Pim D, et al. (Декабрь 1984 г.). «Выделение и характеристика человеческого клона кДНК P53 P53: экспрессия гена p53 человека» . Embo Journal . 3 (13): 3257–62. doi : 10.1002/j.1460-2075.1984.tb02287.x . PMC 557846 . PMID 6396087 .
- ^ Jump up to: а беременный Isobe M, Emanuel BS, Givol D, et al. (1986). «Локализация гена для человеческого опухолевого антигена P53 до полосы 17P13». Природа . 320 (6057): 84–5. Bibcode : 1986natur.320 ... 84i . doi : 10.1038/320084A0 . PMID 3456488 . S2CID 4310476 .
- ^ Jump up to: а беременный Керн С.Е., Кинцлер К.В., Брускин А. и др. (Июнь 1991 г.). «Идентификация p53 в качестве специфического для последовательности ДНК-связывающего белка». Наука . 252 (5013): 1708–11. Bibcode : 1991sci ... 252.1708K . doi : 10.1126/science.2047879 . PMID 2047879 . S2CID 19647885 .
- ^ Jump up to: а беременный McBride OW, Merry D, Givol D (январь 1986 г.). «Ген для антигена клеточного опухоли P53 человека расположен на хромосоме 17 короткой руки (17P13)» . Труды Национальной академии наук Соединенных Штатов Америки . 83 (1): 130–4. Bibcode : 1986pnas ... 83..130M . doi : 10.1073/pnas.83.1.130 . PMC 322805 . PMID 3001719 .
- ^ Jump up to: а беременный в дюймовый Bourdon JC, Fernandes K, Murray-Zmijewski F, et al. (Сентябрь 2005 г.). «Изоформы P53 могут регулировать транскрипционную активность p53» . Гены и развитие . 19 (18): 2122–37. doi : 10.1101/gad.1339905 . PMC 1221884 . PMID 16131611 .
- ^ Левин А.Дж., Лейн Д.П., ред. (2010). Семья P53 . Перспективы Cold Spring Harbor в биологии. Cold Spring Harbour, NY: Laboratory Press Cold Spring Harbour. ISBN 978-0-87969-830-0 .
- ^ MP Khoury, Bourdon JC (апрель 2011 г.). "Изоформы p53: внутриклеточный микропроцессор?" Полем Гены рак . 2 (4): 453–65. doi : 10.1177/1947601911408893 . PMC 3135639 . PMID 21779513 .
- ^ May P, май E (декабрь 1999 г.). «Двадцать лет исследований р53: структурные и функциональные аспекты белка р53» . Онкоген . 18 (53): 7621–36. doi : 10.1038/sj.onc.1203285 . PMID 10618702 .
- ^ «Ортомам филогенетический маркер: кодирующая последовательность TP53» . Архивировано с оригинала 2018-03-17 . Получено 2009-12-02 .
- ^ Klug SJ, Ressing M, Koenig J, et al. (Август 2009 г.). «Полиморфизм TP53 Codon 72 и рак шейки матки: объединенный анализ отдельных данных из 49 исследований». Lancet. Онкология . 10 (8): 772–84. doi : 10.1016/s1470-2045 (09) 70187-1 . PMID 19625214 .
- ^ Сонойма Т., Сакай А., Мита Ю. и др. (2011). «Полиморфизм TP53 Codon 72 связан с риском рака поджелудочной железы у мужчин, курильщиков и пьющих» . Молекулярная медицина сообщает . 4 (3): 489–95. doi : 10.3892/mmr.2011.449 . PMID 21468597 .
- ^ Alawadi S, Ghabreau L, Alsaleh M, et al. (Сентябрь 2011). «Полиморфизмы генов p53 и риск рака молочной железы у арабских женщин». Медицинская онкология . 28 (3): 709–15. doi : 10.1007/s12032-010-9505-4 . PMID 20443084 . S2CID 207372095 .
- ^ Yu H, Huang YJ, Liu Z, et al. (Сентябрь 2011). «Влияние полиморфизмов промотора MDM2 и полиморфизма кодона P53 72 на риск и возраст в начале плоскоклеточной карциномы головы и шеи» . Молекулярный канцерогенез . 50 (9): 697–706. doi : 10.1002/mc.20806 . PMC 3142329 . PMID 21656578 .
- ^ Piao JM, Kim HN, Song HR, et al. (Сентябрь 2011). «P53 Codon 72 Polymorphism и риск развития рака легких в корейской популяции». Рак легких . 73 (3): 264–7. doi : 10.1016/j.lungcan.2010.12.017 . PMID 21316118 .
- ^ Wang JJ, Zheng Y, Sun L, et al. (Ноябрь 2011). «TP53 кодон 72 полиморфизм и чувствительность к колоректальному раку: мета-анализ». Молекулярная биология отчетов . 38 (8): 4847–53. doi : 10.1007/s11033-010-0619-8 . PMID 21140221 . S2CID 11730631 .
- ^ Цзян Д.К., Яо Л., Рен В.Х. и др. (Декабрь 2011 г.). «Полиморфизм TP53 ARG72PRO и риск рака эндометрия: мета-анализ». Медицинская онкология . 28 (4): 1129–35. doi : 10.1007/s12032-010-9597-x . PMID 20552298 . S2CID 32990396 .
- ^ Thurow HS, Haack R, Hartwig FP, et al. (Декабрь 2011 г.). «Полиморфизм генов TP53: значение для рака, этнической принадлежности и веса при рождении в бразильской когорте». Журнал биологических наук . 36 (5): 823–31. doi : 10.1007/s12038-011-9147-5 . PMID 22116280 . S2CID 23027087 .
- ^ Huang Cy, Su CT, Chu JS, et al. (Декабрь 2011 г.). «Полиморфизмы P53 Codon 72 и MDM2 SNP309 и риска почечного рака в зоне низкого уровня воздействия мышьяка». Токсикология и прикладная фармакология . 257 (3): 349–55. Bibcode : 2011toxap.257..349h . doi : 10.1016/j.taap.2011.09.018 . PMID 21982800 .
- ^ Гилберт С.Ф. Биология развития, 10 -е изд . Sunderland, MA USA: Sinauer Associates, Inc. Publishers. п. 588.
- ^ Национальный центр информации о биотехнологии (1998). "Кожа и соединительная ткань" . Гены и болезнь . Национальные институты здравоохранения США . Получено 2008-05-28 .
- ^ Bates S, Phillips AC, Clark PA, et al. (Сентябрь 1998). «P14ARF связывает опухолевые супрессоры RB и P53». Природа . 395 (6698): 124–5. Bibcode : 1998natur.395..124b . doi : 10.1038/25867 . PMID 9744267 . S2CID 4355786 .
- ^ «Страж Генома начинает загар» . Новый ученый . 17 марта 2007 г. Получено 2007-03-29 .
- ^ Cui R, Widlund HR, Feige E, et al. (Март 2007 г.). «Центральная роль р53 в ответе на солнце и патологической гиперпигментации» . Клетка . 128 (5): 853–64. doi : 10.1016/j.cell.2006.12.045 . PMID 17350573 .
- ^ Jump up to: а беременный Jain AK, Allton K, Iacovino M, et al. (2012). «P53 регулирует клеточный цикл и микроРНК, чтобы способствовать дифференцировке эмбриональных стволовых клеток человека» . PLOS Биология . 10 (2): E1001268. doi : 10.1371/journal.pbio.1001268 . PMC 3289600 . PMID 22389628 .
- ^ Maimets T, Neganova I, Armstrong L, et al. (Сентябрь 2008 г.). «Активация p53 с помощью Nutlin приводит к быстрой дифференцировке эмбриональных стволовых клеток человека» . Онкоген . 27 (40): 5277–87. doi : 10.1038/onc.2008.166 . PMID 18521083 .
- ^ Ter Huurne M, Peng T, Yi G, et al. (Февраль 2020 г.). «Критическая роль p53 в регуляции клеточного цикла эмбриональных стволовых клеток основного состояния» . Отчеты стволовых клеток . 14 (2): 175–183. doi : 10.1016/j.stemcr.2020.01.001 . PMC 7013234 . PMID 32004494 .
- ^ Das B, Bayat-Mokhtari R, Tsui M, et al. (Август 2012 г.). «HIF-2α подавляет p53 для усиления стволовой и регенеративной потенциала эмбриональных стволовых клеток человека» . Стволовые клетки . 30 (8): 1685–95. doi : 10.1002/Stem.1142 . PMC 3584519 . PMID 22689594 .
- ^ Озеро Б.Б., Финк Дж., Клеметсаун Л. и др. (Май 2012 г.). «Контекстно-зависимое усиление индуцированного плюрипотентного перепрограммирования стволовых клеток путем молчания пумы» . Стволовые клетки . 30 (5): 888–97. doi : 10.1002/Stem.1054 . PMC 3531606 . PMID 22311782 .
- ^ Marión RM, Strati K, Li H, et al. (Август 2009 г.). «P53-опосредованная лимита отклика отклика ДНК перепрограммирование для обеспечения целостности генома клеток IPS» . Природа . 460 (7259): 1149–53. Bibcode : 2009natur.460.1149m . doi : 10.1038/nature08287 . PMC 3624089 . PMID 19668189 .
- ^ Yun MH, Gates PB, Brockes JP (октябрь 2013 г.). «Регулирование p53 имеет решающее значение для регенерации конечностей позвоночных» . Труды Национальной академии наук Соединенных Штатов Америки . 110 (43): 17392–7. BIBCODE : 2013PNAS..11017392Y . doi : 10.1073/pnas.1310519110 . PMC 3808590 . PMID 24101460 .
- ^ Aloni-Grinstein R, Shetzer Y, Kaufman T, et al. (Август 2014). «P53: барьер для формирования стволовых клеток рака» . Письма Febs . 588 (16): 2580–9. BIBCODE : 2014FEBSL.588.2580A . doi : 10.1016/j.febslet.2014.02.011 . PMID 24560790 . S2CID 37901173 .
- ^ Jump up to: а беременный Babaei G, Aliarb A, Asghari Vostakolaei M, et al. (Ноябрь 2021 г.). «Сшивка между р53 и метастазированием: фокус на эпителиально-мезенхимальном переходе, раковой стволовой клетке, ангиогенезе, аутофагии и аноикисе». Молекулярная биология отчетов . 48 (11): 7545–7557. doi : 10.1007/s11033-021-06706-1 . PMID 34519942 . S2CID 237506513 .
- ^ Теодоро JG, Эванс С.К., Грин М.Р. (ноябрь 2007 г.). «Ингибирование ангиогенеза опухоли p53: новая роль для Guardian of the Genome». Журнал молекулярной медицины (обзор). 85 (11): 1175–1186. doi : 10.1007/s00109-007-0221-2 . PMID 17589818 . S2CID 10094554 .
- ^ Assadian S, El-Assaad W, Wang XQ, et al. (Март 2012 г.). «P53 ингибирует ангиогенез, индуцируя выработку ареста» . РАНКА . 72 (5): 1270–1279. doi : 10.1158/0008-5472.can-11-2348 . PMID 22253229 .
- ^ Hu W, Feng Z, Teresky AK, et al. (Ноябрь 2007 г.). «P53 регулирует материнское размножение через LIF». Природа . 450 (7170): 721–4. Bibcode : 2007natur.450..721h . doi : 10.1038/nature05993 . PMID 18046411 . S2CID 4357527 .
- ^ Borchsenius SN, Daks A, Fedorova O, et al. (Январь 2018). «Влияние микоплазмы на реакцию организма хозяина посредством передачи сигналов p53/nf-κB». Журнал клеточной физиологии . 234 (1): 171–180. doi : 10.1002/jcp.26781 . PMID 30146800 .
- ^ Bykov VJ, Eriksson SE, Bianchi J, et al. (Февраль 2018 г.). «Нацеливание мутанта p53 для эффективной терапии рака». Природные обзоры. Рак . 18 (2): 89–102. doi : 10.1038/nrc.2017.109 . PMID 29242642 . S2CID 4552678 .
- ^ Han ES, Muller FL, Pérez VI, et al. (Июнь 2008 г.). «Сигнатура экспрессии гена in vivo при окислительном стрессе» . Физиологическая геномика . 34 (1): 112–126. doi : 10.1152/physiolgenomics.00239.2007 . PMC 2532791 . PMID 18445702 .
- ^ Grajales-reyes ge, Colonna M (август 2020 г.). «Ответы интерферонов в вирусных пневмониях». Наука . 369 (6504): 626–627. Bibcode : 2020sci ... 369..626G . doi : 10.1126/science.abd2208 . PMID 32764056 .
- ^ Purvis JE, Karhohs KW, Mock C, et al. (Июнь 2012 г.). "P53 Dynamics Control Cell Fate" . Наука . 336 (6087): 1440–1444. Bibcode : 2012sci ... 336.1440p . doi : 10.1126/science.1218351 . PMC 4162876 . PMID 22700930 .
- ^ Canner JA, Sobo M, Ball S, et al. (Сентябрь 2009 г.). «MI-63: новый ингибитор с малой молекулой нацелен на MDM2 и вызывает апоптоз в эмбриональных и альвеолярных клетках рабдомиосаркомы с p53 дикого типа» . Британский журнал рака . 101 (5): 774–81. doi : 10.1038/sj.bjc.6605199 . PMC 2736841 . PMID 19707204 .
- ^ Hock AK, Vigneron AM, Carter S, et al. (Ноябрь 2011). «Регуляция стабильности и функции p53 с помощью деубиквитинирующего фермента USP42» . Embo Journal . 30 (24): 4921–30. doi : 10.1038/emboj.2011.419 . PMC 3243628 . PMID 22085928 .
- ^ Jump up to: а беременный Yuan J, Luo K, Zhang L, et al. (Февраль 2010 г.). «USP10 регулирует локализацию и стабильность p53 путем деубиквитинирования p53» . Клетка . 140 (3): 384–396. doi : 10.1016/j.cell.2009.12.032 . PMC 2820153 . PMID 20096447 .
- ^ Vakhrusheva O, Smolka C, Gajawada P, et al. (Март 2008 г.). «SIRT7 повышает стресс -устойчивость кардиомиоцитов и предотвращает апоптоз и воспалительную кардиомиопатию у мышей» . Исследование циркуляции . 102 (6): 703–10. doi : 10.1161/circresaha.107.164558 . PMID 18239138 .
- ^ Isbel L, Iskar M, Durdu S, et al. (Июнь 2023 г.). «Считывание метилирования гистона с помощью TRIM24 локально ограничивает открытие хроматина P53» . Природа структурная и молекулярная биология . 30 (7): 948–57. doi : 10.1038/s41594-023-01021-8 . HDL : 2440/139184 . PMC 10352137 . PMID 37386214 .
- ^ Hollstein M, Sidransky D, Vogelstein B, et al. (Июль 1991). «Мутации р53 при раке человека» . Наука . 253 (5015): 49–53. Bibcode : 1991sci ... 253 ... 49h . doi : 10.1126/science.1905840 . PMID 1905840 . S2CID 38527914 .
- ^ Schmitt CA, Fridman JS, Yang M, et al. (Апрель 2002 г.). «Расширение P53 Dupressor Fudies in vivo» . Раковая клетка . 1 (3): 289–98. doi : 10.1016/s1535-6108 (02) 00047-8 . PMID 12086865 .
- ^ Tyner SD, Venkatachalam S, Choi J, et al. (Январь 2002). «Мыши мутантов p53, которые демонстрируют фенотипы, связанные с ранним возрастом». Природа . 415 (6867): 45–53. Bibcode : 2002natur.415 ... 45t . doi : 10.1038/415045a . PMID 11780111 . S2CID 749047 .
- ^ Вентура А., Кирш Д.Г., Маклафлин М.Е. и др. (Февраль 2007 г.). «Восстановление функции p53 приводит к регрессии опухоли in vivo». Природа . 445 (7128): 661–5. doi : 10.1038/nature05541 . PMID 17251932 . S2CID 4373520 .
- ^ Herce HD, Deng W, Helma J, et al. (2013). «Визуализация и целенаправленное нарушение белковых взаимодействий в живых клетках» . Природная связь . 4 : 2660. Bibcode : 2013natco ... 4.2660h . doi : 10.1038/ncomms3660 . PMC 3826628 . PMID 24154492 .
- ^ Пирсон С., Цзя Х, Кандачи К (январь 2004 г.). «Китай одобряет первую генную терапию» . Nature Biotechnology . 22 (1): 3–4. doi : 10.1038/nbt0104-3 . PMC 7097065 . PMID 14704685 .
- ^ Angeletti PC, Zhang L, Wood C (2008). «Вирусная этиология злокачественных новообразований, связанных с СПИДом». ВИЧ-1: молекулярная биология и патогенез . Достижения в области фармакологии. Тол. 56. С. 509–57. doi : 10.1016/s1054-3589 (07) 56016-3 . ISBN 978-0-12-373601-7 Полем PMC 2149907 . PMID 18086422 .
- ^ Ribeiro AS, Charlebois Da, Lloyd-Price J (декабрь 2007 г.). «Cell Line, стохастический симулятор линии ячейки» . Биоинформатика . 23 (24): 3409–3411. doi : 10.1093/bioinformatics/btm491 . PMID 17928303 .
- ^ Jump up to: а беременный Bullock AN, Henckel J, Dedecker BS, et al. (Декабрь 1997). «Термодинамическая стабильность ядра дикого типа и мутанта p53-ядра» . Труды Национальной академии наук Соединенных Штатов Америки . 94 (26): 14338–42. Bibcode : 1997pnas ... 9414338b . doi : 10.1073/pnas.94.26.14338 . PMC 24967 . PMID 9405613 .
- ^ Köbel M, Ronnett BM, Singh N, et al. (Январь 2019). «Интерпретация иммуногистохимии р53 при карциномах эндометрия: к повышению воспроизводимости» . Международный журнал гинекологической патологии . 38 (Suppl 1): S123 - S131. doi : 10.1097/pgp.0000000000000488 . PMC 6127005 . PMID 29517499 .
 Эта статья включает в себя текст, доступный по лицензии CC по 4,0 .
Эта статья включает в себя текст, доступный по лицензии CC по 4,0 .
- ^ Изображение взято из следующего источника, с некоторой модификацией Микаэля Хёггстрем, MD:
- Schallenberg S, Plage H, Hofbauer S, et al. (2023). «Измененная экспрессия p53/p16 связана с прогрессированием уротелия карциномы, но в основном не связана с прогнозом в опухолях, инвазивных мышц» . Acta Oncol . 62 (12): 1880–1889. doi : 10.1080/0284186x.2023.2277344 . PMID 37938166 . - ^ Источник роли в отличием PUNLMP от низкого класса карциномы:
- Kalantari MR, Ahmadnia H (2007). «Сверхэкспрессия P53 в уротелевых новообразованиях мочевого пузыря: новый аспект Всемирной организации здравоохранения/Международного общества урологической патологии» . Urol J. 4 (4): 230–3. PMID 18270948 . - ^ Mitkin NA, Hook CD, Schwartz AM, et al. (Март 2015 г.). «P53-зависимая экспрессия хемокинового рецептора CXCR5 в клетках рака молочной железы MCF-7» . Научные отчеты . 5 (5): 9330. BIBCODE : 2015NATSR ... 5E9330M . doi : 10.1038/srep09330 . PMC 4365401 . PMID 25786345 .
- ^ Авраам С.А., Хопкрофт Л.Е., Каррик Э. и др. (Июнь 2016 г.). «Двойное нацеливание p53 и c-myc избирательно устраняет лейкемические стволовые клетки» . Природа . 534 (7607): 341–6. Bibcode : 2016natur.534..341a . doi : 10.1038/nature18288 . PMC 4913876 . PMID 27281222 .
- ^ «Ученые идентифицируют препараты, чтобы нацелиться на« ахиллесовую пятку »хронических миелоидных клеток лейкоза» . MyScience . 2016-06-08 . Получено 2016-06-09 .
- ^ Jump up to: а беременный MP Khoury, Bourdon JC (апрель 2011 г.). "Изоформы p53: внутриклеточный микропроцессор?" Полем Гены и рак . 2 (4): 453–65. doi : 10.1177/1947601911408893 . PMC 3135639 . PMID 21779513 .
- ^ Avery-Kiejda Ka, Morten B, Wong-Brown MW, et al. (Март 2014 г.). «Относительная экспрессия мРНК изоформ р53 при раке молочной железы связана с клиническими особенностями и результатами» . Канцерогенез . 35 (3): 586–96. doi : 10.1093/carcin/bgt411 . PMID 24336193 .
- ^ Arsic N, Gadea G, Lagerqvist EL, et al. (Апрель 2015). «Изоформа p53 Δ133p53β способствует раковым стволовым клеткам» . Отчеты стволовых клеток . 4 (4): 531–40. doi : 10.1016/j.stemcr.2015.02.001 . PMC 4400643 . PMID 25754205 .
- ^ Harami-Papp H, Pongor LS, Munkácsy G, et al. (Октябрь 2016). «Мутация TP53 достигает энергетического метаболизма и увеличивает гликолиз при раке молочной железы» . Oncotarget . 7 (41): 67183–67195. doi : 10.18632/oncotarget.11594 . PMC 5341867 . PMID 27582538 .
- ^ Geva-Zatorsky N, Rosenfeld N, Itzkovitz S, et al. (Июнь 2006 г.). «Колебания и изменчивость в системе P53» . Биология молекулярных систем . 2 : 2006.0033. doi : 10.1038/msb4100068 . PMC 1681500 . PMID 16773083 .
- ^ Proctor CJ, Grey DA (август 2008 г.). «Объяснение колебаний и изменчивости в системе p53-MDM2» . BMC Системная биология . 2 (75): 75. doi : 10.1186/1752-0509-2-75 . PMC 2553322 . PMID 18706112 .
- ^ Чонг К.Х., Самарасингхе С., Куласири Д. (декабрь 2013 г.). «Математическое моделирование базальной динамики p53 и реакции на повреждение ДНК». C-FACS . 259 (20 -й Международный конгресс по математическому моделированию и моделированию): 670–6. doi : 10.1016/j.mbs.2014.10.010 . PMID 25433195 .
- ^ Chumakov PM, Iotsova VS, Georgiev GP (1982). «[Выделение плазмидного клона, содержащего последовательность мРНК для невирусного Т-антигена мыши». Doklady Akademii Nauk SSSR (на русском языке). 267 (5): 1272–5. PMID 6295732 .
- ^ Орен М, Левин А.Дж. (январь 1983 г.). «Молекулярное клонирование кДНК, специфичное для мышиного антигена клеточного опухоли p53» . Труды Национальной академии наук Соединенных Штатов Америки . 80 (1): 56–9. Bibcode : 1983pnas ... 80 ... 56o . doi : 10.1073/pnas.80.1.56 . PMC 393308 . PMID 6296874 .
- ^ Закут-Хури Р., Орен М., Биенц Б. и др. (1983). «Один ген и псевдоген для клеточного опухолевого антигена p53». Природа . 306 (5943): 594–7. Bibcode : 1983natur.306..594Z . doi : 10.1038/306594A0 . PMID 6646235 . S2CID 4325094 .
- ^ Закут-Хури Р., Биенц-Тадмор Б., Гивол Д. и др. (Май 1985). «Антиген клеточного опухоли человека человека: последовательность кДНК и экспрессия в клетках COS» . Embo Journal . 4 (5): 1251–5. doi : 10.1002/j.1460-2075.1985.tb03768.x . PMC 554332 . PMID 4006916 .
- ^ Baker SJ, Fearon ER, Nigro JM, et al. (Апрель 1989). «Хромосома 17 делеции и мутации гена p53 в колоректальных карциномах». Наука . 244 (4901): 217–21. Bibcode : 1989sci ... 244..217b . doi : 10.1126/science.2649981 . PMID 2649981 .
- ^ Finlay CA, Hinds PW, Levine AJ (июнь 1989 г.). «Протоонкоген P53 может действовать как подавитель трансформации» . Клетка . 57 (7): 1083–93. doi : 10.1016/0092-8674 (89) 90045-7 . PMID 2525423 .
- ^ Raycroft L, Wu Hy, Lozano G (август 1990 г.). «Транскрипционная активация с помощью дикого типа, но не трансформирующих мутантов антинокогена p53» . Наука . 249 (4972): 1049–1051. Bibcode : 1990sci ... 249.1049R . doi : 10.1126/science.2144364 . PMC 2935288 . PMID 2144364 .
- ^ Мальцман В., Чизи Л. (сентябрь 1984 г.). «УФ -облучение стимулирует уровни антигена клеточного опухоли p53 в неттрансформированных клетках мыши» . Молекулярная и клеточная биология . 4 (9): 1689–94. doi : 10.1128/mcb.4.9.1689 . PMC 368974 . PMID 6092932 .
- ^ Kastan MB, Kuerbitz SJ (декабрь 1993 г.). «Контроль ареста G1 после повреждения ДНК» . Перспективы здоровья окружающей среды . 101 (Suppl 5): 55–8. doi : 10.2307/3431842 . JSTOR 3431842 . PMC 1519427 . PMID 8013425 .
- ^ Кошленд де (декабрь 1993 г.). «Молекула года». Наука . 262 (5142): 1953. Bibcode : 1993sci ... 262.1953K . doi : 10.1126/science.8266084 . PMID 8266084 .
- ^ Venot C, Maratrat M, Dureuil C, et al. (Август 1998). «Потребность в функциональном домене P53, богатый пролином для посредничества апоптоза, коррелирует со специфической трансактивацией гена Pig3 и с транскрипционной репрессией» . Embo Journal . 17 (16): 4668–79. doi : 10.1093/emboj/17.16.4668 . PMC 1170796 . PMID 9707426 .
- ^ Jump up to: а беременный Larsen S, Yokochi T, Isogai E, et al. (Февраль 2010 г.). «LMO3 взаимодействует с p53 и ингибирует ее транскрипционную активность». Биохимическая и биофизическая исследовательская коммуникация . 392 (3): 252–7. doi : 10.1016/j.bbrc.2009.12.010 . PMID 19995558 .
- ^ Вреден К.Л., Чен Х (март 2005 г.). «C -концерн белков семейства p53 является детерминантой судьбы клеток» . Молекулярная и клеточная биология . 25 (5): 2014–30. doi : 10.1128/mcb.25.5.2014-2030.2005 . PMC 549381 . PMID 15713654 .
- ^ Bell S, Klein C, Müller L, et al. (Октябрь 2002). «P53 содержит большие неструктурированные регионы в его родном состоянии». Журнал молекулярной биологии . 322 (5): 917–27. doi : 10.1016/s0022-2836 (02) 00848-3 . PMID 12367518 .
- ^ Ziemer MA, Mason A, Carlson DM (сентябрь 1982). «Беспомянутые трансляции пролиновых мРНК белка» . Журнал биологической химии . 257 (18): 11176–80. doi : 10.1016/s0021-9258 (18) 33948-6 . PMID 7107651 .
- ^ Zhu J, Zhang S, Jiang J, et al. (Декабрь 2000 г.). «Определение функциональных доменов p53, необходимых для индукции апоптоза» . Журнал биологической химии . 275 (51): 39927–34. doi : 10.1074/jbc.m005676200 . PMID 10982799 .
- ^ Jump up to: а беременный Han JM, Park BJ, Park SG, et al. (Август 2008 г.). «AIMP2/P38, каркас для мульти-тРНК-синтетазного комплекса, реагирует на генотоксические стрессы через p53» . Труды Национальной академии наук Соединенных Штатов Америки . 105 (32): 11206–11. Bibcode : 2008pnas..10511206H . doi : 10.1073/pnas.0800297105 . PMC 2516205 . PMID 18695251 .
- ^ Jump up to: а беременный Kojic S, Medeot E, Guccione E, et al. (Май 2004 г.). «Белок ANKRD2, связь между саркором и ядром в скелетных мышцах». Журнал молекулярной биологии . 339 (2): 313–25. doi : 10.1016/j.jmb.2004.03.071 . PMID 15136035 .
- ^ Jump up to: а беременный Gueven N, Becherel OJ, Kijas AW, et al. (Май 2004 г.). «Апратаксин, новый белок, который защищает от генотоксического стресса» . Молекулярная генетика человека . 13 (10): 1081–93. doi : 10.1093/hmg/ddh122 . PMID 15044383 .
- ^ Jump up to: а беременный Fabbro M, Savage K, Hobson K, et al. (Июль 2004 г.). «Комплексы BRCA1-BARD1 необходимы для фосфорилирования p53SER-15 и остановки G1/S после ионизирующего радиационного повреждения ДНК» . Журнал биологической химии . 279 (30): 31251–8. doi : 10.1074/jbc.m405372200 . PMID 15159397 .
- ^ Jump up to: а беременный в Kim St, Lim DS, Canman CE, et al. (Декабрь 1999). «Субстратная специфичность и идентификация предполагаемых субстратов членов семейства киназы» . Журнал биологической химии . 274 (53): 37538–43. doi : 10.1074/jbc.274.53.37538 . PMID 10608806 .
- ^ Kang J, Ferguson D, Song H, et al. (Январь 2005 г.). «Функциональное взаимодействие H2AX, NBS1 и P53 в ATM-зависимых реакциях повреждения ДНК и подавления опухоли» . Молекулярная и клеточная биология . 25 (2): 661–70. doi : 10.1128/mcb.25.2.2.661-670.2005 . PMC 543410 . PMID 15632067 .
- ^ Ханна К.К., Китинг К.Е., Козлов С. и др. (Декабрь 1998). «ATM связывает и фосфорилирует p53: картирование области взаимодействия». Природа генетика . 20 (4): 398–400. doi : 10.1038/3882 . PMID 9843217 . S2CID 23994762 .
- ^ Westphal CH, Schmaltz C, Rowan S, et al. (Май 1997). «Генетические взаимодействия между ATM и p53 влияют на клеточную пролиферацию и облучение контрольно-пропускными пунктами клеточного цикла». РАНКА . 57 (9): 1664–7. PMID 9135004 .
- ^ Stelzl U, Worm U, Lalowski M, et al. (Сентябрь 2005 г.). «Сеть взаимодействия белка-белок-белок: ресурс для аннотирования протеома» . Клетка . 122 (6): 957–68. doi : 10.1016/j.cell.2005.08.029 . HDL : 11858/00-001M-0000-0010-8592-0 . PMID 16169070 .
- ^ Ян С., Ван Х, Бойд Д.Д. (март 2002 г.). «ATF3 подавляет экспрессию коллагеназы типа IV 72 кДа (MMP-2) путем противодействия p53-зависимой транса-активации промотора коллагеназы» . Журнал биологической химии . 277 (13): 10804–12. doi : 10.1074/jbc.m112069200 . PMID 11792711 .
- ^ Chen SS, Chang PC, Cheng YW, et al. (Сентябрь 2002 г.). «Подавление онкогенной активности STK15 требует независимой от трансактивации функции p53» . Embo Journal . 21 (17): 4491–9. doi : 10.1093/emboj/cdf409 . PMC 126178 . PMID 12198151 .
- ^ Leu Ji, Dumont P, Hafey M, et al. (Май 2004 г.). «Митохондриальный p53 активирует BAK и вызывает разрушение комплекса Bak-MCL1». Природная клеточная биология . 6 (5): 443–50. doi : 10.1038/ncb1123 . PMID 15077116 . S2CID 43063712 .
- ^ Jump up to: а беременный в дюймовый и фон Dong Y, Hakimi MA, Chen X, et al. (Ноябрь 2003). «Регуляция BRCC, голооферментного комплекса, содержащего BRCA1 и BRCA2, с помощью сигнальной подъеты и его роли в репарации ДНК» . Молекулярная клетка . 12 (5): 1087–99. doi : 10.1016/s1097-2765 (03) 00424-6 . PMID 14636569 .
- ^ Jump up to: а беременный в Sengupta S, Robles AI, Linke SP, et al. (Сентябрь 2004 г.). «Функциональное взаимодействие между BLM Helicase и 53BP1 в CHK1-опосредованном пути во время остановки S-фазы» . Журнал клеточной биологии . 166 (6): 801–13. doi : 10.1083/jcb.200405128 . PMC 2172115 . PMID 15364958 .
- ^ Wang XW, Tseng A, Ellis NA, et al. (Август 2001 г.). «Функциональное взаимодействие p53 и BLM ДНК -геликазы при апоптозе» . Журнал биологической химии . 276 (35): 32948–55. doi : 10.1074/jbc.m103298200 . PMID 11399766 .
- ^ Garkavtsev IV, Kley N, Grigorian IA, et al. (Декабрь 2001 г.). «Белок синдрома Блума взаимодействует и сотрудничает с p53 в регуляции транскрипции и контроля роста клеток». Онкоген . 20 (57): 8276–80. doi : 10.1038/sj.onc.1205120 . PMID 11781842 . S2CID 13084911 .
- ^ Jump up to: а беременный Yang Q, Zhang R, Wang XW, et al. (Август 2002). «Обработка холлидея соединений BLM и HELICASES регулируется P53» . Журнал биологической химии . 277 (35): 31980–7. doi : 10.1074/jbc.m204111200 . HDL : 10026.1/10341 . PMID 12080066 .
- ^ Abramovitch S, Werner H (2003). «Функциональные и физические взаимодействия между BRCA1 и P53 в регуляции транскрипции гена IGF-IR». Гормона и метаболические исследования . 35 (11–12): 758–62. doi : 10.1055/s-2004-814154 . PMID 14710355 . S2CID 20898175 .
- ^ Ouchi T, Monteiro AN, August A, et al. (Март 1998 г.). «BRCA1 регулирует p53-зависимую экспрессию генов» . Труды Национальной академии наук Соединенных Штатов Америки . 95 (5): 2302–6. Bibcode : 1998pnas ... 95.2302O . doi : 10.1073/pnas.95.5.2302 . PMC 19327 . PMID 9482880 .
- ^ Chai YL, Cui J, Shao N, et al. (Январь 1999). «Второй домен BRCT белков BRCA1 взаимодействует с p53 и стимулирует транскрипцию от промотора P21WAF1/CIP1». Онкоген . 18 (1): 263–8. doi : 10.1038/sj.onc.1202323 . PMID 9926942 . S2CID 7462625 .
- ^ Zhang H, Somasundaram K, Peng Y, et al. (Апрель 1998 г.). «BRCA1 физически ассоциируется с p53 и стимулирует ее транскрипционную активность». Онкоген . 16 (13): 1713–21. doi : 10.1038/sj.onc.1201932 . PMID 9582019 . S2CID 24616900 .
- ^ Marmorstein Ly, Ouchi T, Aaronson SA (ноябрь 1998 г.). «Продукт гена BRCA2 функционально взаимодействует с p53 и RAD51» . Труды Национальной академии наук Соединенных Штатов Америки . 95 (23): 13869–74. Bibcode : 1998pnas ... 9513869M . doi : 10.1073/pnas.95.23.13869 . PMC 24938 . PMID 9811893 .
- ^ Uramoto H, Izumi H, Nagatani G, et al. (Апрель 2003 г.). «Физическое взаимодействие супрессора опухоли p53/p73 с CCAAT-связывающим транскрипционным фактором 2 (CTF2) и дифференциальной регуляцией экспрессии гена высокой мобильности человека 1 (HMG1)» . Биохимический журнал . 371 (Pt 2): 301–10. doi : 10.1042/bj20021646 . PMC 1223307 . PMID 12534345 .
- ^ Jump up to: а беременный Li L, Ljungman M, Dixon JE (январь 2000 г.). «Фосфатазы CDC14 человека взаимодействуют и дефосфорилируют белок -супрессор опухоли p53» . Журнал биологической химии . 275 (4): 2410–4. doi : 10.1074/jbc.275.4.2410 . PMID 10644693 .
- ^ Luciani MG, Hutchins JR, Zheleva D, et al. (Июль 2000 г.). «C-концевой регуляторный домен P53 содержит функциональный сайт стыковки для циклина A». Журнал молекулярной биологии . 300 (3): 503–18. doi : 10.1006/jmbi.2000.3830 . PMID 10884347 .
- ^ Ababneh M, Götz C, Dentenarh M (май 2001). «Понижающая регуляция активности протеинкиназы CDC2/циклина B путем связывания p53 с p34 (CDC2)». Биохимическая и биофизическая исследовательская коммуникация . 283 (2): 507–12. doi : 10.1006/bbrc.2001.4792 . PMID 11327730 .
- ^ Abedini MR, Muller EJ, Brun J, et al. (Июнь 2008 г.). «Цисплатин индуцирует p53-зависимую флик-подобное ингибирующее белок убиквитинирование в клетках рака яичников» . РАНКА . 68 (12): 4511–7. doi : 10.1158/0008-5472.can-08-0673 . PMID 18559494 .
- ^ Jump up to: а беременный Goudelock DM, Jiang K, Pereira E, et al. (Август 2003 г.). «Регуляторные взаимодействия между контрольной точкой киназы CHK1 и белками ДНК-зависимого комплекса протеинкиназы» . Журнал биологической химии . 278 (32): 29940–7. doi : 10.1074/jbc.m301765200 . PMID 12756247 .
- ^ Tian H, Faje AT, Lee SL, et al. (2002). «Индуцированное радиацией фосфорилирование CHK1 в S345 связано с p53-зависимыми путями остановки клеточного цикла» . Неоплазия . 4 (2): 171–80. doi : 10.1038/sj.neo.7900219 . PMC 1550321 . PMID 11896572 .
- ^ Zhao L, Samuels T, Winckler S, et al. (Январь 2003). «Циклин G1 обладает ингибирующей активностью роста, связанной с путями супрессора опухолей ARF-MDM2-P53 и PRB». Молекулярное исследование рака . 1 (3): 195–206. PMID 12556559 .
- ^ Jump up to: а беременный Ito A, Kawaguchi Y, Lai CH, et al. (Ноябрь 2002). «MDM2-HDAC1-опосредованный деацетилирование p53 требуется для его деградации» . Embo Journal . 21 (22): 6236–45. doi : 10.1093/emboj/cdf616 . PMC 137207 . PMID 12426395 .
- ^ Jump up to: а беременный Livengood JA, Scoggin Ke, Van Orden K, et al. (Март 2002 г.). «Транскрипционная активность p53 опосредуется через домен между SRC1 CBP/P300» . Журнал биологической химии . 277 (11): 9054–61. doi : 10.1074/jbc.m108870200 . PMID 11782467 .
- ^ Jump up to: а беременный Giebler HA, Lemasson I, Nyborg JK (июль 2000 г.). «P53 Рекрутирование белка, связывающего CREB, опосредованного с помощью фосфорилированного CREB: новый путь регуляции супрессора опухоли» . Молекулярная и клеточная биология . 20 (13): 4849–58. doi : 10.1128/mcb.20.13.4849-4858.2000 . PMC 85936 . PMID 10848610 .
- ^ Jump up to: а беременный Schneider E, Mentenarh M, Wagner P (ноябрь 1998 г.). «Регуляция активности Cak -киназы с помощью p53». Онкоген . 17 (21): 2733–41. doi : 10.1038/sj.onc.1202504 . PMID 9840937 . S2CID 6281777 .
- ^ Jump up to: а беременный KO LJ, Shieh Sy, Chen X, et al. (Декабрь 1997). «P53 фосфорилируется с помощью CDK7-циклина H в p36MAT1-зависимым образом» . Молекулярная и клеточная биология . 17 (12): 7220–9. doi : 10.1128/mcb.17.12.7220 . PMC 232579 . PMID 9372954 .
- ^ Yavuzer U, Smith GC, Bliss T, et al. (Июль 1998 г.). «Независимая ДНК-независимая активация ДНК-ПК, опосредованной посредством связи с ДНК-связывающим белком C1D» . Гены и развитие . 12 (14): 2188–99. doi : 10.1101/gad.12.14.2188 . PMC 317006 . PMID 9679063 .
- ^ Jump up to: а беременный Rizos H, Diefenbach E, Badhwar P, et al. (Февраль 2003 г.). «Ассоциация P14ARF с транскрипционным репрессором P120E4F усиливает ингибирование клеточного цикла» . Журнал биологической химии . 278 (7): 4981–9. doi : 10.1074/jbc.m210978200 . PMID 12446718 .
- ^ Сэнди П., Гостисса М., Фогал В. и др. (Январь 2000). «P53 участвует в P120E4F-опосредованном аресте роста» . Онкоген . 19 (2): 188–99. doi : 10.1038/sj.onc.1203250 . PMID 10644996 .
- ^ Jump up to: а беременный в Gallagher WM, Argentini M, Sierra V, et al. (Июнь 1999 г.). «MBP1: новый мутант p53-специфический партнер белка с онкогенными свойствами» . Онкоген . 18 (24): 3608–16. doi : 10.1038/sj.onc.1202937 . PMID 10380882 .
- ^ Cuddihy AR, Wong AH, Tam NW, et al. (Апрель 1999). «Двухцепочечная РНК-активированная протеинкиназа PKR физически ассоциируется с опухолевым супрессором p53 и фосфорилирует человеческий p53 на серине 392 in vitro». Онкоген . 18 (17): 2690–702. doi : 10.1038/sj.onc.1202620 . PMID 10348343 . S2CID 22467088 .
- ^ Shinobu N, Maeda T, Aso T, et al. (Июнь 1999 г.). «Физическое взаимодействие и функциональный антагонизм между фактором удлинения РНК -полимеразы II ELL и P53» . Журнал биологической химии . 274 (24): 17003–10. doi : 10.1074/jbc.274.24.17003 . PMID 10358050 .
- ^ Гроссман С.Р., Перес М., Кунг А.Л. и др. (Октябрь 1998). «Комплексы P300/MDM2 участвуют в MDM2-опосредованной деградации p53» . Молекулярная клетка . 2 (4): 405–15. doi : 10.1016/s1097-2765 (00) 80140-9 . PMID 9809062 .
- ^ W, Kim J, Roeder RG (июнь 2004 г.). «Упорядоченные кооперативные функции PRMT1, P300 и CARM1 в активации транскрипции с помощью p53» . Клетка . 117 (6): 735–48. doi : 10.1016/j.cell.2004.05.009 . PMID 15186775 .
- ^ Pastorcic M, Das HK (ноябрь 2000 г.). «Регуляция транскрипции гена пресенилина-1 человека с помощью транскрипционных факторов ETS и p53 Protooncogene» . Журнал биологической химии . 275 (45): 34938–45. doi : 10.1074/jbc.m005411200 . PMID 10942770 .
- ^ Jump up to: а беременный Wang XW, Yeh H, Schaeffer L, et al. (Июнь 1995 г.). «P53 модуляция активности восстановления нуклеотидных ударов, ассоциированной с TFIIH» . Природа генетика . 10 (2): 188–95. doi : 10.1038/ng0695-188 . HDL : 1765/54884 . PMID 7663514 . S2CID 38325851 .
- ^ Yu A, Fan HY, Liao D, et al. (Май 2000). «Активация p53 или потеря белка репарации синдрома Cockayne Group B вызывает хрупкость метафазы генов U1, U2 и 5S человека» . Молекулярная клетка . 5 (5): 801–10. doi : 10.1016/s1097-2765 (00) 80320-2 . PMID 10882116 .
- ^ Tsai Ry, McKay Rd (декабрь 2002 г.). «Нуклеолярный механизм, контролирующий пролиферацию клеток в стволовых клетках и раковых клетках» . Гены и развитие . 16 (23): 2991–3003. doi : 10.1101/gad.55671 . PMC 187487 . PMID 12464630 .
- ^ Peng YC, Kuo F, Breiding DE, et al. (Сентябрь 2001 г.). «AMF1 (GPS2) модулирует трансактивацию p53» . Молекулярная и клеточная биология . 21 (17): 5913–24. doi : 10.1128/mcb.21.17.5913-5924.2001 . PMC 87310 . PMID 11486030 .
- ^ Statcharasit P, Bijur GN, Zmijewski JW, et al. (Июнь 2002 г.). «Прямое, активирующее взаимодействие между гликогенсинтазойкиназой-3бета и p53 после повреждения ДНК» . Труды Национальной академии наук Соединенных Штатов Америки . 99 (12): 7951–5. Bibcode : 2002pnas ... 99.7951W . doi : 10.1073/pnas.122062299 . PMC 123001 . PMID 12048243 .
- ^ Jump up to: а беременный Акакура С., Йошида М., Йонда Ю. и соавт. (Май 2001). «Роль HSC70 в регуляции нуклеоцитоплазматического транспорта чувствительного к температуре р53 (р53VAL-135)» . Журнал биологической химии . 276 (18): 14649–57. doi : 10.1074/jbc.m100200200 . PMID 11297531 .
- ^ Ван С, Чен Дж (январь 2003 г.). «Фосфорилирование и связывание HSP90 опосредуют стабилизацию теплового шока p53» . Журнал биологической химии . 278 (3): 2066–71. doi : 10.1074/jbc.m206697200 . PMID 12427754 .
- ^ Peng Y, Chen L, Li C, et al. (Ноябрь 2001 г.). «Ингибирование MDM2 HSP90 способствует мутантной стабилизации p53» . Журнал биологической химии . 276 (44): 40583–90. doi : 10.1074/jbc.m102817200 . PMID 11507088 .
- ^ Chen D, Li M, Luo J, et al. (Апрель 2003 г.). «Прямое взаимодействие между HIF-1 Alpha и MDM2 модулирует функцию p53» . Журнал биологической химии . 278 (16): 13595–8. doi : 10.1074/jbc.c200694200 . PMID 12606552 .
- ^ Рави Р., Мукерджи Б., Бхуджвалла З.М. и др. (Январь 2000). «Регуляция ангиогенеза опухоли путем p53-индуцированной деградации гипоксии-индуцируемого фактора 1альфа» . Гены и развитие . 14 (1): 34–44. doi : 10.1101/gad.14.1.34 . PMC 316350 . PMID 10640274 .
- ^ Hansson LO, Friedler A, Freund S, et al. (Август 2002). «Два мотива последовательности из HIF-1alpha связываются с ДНК-связывающим сайтом p53» . Труды Национальной академии наук Соединенных Штатов Америки . 99 (16): 10305–9. Bibcode : 2002pnas ... 9910305H . doi : 10.1073/pnas.122347199 . PMC 124909 . PMID 12124396 .
- ^ WG, Kanekal M, Simon MC, et al. (Март 1998 г.). «Стабилизация P53 дикого типа с помощью гипоксии-индуцируемого фактора 1альфа». Природа . 392 (6674): 405–8. Bibcode : 1998natur.392..405a . doi : 10.1038/32925 . PMID 9537326 . S2CID 4423081 .
- ^ Kondo S, Lu Y, Debbas M, et al. (Апрель 2003 г.). «Характеристика клеток и мышей с геном, дефицитными для p53-связывающей киназы гомеодомен-взаимодействующей протеинкиназы 1 (HIPK1)» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (9): 5431–6. Bibcode : 2003pnas..100.5431K . doi : 10.1073/pnas.0530308100 . PMC 154362 . PMID 12702766 .
- ^ Hofmann TG, Möller A, Sirma H, et al. (Январь 2002). «Регуляция активности р53 путем его взаимодействия с гомеодомен-взаимодействующей протеинкиназой-2». Природная клеточная биология . 4 (1): 1–10. doi : 10.1038/ncb715 . PMID 11740489 . S2CID 37789883 .
- ^ Kim EJ, Park JS, UM SJ (август 2002 г.). «Идентификация и характеристика HIPK2, взаимодействующего с P73 и модулирующих функции семейства p53 in vivo» . Журнал биологической химии . 277 (35): 32020–8. doi : 10.1074/jbc.m200153200 . PMID 11925430 .
- ^ Имамура Т., Изуми Х., Нагатани Г. и др. (Март 2001 г.). «Взаимодействие с p53 усиливает связывание цисплатино-модифицированной ДНК с помощью белка группы высокой подвижности 1 белка» . Журнал биологической химии . 276 (10): 7534–40. doi : 10.1074/jbc.m008143200 . PMID 11106654 .
- ^ Dintilhac A, Bernués J (март 2002 г.). «HMGB1 взаимодействует со многими, по -видимому, не связанными белками, распознавая короткие аминокислотные последовательности» . Журнал биологической химии . 277 (9): 7021–8. doi : 10.1074/jbc.m108417200 . HDL : 10261/112516 . PMID 11748221 .
- ^ Wadhwa R, Yaguchi T, Hasan Mk, et al. (Апрель 2002 г.). «Член семейства HSP70, MOT-2/MTHSP70/GRP75, связывается с цитоплазматическим доменом секвестрации белка p53». Экспериментальные исследования клеток . 274 (2): 246–53. doi : 10.1006/excr.2002.5468 . PMID 11900485 .
- ^ Steffan JS, Kazantsev A, Spasic-Boskovic O, et al. (Июнь 2000 г.). «Белок болезни Хантингтона взаимодействует с p53 и CREB-связывающим белком и подавляет транскрипцию» . Труды Национальной академии наук Соединенных Штатов Америки . 97 (12): 6763–8. Bibcode : 2000pnas ... 97.6763s . doi : 10.1073/pnas.100110097 . PMC 18731 . PMID 10823891 .
- ^ Leung KM, Po LS, Tsang FC, et al. (Сентябрь 2002 г.). «Кандидатный супрессор опухоли ING1B может стабилизировать p53, нарушая регуляцию p53 с помощью MDM2». РАНКА . 62 (17): 4890–3. PMID 12208736 .
- ^ Garkavtsev I, Grigorian IA, Ossovskaya VS, et al. (Январь 1998). «Кандидат -супрессор опухоли P33ING1 сотрудничает с p53 в контроле роста клеток». Природа . 391 (6664): 295–8. Bibcode : 1998natur.391..295g . doi : 10.1038/34675 . PMID 9440695 . S2CID 4429461 .
- ^ Jump up to: а беременный Shiseki M, Nagashima M, Pedeux RM, et al. (Май 2003 г.). «P29ING4 и P28ING5 связываются с p53 и p300 и усиливают активность p53». РАНКА . 63 (10): 2373–8. PMID 12750254 .
- ^ Tsai KW, Tseng HC, Lin WC (октябрь 2008 г.). «Два события распыления колебаний влияют на субнаклеарную локализацию белка ING4». Экспериментальные исследования клеток . 314 (17): 3130–41. doi : 10.1016/j.yexcr.2008.08.002 . PMID 18775696 .
- ^ Чанг (март 2002 г.). «Неикирин-C-концерн Ikappa Balpha физически взаимодействует с p53 in vivo и диссоциирует в ответ на апоптотический стресс, гипоксию, повреждение ДНК и трансформирующее фактор роста 1-опосредованное подавление роста» . Журнал биологической химии . 277 (12): 10323–31. doi : 10.1074/jbc.m106607200 . PMID 11799106 .
- ^ Jump up to: а беременный Курки С., Латонен Л, Лайхо М (октябрь 2003 г.). «Клеточный стресс и повреждение ДНК вызывают временные различные комплексы MDM2, P53 и PML и специфичную для повреждения ядерная перемещение» . Журнал сотовой науки . 116 (Pt 19): 3917–25. doi : 10.1242/jcs.00714 . PMID 12915590 .
- ^ Jump up to: а беременный Freeman DJ, Li AG, Wei G, et al. (Февраль 2003 г.). «Супрессор опухоли PTEN регулирует уровни и активность белка p53 посредством фосфатазы, зависимых и -независимых механизмов» . Раковая клетка . 3 (2): 117–30. doi : 10.1016/s1535-6108 (03) 00021-7 . PMID 12620407 .
- ^ Jump up to: а беременный Zhang Y, Xiong Y, Yarbrough WG (март 1998 г.). «ARF способствует деградации MDM2 и стабилизирует делецию локуса P53: ARF-INK4A ухудшает как пути подавления опухоли RB, так и p53» . Клетка . 92 (6): 725–34. doi : 10.1016/s0092-8674 (00) 81401-4 . PMID 9529249 .
- ^ Badciong JC, Haas AL (декабрь 2002 г.). «MDMX - это безымянная убиквитин -лигаза, способная синергически усилить убиквитинирование MDM2» . Журнал биологической химии . 277 (51): 49668–75. doi : 10.1074/jbc.m208593200 . PMID 12393902 .
- ^ Shvarts A, Bazuine M, Dekker P, et al. (Июль 1997). «Выделение и идентификация человеческого гомолога нового p53-связывающего белка, MDMX» (PDF) . Геномика . 43 (1): 34–42. doi : 10.1006/geno.1997.4775 . HDL : 2066/142231 . PMID 9226370 . S2CID 11794685 .
- ^ Frade R, Balbo M, Barel M (декабрь 2000 г.). «RB18A, чей ген локализуется на хромосоме 17Q12-Q21.1, регулирует трансактивирующую активность in vivo p53». РАНКА . 60 (23): 6585–9. PMID 11118038 .
- ^ Drané P, Barel M, Balbo M, et al. (Декабрь 1997). «Идентификация RB18A, новый регуляторный белок P53 205 кДа, который разделяет антигенные и функциональные свойства с p53» . Онкоген . 15 (25): 3013–24. doi : 10.1038/sj.onc.1201492 . PMID 9444950 .
- ^ Hu MC, Qiu WR, Wang YP (ноябрь 1997 г.). «JNK1, JNK2 и JNK3-P53 N-концевые сериновые 34 киназы» . Онкоген . 15 (19): 2277–87. doi : 10.1038/sj.onc.1201401 . PMID 9393873 .
- ^ Lin Y, Khohlatchev A, Figeys D, et al. (Декабрь 2002 г.). «Смертельный белок 4 связывает MST1 и увеличивает MST1-индуцированный апоптоз» . Журнал биологической химии . 277 (50): 47991–8001. doi : 10.1074/jbc.m202630200 . PMID 12384512 .
- ^ Taniura H, Matsumoto K, Yoshikawa K (июнь 1999 г.). «Физические и функциональные взаимодействия супрессора роста нейронов Necdin с p53» . Журнал биологической химии . 274 (23): 16242–8. doi : 10.1074/jbc.274.23.16242 . PMID 10347180 .
- ^ Daniely Y, Dimitrova DD, Borowiec JA (август 2002 г.). «Стресс-зависимая мобилизация нуклеолинов, опосредованная формацией комплекса р53-нуклеолина» . Молекулярная и клеточная биология . 22 (16): 6014–22. doi : 10.1128/mcb.22.16.6014-6022.2002 . PMC 133981 . PMID 12138209 .
- ^ Colaluca In, Tosoni D, Nuciforo P, et al. (Январь 2008 г.). «Оцептивно контролирует активность супрессора опухоли p53». Природа . 451 (7174): 76–80. Bibcode : 2008natur.451 ... 76c . doi : 10.1038/nature06412 . PMID 18172499 . S2CID 4431258 .
- ^ Jump up to: а беременный в Choy Mk, Movassagh M, Siggens L, et al. (Июнь 2010 г.). «Высокопроизводительное секвенирование идентифицирует STAT3 как ДНК-ассоциированный фактор для p53-NF-KAPPAB-зависимой экспрессии гена при сердечной недостаточке человека» . Медицина генома . 2 (6): 37. doi : 10.1186/gm158 . PMC 2905097 . PMID 20546595 .
- ^ Jump up to: а беременный Zhang Y, Wolf GW, Bhat K, et al. (Декабрь 2003 г.). «Рибосомный белок L11 отрицательно регулирует онкопротеин MDM2 и опосредует p53-зависимый путь рибосомально-стрессовой контрольной точки» . Молекулярная и клеточная биология . 23 (23): 8902–12. doi : 10.1128/mcb.23.23.8902-8912.2003 . PMC 262682 . PMID 14612427 .
- ^ Nikolaev AY, Li M, Puskas N, et al. (Январь 2003). «PARC: цитоплазматический якорь для p53» . Клетка . 112 (1): 29–40. doi : 10.1016/s0092-8674 (02) 01255-2 . PMID 12526791 .
- ^ Malanga M, Pleschke JM, Kleczkowska HE, et al. (Май 1998). «Поли (ADP-рибоза) связывается со специфическими доменами p53 и изменяет его функции связывания ДНК» . Журнал биологической химии . 273 (19): 11839–43. doi : 10.1074/jbc.273.19.11839 . PMID 9565608 .
- ^ Кахио Т., Нишида Т., Ясуда Х (сентябрь 2001 г.). «Вовлечение PIAS1 в сумоилировании опухолевого супрессора p53» . Молекулярная клетка . 8 (3): 713–8. doi : 10.1016/s1097-2765 (01) 00349-5 . PMID 11583632 .
- ^ Wulf GM, Liou YC, Ryo A, et al. (Декабрь 2002 г.). «Роль PIN1 в регуляции стабильности р53 и трансактивации p21 и контрольно -пропускных пунктов клеточного цикла в ответ на повреждение ДНК» . Журнал биологической химии . 277 (50): 47976–9. doi : 10.1074/jbc.c200538200 . PMID 12388558 .
- ^ Zacchi P, Gostissa M, Uchida T, et al. (Октябрь 2002). «Пролилазомераза PIN1 выявляет механизм контроля функций р53 после генотоксических оскорблений». Природа . 419 (6909): 853–7. Bibcode : 2002natur.419..853z . doi : 10.1038/nature01120 . PMID 12397362 . S2CID 4311658 .
- ^ Huang SM, Schönthal AH, Stallcup MR (апрель 2001 г.). «Улучшение p53-зависимой активации гена транскрипционным коактиватором ZAC1». Онкоген . 20 (17): 2134–43. doi : 10.1038/sj.onc.1204298 . PMID 11360197 . S2CID 21331603 .
- ^ Xie S, Wu H, Wang Q, et al. (Ноябрь 2001 г.). «PLK3 функционально связывает повреждение ДНК с остановкой клеточного цикла и апоптоз, по крайней мере частично через путь p53» . Журнал биологической химии . 276 (46): 43305–12. doi : 10.1074/jbc.m106050200 . PMID 11551930 .
- ^ Bahassi EM, Conn CW, Myer DL, et al. (Сентябрь 2002 г.). «Пополо-подобная киназа млекопитающая 3 (PLK3) представляет собой многофункциональный белок, участвующий в путях реакции на стресс». Онкоген . 21 (43): 6633–40. doi : 10.1038/sj.onc.1205850 . PMID 12242661 . S2CID 24106070 .
- ^ Simons A, Melamed-Bessudo C, Wolkowicz R, et al. (Январь 1997). «Пакт: клонирование и характеристика клеточного связывающего белка p53, который взаимодействует с RB» . Онкоген . 14 (2): 145–55. doi : 10.1038/sj.onc.1200825 . PMID 9010216 .
- ^ Fusaro G, Dasgupta P, Rastogi S, et al. (Ноябрь 2003). «Прогибитин индуцирует транскрипционную активность p53 и экспортируется из ядра при апоптотической передаче сигналов» . Журнал биологической химии . 278 (48): 47853–61. doi : 10.1074/jbc.m305171200 . PMID 14500729 .
- ^ Fogal V, Gostissa M, Sandy P, et al. (Ноябрь 2000). «Регуляция активности р53 в ядерных телах специфической изоформой PML» . Embo Journal . 19 (22): 6185–95. doi : 10.1093/emboj/19.22.6185 . PMC 305840 . PMID 11080164 .
- ^ Guo A, Salomoni P, Luo J, et al. (Октябрь 2000). «Функция PML в p53-зависимом апоптозе». Природная клеточная биология . 2 (10): 730–6. doi : 10.1038/35036365 . PMID 11025664 . S2CID 13480833 .
- ^ Jump up to: а беременный Zhang Z, Zhang R (март 2008 г.). «Активатор протеасомы PA28 гамма регулирует p53, усиливая его MDM2-опосредованную деградацию» . Embo Journal . 27 (6): 852–64. doi : 10.1038/emboj.2008.25 . PMC 2265109 . PMID 18309296 .
- ^ Lim St, Chen XL, Lim Y, et al. (Январь 2008 г.). «Ядерный FAK способствует пролиферации и выживанию клеток посредством деградации р53 с Фермой» . Молекулярная клетка . 29 (1): 9–22. doi : 10.1016/j.molcel.2007.11.031 . PMC 2234035 . PMID 18206965 .
- ^ Bernal JA, Luna R, Espina A, et al. (Октябрь 2002). «Человеческий секурин взаимодействует с p53 и модулирует p53-опосредованную транскрипционную активность и апоптоз». Природа генетика . 32 (2): 306–11. doi : 10.1038/ng997 . PMID 12355087 . S2CID 1770399 .
- ^ Stürzbecher HW, Donzelmann B, Henning W, et al. (Апрель 1996 г.). «P53 связан непосредственно с гомологичными процессами рекомбинации через взаимодействие белка RAD51/RecA» . Embo Journal . 15 (8): 1992–2002. doi : 10.1002/j.1460-2075.1996.tb00550.x . PMC 450118 . PMID 8617246 .
- ^ Buchhop S, Gibson MK, Wang XW, et al. (Октябрь 1997). «Взаимодействие p53 с белком RAD51 человека» . Исследование нуклеиновых кислот . 25 (19): 3868–74. doi : 10.1093/nar/25.19.3868 . PMC 146972 . PMID 9380510 .
- ^ Leng RP, Lin Y, Ma W, et al. (Март 2003 г.). «PIRH2, индуцированная P53-индуцированная убиквитин-белковая лигаза, способствует деградации p53» . Клетка . 112 (6): 779–91. doi : 10.1016/s0092-8674 (03) 00193-4 . PMID 12654245 .
- ^ Sheng Y, Laister RC, Lemak A, et al. (Декабрь 2008 г.). «Молекулярная основа опосредованного PIRH2-опосредованным UbiquityLation P53» . Природа структурная и молекулярная биология . 15 (12): 1334–42. doi : 10.1038/nsmb.1521 . PMC 4075976 . PMID 19043414 .
- ^ Романа Ли, Уиллерс Х., Благосклонни М.В. и др. (Декабрь 2004 г.). «Взаимодействие р53 с белком репликации А А опосредует подавление гомологичной рекомбинации». Онкоген . 23 (56): 9025–33. doi : 10.1038/sj.onc.1207982 . PMID 15489903 . S2CID 23482723 .
- ^ Riva F, Zuco V, Vink AA, et al. (Декабрь 2001 г.). «УФ-индуцированный разрез ДНК и рекрутирование ядерного антигена клеток для репарации для репарации, которые происходят независимо от взаимодействия белка P53-репликации в клетках карциномы дикого типа p53 и мутантной карциномы яичника». Канцерогенез . 22 (12): 1971–8. doi : 10.1093/карцин/22.12.1971 . PMID 11751427 .
- ^ Lin J, Yang Q, Yan Z, et al. (Август 2004 г.). «Ингибирование S100B восстанавливает уровни р53 в первичных клетках рака злокачественной меланомы» . Журнал биологической химии . 279 (32): 34071–7. doi : 10.1074/jbc.m405419200 . PMID 15178678 .
- ^ Jump up to: а беременный Minty A, Dumont X, Kaghad M, et al. (Ноябрь 2000). «Ковалентная модификация p73Alpha с помощью SUMO-1. Двухгибридный скрининг с p73 идентифицирует новые белки-интертакты SUMO-1 и мотив взаимодействия SUMO-1» . Журнал биологической химии . 275 (46): 36316–23. doi : 10.1074/jbc.m004293200 . PMID 10961991 .
- ^ Jump up to: а беременный Ivanchuk SM, Mondal S, Rutka JT (июнь 2008 г.). «P14ARF взаимодействует с DAXX: влияние на HDM2 и P53» . Клеточный цикл . 7 (12): 1836–50. doi : 10.4161/cc.7.12.6025 . PMID 18583933 .
- ^ Jump up to: а беременный Lee D, Kim JW, Seo T, et al. (Июнь 2002 г.). «Комплекс SWI/SNF взаимодействует с супрессором опухоли p53 и необходим для активации p53-опосредованной транскрипции» . Журнал биологической химии . 277 (25): 22330–7. doi : 10.1074/jbc.m111987200 . PMID 11950834 .
- ^ Young PJ, Day PM, Zhou J, et al. (Январь 2002). «Прямое взаимодействие между белком моторного нейрона выживания и p53 и его взаимосвязи с мышечной атрофией позвоночника» . Журнал биологической химии . 277 (4): 2852–9. doi : 10.1074/jbc.m108769200 . PMID 11704667 .
- ^ Сето Е., Ушева А., Замбетти Г.П. и соавт. (Декабрь 1992). «P53 дикого типа связывается с TATA-связывающим белком и подавляет транскрипцию» . Труды Национальной академии наук Соединенных Штатов Америки . 89 (24): 12028–32. Bibcode : 1992pnas ... 8912028s . doi : 10.1073/pnas.89.24.12028 . PMC 50691 . PMID 1465435 .
- ^ CVEKL A, Kashanchi F, Brady JN, et al. (Июнь 1999 г.). «Взаимодействие PAX-6 с TATA-BOX-связывающим белком и белком ретинобластомы». Расследование офтальмология и визуальная наука . 40 (7): 1343–50. PMID 10359315 .
- ^ McPherson LA, Loktev AV, Weigel RJ (ноябрь 2002 г.). «Опухолевая активность супрессора AP2ALPHA, опосредованная путем прямого взаимодействия с p53» . Журнал биологической химии . 277 (47): 45028–33. doi : 10.1074/jbc.m208924200 . PMID 12226108 .
- ^ Sørensen TS, Girling R, Lee CW, et al. (Октябрь 1996). «Функциональное взаимодействие между DP-1 и P53» . Молекулярная и клеточная биология . 16 (10): 5888–95. doi : 10.1128/mcb.16.10.5888 . PMC 231590 . PMID 8816502 .
- ^ Green DR, Chipuk JE (июль 2006 г.). «P53 и метаболизм: внутри Тигара» . Клетка . 126 (1): 30–2. doi : 10.1016/j.cell.2006.06.032 . PMID 16839873 .
- ^ Gobert C, Skladanowski A, Larsen AK (август 1999 г.). «Взаимодействие между P53 и ДНК-топоизомеразой I по-разному регулируется в клетках с диким типом и мутантом p53» . Труды Национальной академии наук Соединенных Штатов Америки . 96 (18): 10355–60. Bibcode : 1999pnas ... 9610355G . doi : 10.1073/pnas.96.18.10355 . PMC 17892 . PMID 10468612 .
- ^ Mao Y, Mehl IR, Muller Mt (февраль 2002 г.). «Субноклеарное распределение топоизомеразы I связано с постоянной транскрипцией и статусом p53» . Труды Национальной академии наук Соединенных Штатов Америки . 99 (3): 1235–40. Bibcode : 2002pnas ... 99.1235M . doi : 10.1073/pnas.022631899 . PMC 122173 . PMID 11805286 .
- ^ Jump up to: а беременный Cowell IG, Okorokov AL, Cutts SA, et al. (Февраль 2000 г.). «Человеческая топоизомераза Iialpha и Iibeta взаимодействуют с C-концевой областью p53». Экспериментальные исследования клеток . 255 (1): 86–94. doi : 10.1006/excr.1999.4772 . PMID 10666337 .
- ^ Derbyshire DJ, Basu BP, Serpell LC, et al. (Июль 2002 г.). «Кристаллическая структура человеческих доменов 53BP1 BRCT, связанная с супрессором опухоли p53» . Embo Journal . 21 (14): 3863–72. doi : 10.1093/emboj/cdf383 . PMC 126127 . PMID 12110597 .
- ^ Ekblad CM, Friedler A, Veprintsev D, et al. (Март 2004 г.). «Сравнение доменов BRCT BRCA1 и 53BP1: биофизический анализ» . Белковая наука . 13 (3): 617–25. doi : 10.1110/ps.03461404 . PMC 2286730 . PMID 14978302 .
- ^ Ло К.В., Кан Х.М., Чан Л.Н. и др. (Март 2005 г.). «Светочная цепь динамина 8 кДа связывается с p53-связывающим белком 1 и опосредует вызванное повреждением ДНК накопление ядер P53» . Журнал биологической химии . 280 (9): 8172–9. doi : 10.1074/jbc.m411408200 . PMID 15611139 .
- ^ Joo Ws, Jeffrey PD, Cantor SB, et al. (Март 2002 г.). «Структура области BRCT 53BP1, связанная с p53, и ее сравнение со структурой BRCA1 BRCT» . Гены и развитие . 16 (5): 583–93. doi : 10.1101/gad.959202 . PMC 155350 . PMID 11877378 .
- ^ Derbyshire DJ, Basu BP, Date T, et al. (Октябрь 2002). «Очистка, кристаллизация и предварительный рентгеновский анализ доменов BRCT человека 53BP1, связанных с супрессором опухоли p53». Acta Crystallographica d . 58 (Pt 10 Pt 2): 1826–9. Bibcode : 2002ccrd..58.1826d . doi : 10.1107/s0907444901010910 . PMID 12351827 .
- ^ Jump up to: а беременный Iwabuchi K, Bartel PL, Li B, et al. (Июнь 1994 г.). «Два клеточных белка, которые связываются с диким типом, но не мутантом p53» . Труды Национальной академии наук Соединенных Штатов Америки . 91 (13): 6098–102. Bibcode : 1994pnas ... 91.6098i . doi : 10.1073/pnas.91.13.6098 . PMC 44145 . PMID 8016121 .
- ^ Наумвский Л., Клири М.Л. (июль 1996 г.). «P53-связывающий белок 53BP2 также взаимодействует с BC12 и препятствует прогрессированию клеточного цикла при G2/M» . Молекулярная и клеточная биология . 16 (7): 3884–92. doi : 10.1128/mcb.16.7.3884 . PMC 231385 . PMID 8668206 .
- ^ Tomasini R, Samir AA, Carrier A, et al. (Сентябрь 2003 г.). «TP53INP1S и гомеодомен-взаимодействие протеинкиназы-2 (HIPK2) являются партнерами в регуляции активности p53» . Журнал биологической химии . 278 (39): 37722–9. doi : 10.1074/jbc.m301979200 . PMID 12851404 .
- ^ Okamura S, Arakawa H, Tanaka T, et al. (Июль 2001 г.). «p53dinp1, индуцируемый ген p53, регулирует p53-зависимый апоптоз» . Молекулярная клетка . 8 (1): 85–94. doi : 10.1016/s1097-2765 (01) 00284-2 . PMID 11511362 .
- ^ Li L, Liao J, Ruland J, et al. (Февраль 2001 г.). «Регуляторная петля TSG101/MDM2 модулирует деградацию MDM2 и контроль обратной связи MDM2/P53» . Труды Национальной академии наук Соединенных Штатов Америки . 98 (4): 1619–24. Bibcode : 2001pnas ... 98.1619L . doi : 10.1073/pnas.98.4.1619 . PMC 29306 . PMID 11172000 .
- ^ Lyahovich A, MP Shekhar (апрель 2003 г.). «Образование супрамолекулярного комплекса между RAD6 и белками пути p53 во время ответа, вызванного повреждением ДНК» . Молекулярная и клеточная биология . 23 (7): 2463–75. doi : 10.1128/mcb.23.7.2463-2475.2003 . PMC 150718 . PMID 12640129 .
- ^ Shen Z, Pardington-Purtymun PE, Comeaux JC, et al. (Октябрь 1996). «Ассоциации UBE2I с белками RAD52, UBL1, P53 и RAD51 в дрожжевой двухгибридной системе» . Геномика . 37 (2): 183–6. doi : 10.1006/geno.1996.0540 . PMID 8921390 .
- ^ Bernier-Villamor V, Sampson DA, Matunis MJ, et al. (Февраль 2002 г.). «Структурная основа для E2-опосредованного конъюгации SUMO, выявленная комплексом между убиквитином-конъюгивающим ферментом UBC9 и Rangap1» . Клетка . 108 (3): 345–56. doi : 10.1016/s0092-8674 (02) 00630-x . PMID 11853669 .
- ^ Sehat B, Andersson S, Girnita L, et al. (Июль 2008 г.). «Идентификация C-CBL в качестве новой лигазы для рецептора-инсулиноподобного фактора роста-I с различными ролями MDM2 в убиквитинировании и эндоцитозе рецептора». РАНКА . 68 (14): 5669–77. doi : 10.1158/0008-5472.can-07-6364 . PMID 18632619 .
- ^ Song MS, Song SJ, Kim Sy, et al. (Июль 2008 г.). «Опухолевой супрессор RASSF1A способствует самоибицитивации MDM2, нарушая комплекс MDM2-DAXX-HAUSP» . Embo Journal . 27 (13): 1863–74. doi : 10.1038/emboj.2008.115 . PMC 2486425 . PMID 18566590 .
- ^ Yang W, Dicker DT, Chen J, et al. (Март 2008 г.). «CARPS усиливает оборот P53, разлагая 14-3-3SIGMA и стабилизируя MDM2» . Клеточный цикл . 7 (5): 670–82. doi : 10.4161/cc.7.5.5701 . PMID 18382127 .
- ^ Abe Y, Oda-Sato E, Tobiume K, et al. (Март 2008 г.). «Передача передачи сигналов Hedgehog p53-опосредованное опухоль-подавление путем активации MDM2» . Труды Национальной академии наук Соединенных Штатов Америки . 105 (12): 4838–43. Bibcode : 2008pnas..105.4838a . doi : 10.1073/pnas.0712216105 . PMC 2290789 . PMID 18359851 .
- ^ Dohmesen C, Koeppel M, Dobbelstein M (январь 2008 г.). «Специфическое ингибирование MDM2-опосредованного Neddilation с помощью TIP60». Клеточный цикл . 7 (2): 222–31. doi : 10.4161/cc.7.2.5185 . PMID 18264029 . S2CID 8023403 .
- ^ Li M, Chen D, Shiloh A, et al. (Апрель 2002 г.). «Деубиквитинирование p53 с помощью Hausp является важным путем для стабилизации p53». Природа . 416 (6881): 648–53. Bibcode : 2002natur.416..648L . doi : 10.1038/nature737 . PMID 11923872 . S2CID 4389394 .
- ^ Brosh RM, Karmakar P, Sommers JA, et al. (Сентябрь 2001 г.). «P53 модулирует экзонуклеазной активности белка синдрома Вернера» . Журнал биологической химии . 276 (37): 35093–102. doi : 10.1074/jbc.m103332200 . PMID 11427532 .
- ^ Chang NS, Pratt N, Heath J, et al. (Февраль 2001 г.). «Индукция гиалуронидазы доменной доменной оксидоредуктазы WW, которая усиливает цитотоксичность фактора некроза опухоли» . Журнал биологической химии . 276 (5): 3361–70. doi : 10.1074/jbc.m007140200 . PMID 11058590 .
- ^ Okamoto T, Izumi H, Imamura T, et al. (Декабрь 2000 г.). «Прямое взаимодействие p53 с белком, связывающим Y-бокса, YB-1: механизм регуляции экспрессии генов человека». Онкоген . 19 (54): 6194–202. doi : 10.1038/sj.onc.1204029 . PMID 11175333 . S2CID 19222684 .
- ^ Келли К.Д., Миллер К.Р., Тодд А. и др. (Май 2010). «Ypel3, p53-регулируемый ген, который вызывает клеточное старение» . РАНКА . 70 (9): 3566–75. doi : 10.1158/0008-5472.can-09-3219 . PMC 2862112 . PMID 20388804 .
- ^ Уотерман М.Дж., Ставриди Э.С., Уотерман Дж.Л. и др. (Июнь 1998 г.). «Атм-зависимая активация p53 включает дефосфорилирование и связь с 14-3-3 белками». Природа генетика . 19 (2): 175–8. doi : 10.1038/542 . PMID 9620776 . S2CID 26600934 .
- ^ Liu J, Grogan L, Nau MM, et al. (Апрель 2001 г.). «Физическое взаимодействие между p53 и первичным ответом геном Egr-1». Международный журнал онкологии . 18 (4): 863–70. doi : 10.3892/ijo.18.4.863 . PMID 11251186 .
- ^ Bai L, Merchant JL (июль 2001 г.). «ZBP-89 способствует остановке роста путем стабилизации p53» . Молекулярная и клеточная биология . 21 (14): 4670–83. doi : 10.1128/mcb.21.14.4670-4683.2001 . PMC 87140 . PMID 11416144 .
- ^ Yamakuchi M, Lowenstein CJ (март 2009 г.). «MiR-34, SIRT1 и P53: петля обратной связи» . Клеточный цикл . 8 (5): 712–5. doi : 10.4161/cc.8.5.7753 . PMID 19221490 .
- ^ Wang Y, Zhang J, Li J, et al. (Май 2019). «Circrna_014511 влияет на радиочувствительность мезенхимальных стволовых клеток костного мозга путем связывания с miR-29b-2-5p» . Боснийский журнал базовых медицинских наук . 19 (2): 155–163. doi : 10.17305/bjbms.2019.3935 . PMC 6535393 . PMID 30640591 .
Внешние ссылки
[ редактировать ]- "P53 Base Base" . Lane Group в Институте молекулярной и клеточной биологии (IMCB), Сингапур. Архивировано из оригинала 2006-01-03 . Получено 2008-04-06 .
- Generons/ncbi/nih/your intrint на синдроме Li-Fraumeni
- Опухолевый белок p53 @ omim
- P53 Восстановление функции
- P53 @ Атлас генетики и цитогенетики в онкологии и гематологии
- TP53 Gene @ GeneCard
- P53 Новости предоставлены организацией Insciences
- Goodsel DS (2002-07-01). «P53 -супрессор опухоли» . Молекула месяца . RCSB Белковой банк данных . Получено 2008-04-06 .
- Soussi T. "P53 Веб -сайт" . Получено 2008-04-06 .
- Живые LFS некоммерческий синдром Li-Fraumeni Организация поддержки пациентов
- George Pantziarka TP53 Доверяйте группе поддержки из Великобритании для людей с синдромом Ли-Фраумени или другими расстройствами, связанными с TP53
- IARC TP53 База данных о соматических мутациях, поддерживаемая в IARC, Лион, Магали Оливье
- PDBE-KB предоставляет обзор всей информации о структуре, доступной в PDB для человека P53.
- Научные конформационные изменения p53 при связывании с ДНК