Норэтистерон
 | |
 | |
| Клинические данные | |
|---|---|
| Торговые названия | Много |
| Other names | NET; Norethindrone; NSC-9564; LG-202; Ethinylnortestosterone; Norpregneninolone; Anhydrohydroxy-norprogesterone; Ethinylestrenolone; 17α-Ethynyl-19-nortestosterone; 17α-Ethynylestra-4-en-17β-ol-3-one; 17α-Hydroxy-19-norpregn-4-en-20-yn-3-one |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a604034 |
| License data | |
| Routes of administration | By mouth, intramuscular injection (as NETE) |
| Drug class | Progestogen (medication); Progestin |
| ATC code | |
| Legal status | |
| Legal status | |
| Pharmacokinetic data | |
| Bioavailability | 47–73% (mean 64%)[2][3] |
| Protein binding | 97%:[4] Albumin: 61%;[4] SHBG: 36%[4] |
| Metabolism | Mainly CYP3A4 (liver);[5] also 5α-/5β-reductase, 3α-/3β-HSD, and aromatase |
| Elimination half-life | 5.2–12.8 hours (mean 8.0 hours)[2] |
| Identifiers | |
| CAS Number | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.000.619 |
| Chemical and physical data | |
| Formula | C20H26O2 |
| Molar mass | 298.426 g·mol−1 |
| 3D model (JSmol) | |
| Melting point | 203 to 204 °C (397 to 399 °F) |
| (verify) | |
Норэтистерон , также известный как норэтиндрон и продаваемый под многими торговыми марками, представляет собой прогестиновый препарат, используемый в противозачаточных таблетках , менопаузальной гормональной терапии и для лечения гинекологических заболеваний . [ 4 ] [ 6 ] Лекарство доступно как в низких, так и в высоких дозах, как отдельно, так и в сочетании с эстрогеном . [ 6 ] [ 7 ] Его применяют внутрь или, как норэтистерона энантат , путем инъекции в мышцу . [ 4 ] [ 6 ] [ 8 ]
Побочные эффекты норэтистерона включают нарушения менструального цикла , головные боли , тошноту , болезненность молочных желез , изменения настроения , прыщи , усиленный рост волос . [ 9 ] [ 10 ] Норэтистерон представляет собой прогестин или синтетический прогестаген и, следовательно, является агонистом рецептора прогестерона , биологической мишени прогестагенов, таких как прогестерон . [ 4 ] [ 6 ] Он обладает слабой андрогенной и эстрогенной активностью, преимущественно в высоких дозах, и не имеет другой важной гормональной активности. [ 4 ] [ 11 ]
Норэтистерон был открыт в 1951 году и стал одним из первых разработанных прогестинов. [ 12 ] [ 13 ] [ 14 ] Впервые он был представлен для медицинского применения отдельно в 1957 году, а в 1963 году — в сочетании с эстрогеном для использования в качестве противозачаточных таблеток. [14][15] It is sometimes referred to as a "first-generation" progestin.[16][17] Along with desogestrel, it is one of the only progestins that is widely available as a progestogen-only "mini pill" for birth control.[18][19] Norethisterone is marketed widely throughout the world.[20] It is available as a generic medication.[21] In 2021, it was the 140th most commonly prescribed medication in the United States, with more than 4 million prescriptions.[22][23] It is on the World Health Organization's List of Essential Medicines.[24]
Medical uses
[edit]Norethisterone is used as a hormonal contraceptive in combination with an estrogen – usually ethinylestradiol (EE) – in combined oral contraceptive pills and alone in progestogen-only pills.
Another medical use of norethisterone is to alleviate endometriosis related pain. In fact, 50% of patients who received medical or surgical treatment for endometriosis-related pelvic pain have benefited from progestin therapy. This could be due to the fact that norethisterone induces endometrial proliferation during secretory phase, which has been shown to alleviate endometrial pain complaints. Another way in which norethisterone may be acting to reduce endometrial pain is via inhibition of ovulation. Endometriosis pain and discomfort is worse during ovulation.[25]
| Composition | Dose | Brand names | Use |
|---|---|---|---|
| NET only | Low (e.g., 0.35 mg) | Multiple[a] | Progestogen-only oral contraceptive |
| NET or NETA only | High (e.g., 5 mg, 10 mg) | Multiple[b] | Gynecological disorders and other uses |
| NETE only | Injection (e.g., 200 mg) | Multiple[c] | Progestogen-only injectable contraceptive |
| NET or NETA with ethinylestradiol | Low (e.g., 0.4 mg, 0.5 mg, 0.75 mg, 1 mg, 1.5 mg) | Multiple[d] | Combined oral contraceptive |
| NET with mestranol | Low (e.g., 1 mg, 2 mg) | Multiple[e] | Combined oral contraceptive |
| NETA with estradiol | Low (e.g., 0.1 mg, 0.5 mg) | Multiple[f] | Combined menopausal hormone therapy |
| NETE with estradiol valerate | Injection (e.g., 50 mg) | Multiple[g] | Combined injectable contraceptive |
| Abbreviations: NET = Norethisterone. NETA = Norethisterone acetate. NETE = Norethisterone enanthate. Sources: [26][27] [28][29] Notes: | |||
Contraindications
[edit]High-dose (10 mg/day) norethisterone has been associated with hepatic veno-occlusive disease, and because of this adverse effect, norethisterone should not be given to patients undergoing allogeneic bone marrow transplantation, as it has been associated with substantially lower one-year survival post-transplantation.[30]: 217 [31]
Side effects
[edit]At contraceptive and hormone replacement dosages (0.35 to 1 mg/day), norethisterone has essentially progestogenic side effects only. In most clinical studies of norethisterone for contraception or menopausal hormone therapy, the drug has been combined with an estrogen, and for this reason, it is difficult to determine which of the side effects were caused by norethisterone and which of them were caused by estrogen in such research. However, NETE, an intramuscularly administered prodrug of norethisterone which is used as a long-acting contraceptive, is used without an estrogen, and hence can be employed as a surrogate for norethisterone in terms of understanding its effects and tolerability. In clinical studies, the most common side effect with NETE has been menstrual disturbances, including prolonged bleeding or spotting and amenorrhea.[30]: 253 Other side effects have included periodic abdominal bloating and breast tenderness, both of which are thought to be due to water retention and can be relieved with diuretics.[30]: 253 There has been no association with weight gain, and blood pressure, blood clotting, and glucose tolerance have all remained normal.[30]: 253 However, a decrease in HDL cholesterol has been observed.[30]: 253
At high doses (5 to 60 mg/day), for instance those used in the treatment of gynecological disorders, norethisterone can cause hypogonadism due to its antigonadotropic effects and can have estrogenic and weak androgenic side effects.
High doses of NETA (10 mg/day) have been associated with abnormal liver function tests, including significant elevations in liver enzymes.[32][33][34] These liver enzymes included lactate dehydrogenase and glutamate pyruvate transaminase.[34] Although they were described as having no clinical relevance,[34] the elevated liver enzymes associated with NETA may have precluded its further development for male hormonal contraception.[32][33]
Androgenic
[edit]Due to its weak androgenic activity, norethisterone can produce androgenic side effects such as acne, hirsutism, and voice changes of slight severity in some women at high dosages (e.g., 10 to 40 mg/day).[10] This is notably not the case with combined oral contraceptives that contain norethisterone and EE, however.[11] Such formulations contain low dosages of norethisterone (0.35 to 1 mg/day)[11] in combination with estrogen and are actually associated with improvement in acne symptoms.[35][36] In accordance, they are in fact approved by the FDA for the treatment of acne in women in the United States.[35][36] The improvement in acne symptoms is believed to be due to a 2- to 3-fold increase in sex hormone-binding globulin (SHBG) levels and a consequent decrease in free testosterone levels caused by EE, which results in an overall decrease in androgenic signaling in the body.[37]
The sebaceous glands are highly androgen-sensitive and their size and activity are potential markers of androgenic effect.[38] A high dosage of 20 mg/day norethisterone or NETA has been found to significantly stimulate the sebaceous glands, whereas lower dosages of 5 mg/day and 2.5 mg/day norethisterone and NETA, respectively, did not significantly stimulate sebum production and were consequently regarded as devoid of significant androgenicity.[38] Conversely, dosages of norethisterone of 0.5 to 3 mg/day have been found to dose-dependently decrease SHBG levels (and hence to suppress hepatic SHBG production), which is another highly sensitive marker of androgenicity.[39]
A large clinical study of high to very high oral dosages of norethisterone (10 to 40 mg/day) administered for prolonged periods of time (4 to 35 weeks) to prevent miscarriage in pregnant women found that 5.5% of the women experienced mild androgenic side effects such as mild voice changes (hoarseness), acne, and hirsutism and that 18.3% of female infants born to the mothers showed, in most cases only slight, virilization of the genitals.[10] Maternal androgenic symptoms occurred most often in women who received a dosage of norethisterone of 30 mg/day or more for a period of 15 weeks or longer.[10] In the female infants who experienced virilization of the genitals, the sole manifestation in 86.7% of the cases was varied but almost always slight enlargement of the clitoris.[10] In the remaining 13.3% of the affected cases, marked clitoral enlargement and partial fusion of the labioscrotal folds occurred.[10] The dosages used in these cases were 20 to 40 mg/day.[10]
In a letter to the editor on the topic of virilization caused by high dosages of NETA in women, a physician expressed that they had not observed the "slightest evidence of virilization" and that there had "certainly been no hirsutism nor any voice changes" in 55 women with advanced breast cancer that they had treated with 30 to 60 mg/day norethisterone for up to six months.[40]
High-dosage norethisterone has been used to suppress menstruation in women with severe intellectual disability who were incapable of handling their own menses.[41][42] A study of 118 nulliparous women treated with 5 mg/day norethisterone for a period of 2 to 30 months found that the drug was effective in producing amenorrhea in 86% of the women, with breakthrough bleeding occurring in the remaining 14%.[41] Side effects including weight gain, hirsutism, acne, headache, nausea, and vomiting all did not appear to increase in incidence and no "disturbing side effects" were noted in any of the women.[41][42] Another study of 5 mg/day norethisterone in 132 women also made no mention of androgenic side effects.[43] These findings suggest little to no risk of androgenic side effects with norethisterone at a dosage of 5 mg/day.[41][42] A study of 194 women treated with 5 to 15 mg/day NETA for a median duration of 13 months of therapy to suppress symptoms of endometriosis observed no side effects in 55.2% of patients, weight gain in 16.1%, acne in 9.9%, mood lability in 8.9%, hot flashes in 8.3%, and voice deepening in two women (1.0%).[44]
Estrogenic
[edit]Norethisterone is weakly estrogenic (via conversion into its metabolite EE), and for this reason, it has been found at high dosages to be associated with high rates of estrogenic side effects such as breast enlargement in women and gynecomastia in men, but also with improvement of menopausal symptoms in postmenopausal women.[45] It has been suggested that very high dosages (e.g., 40 mg/day, which are sometimes used in clinical practice for various indications) of NETA (and by extension norethisterone) may result in an increased risk of venous thromboembolism (VTE) analogously to high dosages (above 50 μg/day) of EE, and that even doses of NETA of 10 to 20 mg, which correspond to EE doses of approximately 20 to 30 μg/day, may in certain women be associated with increased risk.[46][47] A study also found that ethinylestradiol and norethisterone had a greater influence on coagulation factors when the dose of norethisterone was 3 or 4 mg than when it was 1 mg.[48] This might have been due to additional ethinylestradiol generated by higher doses of norethisterone.[48]
Overdose
[edit]There have been no reports of serious side effects with overdose of norethisterone, even in small children.[49] As such, overdose usually does not require treatment.[49] High dosages of as much as 60 mg/day norethisterone have been studied for extended treatment durations without serious adverse effects described.[40]
Interactions
[edit]5α-Reductase plays an important role in the metabolism of norethisterone, and 5α-reductase inhibitors such as finasteride and dutasteride can inhibit its metabolism.[citation needed] Norethisterone is partially metabolized via hydroxylation by CYP3A4, and inhibitors and inducers of CYP3A4 can significantly alter circulating levels of norethisterone.[5] For instance, the CYP3A4 inducers rifampicin and bosentan have been found to decrease norethisterone exposure by 42% and 23%, respectively, and the CYP3A4 inducers carbamazepine and St. John's wort have also been found to accelerate norethisterone clearance.[5]
Pharmacology
[edit]Pharmacodynamics
[edit]Norethisterone is a potent progestogen and a weak androgen and estrogen.[4] That is, it is a potent agonist of the progesterone receptor (PR) and a weak agonist of the androgen receptor (AR) and the estrogen receptor (ER).[4] Norethisterone itself has insignificant affinity for the ER; its estrogenic activity is from an active metabolite that is formed in very small amounts, ethinylestradiol (EE), which is a very potent estrogen.[4] Norethisterone and its metabolites have negligible affinity for the glucocorticoid receptor (GR) and mineralocorticoid receptor (MR) and hence have no glucocorticoid, antiglucocorticoid, mineralocorticoid, or antimineralocorticoid activity.[4]
Progestogenic activity
[edit]Norethisterone is a potent progestogen and binds to the PR with approximately 150% of the affinity of progesterone.[4] In contrast, its parent compounds, testosterone, nandrolone (19-nortestosterone), and ethisterone (17α-ethynyltestosterone), have 2%, 22%, and 44% of the relative binding affinity of progesterone for the PR.[50] Unlike norethisterone, its major active metabolite 5α-dihydronorethisterone (5α-DHNET), which is formed by transformation via 5α-reductase, has been found to possess both progestogenic and marked antiprogestogenic activity,[51] although its affinity for the PR is greatly reduced relative to norethisterone at only 25% of that of progesterone.[4] Norethisterone produces similar changes in the endometrium and vagina, such as endometrial transformation, and is similarly antigonadotropic, ovulation-inhibiting, and thermogenic in women compared to progesterone, which is in accordance with its progestogenic activity.[52][50][53]
Androgenic activity
[edit]Norethisterone has approximately 15% of the affinity of the anabolic–androgenic steroid (AAS) metribolone (R-1881) for the AR, and in accordance, is weakly androgenic.[4] In contrast to norethisterone, 5α-DHNET, the major metabolite of norethisterone, shows higher affinity for the AR, with approximately 27% of the affinity of metribolone.[4] However, although 5α-DHNET has higher affinity for the AR than norethisterone, it has significantly diminished and in fact almost abolished androgenic potency in comparison to norethisterone in rodent bioassays.[54][55] Similar findings were observed for ethisterone (17α-ethynyltestosterone) and its 5α-reduced metabolite, whereas 5α-reduction enhanced both the AR affinity and androgenic potency of testosterone and nandrolone (19-nortestosterone) in rodent bioassays.[55] As such, it appears that the ethynyl group of norethisterone at the C17α position is responsible for its loss of androgenicity upon 5α-reduction.[55]
Norethisterone (0.5 to 3 mg/day) has been found to dose-dependently decrease circulating SHBG levels, which is a common property of androgens and is due to AR-mediated suppression of hepatic SHBG production.[39] The drug also has estrogenic activity, and estrogens are known to increase SHBG hepatic production and circulating levels, so it would appear that the androgenic activity of norethisterone overpowers its estrogenic activity in this regard.[39]
Norethisterone is bound to a considerable extent (36%) to SHBG in circulation.[4] Although it has lower affinity for SHBG than endogenous androgens and estrogens,[56] Norethisterone may displace testosterone from SHBG and thereby increase free testosterone levels, and this action may contribute to its weak androgenic effects.[57]
Estrogenic activity
[edit]
Norethisterone binds to the ERs, the ERα and the ERβ, with 0.07% and 0.01% of the relative binding affinity of estradiol.[58] Due to these very low relative affinities, it is essentially inactive itself as a ligand of the ERs at clinical concentrations.[4] However, norethisterone has been found to be a substrate for aromatase and is converted in the liver to a small extent (0.35%) to the highly potent estrogen ethinylestradiol (EE), and for this reason, unlike most other progestins, norethisterone has some estrogenic activity.[4] However, with typical dosages of norethisterone used in oral contraceptives (0.5 to 1 mg), the levels of EE produced are low, and it has been said that they are probably without clinical relevance.[4] Conversely, doses of 5 and 10 mg of norethisterone, which are used in the treatment of gynecological disorders, are converted at rates of 0.7% and 1.0% and produce levels of EE that correspond to those produced by 30 and 60 μg dosages of EE, respectively.[2][4] The levels of EE formed by 0.5 and 1 mg of norethisterone have been estimated based on higher dosages as corresponding to 2 and 10 μg dosages of EE, respectively.[2] At high doses, norethisterone may increase the risk of venous thromboembolism due to metabolism into EE.[59]
Neurosteroid activity
[edit]Подобно прогестерону и тестостерону , норэтистерон метаболизируется до 3,5- тетрагидрометаболитов . [ 60 ] Взаимодействуют ли эти метаболиты норэтистерона с ГАМК А рецептором так же, как 3,5-тетрагидро метаболиты прогестерона и тестостерона, такие как аллопрегнанолон и 3α-андростандиол соответственно, является темой, которая, по-видимому, не изучена и, следовательно, требует разъяснения. [ 60 ]
Ингибирование стероидогенеза
[ редактировать ]Норэтистерон является субстратом и, как известно, является ингибитором с 5α-редуктазы ингибированием 4,4% и 20,1% при 0,1 и 1 мкМ соответственно. [ 4 ] Однако терапевтические концентрации норэтистерона находятся в низком наномолярном диапазоне, поэтому это действие может не иметь клинического значения при обычных дозах. [ 4 ]
Было обнаружено, что норэтистерон и его основной активный метаболит 5α-DHNET действуют как необратимые ингибиторы ароматазы (K i = 1,7 мкМ и 9,0 мкМ соответственно). [ 61 ] Однако, как и в случае с 5α-редуктазой, необходимые концентрации, вероятно, слишком высоки, чтобы быть клинически значимыми при типичных дозировках. [ 4 ] 5α-DHNET был специально оценен и оказался селективным в ингибировании ароматазы и не влияет на фермент расщепления боковой цепи холестерина (P450scc), 17α-гидроксилазу / 17,20-лиазу , 21-гидроксилазу или 11β-гидроксилазу. . [ 61 ] Поскольку он не ароматизируется (и, следовательно, не может трансформироваться в эстрогенный метаболит), в отличие от норэтистерона, 5α-DHNET был предложен в качестве потенциального терапевтического агента при лечении ER-положительного рака молочной железы . [ 61 ]
Другая деятельность
[ редактировать ]Норэтистерон является очень слабым ингибитором CYP2C9 и CYP3A4 ( IC 50 = 46 мкМ и 51 мкМ соответственно), но эти действия требуют очень высоких концентраций норэтистерона, которые намного превышают терапевтические уровни циркулирующей крови (которые находятся в наномолярном диапазоне) и, следовательно, вероятно, не имеет клинического значения. [ 4 ]
Было обнаружено, что норэтистерон и некоторые из его 5α-восстановленных метаболитов оказывают сосудорасширяющее действие у животных, которое не зависит от рецепторов половых стероидов и, следовательно, по-видимому, имеет негеномный механизм. [ 62 ]
Норэтистерон стимулирует пролиферацию клеток MCF-7 рака молочной железы мембранный компонент - in vitro , действие, которое не зависит от классических PR и вместо этого опосредуется через 1 рецептора прогестерона (PGRMC1). [ 63 ] Некоторые другие прогестины действуют в этом анализе аналогичным образом, тогда как прогестерон действует нейтрально. [ 63 ] Неясно, могут ли эти результаты объяснить различные риски рака молочной железы, наблюдаемые при применении прогестерона и прогестинов в клинических исследованиях . [ 64 ]
Антигонадотропные эффекты
[ редактировать ]Благодаря своей прогестагенной активности норэтистерон подавляет ось гипоталамус-гипофиз-гонады (ось HPG) и, следовательно, оказывает антигонадотропное действие. [ 4 ] [ 50 ] Ожидается, что эстрогенная активность норэтистерона в высоких дозах также будет способствовать его антигонадотропному эффекту. [ 65 ] Благодаря своему антигонадотропному действию норэтистерон подавляет железами половых гормонов половыми выработку , подавляет овуляцию у женщин и подавляет сперматогенез у мужчин. [ 4 ] [ 50 ] [ 66 ]
доза Ингибирующая овуляцию как перорального норэтистерона, так и перорального НЕТА составляет около 0,5 мг/день для женщин. [ 4 ] [ 67 ] [ 68 ] Однако существуют некоторые противоречивые данные, позволяющие предположить, что для полного подавления овуляции могут потребоваться более высокие дозы. [ 69 ] Было обнаружено, что внутримышечная инъекция 200 мг NETE предотвращает овуляцию и подавляет уровни эстрадиола , прогестерона , лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ) у женщин. [ 70 ] [ 71 ] [ 72 ] [ 73 ]
Ранние исследования перорального применения норэтистерона у мужчин, применявших дозы от 20 до 50 мг/день, выявили подавление 17-кетостероидов экскреции , повышенную экскрецию эстрогена (из-за превращения в этинилэстрадиол ), подавление сперматогенеза, либидо и эректильной функции , а также частоту гинекомастии . [ 74 ] [ 75 ] [ 76 ] [ 45 ] [ 77 ] Сообщалось, что пероральный прием норэтистерона 25 мг/день в течение 3 недель у мужчин подавляет уровень тестостерона примерно на 70%, до 100–200 нг/дл, в течение 4–5 дней, а также подавляет количество сперматозоидов и не оказывают влияния на либидо или эректильную функцию в течение этого короткого периода времени. [ 78 ] [ 79 ] У здоровых молодых мужчин НЭТА в дозе от 5 до 10 мг/день перорально в течение 2 недель подавлял уровень тестостерона с ~527 нг/дл до ~231 нг/дл (–56%). [ 80 ]

однократная внутримышечная инъекция NETE в дозе 200 мг отдельно или в сочетании с валератом эстрадиола в дозе 2 мг вызывает быстрое, сильное и устойчивое снижение уровней гонадотропина и тестостерона на срок до одного месяца у мужчин. Было обнаружено, что [ 66 ] [ 82 ] [ 83 ] Было также обнаружено, что внутримышечные инъекции 200 мг НЭТЕ один раз в 3 недели подавляют сперматогенез у мужчин. [ 74 ] [ 84 ] Аналогично, было обнаружено, что однократная внутримышечная инъекция 50 мг NETE в сочетании с 5 мг валерата эстрадиола сильно подавляет уровень тестостерона у мужчин. [ 81 ] Уровни тестостерона снизились с ~503 нг/дл в исходном состоянии до ~30 нг/дл в самой низкой точке (–94%), которая произошла на 7-й день после инъекции. [ 81 ]
Фармакокинетика
[ редактировать ]Фармакокинетика норэтистерона была рассмотрена. [ 4 ] [ 85 ]
Поглощение
[ редактировать ]Биодоступность . % норэтистерона при пероральном приеме составляет от 47 до 73%, при этом средняя биодоступность при пероральном приеме составляет 64 [ 2 ] [ 3 ] микронизация Было обнаружено, что значительно улучшает биодоступность норэтистерона при пероральном приеме за счет увеличения кишечной абсорбции и снижения кишечного метаболизма . [ 4 ] [ 86 ] Было обнаружено, что однократная пероральная доза норэтистерона 2 мг приводит к пиковым уровням препарата в крови 12 нг/мл (40 нмоль/л), тогда как однократная пероральная доза норэтистерона 1 мг в сочетании с 2 мг эстрадиола приводит к пиковому уровню препарата в крови. уровень норэтистерона 8,5 нг/мл (29 нмоль/л) через час после введения. [ 4 ]
Распределение
[ редактировать ]Связывание норэтистерона с белками плазмы составляет 97%. [ 4 ] На 61% он связан с альбумином и на 36% — с ГСПГ. [ 4 ]
Метаболизм
[ редактировать ]Метаболизм норэтистерона и его пролекарств у человека
|
норэтистерона составляет Период полувыведения от 5,2 до 12,8 часов, средний период полувыведения составляет 8,0 часов. [ 2 ] Метаболизм норэтистерона очень похож на метаболизм тестостерона (и нандролона) и происходит главным образом за счет снижения Δ 4 двойная связь до 5α- и 5β-дигидронорэтистерона, после чего происходит восстановление кетогруппы С3 до четырех изомеров 3,5 -тетрагидронорэтистерона. [ 4 ] Эти превращения катализируются 5α- и 5β-редуктазой и 3α- и 3β-гидроксистероиддегидрогеназой как в печени , так и во внепеченочных тканях, таких как гипофиз , матка , предстательная железа , влагалище и молочная железа . [ 96 ] За исключением 3α,5α- и 3β,5α-тетрагидронорэтистерона, которые обладают значительным сродством к ЭР и в некоторой степени эстрогенными, 3,5-тетрагидрометаболиты норэтистерона неактивны с точки зрения сродства к рецепторам половых стероидов (в частности, к рецепторам половых стероидов). , PR, AR и ER). [ 97 ] [ 98 ] [ 99 ] Небольшое количество норэтистерона также преобразуется ароматазой в ЭЭ. [ 2 ] [ 4 ] [ 46 ] метаболизируется в печени посредством гидроксилирования Норэтистерон также , главным образом с помощью CYP3A4 . [ 5 ] Некоторая конъюгация (включая глюкуронидацию и сульфатирование ) [ 96 ] [ 100 ] Норэтистерона и его метаболитов происходит, несмотря на стерические препятствия со стороны этинильной группы при C17α. [ 4 ] Этинильная группа норэтистерона сохраняется примерно в 90% всех его метаболитов. [ 4 ]
Норэтистерон используется в противозачаточных таблетках, в отличие от самого прогестерона, поскольку при пероральном приеме он не метаболизируется так быстро, как прогестерон. При пероральном приеме прогестерон быстро метаболизируется в желудочно-кишечном тракте и печени и расщепляется на множество различных метаболитов. Принимая во внимание, что норэтистерон не так быстро метаболизируется, что позволяет норэтистерону присутствовать в более высоких количествах, что позволяет ему более эффективно конкурировать за сайты связывания рецепторов прогестерона. [ 4 ]
Устранение
[ редактировать ]Норэтистерон выводится от 33 до 81% с мочой и от 35 до 43% с калом . [ 101 ]
Химия
[ редактировать ]Норэтистерон, также известный как 17α-этинил-19-нортестостерон или как 17α-этинилестра-4-ен-17β-ол-3-он, представляет синтетический эстран стероид и производное тестостерона собой . [ 102 ] [ 28 ] В частности, это производное тестостерона, в котором этинильная группа была добавлена в положении C17α, а метильная группа в положении C19 удалена; следовательно, это комбинированное производное этистерона (17α-этинилтестостерон) и нандролона (19-нортестостерон). [ 102 ] [ 28 ] Эти модификации приводят к увеличению прогестагенной активности и при пероральном приеме биодоступности , а также к снижению андрогенной / анаболической активности. [ 103 ]
Производные
[ редактировать ]Норэтистерон (NET) является исходным соединением большой группы прогестинов, в которую входит большинство прогестинов, известных как производные 19-нортестостерона. [ 104 ] Эта группа делится по химической структуре на эстраны (производные норэтистерона) и гонаны (18-метилгонаны или 13β-этилэстраны; производные левоноргестрела ) и включает следующие имеющиеся в продаже препараты: [ 105 ]
|
|
Некоторые из них действуют как пролекарства норэтистерона, включая НЕТА, NETE, диацетат этинодиола , линестренол и ацетат квингестанола . [ 106 ] [ 107 ] [ 108 ] Норэтинодрел также может быть пролекарством норэтистерона. [ 4 ] [ 2 ] НЕТА принимается внутрь так же, как норэтистерон, а НЕТЕ вводится путем инъекции в мышцу . [ 11 ]
Не-17α-этинилированный
[ редактировать ]19-нортестостероновые (19-NT) прогестины, которые технически не являются производными норэтистерона (поскольку они не имеют этинильной группы C17α ), но все же тесно связаны (с другими заменами в положениях C17α и/или C16β), включают следующие имеющиеся в продаже лекарства. : [ 102 ] [ 28 ]
- C17α Виниловые (этенильные) производные норгестерона (17α-винил-δ 5(10) -19-NT) и норвинистерон (17α-винил-19-NT)
- C17α Аллильные производные аллилэстренол (3-декето-17α-аллил-19-NT) и альтреногест (17α-аллил-δ 9,11 -19-НТ)
- C17α- алкильное производное норметандрона (17α-метил-19-NT)
- C17α Цианометильное производное диеногест (17α-цианометил-δ 9 -19-НТ)
- Этильное производное C16β оксендолона (16β-этил-19-NT)
Многие анаболические стероиды семейства 19-нортестостерона, такие как норэтандролон и этилэстренол , также являются мощными прогестагенами, но никогда не продавались как таковые.
Синтез
[ редактировать ]химического синтеза норэтистерона. Опубликованы результаты [ 102 ] [ 85 ]
Синтез 1
[ редактировать ]
3-метиловый эфир эстрадиола ( 1 , EME) частично восстанавливается до 1,5-диена ( 2 ), что также происходит на первой стадии синтеза нандролона. Затем окисление Оппенауэра преобразует гидроксильную группу C17β в кетоновую функциональную группу ( 3 ). Затем его подвергают реакции с ацетилидом металла с образованием соответствующего этинильного соединения C17α ( 4 ). Гидролиз эфира енола в мягких условиях приводит непосредственно к ( 5 ), [ 109 ] который, по-видимому, представляет собой норэтинодрел (хотя Леднисер в своей книге утверждает, что это «этинодрел» (который может быть синонимом этинодиола ); этинодрел имеет присоединенный атом хлора ), перорально активный прогестин. Это прогестагенный компонент первого орального контрацептива , поступившего в продажу (т.е. Эновида). Обработка эфира этиниленола сильной кислотой приводит к образованию норэтистерона ( 6 ). [ 12 ]
На практике эти и все другие комбинированные пероральные контрацептивы представляют собой смеси 1–2% ЭЭ или местранола и перорального прогестина . Было высказано предположение, что открытие необходимости использования эстрогена в дополнение к прогестину для обеспечения контрацептивной эффективности связано с наличием небольшого количества невосстановленного ЭМЕ ( 1 ) в ранних партиях из 2 препаратов . При окислении и этинилировании это , конечно, приведет к образованию местранола ( 3 ). В любом случае необходимость присутствия эстрогена в смеси в настоящее время хорошо установлена экспериментально.
Синтез 2
[ редактировать ]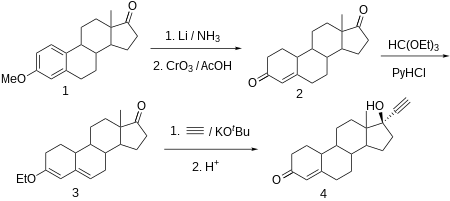
Норэтистерон производится из эстр-4-ен-3,17-диона (боландиона), который, в свою очередь, синтезируется путем частичного восстановления ароматической области 3-О-метилового эфира эстрона литием в жидком аммиаке и одновременно кетогруппа при C17α превращается в гидроксильную группу, которая затем снова окисляется до кетогруппы триоксидом хрома в уксусной кислоте . Сопряженный олефин C4-C5 и карбонильную группу при C3 затем преобразуют в этиловый эфир диенола с использованием этилортоформиата . Полученный продукт этинилируют ацетиленом в присутствии трет-бутоксида калия . После гидрохлоридного гидролиза образовавшегося О-производного калия, в ходе которого гидролизуется и еноловый эфир, а оставшаяся двойная связь сдвигается, получается искомый норэтистерон.
История
[ редактировать ]Норэтистерон был впервые синтезирован химиками Луисом Мирамонтесом , Карлом Джерасси и Джорджем Розенкранцем в компании Syntex в Мехико в 1951 году. [ 12 ] Он был получен из этистерона и, как было обнаружено, обладал примерно в 20 раз большей эффективностью в качестве прогестагена по сравнению с ним. [ нужна ссылка ] высокоактивным пероральным прогестагеном Норэтистерон был первым синтезированным , и ему предшествовали (как прогестаген) прогестерон (1934 г.), этистерон (1938 г.), 19-норпрогестерон (1944 г.) и 17α-метилпрогестерон (1949 г.), а также нандролон. (1950), тогда как норэтинодрел (1952) и норэтандролон (1953) следовали за синтезом норэтистерона. [ 13 ] [ 14 ] Препарат был представлен под названием Норлютин в США в 1957 году. [ 15 ] Впоследствии норэтистерон был объединен с местранолом и поступил на рынок под названием Ortho-Novum в США в 1963 году. Это был второй прогестин после норетинодрела в 1960 году, который использовался в составе пероральных контрацептивов . [ 14 ] дополнительные противозачаточные препараты, содержащие норэтистерон в сочетании с местранолом или ЭЭ, такие как норлестрин и норинил . В 1964 году в США появились [ 14 ]
Общество и культура
[ редактировать ]Общие имена
[ редактировать ]Норэтистерон — это INN Tooltip и BAN препарата Tooltip, а норэтиндрон — его название, принятое в USAN . [ 102 ] [ 28 ]
Названия брендов
[ редактировать ]Норэтистерон доступен в Бангладеш под торговыми марками Menogia (ACI), Normens (Renata) и т. д. Норэтистерон (NET), в том числе как NETA и NETE, продается под многими торговыми марками по всему миру. [ 28 ] [ 20 ]
Доступность
[ редактировать ]Соединенные Штаты
[ редактировать ]Ранее норэтистерон был доступен в США отдельно в таблетках по 5 мг под торговой маркой Норлютин, но с тех пор этот препарат был снят с производства в этой стране. [ 27 ] Тем не менее, НЕТА по-прежнему доступен в США в виде таблеток по 5 мг под торговой маркой Айгестин. [ 27 ] Это один из немногих неконтрацептивных лекарственных форм, содержащих только прогестаген, который по-прежнему доступен в Соединенных Штатах. [ 27 ] Другие включают прогестерон , медроксипрогестерона ацетат , мегестрола ацетат и гидроксипрогестерона капроат , а также атипичный агент даназол . [ 27 ]
И норэтистерон, и НЕТА также доступны в США в качестве противозачаточных средств. [ 27 ] Норэтистерон доступен как отдельно (торговые марки Camila, Errin, Heather, Micronor, Nor-QD и другие), так и в сочетании с ЭЭ (Norinyl, Ortho-Novum, другие) или местранолом (Norinyl, Ortho-Novum, другие), в то время как НЕТА доступен только в сочетании с ЭЭ (Норлестрином и др.). [ 27 ] NETE не доступен в США ни в какой форме. [ 27 ] [ 115 ] [ 116 ]
Исследовать
[ редактировать ]Норэтистерон, как NETA и NETE, изучался на предмет использования в качестве потенциального мужского гормонального контрацептива в сочетании с тестостероном у мужчин. [ 117 ] [ 118 ]
норэтистерона длительного действия Микросферы для внутримышечных инъекций изучались на предмет потенциального использования в качестве противозачаточных средств. [ 119 ]
Ссылки
[ редактировать ]- ^ «Обновления о безопасности бренда в монографии о продукции» . Здоровье Канады . 6 июня 2024 года. Архивировано из оригинала 29 марта 2024 года . Проверено 8 июня 2024 г.
- ^ Перейти обратно: а б с д и ж г час Станчик ФЗ (сентябрь 2002 г.). «Фармакокинетика и эффективность прогестинов, используемых для заместительной гормональной терапии и контрацепции». Обзоры по эндокринным и метаболическим расстройствам . 3 (3): 211–24. дои : 10.1023/А:1020072325818 . ПМИД 12215716 . S2CID 27018468 .
- ^ Перейти обратно: а б Фотерби К. (август 1996 г.). «Биодоступность пероральных половых стероидов, используемых в оральной контрацепции и заместительной гормональной терапии». Контрацепция . 54 (2): 59–69. дои : 10.1016/0010-7824(96)00136-9 . ПМИД 8842581 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в v В х и С аа аб и объявление но из в ах есть также и аль являюсь а Куль Х. (август 2005 г.). «Фармакология эстрогенов и прогестагенов: влияние различных путей введения» (PDF) . Климактерический . 8 (Приложение 1): 3–63. дои : 10.1080/13697130500148875 . ПМИД 16112947 . S2CID 24616324 . Архивировано (PDF) из оригинала 22 августа 2016 года . Проверено 6 сентября 2018 г.
- ^ Перейти обратно: а б с д Корхонен Т., Турпейнен М., Толонен А., Лайне К., Пелконен О. (май 2008 г.). «Идентификация ферментов цитохрома P450 человека, участвующих в биотрансформации линэстренола и норэтиндрона in vitro». Журнал биохимии стероидов и молекулярной биологии . 110 (1–2): 56–66. дои : 10.1016/j.jsbmb.2007.09.025 . ПМИД 18356043 . S2CID 10809537 .
- ^ Перейти обратно: а б с д Тайтель Х.Ф., Кафриссен М.Е. (1995). «Норэтиндрон - обзор терапевтического применения». Международный журнал исследований фертильности и менопаузы . 40 (4): 207–23. ПМИД 8520623 .
- ^ Олден К.Р., Lowdermilk DL, Cashion MC, Perry SE (27 декабря 2013 г.). Охрана материнства и женского здоровья - Электронная книга . Elsevier Науки о здоровье. стр. 135–. ISBN 978-0-323-29368-6 . Архивировано из оригинала 9 марта 2023 года . Проверено 8 января 2018 г.
- ^ Перейти обратно: а б Куль Х. (сентябрь 1990 г.). «Фармакокинетика эстрогенов и прогестагенов». Зрелость . 12 (3): 171–197. дои : 10.1016/0378-5122(90)90003-о . ПМИД 2170822 .
- ^ «АЙГЕСТИН® (таблетки норэтиндронацетата, USP)» (PDF) . Архивировано (PDF) из оригинала 10 февраля 2017 г. Проверено 11 июля 2024 г.
- ^ Перейти обратно: а б с д и ж г Джейкобсон Б.Д. (октябрь 1962 г.). «Опасности терапии норэтиндроном во время беременности». Американский журнал акушерства и гинекологии . 84 (7): 962–8. дои : 10.1016/0002-9378(62)90075-3 . ПМИД 14450719 .
- ^ Перейти обратно: а б с д Рабочая группа МАИР по оценке канцерогенных рисков для человека; Всемирная организация здравоохранения; Международное агентство по исследованию рака (2007). Комбинированные эстроген-прогестагенные контрацептивы и комбинированная эстроген-прогестагенная менопаузальная терапия . Всемирная организация здравоохранения. стр. 417–. ISBN 978-92-832-1291-1 . Архивировано из оригинала 10 января 2023 года . Проверено 12 октября 2016 г.
Норэтистерон и его ацетатные и энантатные эфиры являются прогестагенами, обладающими слабыми эстрогенными и андрогенными свойствами.
- ^ Перейти обратно: а б с д Джерасси К., Мирамонтес Л., Розенкранц Г., Сондхаймер Ф., Лонго Л.Д. (январь 2006 г.). «Стероиды LIV. Синтез 19-нор-17-альфа-этинилтестостерона и 19-нор-17-альфа-метилтестостерона. 1954». Американский журнал акушерства и гинекологии . 194 (1): 289, обсуждение 290. doi : 10.1021/ja01645a010 . ПМИД 16389045 .
- ^ Перейти обратно: а б Шупе Д (7 ноября 2007 г.). Справочник по контрацепции: Руководство по практическому управлению . Springer Science & Business Media. стр. 15–. ISBN 978-1-59745-150-5 .
- ^ Перейти обратно: а б с д и Маркс Л (2010). Сексуальная химия: история противозачаточных таблеток . Издательство Йельского университета. стр. 74, 76. ISBN. 978-0-300-16791-7 .
- ^ Перейти обратно: а б Издательство Уильяма Эндрю (22 октября 2013 г.). Энциклопедия фармацевтического производства, 3-е издание . Эльзевир. стр. 2935–. ISBN 978-0-8155-1856-3 .
- ^ Хэтчер Р.А., Нельсон А.Л. (2007). Контрацептивные технологии . Яркие Медиа. стр. 195–. ISBN 978-1-59708-001-9 . Архивировано из оригинала 10 января 2023 года . Проверено 8 января 2018 г.
- ^ Гунашила С. (14 марта 2011 г.). Практическое решение гинекологических проблем . JP Medical Ltd., стр. 31–. ISBN 978-93-5025-240-6 . Архивировано из оригинала 9 марта 2023 года . Проверено 8 января 2018 г.
- ^ Граймс Д.А., Лопес Л.М., О'Брайен П.А., Раймонд Э.Г. (ноябрь 2013 г.). «Прогестиновые таблетки для контрацепции». Кокрейновская база данных систематических обзоров (11): CD007541. дои : 10.1002/14651858.CD007541.pub3 . ПМИД 24226383 .
- ^ Хуссейн С.Ф. (февраль 2004 г.). «Таблетки, содержащие только прогестаген, и высокое кровяное давление: есть ли связь? Обзор литературы». Контрацепция . 69 (2): 89–97. doi : 10.1016/j.contraception.2003.09.002 . ПМИД 14759612 .
- ^ Перейти обратно: а б «Норетистерон» . Архивировано из оригинала 15 сентября 2018 года . Проверено 8 января 2018 г.
- ^ «Доступность генерика Айгестина» . Архивировано из оригинала 24 августа 2018 года . Проверено 8 января 2018 г.
- ^ «Топ-300 2021 года» . КлинКальк . Архивировано из оригинала 15 января 2024 года . Проверено 14 января 2024 г.
- ^ «Норэтиндрон – Статистика употребления лекарств» . КлинКальк . Архивировано из оригинала 3 марта 2021 года . Проверено 14 января 2024 г.
- ^ Всемирная организация здравоохранения (2021 г.). Примерный список основных лекарственных средств Всемирной организации здравоохранения: 22-й список (2021 г.) . Женева: Всемирная организация здравоохранения. hdl : 10665/345533 . ВОЗ/MHP/HPS/EML/2021.02.
- ^ Ким Джей-Джей, Курита Т., Булун С.Э. (февраль 2013 г.). «Действие прогестерона при раке эндометрия, эндометриозе, миоме матки и раке молочной железы» . Эндокринные обзоры . 34 (1): 130–62. дои : 10.1210/er.2012-1043 . ПМК 3565104 . ПМИД 23303565 .
- ^ «Норетистерон» . Наркотики.com .
- ^ Перейти обратно: а б с д и ж г час «Drugs@FDA: Лекарственные препараты, одобренные FDA» . Управление по контролю за продуктами и лекарствами США. Архивировано из оригинала 16 ноября 2016 года . Проверено 27 ноября 2016 г.
- ^ Перейти обратно: а б с д и ж Index Nominum 2000: Международный каталог лекарств . Тейлор и Фрэнсис. Январь 2000. стр. 100–100. 749–. ISBN 978-3-88763-075-1 .
- ^ Рабочая группа МАИР по оценке канцерогенных рисков для человека; Международное агентство по исследованию рака (1 января 1999 г.). Гормональная контрацепция и гормональная терапия в постменопаузе (PDF) . МАИР. п. 65. ИСБН 978-92-832-1272-0 .
- ^ Перейти обратно: а б с д и Аронсон Дж. К. (21 февраля 2009 г.). Побочные эффекты эндокринных и метаболических препаратов Мейлера . Эльзевир. стр. 217, 253, 275. ISBN. 978-0-08-093292-7 .
- ^ Хэгглунд Х., Рембергер М., Клаессон С., Леннквист Б., Юнгман П., Рингден О. (декабрь 1998 г.). «Лечение норэтистероном, основной фактор риска веноокклюзионного заболевания печени после аллогенной трансплантации костного мозга». Кровь . 92 (12): 4568–72. дои : 10.1182/blood.V92.12.4568 . ПМИД 9845522 .
- ^ Перейти обратно: а б Корниа П.Б., Анавальт Б.Д. (ноябрь 2004 г.). «Мужская гормональная контрацепция». Мнение экспертов о новых лекарствах . 9 (2): 335–344. дои : 10.1517/14728214.9.2.335 . ПМИД 15571489 . S2CID 26886374 .
- ^ Перейти обратно: а б Корниа П.Б., Анавальт Б.Д. (2005). «Мужские гормональные контрацептивы: потенциально патентоспособный и прибыльный продукт». Экспертное заключение о терапевтических патентах . 15 (12): 1727–1737. дои : 10.1517/13543776.15.12.1727 . ISSN 1354-3776 . S2CID 83941717 .
- ^ Перейти обратно: а б с Камишке А., Хойерманн Т., Крюгер К., фон Эккардштейн С., Шеллшмидт И., Рюбиг А., Нишлаг Е. (февраль 2002 г.). «Эффективный гормональный мужской контрацептив, использующий ундеканоат тестостерона с пероральными или инъекционными препаратами норэтистерона» . Журнал клинической эндокринологии и метаболизма . 87 (2): 530–539. дои : 10.1210/jcem.87.2.8218 . ПМИД 11836281 .
- ^ Перейти обратно: а б Джанкинс-Хопкинс Дж. М. (март 2010 г.). «Гормональная терапия прыщей». Журнал Американской академии дерматологии . 62 (3): 486–8. дои : 10.1016/j.jaad.2009.12.002 . ПМИД 20159314 .
- ^ Перейти обратно: а б Аровохолу А.О., Галло М.Ф., Лопес Л.М., Граймс Д.А. (июль 2012 г.). Аровохолу А.О. (ред.). «Комбинированные оральные контрацептивы для лечения акне». Кокрейновская база данных систематических обзоров (7): CD004425. дои : 10.1002/14651858.CD004425.pub6 . ПМИД 22786490 .
- ^ ван Влотен В.А., Сигурдссон В. (2004). «Выбор орального контрацептива для лечения акне у женщин». Американский журнал клинической дерматологии . 5 (6): 435–41. дои : 10.2165/00128071-200405060-00008 . ПМИД 15663340 . S2CID 9947402 .
- ^ Перейти обратно: а б Почи П.Е., Штраус Дж.С. (декабрь 1965 г.). «Отсутствие андрогенного воздействия на сальные железы человека при приеме норэтиндрона в низких дозах». Американский журнал акушерства и гинекологии . 93 (7): 1002–4. дои : 10.1016/0002-9378(65)90162-6 . ПМИД 5843402 .
- ^ Перейти обратно: а б с д Кунц В., Хойнер А., Хюмпель М., Зайферт В., Михаэлис К. (декабрь 1997 г.). «Превращение норэтистерона и норэтистерона ацетата in vivo в этинилэтрадиол у женщин в постменопаузе». Контрацепция . 56 (6): 379–85. дои : 10.1016/s0010-7824(97)00174-1 . ПМИД 9494772 .
- ^ Перейти обратно: а б Карвен С. (1962). «Вирилизация норэтистероном» . БМЖ . 1 (5289): 1415. doi : 10.1136/bmj.1.5289.1415-a . ISSN 0959-8138 . ЧВК 1958463 .
- ^ Перейти обратно: а б с д Роксбург Д.Р., Западный MJ (август 1973 г.). «Использование норэтистерона для подавления менструации у женщин с серьезной умственной отсталостью» . Медицинский журнал Австралии . 2 (7): 310–3. дои : 10.5694/j.1326-5377.1973.tb128175.x . ПМИД 4746398 . S2CID 204094551 . Архивировано из оригинала 20 декабря 2016 года . Проверено 6 декабря 2016 г.
- ^ Перейти обратно: а б с Роксбург Д.Р., Западный MJ (август 1973 г.). «Использование норэтистерона для подавления менструации у женщин с серьезной умственной отсталостью». Медицинский журнал Австралии . 2 (7): 310–3. дои : 10.1097/00006254-197408000-00021 . ПМИД 4746398 .
- ^ Совет JA (апрель 1965 г.). «Клиническая оценка применения пероральных контрацептивов норэтиндрона 5 мг плюс местранола 0,075 мг» . Журнал Канадской медицинской ассоциации . 92 (15): 814–7. ЧВК 1927985 . ПМИД 14272499 .
- ^ Касер DJ, Миссмер С.А., Берри К.Ф., Лауфер М.Р. (апрель 2012 г.). «Использование только норэтиндрона ацетата для послеоперационного подавления симптомов эндометриоза». Журнал детской и подростковой гинекологии . 25 (2): 105–108. дои : 10.1016/j.jpag.2011.09.013 . ПМИД 22154396 .
- ^ Перейти обратно: а б Полсен К.А., Лич Р.Б., Ланман Дж., Голдстон Н., Мэддок В.О., Хеллер К.Г. (октябрь 1962 г.). «Природная эстрогенность норэтиндрона и норэтинодрела: сравнение с другими синтетическими прогестинами и прогестероном». Журнал клинической эндокринологии и метаболизма . 22 (10): 1033–9. doi : 10.1210/jcem-22-10-1033 . ПМИД 13942007 .
- ^ Перейти обратно: а б Чу MC, Чжан X, Генцшайн Э, Станчик ФЗ, Лобо Р.А. (июнь 2007 г.). «Образование этинилэстрадиола у женщин при лечении норэтиндрона ацетатом» . Журнал клинической эндокринологии и метаболизма . 92 (6): 2205–7. дои : 10.1210/jc.2007-0044 . ПМИД 17341557 .
- ^ Коннолли А., Britton AG (31 марта 2017 г.). Женское здоровье в первичной медико-санитарной помощи . Издательство Кембриджского университета. стр. 153–. ISBN 978-1-108-16595-2 .
- ^ Перейти обратно: а б Фаррис М., Бастианелли С., Розато Е., Бросенс И., Бенаджано Дж. (октябрь 2017 г.). «Фармакодинамика комбинированных эстроген-гестагенных пероральных контрацептивов: 2. Влияние на гемостаз». Экспертное обозрение клинической фармакологии . 10 (10): 1129–1144. дои : 10.1080/17512433.2017.1356718 . ПМИД 28712325 . S2CID 205931204 .
- ^ Перейти обратно: а б «ОРТО МИКРОНОР ТАБЛЕТКИ (НОРЕТИНДРОН)» (PDF) . Архивировано (PDF) из оригинала 10 февраля 2017 г. Проверено 1 апреля 2018 г.
- ^ Перейти обратно: а б с д и Куль Х (2011). «Фармакология прогестагенов» (PDF) . J Репродукциимед Эндокринол . 8 (1): 157–177. Архивировано (PDF) из оригинала 11 октября 2016 года . Проверено 10 октября 2016 г.
- ^ , Цао, округ Колумбия (июнь 1985 г.). «[Антипрогестагенное действие 5-альфа-дигидронорэтистерона]». Чжунго Яо Ли Сюэ Бао = Acta Pharmacologica Sinica (на китайском языке) Чу Ю.Х., Ли QA, Чжао З.Ф., Чжоу Ю.П. . . 125–9
- ^ Маккуистион Л.Е., Ки Дж.Л., Хейс Э.Р. (25 марта 2014 г.). Фармакология: подход к сестринскому процессу, ориентированный на пациента . Elsevier Науки о здоровье. стр. 846–. ISBN 978-0-323-29348-8 .
- ^ Гринблатт РБ (июль 1956 г.). «Прогестагенная активность 17-альфа-этинил-19-нортестостерона». Журнал клинической эндокринологии и метаболизма . 16 (7): 869–75. doi : 10.1210/jcem-16-7-869 . ПМИД 13332050 .
- ^ Фрагкаки А.Г., Анжелис Ю.С., Куппарис М., Цантили-Какулиду А., Кокотос Г., Георгакопулос С. (февраль 2009 г.). «Структурные характеристики анаболических андрогенных стероидов, способствующие связыванию с андрогенными рецепторами и их анаболической и андрогенной активности. Применяемые модификации структуры стероидов». Стероиды . 74 (2): 172–97. doi : 10.1016/j.steroids.2008.10.016 . ПМИД 19028512 . S2CID 41356223 .
Многие синтетические стероиды с высокой миотрофической активностью проявляют миотрофно-андрогенную диссоциацию, поскольку из-за изменений, вносимых в структуру кольца А, они, вероятно, не будут субстратами для 5α-редуктаз [85]. 5α-редукция не всегда усиливает андрогенную активность, несмотря на высокую RBA андрогенов к АР. Так обстоит дело с норэтистероном (рис. 1, 34), синтетическим производным 19-нор-17α-этинилтестостерона, который также подвергается ферментативно-опосредованному 5α-восстановлению и оказывает мощное андрогенное действие на органы-мишени. 5α-восстановленный норэтистерон демонстрирует более высокое связывание AR, но демонстрирует значительно более низкую андрогенную активность, чем неизмененный норэтистерон [102,103].
- ^ Перейти обратно: а б с Лемус А.Е., Энрикес Х., Гарсиа Г.А., Грильаска И., Перес-Паласиос Г. (январь 1997 г.). «5-альфа-восстановление норэтистерона повышает его аффинность связывания с рецепторами андрогенов, но снижает его андрогенную активность». Журнал биохимии стероидов и молекулярной биологии . 60 (1–2): 121–9. дои : 10.1016/s0960-0760(96)00172-0 . ПМИД 9182866 . S2CID 33771349 .
- ^ Филши М., Гийбо Дж. (22 октября 2013 г.). Контрацепция: наука и практика . Эльзевир Наука. стр. 26–. ISBN 978-1-4831-6366-6 .
Норэтистерон связывается с ГСПГ с меньшим сродством, чем эндогенные андрогены и эстрогены [...]
- ^ Аззиз Р. (8 ноября 2007 г.). Расстройства избытка андрогенов у женщин . Springer Science & Business Media. стр. 124–. ISBN 978-1-59745-179-6 .
- ^ Койпер Г.Г., Карлссон Б., Грандьен К., Энмарк Е., Хэггблад Дж., Нильссон С., Густафссон Дж.А. (март 1997 г.). «Сравнение специфичности связывания лигандов и распределения транскриптов в тканях альфа- и бета-рецепторов эстрогена» . Эндокринология . 138 (3): 863–70. дои : 10.1210/endo.138.3.4979 . ПМИД 9048584 .
- ^ Виграц I, Куль Х (сентябрь 2006 г.). «Метаболические и клинические эффекты прогестагенов». Европейский журнал контрацепции и репродуктивного здоровья . 11 (3): 153–61. дои : 10.1080/13625180600772741 . ПМИД 17056444 . S2CID 27088428 .
- ^ Перейти обратно: а б Джатти С., Мелканги Р.К., Песарези М. (август 2016 г.). «Обратная сторона прогестинов: влияние на мозг» . Журнал молекулярной эндокринологии . 57 (2): Р109-26. doi : 10.1530/JME-16-0061 . ПМИД 27339142 .
- ^ Перейти обратно: а б с Ямамото Т., Тамура Т., Китаваки Дж., Осава Ю., Окада Х. (июнь 1994 г.). «Суицидальная инактивация ароматазы в плаценте человека и лейомиоме матки 5-альфа-дигидронорэтиндроном, метаболитом норэтиндрона, и его влияние на ферменты, продуцирующие стероиды». Европейский журнал эндокринологии . 130 (6): 634–40. дои : 10.1530/axis.0.1300634 . ПМИД 8205267 .
- ^ Перуски М., Вильялон К.М., Наваррете Э., Гарсиа Г.А., Перес-Паласиос Г., Лемус А.Е. (август 2003 г.). «Сосудорасширяющий эффект норэтистерона и его 5-альфа-метаболитов: новое негеномное действие». Европейский журнал фармакологии . 475 (1–3): 161–9. дои : 10.1016/s0014-2999(03)02106-x . ПМИД 12954372 .
- ^ Перейти обратно: а б Нойбауэр Х., Ма Кью, Чжоу Дж., Юй К., Руан Х., Сигер Х. и др. (октябрь 2013 г.). «Возможная роль PGRMC1 в развитии рака молочной железы». Климактерический . 16 (5): 509–13. дои : 10.3109/13697137.2013.800038 . ПМИД 23758160 . S2CID 29808177 .
- ^ Траберт Б., Шерман М.Э., Каннан Н., Станчик Ф.З. (апрель 2020 г.). «Прогестерон и рак молочной железы» . Эндокринные обзоры . 41 (2): 320–344. дои : 10.1210/endrev/bnz001 . ПМЦ 7156851 . ПМИД 31512725 .
- ^ Андерсон Р.А., Бэрд Д.Т. (декабрь 2002 г.). «Мужская контрацепция» (PDF) . Эндокринные обзоры . 23 (6): 735–62. дои : 10.1210/er.2002-0002 . ПМИД 12466187 . Архивировано (PDF) из оригинала 28 августа 2021 года . Проверено 11 декабря 2019 г.
- ^ Перейти обратно: а б Камишке А., Нишлаг Е (январь 2004 г.). «Прогресс на пути к гормональной мужской контрацепции». Тенденции в фармакологических науках . 25 (1): 49–57. дои : 10.1016/j.tips.2003.11.009 . ПМИД 14723979 .
- ^ Рудель HW (сентябрь 1968 г.). «Фармакология оральных контрацептивов». Клиническая акушерство и гинекология . 11 (3): 632–44. дои : 10.1097/00003081-196811030-00002 . ПМИД 4878826 .
- ^ Станчик ФЗ (ноябрь 2003 г.). «Не все прогестины одинаковы». Стероиды . 68 (10–13): 879–90. doi : 10.1016/j.steroids.2003.08.003 . ПМИД 14667980 . S2CID 44601264 .
- ^ Эндрикат Дж., Герлингер С., Ричард С., Розенбаум П., Дюстерберг Б. (декабрь 2011 г.). «Дозы прогестинов для ингибирования овуляции: систематический обзор доступной литературы и препаратов, продаваемых во всем мире». Контрацепция . 84 (6): 549–57. doi : 10.1016/j.contraception.2011.04.009 . ПМИД 22078182 .
- ^ Шупе Д (1993). «Инъекционные контрацептивы и противозачаточные вагинальные кольца». Контрацепция . Клинические перспективы в акушерстве и гинекологии. Спрингер. стр. 144–157. дои : 10.1007/978-1-4612-2730-4_13 . ISBN 978-1-4612-7645-6 . ISSN 0178-0328 .
- ^ Вайнер Э., Йоханссон Э.Д. (апрель 1975 г.). «Уровень норэтиндрона в плазме после внутримышечной инъекции 200 мг норэтиндрона энантата». Контрацепция . 11 (4): 419–25. дои : 10.1016/0010-7824(75)90004-9 . ПМИД 1122756 .
- ^ Фотерби К., Ховард Дж., Шриманкер К., Элдер М., Пока П.Г. (декабрь 1977 г.). «Влияние норэтистерона энантата на уровни гонадотропинов в сыворотке». Контрацепция . 16 (6): 591–604. дои : 10.1016/0010-7824(77)90060-9 . ПМИД 606499 .
- ^ Гебельсманн Ю, Станчик ФЗ, Бреннер П.Ф., Гебельсманн А.Э., Генцшайн Е.К., Мишелл Д.Р. (март 1979 г.). «Концентрация норэтиндрона (NET) в сыворотке после внутримышечной инъекции NET энантата. Влияние на сывороточный ЛГ, ФСГ, эстрадиол и прогестерон». Контрацепция . 19 (3): 283–313. дои : 10.1016/0010-7824(79)90022-2 . ПМИД 572279 .
- ^ Перейти обратно: а б Нойманн Ф., Диалло Ф.А., Хасан Ш., Шенк Б., Траоре I (1976). «Влияние фармацевтических соединений на мужскую фертильность» . Андрология . 8 (3): 203–235. дои : 10.1111/j.1439-0272.1976.tb02137.x . ПМИД 793446 . S2CID 24859886 .
- ^ Хеллер К.Г., Лэйдлоу В.М., Харви Х.Т., Нельсон В.О. (июль 1958 г.). «Влияние гестагенных соединений на репродуктивные процессы мужчины». Анналы Нью-Йоркской академии наук . 71 (5): 649–65. дои : 10.1111/j.1749-6632.1958.tb54641.x . ПМИД 13583821 . S2CID 32637425 .
- ^ Хеллер К.Г., Мур Д.Д., Полсен К.А., Нельсон В.О., Лэйдлоу В.М. (декабрь 1959 г.). «Влияние прогестерона и синтетических прогестинов на репродуктивную физиологию нормальных мужчин» . Труды Федерации . 18 : 1057–65. ПМИД 14400846 . Архивировано из оригинала 18 декабря 2018 года . Проверено 11 декабря 2019 г.
- ^ Полсен, Калифорния (март 1965 г.). «Метаболизм прогестина: особое внимание к эстрогенным путям». Метаболизм . 14 (3): SUPPL: 313–9. дои : 10.1016/0026-0495(65)90018-1 . ПМИД 14261416 .
- ^ Мудгал Н.Р., Суреш Р. (1995). «Некоторые мысли о разработке химических противозачаточных средств для мужчин» (PDF) . Современная наука (Бангалор) . 68 (4): 470–474. ISSN 0011-3891 . Архивировано из оригинала (PDF) 11 декабря 2019 года . Проверено 11 декабря 2019 г.
- ^ Йохонсон Э.Д., Нюгрен К.Г. (1973). «Депрессия уровня тестостерона в плазме у мужчин с норэтиндроном». Контрацепция . 8 (3): 219–226. дои : 10.1016/0010-7824(73)90032-2 . ISSN 0010-7824 .
- ^ Зицманн М., Рохайем Дж., Райдт Дж., Клиш С., Кумар Н., Ситрук-Уэр Р., Нишлаг Э. (май 2017 г.). «Влияние различных прогестинов с трансдермальным тестостероном или без него на уровни гонадотропинов для неинвазивной гормональной мужской контрацепции: рандомизированное клиническое исследование» . Андрология . 5 (3): 516–526. дои : 10.1111/andr.12328 . ПМИД 28189123 . S2CID 41502711 .
- ^ Перейти обратно: а б с д Альварес Б.Д. (11 мая 2011 г.). 50 мг норэтистерона энантата и 5 мг валерата эстрадиола на общий уровень тестостерона у Влияние дозы здоровых мексиканских мужчин ] (MSc). Национальный политехнический институт Мексики. Архивировано из оригинала 16 сентября 2022 года . Проверено 12 сентября 2022 г.
- ^ Эмори Дж. К. (2003). «Андрогены и мужская контрацепция». Андрогены в здоровье и болезни . Современная эндокринология. Хумана Пресс. стр. 405–417. дои : 10.1007/978-1-59259-388-0_21 . ISBN 978-1-61737-314-5 .
- ^ Камишке А., Дибеккер Дж., Нишлаг Э. (сентябрь 2000 г.). «Потенциал норэтистерона энантата для мужской контрацепции: фармакокинетика и подавление функции гипофиза и половых желез». Клиническая эндокринология . 53 (3): 351–358. дои : 10.1046/j.1365-2265.2000.01097.x . ПМИД 10971453 . S2CID 70515136 .
- ^ Петри Р., Мосс Дж., Сенге Т., Рауш-Штрооман Дж.Г. (1970). «Влияние ацетата ципротерона, энантата норэтистерона и капроата гестонорона на ось гипофиз-гонады у мужчин». , норэтистерона-энантата и гестонорона-капроата на гипофизарно-гонадную ось мужчин Влияние ципротерон-ацетата у Симпозиум Немецкого общества эндокринологии в Ульме с 26 по 28 числа. Февраль 1970 года. Спрингер. стр. 428–430. дои : 10.1007/978-3-642-80591-2_118 . ISBN 9783642805912 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Перейти обратно: а б Гестагены . Издательство Спрингер. 27 ноября 2013 г., стр. 13–14, 283–284. ISBN 978-3-642-99941-3 . Архивировано из оригинала 10 января 2023 года . Проверено 19 сентября 2018 г.
- ^ Саперштейн С., Эдгрен Р.А., Юнг Д., Мрощак Э.Дж., Ли Г.Дж., Дорр А., Притчард Р., Кушинский С., Фонг Дж.К., Комбс Д.Л. (декабрь 1989 г.). «Фармакокинетика норэтиндрона: влияние размера частиц». Контрацепция . 40 (6): 731–40. дои : 10.1016/0010-7824(89)90075-9 . ПМИД 2620531 .
- ^ Фридрих С., Берсе М., Кляйн С., Роде Б., Хёхель Дж. (июнь 2018 г.). «Образование этинилэстрадиола in vivo после внутримышечного введения норэтистерона энантата». Журнал клинической фармакологии . 58 (6): 781–789. дои : 10.1002/jcph.1079 . ПМИД 29522253 . S2CID 3813229 .
- ^ Тийссен Дж. Х. (сентябрь 1972 г.). «Метаболизм перорально активных синтетических гестагенных соединений». В Тауске М (ред.). Фармакология эндокринной системы и родственных препаратов: прогестерон, гестагенные препараты и средства против бесплодия . Том. II. Пергамон Пресс. стр. 217–273. ISBN 978-0080168128 . OCLC 278011135 .
- ^ Окада Х (2010). «Рецепторы и механизм действия синтетических прогестагенов». Азиатско-Океанский журнал акушерства и гинекологии . 7 (1): 15–27. дои : 10.1111/j.1447-0756.1981.tb00511.x . ISSN 0389-2328 .
- ^ Бриггс М.Х. (1980). «Сравнительная фармакодинамика и фармакокинетика противозачаточных стероидов у животных и человека: выборочный обзор». Клиническая фармакология и терапия . Пэлгрейв Макмиллан, Великобритания. стр. 493–518. дои : 10.1007/978-1-349-05952-2_57 . ISBN 978-1-349-05954-6 .
- ^ Томас Дж. А., Кинан Э. Дж. (1986). «Прогестины и оральные контрацептивы». Принципы эндокринной фармакологии . Спрингер. стр. 167–196. дои : 10.1007/978-1-4684-5036-1_8 . ISBN 978-1-4684-5036-1 .
- ^ Орм М.Л., Бэк-ди-джей, Брекенридж AM (1983). «Клиническая фармакокинетика пероральных контрацептивных стероидов». Клиническая фармакокинетика . 8 (2): 95–136. дои : 10.2165/00003088-198308020-00001 . ПМИД 6342899 . S2CID 43298472 .
- ^ Фотерби К. (1974). «Метаболизм синтетических стероидов животными и человеком». Акта Эндокринологика. Дополнение . 185 : 119–147. дои : 10.1530/acta.0.075s119 . ПМИД 4206183 .
- ^ Куль Х., Виграц I (август 2007 г.). «Могут ли производные 19-нортестостерона ароматизироваться в печени взрослых людей? Есть ли клинические последствия?». Климактерический . 10 (4): 344–353. дои : 10.1080/13697130701380434 . ПМИД 17653961 . S2CID 20759583 .
- ^ Станчик Ф.З., Рой С. (июль 1990 г.). «Метаболизм левоноргестрела, норэтиндрона и структурно родственных противозачаточных стероидов». Контрацепция . 42 (1): 67–96. дои : 10.1016/0010-7824(90)90093-Б . ПМИД 2143719 .
- ^ Перейти обратно: а б Шунен В.Г., Декерс Г.Х., де Гуйер М.Е., де Рис Р., Клоостербур Х.Дж. (ноябрь 2000 г.). «Гормональные свойства норэтистерона, 7-альфа-метилнорэтистерона и их производных». Журнал биохимии стероидов и молекулярной биологии . 74 (4): 213–22. дои : 10.1016/s0960-0760(00)00125-4 . ПМИД 11162927 . S2CID 19797254 .
[...] несколько моно- и дисульфатированных, а также моно- и диглюкуронидированных метаболитов НЭТ были обнаружены в моче женщин, получавших НЭТ [16,17]. В неконъюгированной форме эти метаболиты NET (или MeNET) представлены 5α- и 5β-восстановленными NET (5α-NET или 5β-NET), а также 3α- и 3β-гидрированными 5α-NET и 5β-NET, что приводит к 3α,5α -NET, 3β,5α-NET, 3α,5β-NET и 3β,5β-NET или их соответствующие метаболиты MeNET (рис. 1 и 2). Эти стероидные преобразования NET или MeNET могут происходить в печени, а также в гипофизе, эндометрии, предстательной железе, влагалище и молочной железе. Ферментами, участвующими в этих метаболических процессах, являются 5α- и 5β-редуктаза, а также 3α- и 3β-гидроксистероиддегидрогеназа (HSD).
- ^ Чавес Б.А., Вильчис Ф., Перес А.Е., Гарсиа Г.А., Грилласка И., Перес-Паласиос Г. (январь 1985 г.). «Стереоспецифичность внутриклеточного связывания норэтистерона и его метаболитов, восстанавливающих А-кольцо» . Журнал биохимии стероидов . 22 (1): 121–6. дои : 10.1016/0022-4731(85)90151-7 . ПМИД 3871879 .
- ^ Гарса-Флорес Х., Вильчис Ф., Гарсиа Г.А., Менхивар М., Перес-Паласиос Г. (июнь 1986 г.). «Уменьшение А-кольца усиливает антигонадотропную активность норэтистерона». Акта Эндокринологика . 112 (2): 278–83. дои : 10.1530/acta.0.1120278 . ПМИД 3090814 .
- ^ Лемус А.Е., Энрикес Х., Эрнандес А., Сантильян Р., Перес-Паласиос Г. (февраль 2009 г.). «Биоконверсия норэтистерона, агониста рецептора прогестерона, в агонисты рецепторов эстрогена в остеобластных клетках» . Журнал эндокринологии . 200 (2): 199–206. дои : 10.1677/JOE-08-0166 . ПМИД 19008332 .
- ^ Скарси К.К., Дарин К.М., Чаппелл К.А., Нитц С.М., Ламорд М. (ноябрь 2016 г.). «Лекарственное взаимодействие, эффективность и безопасность гормональных контрацептивов у женщин, живущих с ВИЧ» . Безопасность лекарств . 39 (11): 1053–1072. дои : 10.1007/s40264-016-0452-7 . ПМК 5048570 . ПМИД 27562873 .
- ^ ДеГрут ЖЖ (2001). Эндокринология . Компания WB Saunders. п. 2617. ИСБН 978-0-7216-7843-6 .
- ^ Перейти обратно: а б с д и Элкс Дж. (14 ноября 2014 г.). Словарь лекарств: Химические данные: Химические данные, структуры и библиография . Спрингер. стр. 886–. ISBN 978-1-4757-2085-3 . Архивировано из оригинала 10 января 2023 года . Проверено 5 октября 2016 г.
- ^ Хвалиш К., Суррей Э., Станчик Ф.З. (июнь 2012 г.). «Гормональный профиль ацетата норэтиндрона: обоснование дополнительной терапии агонистами гонадотропин-рилизинг-гормона у женщин с эндометриозом». Репродуктивные науки . 19 (6): 563–71. дои : 10.1177/1933719112438061 . ПМИД 22457429 . S2CID 2882899 .
- ^ Шупе Д., Хазелтин Ф.П. (6 декабря 2012 г.). Контрацепция . Springer Science & Business Media. стр. 112–. ISBN 978-1-4612-2730-4 .
- ^ Райан К.Дж. (1999). Гинекология Кистнера и женское здоровье . Мосби. п. 292. ИСБН 978-0-323-00201-1 .
- ^ Хаммерштейн Дж. (декабрь 1990 г.). «Пролекарства: преимущество или недостаток?». Американский журнал акушерства и гинекологии . 163 (6, часть 2): 2198–203. дои : 10.1016/0002-9378(90)90561-К . ПМИД 2256526 .
- ^ Эдельман А.Б., Черала Г., Станчик Ф.З. (октябрь 2010 г.). «Метаболизм и фармакокинетика противозачаточных стероидов у женщин с ожирением: обзор». Контрацепция . 82 (4): 314–23. doi : 10.1016/j.contraception.2010.04.016 . ПМИД 20851224 .
- ^ Рейно Дж.П., Оджасу Т. (ноябрь 1986 г.). «Разработка и использование антагонистов половых стероидов». Журнал биохимии стероидов . 25 (5Б): 811–33. дои : 10.1016/0022-4731(86)90313-4 . ПМИД 3543501 .
Аналогичным андрогенным потенциалом обладает норэтистерон и его пролекарства (норэтистерона ацетат, этинодиола диацетат, линестренол, норэтинодрел, квингестанол [ацетат]).
- ^ Перейти обратно: а б Фрэнк Б. Колтон, патент США 2 655 518 (1952 г., компания Searle & Co).
- ^ Ринголд Х.Дж., Розенкранц Г., Сондхаймер Ф. (1956). «Стероиды. LXXX.11-Метил-19-нортестостерон и 1-Метил-17α-этинил-19-нортестостерон». Журнал Американского химического общества . 78 (11): 2477–2479. дои : 10.1021/ja01592a037 .
- ^ Юбервассер Х, Хойслер К, Кальвода Дж, Мейстре С, Виланд П, Аннер Г, Веттштейн А (1963). «19-норстероид II. Простой процесс получения производных 19-норандростана. О стероидах, 193-е сообщение». Helvetica Chimica Acta . 46 :344-352. дои : 10.1002/hlca.19630460135 .
- ^ Онкен Д., Хойблен Д. (январь 1970 г.). «[Этинилированные стероиды]». Аптека . 25 (1): 3–9. ПМИД 4914401 .
- ^ Патент США 2744122.
- ^ Патент США 2774777.
- ^ Буллоу В.Л. (2001). Энциклопедия контроля над рождаемостью . АВС-КЛИО. стр. 145–. ISBN 978-1-57607-181-6 . Архивировано из оригинала 10 января 2023 года . Проверено 27 ноября 2016 г.
- ^ Московиц Э.Х., Дженнингс Б. (13 сентября 1996 г.). Принудительная контрацепция?: Моральные и политические проблемы контроля над рождаемостью длительного действия . Издательство Джорджтаунского университета. стр. 40–. ISBN 978-1-58901-807-5 .
- ^ Нишлаг Э (ноябрь 2010 г.). «Клинические испытания мужской гормональной контрацепции» (PDF) . Контрацепция . 82 (5): 457–70. doi : 10.1016/j.contraception.2010.03.020 . ПМИД 20933120 . Архивировано (PDF) из оригинала 5 декабря 2020 года . Проверено 28 декабря 2018 г.
- ^ Нишлаг Э., Бере Х.М., Нишлаг Э., Бере Х.М., Нишлаг С. (2012). Нишлаг Э., Бере Х.М., Нишлаг С. (ред.). «Основная роль тестостерона в гормональной мужской контрацепции». Тестостерон : 470-493. дои : 10.1017/CBO9781139003353.023 . ISBN 9781139003353 .
- ^ Бенаджано Дж., Primiero FM (июнь 1983 г.). «Контрацептивы длительного действия. Современное состояние». Наркотики . 25 (6): 570–609. дои : 10.2165/00003495-198325060-00003 . ПМИД 6223801 . S2CID 45898359 .
Дальнейшее чтение
[ редактировать ]- Брогден Р.Н., Спейт Т.М., Эйвери Г.С. (1973). «Оральные контрацептивы, содержащие только прогестаген: предварительный отчет о действии и клиническом использовании норгестрела и норэтистерона». Наркотики . 6 (3): 169–81. дои : 10.2165/00003495-197306030-00004 . ПМИД 4130566 . S2CID 42295736 .
- «Норетистерон и норэтистерона ацетат». Монографии МАИР по оценке канцерогенного риска химических веществ для человека . 21 : 441–60. Декабрь 1979 г. PMID 120838 .
- Станчик Ф.З., Рой С. (июль 1990 г.). «Метаболизм левоноргестрела, норэтиндрона и структурно родственных противозачаточных стероидов». Контрацепция . 42 (1): 67–96. дои : 10.1016/0010-7824(90)90093-б . ПМИД 2143719 .
- Уайзман Л.Р., Мактавиш Д. (март 1994 г.). «Трансдермальный эстрадиол/норэтистерон. Обзор его фармакологических свойств и клинического применения у женщин в постменопаузе». Наркотики и старение . 4 (3): 238–56. дои : 10.2165/00002512-199404030-00006 . ПМИД 8199397 . S2CID 68007924 .
- Тайтель Х.Ф., Кафриссен М.Е. (1995). «Норэтиндрон - обзор терапевтического применения». Международный журнал исследований фертильности и менопаузы . 40 (4): 207–23. ПМИД 8520623 .
- Майер В.Е., Герман-младший (август 2001 г.). «Фармакология и токсикология этинилэстрадиола и ацетата норэтиндрона у экспериментальных животных». Нормативная токсикология и фармакология . 34 (1): 53–61. дои : 10.1006/rtph.2001.1483 . ПМИД 11502156 .
- Риис Б.Дж., Леманн Х.Дж., Кристиансен К. (октябрь 2002 г.). «Норэтистерона ацетат в сочетании с эстрогенами: влияние на скелет и другие органы. Обзор». Американский журнал акушерства и гинекологии . 187 (4): 1101–16. дои : 10.1067/моб.2002.122852 . ПМИД 12389012 .
- Дрейпер Б.Х., Моррони С., Хоффман М., Смит Дж., Бексинска М., Хэпгуд Дж., Ван дер Мерве Л. (июль 2006 г.). «Депо-медроксипрогестерон по сравнению с норэтистерона энантатом для прогестагенной контрацепции длительного действия». Кокрейновская база данных систематических обзоров (3): CD005214. дои : 10.1002/14651858.CD005214.pub2 . ПМИД 16856087 .
- Куль Х., Виграц I (август 2007 г.). «Могут ли производные 19-нортестостерона ароматизироваться в печени взрослых людей? Есть ли клинические последствия?». Климактерический . 10 (4): 344–53. дои : 10.1080/13697130701380434 . ПМИД 17653961 . S2CID 20759583 .
- Кейси CL, Мюррей, Калифорния (2008). «Обновление HT: внимание к комбинированной терапии эстрадиола и норэтиндронацетата» . Клинические вмешательства в старение . 3 (1): 9–16. дои : 10.2147/cia.s1663 . ПМЦ 2544373 . ПМИД 18488874 .
- Паулен М.Е., Кертис К.М. (октябрь 2009 г.). «Когда женщина может повторять инъекции только прогестагена — депо-медроксипрогестерона ацетат или норэтистерона энантат?». Контрацепция . 80 (4): 391–408. doi : 10.1016/j.contraception.2009.03.023 . ПМИД 19751863 .
- Хвалиш К., Суррей Э., Станчик Ф.З. (июнь 2012 г.). «Гормональный профиль ацетата норэтиндрона: обоснование дополнительной терапии агонистами гонадотропин-рилизинг-гормона у женщин с эндометриозом». Репродуктивные науки . 19 (6): 563–71. дои : 10.1177/1933719112438061 . ПМИД 22457429 . S2CID 2882899 .
![Уровни норэтистерона и этинилэстрадиола в течение 24 часов после однократного перорального приема 10 мг НЭТА у женщин в постменопаузе.[39]](http://upload.wikimedia.org/wikipedia/commons/thumb/e/e5/Norethisterone_and_ethinylestradiol_levels_after_a_single_oral_dose_of_10_mg_norethisterone_acetate_in_postmenopausal_women.png/450px-Norethisterone_and_ethinylestradiol_levels_after_a_single_oral_dose_of_10_mg_norethisterone_acetate_in_postmenopausal_women.png)

