Метаболизм


| Часть серии о |
| Биохимия |
|---|
 |
Обмен веществ ( / m ə ˈ t æ b ə l ɪ z ə m / , от греческого : μεταβολή Metabolē , «изменение») — совокупность жизнь поддерживающих химических реакций в организмах . Тремя основными функциями метаболизма являются: преобразование энергии пищи в энергию, доступную для запуска клеточных процессов; превращение пищи в строительные блоки белков , липидов , нуклеиновых кислот и некоторых углеводов ; и устранение метаболических отходов . Эти катализируемые ферментами реакции позволяют организмам расти и размножаться, сохранять свои структуры и реагировать на окружающую среду. Слово метаболизм может также относиться к сумме всех химических реакций, происходящих в живых организмах, включая пищеварение и транспортировку веществ в различные клетки и между ними, и в этом случае описанный выше набор реакций внутри клеток называется промежуточным (или промежуточным). ) обмен веществ.
Метаболические реакции можно разделить на катаболические — расщепление соединений (например, глюкозы до пирувата в результате клеточного дыхания ); или анаболический — накопление ( синтез ) соединений (таких как белки, углеводы, липиды и нуклеиновые кислоты). Обычно катаболизм высвобождает энергию, а анаболизм ее потребляет.
Химические реакции метаболизма организованы в метаболические пути , в которых одно химическое вещество посредством ряда стадий превращается в другое химическое вещество, причем каждый этап обеспечивается определенным ферментом . Ферменты имеют решающее значение для метаболизма, поскольку они позволяют организмам запускать желаемые реакции, которые требуют энергии и не происходят сами по себе, связывая их со спонтанными реакциями , высвобождающими энергию. Ферменты действуют как катализаторы — они позволяют реакции протекать быстрее — а также позволяют регулировать скорость метаболической реакции, например, в ответ на изменения в клеточной среде или на сигналы от других клеток.
Система обмена веществ конкретного организма определяет, какие вещества он найдет питательными , а какие ядовитыми . Например, некоторые прокариоты используют в качестве питательного вещества сероводород , однако этот газ ядовит для животных. [ 1 ] Скорость основного обмена организма является мерой количества энергии, потребляемой всеми этими химическими реакциями.
A striking feature of metabolism is the similarity of the basic metabolic pathways among vastly different species.[2] For example, the set of carboxylic acids that are best known as the intermediates in the citric acid cycle are present in all known organisms, being found in species as diverse as the unicellular bacterium Escherichia coli and huge multicellular organisms like elephants.[3] These similarities in metabolic pathways are likely due to their early appearance in evolutionary history, and their retention is likely due to their efficacy.[4][5] In various diseases, such as type II diabetes, metabolic syndrome, and cancer, normal metabolism is disrupted.[6] The metabolism of cancer cells is also different from the metabolism of normal cells, and these differences can be used to find targets for therapeutic intervention in cancer.[7]
Key biochemicals
[edit]
Most of the structures that make up animals, plants and microbes are made from four basic classes of molecules: amino acids, carbohydrates, nucleic acid and lipids (often called fats). As these molecules are vital for life, metabolic reactions either focus on making these molecules during the construction of cells and tissues, or on breaking them down and using them to obtain energy, by their digestion. These biochemicals can be joined to make polymers such as DNA and proteins, essential macromolecules of life.[8]
| Type of molecule | Name of monomer forms | Name of polymer forms | Examples of polymer forms |
|---|---|---|---|
| Amino acids | Amino acids | Proteins (made of polypeptides) | Fibrous proteins and globular proteins |
| Carbohydrates | Monosaccharides | Polysaccharides | Starch, glycogen and cellulose |
| Nucleic acids | Nucleotides | Polynucleotides | DNA and RNA |
Amino acids and proteins
[edit]Proteins are made of amino acids arranged in a linear chain joined by peptide bonds. Many proteins are enzymes that catalyze the chemical reactions in metabolism. Other proteins have structural or mechanical functions, such as those that form the cytoskeleton, a system of scaffolding that maintains the cell shape.[9] Proteins are also important in cell signaling, immune responses, cell adhesion, active transport across membranes, and the cell cycle.[10] Amino acids also contribute to cellular energy metabolism by providing a carbon source for entry into the citric acid cycle (tricarboxylic acid cycle),[11] especially when a primary source of energy, such as glucose, is scarce, or when cells undergo metabolic stress.[12]
Lipids
[edit]Lipids are the most diverse group of biochemicals. Their main structural uses are as part of internal and external biological membranes, such as the cell membrane.[10] Their chemical energy can also be used. Lipids contain a long, non-polar hydrocarbon chain with a small polar region containing oxygen. Lipids are usually defined as hydrophobic or amphipathic biological molecules but will dissolve in organic solvents such as ethanol, benzene or chloroform.[13] The fats are a large group of compounds that contain fatty acids and glycerol; a glycerol molecule attached to three fatty acids by ester linkages is called a triacylglyceride.[14] Several variations of the basic structure exist, including backbones such as sphingosine in sphingomyelin, and hydrophilic groups such as phosphate in phospholipids. Steroids such as sterol are another major class of lipids.[15]
Carbohydrates
[edit]
Carbohydrates are aldehydes or ketones, with many hydroxyl groups attached, that can exist as straight chains or rings. Carbohydrates are the most abundant biological molecules, and fill numerous roles, such as the storage and transport of energy (starch, glycogen) and structural components (cellulose in plants, chitin in animals).[10] The basic carbohydrate units are called monosaccharides and include galactose, fructose, and most importantly glucose. Monosaccharides can be linked together to form polysaccharides in almost limitless ways.[16]
Nucleotides
[edit]The two nucleic acids, DNA and RNA, are polymers of nucleotides. Each nucleotide is composed of a phosphate attached to a ribose or deoxyribose sugar group which is attached to a nitrogenous base. Nucleic acids are critical for the storage and use of genetic information, and its interpretation through the processes of transcription and protein biosynthesis.[10] This information is protected by DNA repair mechanisms and propagated through DNA replication. Many viruses have an RNA genome, such as HIV, which uses reverse transcription to create a DNA template from its viral RNA genome.[17] RNA in ribozymes such as spliceosomes and ribosomes is similar to enzymes as it can catalyze chemical reactions. Individual nucleosides are made by attaching a nucleobase to a ribose sugar. These bases are heterocyclic rings containing nitrogen, classified as purines or pyrimidines. Nucleotides also act as coenzymes in metabolic-group-transfer reactions.[18]
Coenzymes
[edit]
Metabolism involves a vast array of chemical reactions, but most fall under a few basic types of reactions that involve the transfer of functional groups of atoms and their bonds within molecules.[19] This common chemistry allows cells to use a small set of metabolic intermediates to carry chemical groups between different reactions.[18] These group-transfer intermediates are called coenzymes. Each class of group-transfer reactions is carried out by a particular coenzyme, which is the substrate for a set of enzymes that produce it, and a set of enzymes that consume it. These coenzymes are therefore continuously made, consumed and then recycled.[20]
One central coenzyme is adenosine triphosphate (ATP), the energy currency of cells. This nucleotide is used to transfer chemical energy between different chemical reactions. There is only a small amount of ATP in cells, but as it is continuously regenerated, the human body can use about its own weight in ATP per day.[20] ATP acts as a bridge between catabolism and anabolism. Catabolism breaks down molecules, and anabolism puts them together. Catabolic reactions generate ATP, and anabolic reactions consume it. It also serves as a carrier of phosphate groups in phosphorylation reactions.[21]
A vitamin is an organic compound needed in small quantities that cannot be made in cells. In human nutrition, most vitamins function as coenzymes after modification; for example, all water-soluble vitamins are phosphorylated or are coupled to nucleotides when they are used in cells.[22] Nicotinamide adenine dinucleotide (NAD+), a derivative of vitamin B3 (niacin), is an important coenzyme that acts as a hydrogen acceptor. Hundreds of separate types of dehydrogenases remove electrons from their substrates and reduce NAD+ into NADH. This reduced form of the coenzyme is then a substrate for any of the reductases in the cell that need to transfer hydrogen atoms to their substrates.[23] Nicotinamide adenine dinucleotide exists in two related forms in the cell, NADH and NADPH. The NAD+/NADH form is more important in catabolic reactions, while NADP+/NADPH is used in anabolic reactions.[24]

Mineral and cofactors
[edit]Inorganic elements play critical roles in metabolism; some are abundant (e.g. sodium and potassium) while others function at minute concentrations. About 99% of a human's body weight is made up of the elements carbon, nitrogen, calcium, sodium, chlorine, potassium, hydrogen, phosphorus, oxygen and sulfur. Organic compounds (proteins, lipids and carbohydrates) contain the majority of the carbon and nitrogen; most of the oxygen and hydrogen is present as water.[25]
The abundant inorganic elements act as electrolytes. The most important ions are sodium, potassium, calcium, magnesium, chloride, phosphate and the organic ion bicarbonate. The maintenance of precise ion gradients across cell membranes maintains osmotic pressure and pH.[26] Ions are also critical for nerve and muscle function, as action potentials in these tissues are produced by the exchange of electrolytes between the extracellular fluid and the cell's fluid, the cytosol.[27] Electrolytes enter and leave cells through proteins in the cell membrane called ion channels. For example, muscle contraction depends upon the movement of calcium, sodium and potassium through ion channels in the cell membrane and T-tubules.[28]
Transition metals are usually present as trace elements in organisms, with zinc and iron being most abundant of those.[29] Metal cofactors are bound tightly to specific sites in proteins; although enzyme cofactors can be modified during catalysis, they always return to their original state by the end of the reaction catalyzed. Metal micronutrients are taken up into organisms by specific transporters and bind to storage proteins such as ferritin or metallothionein when not in use.[30][31]
Catabolism
[edit]Catabolism is the set of metabolic processes that break down large molecules. These include breaking down and oxidizing food molecules. The purpose of the catabolic reactions is to provide the energy and components needed by anabolic reactions which build molecules.[32] The exact nature of these catabolic reactions differ from organism to organism, and organisms can be classified based on their sources of energy, hydrogen, and carbon (their primary nutritional groups), as shown in the table below. Organic molecules are used as a source of hydrogen atoms or electrons by organotrophs, while lithotrophs use inorganic substrates. Whereas phototrophs convert sunlight to chemical energy,[33] chemotrophs depend on redox reactions that involve the transfer of electrons from reduced donor molecules such as organic molecules, hydrogen, hydrogen sulfide or ferrous ions to oxygen, nitrate or sulfate. In animals, these reactions involve complex organic molecules that are broken down to simpler molecules, such as carbon dioxide and water. Photosynthetic organisms, such as plants and cyanobacteria, use similar electron-transfer reactions to store energy absorbed from sunlight.[34]
| Energy source | sunlight | photo- | -troph | ||
| molecules | chemo- | ||||
| Hydrogen or electron donor | organic compound | organo- | |||
| inorganic compound | litho- | ||||
| Carbon source | organic compound | hetero- | |||
| inorganic compound | auto- | ||||
The most common set of catabolic reactions in animals can be separated into three main stages. In the first stage, large organic molecules, such as proteins, polysaccharides or lipids, are digested into their smaller components outside cells. Next, these smaller molecules are taken up by cells and converted to smaller molecules, usually acetyl coenzyme A (acetyl-CoA), which releases some energy. Finally, the acetyl group on acetyl-CoA is oxidized to water and carbon dioxide in the citric acid cycle and electron transport chain, releasing more energy while reducing the coenzyme nicotinamide adenine dinucleotide (NAD+) into NADH.[32]
Digestion
[edit]Macromolecules cannot be directly processed by cells. Macromolecules must be broken into smaller units before they can be used in cell metabolism. Different classes of enzymes are used to digest these polymers. These digestive enzymes include proteases that digest proteins into amino acids, as well as glycoside hydrolases that digest polysaccharides into simple sugars known as monosaccharides.[36]
Microbes simply secrete digestive enzymes into their surroundings,[37][38] while animals only secrete these enzymes from specialized cells in their guts, including the stomach and pancreas, and in salivary glands.[39] The amino acids or sugars released by these extracellular enzymes are then pumped into cells by active transport proteins.[40][41]

Energy from organic compounds
[edit]Carbohydrate catabolism is the breakdown of carbohydrates into smaller units. Carbohydrates are usually taken into cells after they have been digested into monosaccharides such as glucose and fructose.[42] Once inside, the major route of breakdown is glycolysis, in which glucose is converted into pyruvate. This process generates the energy-conveying molecule NADH from NAD+, and generates ATP from ADP for use in powering many processes within the cell.[43] Pyruvate is an intermediate in several metabolic pathways, but the majority is converted to acetyl-CoA and fed into the citric acid cycle, which enables more ATP production by means of oxidative phosphorylation. This oxidation consumes molecular oxygen and releases water and the waste product carbon dioxide. When oxygen is lacking, or when pyruvate is temporarily produced faster than it can be consumed by the citric acid cycle (as in intense muscular exertion), pyruvate is converted to lactate by the enzyme lactate dehydrogenase, a process that also oxidizes NADH back to NAD+ for re-use in further glycolysis, allowing energy production to continue.[44] The lactate is later converted back to pyruvate for ATP production where energy is needed, or back to glucose in the Cori cycle. An alternative route for glucose breakdown is the pentose phosphate pathway, which produces less energy but supports anabolism (biomolecule synthesis). This pathway reduces the coenzyme NADP+ to NADPH and produces pentose compounds such as ribose 5-phosphate for synthesis of many biomolecules such as nucleotides and aromatic amino acids.[45]

Fats are catabolized by hydrolysis to free fatty acids and glycerol. The glycerol enters glycolysis and the fatty acids are broken down by beta oxidation to release acetyl-CoA, which then is fed into the citric acid cycle. Fatty acids release more energy upon oxidation than carbohydrates. Steroids are also broken down by some bacteria in a process similar to beta oxidation, and this breakdown process involves the release of significant amounts of acetyl-CoA, propionyl-CoA, and pyruvate, which can all be used by the cell for energy. M. tuberculosis can also grow on the lipid cholesterol as a sole source of carbon, and genes involved in the cholesterol-use pathway(s) have been validated as important during various stages of the infection lifecycle of M. tuberculosis.[46]
Amino acids are either used to synthesize proteins and other biomolecules, or oxidized to urea and carbon dioxide to produce energy.[47] The oxidation pathway starts with the removal of the amino group by a transaminase. The amino group is fed into the urea cycle, leaving a deaminated carbon skeleton in the form of a keto acid. Several of these keto acids are intermediates in the citric acid cycle, for example α-ketoglutarate formed by deamination of glutamate.[48] The glucogenic amino acids can also be converted into glucose, through gluconeogenesis.[49]
Energy transformations
[edit]Oxidative phosphorylation
[edit]In oxidative phosphorylation, the electrons removed from organic molecules in areas such as the citric acid cycle are transferred to oxygen and the energy released is used to make ATP. This is done in eukaryotes by a series of proteins in the membranes of mitochondria called the electron transport chain. In prokaryotes, these proteins are found in the cell's inner membrane.[50] These proteins use the energy from reduced molecules like NADH to pump protons across a membrane.[51]

Pumping protons out of the mitochondria creates a proton concentration difference across the membrane and generates an electrochemical gradient.[52] This force drives protons back into the mitochondrion through the base of an enzyme called ATP synthase. The flow of protons makes the stalk subunit rotate, causing the active site of the synthase domain to change shape and phosphorylate adenosine diphosphate—turning it into ATP.[20]
Energy from inorganic compounds
[edit]Chemolithotrophy is a type of metabolism found in prokaryotes where energy is obtained from the oxidation of inorganic compounds. These organisms can use hydrogen,[53] reduced sulfur compounds (such as sulfide, hydrogen sulfide and thiosulfate),[1] ferrous iron (Fe(II))[54] or ammonia[55] as sources of reducing power and they gain energy from the oxidation of these compounds.[56] These microbial processes are important in global biogeochemical cycles such as acetogenesis, nitrification and denitrification and are critical for soil fertility.[57][58]
Energy from light
[edit]The energy in sunlight is captured by plants, cyanobacteria, purple bacteria, green sulfur bacteria and some protists. This process is often coupled to the conversion of carbon dioxide into organic compounds, as part of photosynthesis, which is discussed below. The energy capture and carbon fixation systems can, however, operate separately in prokaryotes, as purple bacteria and green sulfur bacteria can use sunlight as a source of energy, while switching between carbon fixation and the fermentation of organic compounds.[59][60]
In many organisms, the capture of solar energy is similar in principle to oxidative phosphorylation, as it involves the storage of energy as a proton concentration gradient. This proton motive force then drives ATP synthesis.[61] The electrons needed to drive this electron transport chain come from light-gathering proteins called photosynthetic reaction centres. Reaction centers are classified into two types depending on the nature of photosynthetic pigment present, with most photosynthetic bacteria only having one type, while plants and cyanobacteria have two.[62]
In plants, algae, and cyanobacteria, photosystem II uses light energy to remove electrons from water, releasing oxygen as a waste product. The electrons then flow to the cytochrome b6f complex, which uses their energy to pump protons across the thylakoid membrane in the chloroplast.[34] These protons move back through the membrane as they drive the ATP synthase, as before. The electrons then flow through photosystem I and can then be used to reduce the coenzyme NADP+.[63] This coenzyme can enter the Calvin cycle or be recycled for further ATP generation.[citation needed]
Anabolism
[edit]Anabolism is the set of constructive metabolic processes where the energy released by catabolism is used to synthesize complex molecules. In general, the complex molecules that make up cellular structures are constructed step-by-step from smaller and simpler precursors. Anabolism involves three basic stages. First, the production of precursors such as amino acids, monosaccharides, isoprenoids and nucleotides, secondly, their activation into reactive forms using energy from ATP, and thirdly, the assembly of these precursors into complex molecules such as proteins, polysaccharides, lipids and nucleic acids.[64]
Anabolism in organisms can be different according to the source of constructed molecules in their cells. Autotrophs such as plants can construct the complex organic molecules in their cells such as polysaccharides and proteins from simple molecules like carbon dioxide and water. Heterotrophs, on the other hand, require a source of more complex substances, such as monosaccharides and amino acids, to produce these complex molecules. Organisms can be further classified by ultimate source of their energy: photoautotrophs and photoheterotrophs obtain energy from light, whereas chemoautotrophs and chemoheterotrophs obtain energy from oxidation reactions.[64]
Carbon fixation
[edit]
Photosynthesis is the synthesis of carbohydrates from sunlight and carbon dioxide (CO2). In plants, cyanobacteria and algae, oxygenic photosynthesis splits water, with oxygen produced as a waste product. This process uses the ATP and NADPH produced by the photosynthetic reaction centres, as described above, to convert CO2 into glycerate 3-phosphate, which can then be converted into glucose. This carbon-fixation reaction is carried out by the enzyme RuBisCO as part of the Calvin–Benson cycle.[65] Three types of photosynthesis occur in plants, C3 carbon fixation, C4 carbon fixation and CAM photosynthesis. These differ by the route that carbon dioxide takes to the Calvin cycle, with C3 plants fixing CO2 directly, while C4 and CAM photosynthesis incorporate the CO2 into other compounds first, as adaptations to deal with intense sunlight and dry conditions.[66]
In photosynthetic prokaryotes the mechanisms of carbon fixation are more diverse. Here, carbon dioxide can be fixed by the Calvin–Benson cycle, a reversed citric acid cycle,[67] or the carboxylation of acetyl-CoA.[68][69] Prokaryotic chemoautotrophs also fix CO2 through the Calvin–Benson cycle, but use energy from inorganic compounds to drive the reaction.[70]
Carbohydrates and glycans
[edit]In carbohydrate anabolism, simple organic acids can be converted into monosaccharides such as glucose and then used to assemble polysaccharides such as starch. The generation of glucose from compounds like pyruvate, lactate, glycerol, glycerate 3-phosphate and amino acids is called gluconeogenesis. Gluconeogenesis converts pyruvate to glucose-6-phosphate through a series of intermediates, many of which are shared with glycolysis.[43] However, this pathway is not simply glycolysis run in reverse, as several steps are catalyzed by non-glycolytic enzymes. This is important as it allows the formation and breakdown of glucose to be regulated separately, and prevents both pathways from running simultaneously in a futile cycle.[71][72]
Although fat is a common way of storing energy, in vertebrates such as humans the fatty acids in these stores cannot be converted to glucose through gluconeogenesis as these organisms cannot convert acetyl-CoA into pyruvate; plants do, but animals do not, have the necessary enzymatic machinery.[73] As a result, after long-term starvation, vertebrates need to produce ketone bodies from fatty acids to replace glucose in tissues such as the brain that cannot metabolize fatty acids.[74] In other organisms such as plants and bacteria, this metabolic problem is solved using the glyoxylate cycle, which bypasses the decarboxylation step in the citric acid cycle and allows the transformation of acetyl-CoA to oxaloacetate, where it can be used for the production of glucose.[73][75] Other than fat, glucose is stored in most tissues, as an energy resource available within the tissue through glycogenesis which was usually being used to maintained glucose level in blood.[76]
Polysaccharides and glycans are made by the sequential addition of monosaccharides by glycosyltransferase from a reactive sugar-phosphate donor such as uridine diphosphate glucose (UDP-Glc) to an acceptor hydroxyl group on the growing polysaccharide. As any of the hydroxyl groups on the ring of the substrate can be acceptors, the polysaccharides produced can have straight or branched structures.[77] The polysaccharides produced can have structural or metabolic functions themselves, or be transferred to lipids and proteins by the enzymes oligosaccharyltransferases.[78][79]
Fatty acids, isoprenoids and sterol
[edit]
Fatty acids are made by fatty acid synthases that polymerize and then reduce acetyl-CoA units. The acyl chains in the fatty acids are extended by a cycle of reactions that add the acyl group, reduce it to an alcohol, dehydrate it to an alkene group and then reduce it again to an alkane group. The enzymes of fatty acid biosynthesis are divided into two groups: in animals and fungi, all these fatty acid synthase reactions are carried out by a single multifunctional type I protein,[80] while in plant plastids and bacteria separate type II enzymes perform each step in the pathway.[81][82]
Terpenes and isoprenoids are a large class of lipids that include the carotenoids and form the largest class of plant natural products.[83] These compounds are made by the assembly and modification of isoprene units donated from the reactive precursors isopentenyl pyrophosphate and dimethylallyl pyrophosphate.[84] These precursors can be made in different ways. In animals and archaea, the mevalonate pathway produces these compounds from acetyl-CoA,[85] while in plants and bacteria the non-mevalonate pathway uses pyruvate and glyceraldehyde 3-phosphate as substrates.[84][86] One important reaction that uses these activated isoprene donors is sterol biosynthesis. Here, the isoprene units are joined to make squalene and then folded up and formed into a set of rings to make lanosterol.[87] Lanosterol can then be converted into other sterols such as cholesterol and ergosterol.[87][88]
Proteins
[edit]Organisms vary in their ability to synthesize the 20 common amino acids. Most bacteria and plants can synthesize all twenty, but mammals can only synthesize eleven nonessential amino acids, so nine essential amino acids must be obtained from food.[10] Some simple parasites, such as the bacteria Mycoplasma pneumoniae, lack all amino acid synthesis and take their amino acids directly from their hosts.[89] All amino acids are synthesized from intermediates in glycolysis, the citric acid cycle, or the pentose phosphate pathway. Nitrogen is provided by glutamate and glutamine. Nonessensial amino acid synthesis depends on the formation of the appropriate alpha-keto acid, which is then transaminated to form an amino acid.[90]
Amino acids are made into proteins by being joined in a chain of peptide bonds. Each different protein has a unique sequence of amino acid residues: this is its primary structure. Just as the letters of the alphabet can be combined to form an almost endless variety of words, amino acids can be linked in varying sequences to form a huge variety of proteins. Proteins are made from amino acids that have been activated by attachment to a transfer RNA molecule through an ester bond. This aminoacyl-tRNA precursor is produced in an ATP-dependent reaction carried out by an aminoacyl tRNA synthetase.[91] This aminoacyl-tRNA is then a substrate for the ribosome, which joins the amino acid onto the elongating protein chain, using the sequence information in a messenger RNA.[92]
Nucleotide synthesis and salvage
[edit]Nucleotides are made from amino acids, carbon dioxide and formic acid in pathways that require large amounts of metabolic energy.[93] Consequently, most organisms have efficient systems to salvage preformed nucleotides.[93][94] Purines are synthesized as nucleosides (bases attached to ribose).[95] Both adenine and guanine are made from the precursor nucleoside inosine monophosphate, which is synthesized using atoms from the amino acids glycine, glutamine, and aspartic acid, as well as formate transferred from the coenzyme tetrahydrofolate. Pyrimidines, on the other hand, are synthesized from the base orotate, which is formed from glutamine and aspartate.[96]
Xenobiotics and redox metabolism
[edit]Все организмы постоянно подвергаются воздействию соединений, которые они не могут использовать в пищу и которые могут быть вредными, если будут накапливаться в клетках, поскольку у них нет метаболической функции. Эти потенциально вредные соединения называются ксенобиотиками . [97] Xenobiotics such as synthetic drugs, natural poisons and antibiotics are detoxified by a set of xenobiotic-metabolizing enzymes. In humans, these include cytochrome P450 oxidases,[98] UDP-glucuronosyltransferases,[99] and glutathione S-transferases.[100] This system of enzymes acts in three stages to firstly oxidize the xenobiotic (phase I) and then conjugate water-soluble groups onto the molecule (phase II). The modified water-soluble xenobiotic can then be pumped out of cells and in multicellular organisms may be further metabolized before being excreted (phase III). In ecology, these reactions are particularly important in microbial biodegradation of pollutants and the bioremediation of contaminated land and oil spills.[101] Многие из этих микробных реакций свойственны многоклеточным организмам, но из-за невероятного разнообразия типов микробов эти организмы способны справляться с гораздо более широким спектром ксенобиотиков, чем многоклеточные организмы, и могут разлагать даже стойкие органические загрязнители, такие как хлорорганические соединения. [ 102 ]
Связанной проблемой для аэробных организмов является окислительный стресс . [ 103 ] Здесь процессы, включающие окислительное фосфорилирование и образование дисульфидных связей во время сворачивания белка, производят активные формы кислорода, такие как перекись водорода . [ 104 ] Эти повреждающие оксиданты удаляются антиоксидантными метаболитами, такими как глутатион , и такими ферментами, как каталазы и пероксидазы . [ 105 ] [ 106 ]
Термодинамика живых организмов
[ редактировать ]Живые организмы должны подчиняться законам термодинамики , описывающим перенос тепла и работы . Второй закон термодинамики гласит, что в любой изолированной системе количество энтропии (беспорядка) не может уменьшаться. Хотя удивительная сложность живых организмов, по-видимому, противоречит этому закону, жизнь возможна, поскольку все организмы представляют собой открытые системы , которые обмениваются веществом и энергией с окружающей средой. Живые системы не находятся в равновесии , а представляют собой диссипативные системы , которые поддерживают свое состояние высокой сложности, вызывая большее увеличение энтропии окружающей среды. [ 107 ] Метаболизм клетки достигает этого путем объединения спонтанных процессов катаболизма с неспонтанными процессами анаболизма. С термодинамической точки зрения метаболизм поддерживает порядок, создавая беспорядок. [ 108 ]
Регулирование и контроль
[ редактировать ]Поскольку среда большинства организмов постоянно меняется, реакции метаболизма должны тонко регулироваться, чтобы поддерживать постоянный набор условий внутри клеток, состояние, называемое гомеостазом . [ 109 ] [ 110 ] Метаболическая регуляция также позволяет организмам реагировать на сигналы и активно взаимодействовать с окружающей средой. [ 111 ] Две тесно связанные концепции важны для понимания того, как контролируются метаболические пути. Во-первых, регуляция фермента в пути заключается в том, как его активность увеличивается и уменьшается в ответ на сигналы. Во-вторых, контроль, осуществляемый этим ферментом, — это влияние, которое эти изменения его активности оказывают на общую скорость пути ( поток через путь). [ 112 ] Например, фермент может демонстрировать большие изменения в активности (т.е. он в высокой степени регулируется), но если эти изменения мало влияют на поток метаболического пути, то этот фермент не участвует в контроле этого пути. [ 113 ]
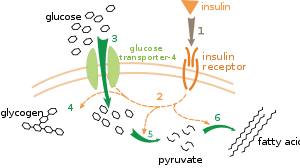
Существует несколько уровней метаболической регуляции. При внутренней регуляции метаболический путь саморегулируется, реагируя на изменения уровней субстратов или продуктов; например, уменьшение количества продукта может увеличить поток через путь для компенсации. [ 112 ] Этот тип регуляции часто включает аллостерическую регуляцию активности нескольких ферментов этого пути. [ 114 ] Внешний контроль предполагает, что клетка многоклеточного организма меняет свой метаболизм в ответ на сигналы других клеток. Эти сигналы обычно имеют форму водорастворимых посланников, таких как гормоны и факторы роста , и обнаруживаются специфическими рецепторами на поверхности клеток. [ 115 ] Эти сигналы затем передаются внутри клетки с помощью систем вторичных мессенджеров , которые часто включают фосфорилирование белков. [ 116 ]
Хорошо изученным примером внешнего контроля является регуляция метаболизма глюкозы гормоном инсулином . [ 117 ] Инсулин вырабатывается в ответ на повышение уровня глюкозы в крови . Связывание гормона с рецепторами инсулина на клетках затем активирует каскад протеинкиназ , которые заставляют клетки поглощать глюкозу и превращать ее в запасные молекулы, такие как жирные кислоты и гликоген . [ 118 ] Метаболизм гликогена контролируется активностью фосфорилазы — фермента, расщепляющего гликоген, и гликогенсинтазы — фермента, который его производит. Эти ферменты регулируются реципрокным образом: фосфорилирование ингибирует гликогенсинтазу, но активирует фосфорилазу. Инсулин вызывает синтез гликогена, активируя протеинфосфатазы и вызывая снижение фосфорилирования этих ферментов. [ 119 ]
Эволюция
[ редактировать ]
Описанные выше центральные пути метаболизма, такие как гликолиз и цикл лимонной кислоты, присутствуют во всех трех доменах живых существ и присутствовали у последнего универсального общего предка . [ 3 ] [ 120 ] Эта универсальная предковая клетка была прокариотом и, вероятно, метаногеном , который имел обширный метаболизм аминокислот, нуклеотидов, углеводов и липидов. [ 121 ] [ 122 ] Сохранение этих древних путей во время более поздней эволюции может быть результатом того, что эти реакции были оптимальным решением их конкретных метаболических проблем, причем такие пути, как гликолиз и цикл лимонной кислоты, производят свои конечные продукты высокоэффективно и за минимальное количество шагов. . [ 4 ] [ 5 ] Первые пути ферментативного метаболизма, возможно, были частью метаболизма пуриновых нуклеотидов, тогда как предыдущие метаболические пути были частью древнего мира РНК . [ 123 ]
Было предложено множество моделей для описания механизмов развития новых метаболических путей. К ним относятся последовательное добавление новых ферментов к короткому предковому пути, дублирование, а затем дивергенция целых путей, а также вовлечение ранее существовавших ферментов и их сборка в новый путь реакции. [ 124 ] Относительная важность этих механизмов неясна, но геномные исследования показали, что ферменты в пути, вероятно, имеют общее происхождение, что позволяет предположить, что многие пути развивались поэтапно с новыми функциями, созданными из ранее существовавших этапов. в пути. [ 125 ] Альтернативная модель основана на исследованиях, которые прослеживают эволюцию структур белков в метаболических сетях. Это предполагает, что ферменты повсеместно рекрутируются, заимствуя ферменты для выполнения аналогичных функций в различных метаболических путях (очевидно из базы данных MANET ). [ 126 ] Эти процессы рекрутирования приводят к образованию эволюционной ферментативной мозаики. [ 127 ] Третья возможность заключается в том, что некоторые части метаболизма могут существовать в виде «модулей», которые можно повторно использовать в разных путях и выполнять схожие функции на разных молекулах. [ 128 ]
Помимо развития новых метаболических путей, эволюция также может привести к потере метаболических функций. Например, у некоторых паразитов метаболические процессы, которые не являются необходимыми для выживания, теряются, и вместо этого предварительно сформированные аминокислоты, нуклеотиды и углеводы могут быть удалены из организма хозяина . [ 129 ] Аналогичное снижение метаболических возможностей наблюдается у эндосимбиотических организмов. [ 130 ]
Расследование и манипуляции
[ редактировать ]
Классически метаболизм изучается с помощью редукционистского подхода, который фокусируется на одном метаболическом пути. Особую ценность представляет использование радиоактивных индикаторов на уровне всего организма, тканей и клеток, которые определяют пути от предшественников к конечным продуктам путем идентификации радиоактивно меченных промежуточных продуктов и продуктов. [ 131 ] Ферменты, катализирующие эти химические реакции, затем можно очистить и исследовать их кинетику и реакцию на ингибиторы . Параллельный подход заключается в идентификации небольших молекул в клетке или ткани; полный набор этих молекул называется метаболомом . В целом эти исследования дают хорошее представление о структуре и функциях простых метаболических путей, но недостаточны применительно к более сложным системам, таким как метаболизм целой клетки. [ 132 ]
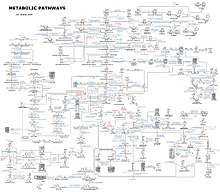
Представление о сложности метаболических сетей в клетках, содержащих тысячи различных ферментов, дает рисунок справа, на котором показаны взаимодействия всего лишь 43 белков и 40 метаболитов: последовательности геномов представляют собой списки, содержащие до 26 500 генов. [ 133 ] Однако теперь можно использовать эти геномные данные для реконструкции полных сетей биохимических реакций и создания более целостных математических моделей, которые могут объяснить и предсказать их поведение. [ 134 ] Эти модели особенно эффективны, когда они используются для интеграции данных о путях и метаболитах, полученных с помощью классических методов, с данными об экспрессии генов , полученными в результате исследований протеомных микрочипов и ДНК . [ 135 ] С помощью этих методов теперь создана модель метаболизма человека, которая будет служить ориентиром для будущих открытий лекарств и биохимических исследований. [ 136 ] Эти модели теперь используются в сетевом анализе , чтобы классифицировать болезни человека на группы, имеющие общие белки или метаболиты. [ 137 ] [ 138 ]
Бактериальные метаболические сети являются ярким примером « галстука-бабочки». [ 139 ] [ 140 ] [ 141 ] организация, архитектура, способная вводить широкий спектр питательных веществ и производить большое разнообразие продуктов и сложных макромолекул, используя относительно небольшое количество промежуточных общих валют. [ 142 ]
Основным технологическим применением этой информации является метаболическая инженерия . Здесь такие организмы, как дрожжи , растения или бактерии, генетически модифицируются, чтобы сделать их более полезными в биотехнологии и способствовать производству лекарств, таких как антибиотики , или промышленных химикатов, таких как 1,3-пропандиол и шикимовая кислота . [ 143 ] [ 144 ] [ 145 ] Эти генетические модификации обычно направлены на уменьшение количества энергии, используемой для производства продукта, повышение урожайности и сокращение образования отходов. [ 146 ]
История
[ редактировать ]Термин «метаболизм» происходит от древнегреческого слова μεταβολή — «метабол», означающего «изменение», которое происходит от μεταβάλλειν — «метабаллеин», что означает «изменяться». [ 147 ]
Греческая философия
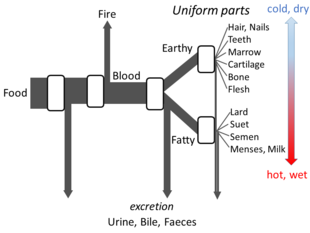
[ редактировать ]Аристотеля В книге «Части животных» изложены достаточно детали его взглядов на метаболизм, чтобы можно было построить модель открытого потока. Он считал, что на каждой стадии процесса материалы из пищи трансформируются, при этом выделяется тепло, как классический элемент огня, а остаточные материалы выделяются в виде мочи, желчи или фекалий. [ 148 ]
Ибн ан-Нафис описал метаболизм в своей работе 1260 года нашей эры под названием «Ар-Рисала аль-Камилия фил Сиера ан-Набавия» («Трактат Камиля о биографии Пророка»), которая включала следующую фразу: «И тело, и его части находятся в непрерывном состоянии. растворения и питания, поэтому они неизбежно претерпевают постоянные изменения». [ 149 ]
Применение научного метода и современных метаболических теорий
[ редактировать ]История научного изучения метаболизма насчитывает несколько столетий и перешла от изучения целых животных в ранних исследованиях к изучению отдельных метаболических реакций в современной биохимии. Первые контролируемые эксперименты по метаболизму человека были опубликованы Санторио Санторио в 1614 году в его книге Ars de statica medicina . [ 150 ] Он описал, как взвешивался до и после еды, сна , работы, секса, голодания, питья и испражнения. Он обнаружил, что большая часть принятой им пищи терялась из-за того, что он называл « неощутимым потом ».

В этих ранних исследованиях механизмы этих метаболических процессов не были идентифицированы, и жизненная сила оживляет живую ткань. считалось, что [ 151 ] В 19 веке, изучая ферментацию сахара в спирт с помощью дрожжей , Луи Пастер пришел к выводу, что брожение катализируется веществами внутри дрожжевых клеток, которые он назвал «ферментами». Он писал, что «спиртовое брожение — это процесс, связанный с жизнью и организацией дрожжевых клеток, а не с гибелью или гниением клеток». [ 152 ] Это открытие, наряду с публикацией Фридрихом Вёлером в 1828 году статьи о химическом синтезе мочевины , [ 153 ] и примечателен тем, что является первым органическим соединением, полученным из полностью неорганических предшественников. Это доказало, что органические соединения и химические реакции, обнаруженные в клетках, в принципе ничем не отличаются от любой другой области химии.
Именно открытие ферментов в начале 20 века Эдуардом Бюхнером отделило изучение химических реакций обмена веществ от биологического изучения клеток и положило начало биохимии . [ 154 ] Масса биохимических знаний быстро росла на протяжении начала 20 века. Одним из самых плодовитых современных биохимиков был Ганс Кребс , который внес огромный вклад в изучение метаболизма. [ 155 ] Он открыл цикл мочевины, а позже, работая с Гансом Корнбергом , цикл лимонной кислоты и глиоксилатный цикл. [ 156 ] [ 157 ] [ 75 ] Современным биохимическим исследованиям во многом способствовала разработка новых методов, таких как хроматография , рентгеновская дифракция , ЯМР-спектроскопия , радиоизотопная маркировка , электронная микроскопия и моделирование молекулярной динамики . Эти методы позволили открыть и детально проанализировать множество молекул и метаболических путей в клетках. [ нужна ссылка ]
См. также
[ редактировать ]- Антропогенный метаболизм – Материальный и энергетический круговорот человеческого общества.
- Антиметаболит – химическое вещество, препятствующее использованию метаболита.
- Калориметрия - определение теплопередачи в системе путем измерения других ее свойств.
- Изотермическая микрокалориметрия - измерение чистой скорости теплового потока в зависимости от прошедшего времени.
- Врожденные нарушения обмена веществ . Класс генетических заболеваний.
- Гипотеза мира железа и серы - Гипотетический сценарий происхождения жизни, теория происхождения жизни «прежде всего метаболизм».
- Метаболическое расстройство - заболевание, связанное с ошибками в метаболических процессах построения или деградации молекул.
- Микрофизиометрия
- Первичные группы питания - Группа организмов
- Протометаболизм
- Респирометрия – оценка скорости метаболизма путем измерения теплопродукции.
- Поток метаболизма
- Метаболизм серы - совокупность химических реакций с участием серы в живых организмах.
- Термический эффект еды - эффект еды.
- Городской метаболизм - Модель потоков материалов и энергии в городах.
- Водный обмен - аспект гомеостаза, касающийся контроля количества воды в организме.
- Переполненный метаболизм – Клеточные явления
- Онкометаболизм
- Reactome - База данных биологических путей
- KEGG – Коллекция баз данных по биоинформатике
Ссылки
[ редактировать ]- ^ Jump up to: а б Фридрих, CG (1997). Физиология и генетика сероокисляющих бактерий . Достижения микробной физиологии. Том. 39. С. 235–89. дои : 10.1016/S0065-2911(08)60018-1 . ISBN 978-0-12-027739-1 . ПМИД 9328649 .
- ^ Пейс НР (январь 2001 г.). «Универсальная природа биохимии» . Труды Национальной академии наук Соединенных Штатов Америки . 98 (3): 805–8. Бибкод : 2001PNAS...98..805P . дои : 10.1073/pnas.98.3.805 . ПМЦ 33372 . ПМИД 11158550 .
- ^ Jump up to: а б Смит Э., Моровиц HJ (сентябрь 2004 г.). «Универсальность в промежуточном метаболизме» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (36): 13168–73. Бибкод : 2004PNAS..10113168S . дои : 10.1073/pnas.0404922101 . ПМК 516543 . ПМИД 15340153 .
- ^ Jump up to: а б Эбенхё О, Генрих Р. (январь 2001 г.). «Эволюционная оптимизация метаболических путей. Теоретическая реконструкция стехиометрии систем, продуцирующих АТФ и НАДН». Бюллетень математической биологии . 63 (1): 21–55. дои : 10.1006/bulm.2000.0197 . ПМИД 11146883 . S2CID 44260374 .
- ^ Jump up to: а б Мелендес-Эвиа Э., Уодделл Т.Г., Касканте М. (сентябрь 1996 г.). «Загадка цикла лимонной кислоты Кребса: сборка частей химически возможных реакций и оппортунизм в разработке метаболических путей в ходе эволюции». Журнал молекулярной эволюции . 43 (3): 293–303. Бибкод : 1996JMolE..43..293M . дои : 10.1007/BF02338838 . ПМИД 8703096 . S2CID 19107073 .
- ^ Смит Р.Л., Сотерс М.Р., Вюст Р.К., Хауткупер Р.Х. (август 2018 г.). «Метаболическая гибкость как адаптация к энергетическим ресурсам и потребностям здоровья и болезней» . Эндокринные обзоры . 39 (4): 489–517. дои : 10.1210/er.2017-00211 . ПМК 6093334 . ПМИД 29697773 .
- ^ Вандер Хайден М.Г., ДеБерардинис Р.Дж. (февраль 2017 г.). «Понимание взаимосвязей между метаболизмом и биологией рака» . Клетка . 168 (4): 657–669. дои : 10.1016/j.cell.2016.12.039 . ПМЦ 5329766 . ПМИД 28187287 .
- ^ Купер GM (2000). «Молекулярный состав клеток» . Клетка: молекулярный подход (2-е изд.). Архивировано из оригинала 27 августа 2020 года . Проверено 25 июня 2020 г.
- ^ Мичи К.А., Лёве Дж (2006). «Динамические нити бактериального цитоскелета». Ежегодный обзор биохимии . 75 : 467–92. doi : 10.1146/annurev.biochem.75.103004.142452 . ПМИД 16756499 . S2CID 4550126 .
- ^ Jump up to: а б с д и Нельсон Д.Л., Кокс М.М. (2005). Ленингерские принципы биохимии . Нью-Йорк: WH Freeman и компания. п. 841 . ISBN 978-0-7167-4339-2 .
- ^ Келлехер Дж.К., Брайан Б.М., Маллет Р.Т., Холлеран А.Л., Мерфи А.Н., Фискум Дж. (сентябрь 1987 г.). «Анализ метаболизма цикла трикарбоновых кислот клеток гепатомы путем сравнения соотношений 14CO2» . Биохимический журнал . 246 (3): 633–9. дои : 10.1042/bj2460633 . ПМЦ 1148327 . ПМИД 3120698 .
- ^ Хотерсолл Дж.С., Ахмед А. (2013). «Метаболическая судьба повышенного поглощения аминокислот дрожжами после катаболитной дерепрессии» . Журнал аминокислот . 2013 : 461901. doi : 10.1155/2013/461901 . ПМЦ 3575661 . ПМИД 23431419 .
- ^ Фэйи Э., Субраманиам С., Браун Х.А., Гласс СК, Меррилл А.Х., Мерфи Р.К. и др. (май 2005 г.). «Комплексная система классификации липидов» . Журнал исследований липидов . 46 (5): 839–61. doi : 10.1194/jlr.E400004-JLR200 . ПМИД 15722563 .
- ^ «Номенклатура липидов Губ-1 и Губ-2» . qmul.ac.uk. Архивировано из оригинала 6 июня 2020 года . Проверено 6 июня 2020 г.
- ^ Берг Дж.М., Тимочко Дж.Л., Гатто-младший Г.Дж., Страйер Л. (8 апреля 2015 г.). Биохимия (8-е изд.). Нью-Йорк: WH Freeman. п. 362. ИСБН 978-1-4641-2610-9 . OCLC 913469736 .
- ^ Раман Р., Рагурам С., Венкатараман Г., Полсон Дж.К., Сасисекхаран Р. (ноябрь 2005 г.). «Гликомика: интегрированный системный подход к структурно-функциональным взаимоотношениям гликанов». Природные методы . 2 (11): 817–24. дои : 10.1038/nmeth807 . ПМИД 16278650 . S2CID 4644919 .
- ^ Сьерра С., Купфер Б., Кайзер Р. (декабрь 2005 г.). «Основы вирусологии ВИЧ-1 и его репликации». Журнал клинической вирусологии . 34 (4): 233–44. дои : 10.1016/j.jcv.2005.09.004 . ПМИД 16198625 .
- ^ Jump up to: а б Виммер М.Дж., Роуз И.А. (1978). «Механизмы реакций переноса группы, катализируемых ферментами». Ежегодный обзор биохимии . 47 : 1031–78. дои : 10.1146/annurev.bi.47.070178.005123 . ПМИД 354490 .
- ^ Митчелл П. (март 1979 г.). «Девятая лекция сэра Ганса Кребса. Компартментация и коммуникация в живых системах. Лигандная проводимость: общий каталитический принцип в химических, осмотических и хемиосмотических реакционных системах» . Европейский журнал биохимии . 95 (1): 1–20. дои : 10.1111/j.1432-1033.1979.tb12934.x . ПМИД 378655 .
- ^ Jump up to: а б с Димрот П., фон Баллмос С., Мейер Т. (март 2006 г.). «Каталитические и механические циклы в синтезе F-АТФ. Четвертый в серии обзоров циклов» . Отчеты ЭМБО . 7 (3): 276–82. дои : 10.1038/sj.embor.7400646 . ПМЦ 1456893 . ПМИД 16607397 .
- ^ Бонора М., Патерньяни С., Римесси А., Де Марчи Е., Суски Дж.М., Бонони А. и др. (сентябрь 2012 г.). «Синтез и хранение АТФ» . Пуринергическая сигнализация . 8 (3): 343–57. дои : 10.1007/s11302-012-9305-8 . ПМК 3360099 . ПМИД 22528680 .
- ^ Берг Дж. М., Тимочко Дж. Л., Страйер Л. (2002). «Витамины часто являются предшественниками коферментов» . Биохимия. 5-е издание . Архивировано из оригинала 15 декабря 2020 года . Проверено 9 июня 2020 г.
- ^ Поллак Н., Дёлле С., Циглер М. (март 2007 г.). «Сила восстановления: пиридиновые нуклеотиды — маленькие молекулы с множеством функций» . Биохимический журнал . 402 (2): 205–18. дои : 10.1042/BJ20061638 . ПМК 1798440 . ПМИД 17295611 .
- ^ Фатих Ю (2009). Достижения биохимии пищевых продуктов . Бока-Ратон: CRC Press. п. 228. ИСБН 978-1-4200-0769-5 . OCLC 607553259 .
- ^ Хеймсфилд С.Б., Ваки М., Кехайяс Дж., Лихтман С., Дилманиан Ф.А., Камен Ю. и др. (август 1991 г.). «Химический и элементный анализ человека in vivo с использованием улучшенных моделей состава тела». Американский журнал физиологии . 261 (2 ч. 1): E190-8. дои : 10.1152/ajpendo.1991.261.2.E190 . ПМИД 1872381 .
- ^ «Электролитный баланс» . Анатомия и физиология . ОпенСтакс. Архивировано из оригинала 2 июня 2020 года . Проверено 23 июня 2020 г.
- ^ Лодиш Х., Берк А., Зипурски С.Л., Мацудайра П., Балтимор Д., Дарнелл Дж. (2000). «Потенциал действия и проводимость электрических импульсов» . Молекулярно-клеточная биология (4-е изд.). Архивировано из оригинала 30 мая 2020 года . Проверено 23 июня 2020 г. - через NCBI.
- ^ Дулханти AF (сентябрь 2006 г.). «Связь возбуждения-сокращения с 1950-х годов в новое тысячелетие». Клиническая и экспериментальная фармакология и физиология . 33 (9): 763–72. дои : 10.1111/j.1440-1681.2006.04441.x . ПМИД 16922804 . S2CID 37462321 .
- ^ Торрес-Ромеро Х.К., Альварес-Санчес М.Е., Фернандес-Мартин К., Альварес-Санчес Л.К., Арана-Аргаес В., Рамирес-Камачо М., Лара-Рьегос Х. (2018). «Выброс цинка у Trichomonas vaginalis: идентификация и анализ экспрессии CDF-подобных генов in silico». В Оливарес-Кирос Л., Ресендис-Антонио О (ред.). Количественные модели микроскопических и макроскопических биологических макромолекул и тканей . Чам: Международное издательство Springer. стр. 149–168. дои : 10.1007/978-3-319-73975-5_8 . ISBN 978-3-319-73975-5 .
- ^ Казинс Р.Дж., Люцци Дж.П., Лихтен Л.А. (август 2006 г.). «Транспорт, незаконный оборот и сигналы цинка у млекопитающих» . Журнал биологической химии . 281 (34): 24085–9. дои : 10.1074/jbc.R600011200 . ПМИД 16793761 . Архивировано из оригинала 25 июня 2020 года . Проверено 24 июня 2020 г.
- ^ Данн Л.Л., Сурьо Рахманто Ю., Ричардсон Д.Р. (февраль 2007 г.). «Поглощение железа и метаболизм в новом тысячелетии». Тенденции в клеточной биологии . 17 (2): 93–100. дои : 10.1016/j.tcb.2006.12.003 . ПМИД 17194590 .
- ^ Jump up to: а б Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2002). «Как клетки получают энергию из пищи». Молекулярная биология клетки (4-е изд.). Архивировано из оригинала 5 июля 2021 года . Проверено 25 июня 2020 г. - через NCBI.
- ^ Рэйвен Дж. (3 сентября 2009 г.). «Вклад аноксигенной и оксигенной фототрофии и хемолитотрофии в потоки углерода и кислорода в водной среде» . Водная микробная экология . 56 : 177–192. дои : 10.3354/ame01315 . ISSN 0948-3055 . Архивировано из оригинала 25 июня 2020 года . Проверено 25 июня 2020 г.
- ^ Jump up to: а б Нельсон Н., Бен-Шем А. (декабрь 2004 г.). «Сложная архитектура кислородного фотосинтеза». Обзоры природы. Молекулярно-клеточная биология . 5 (12): 971–82. дои : 10.1038/nrm1525 . ПМИД 15573135 . S2CID 5686066 .
- ^ Мэдиган М.Т., Мартинко Дж.М. (2006). Микробиология Брока (11-е, исправленное изд.). Мюнхен: исследования Пирсона. стр. 604, 621. ISBN. 3-8273-7187-2 . ОСЛК 162303067 .
- ^ Демирель Ю. (2016). Энергия: производство, преобразование, хранение, сохранение и соединение (Второе изд.). Линкольн: Спрингер. п. 431. ИСБН 978-3-319-29650-0 . OCLC 945435943 .
- ^ Хезе CC, Финкельштейн Р.А. (декабрь 1993 г.). «Бактериальные внеклеточные цинксодержащие металлопротеазы» . Микробиологические обзоры . 57 (4): 823–37. дои : 10.1128/MMBR.57.4.823-837.1993 . ПМК 372940 . ПМИД 8302217 .
- ^ Гупта Р., Гупта Н., Рати П. (июнь 2004 г.). «Бактериальные липазы: обзор производства, очистки и биохимических свойств». Прикладная микробиология и биотехнология . 64 (6): 763–81. дои : 10.1007/s00253-004-1568-8 . ПМИД 14966663 . S2CID 206934353 .
- ^ Хойл Т. (1997). «Пищеварительная система: связь теории и практики». Британский журнал медсестер . 6 (22): 1285–91. дои : 10.12968/bjon.1997.6.22.1285 . ПМИД 9470654 .
- ^ Суба В.В., Пачитти А.Дж. (1992). «Как аминокислоты попадают в клетки: механизмы, модели, меню и медиаторы». Журнал парентерального и энтерального питания . 16 (6): 569–78. дои : 10.1177/0148607192016006569 . ПМИД 1494216 .
- ^ Барретт, член парламента, Уолмсли, А.Р., Гулд Г.В. (август 1999 г.). «Структура и функции вспомогательных транспортеров сахара». Современное мнение в области клеточной биологии . 11 (4): 496–502. дои : 10.1016/S0955-0674(99)80072-6 . ПМИД 10449337 .
- ^ Белл Дж.И., Бурант К.Ф., Такеда Дж., Гулд Г.В. (сентябрь 1993 г.). «Структура и функции вспомогательных переносчиков сахара у млекопитающих» . Журнал биологической химии . 268 (26): 19161–4. дои : 10.1016/S0021-9258(19)36489-0 . ПМИД 8366068 .
- ^ Jump up to: а б Буше С., Серди С., Кан С.Р., Goldfine AB (октябрь 2004 г.). «Клеточная судьба глюкозы и ее значение при диабете 2 типа» . Эндокринные обзоры . 25 (5): 807–30. дои : 10.1210/er.2003-0026 . ПМИД 15466941 .
- ^ Альфарук К.О., Вердуско Д., Раух С., Муддатир А.К., Адиль Х.Х., Эльхассан Г.О. и др. (18 декабря 2014 г.). «Гликолиз, метаболизм опухоли, рост и распространение рака. Новая этиопатогенетическая перспектива на основе pH и терапевтический подход к старому вопросу рака» . Онсознание . 1 (12): 777–802. doi : 10.18632/oncoscience.109 . ПМК 4303887 . ПМИД 25621294 .
- ^ Крюгер, Николас Дж; фон Шавен, Антье (2003). «Окислительный пентозофосфатный путь: структура и организация». Современное мнение в области биологии растений . 6 (3): 236–246. Бибкод : 2003COPB....6..236K . дои : 10.1016/S1369-5266(03)00039-6 . ПМИД 12753973 .
- ^ Випперман М.Ф., Сэмпсон Н.С., Томас С.Т. (2014). «Патоген оидной ярости: утилизация холестерина микобактериями туберкулеза» . Критические обзоры по биохимии и молекулярной биологии . 49 (4): 269–93. дои : 10.3109/10409238.2014.895700 . ПМЦ 4255906 . ПМИД 24611808 .
- ^ Саками В., Харрингтон Х (1963). «Метаболизм аминокислот». Ежегодный обзор биохимии . 32 : 355–98. дои : 10.1146/annurev.bi.32.070163.002035 . ПМИД 14144484 .
- ^ Броснан Дж. Т. (апрель 2000 г.). «Глутамат на стыке обмена аминокислот и углеводов» . Журнал питания . 130 (дополнение 4S): 988S–90S. дои : 10.1093/jn/130.4.988S . ПМИД 10736367 .
- ^ Янг В.Р., Аджами А.М. (сентябрь 2001 г.). «Глютамин: император или его одежда?» . Журнал питания . 131 (9 Suppl): 2449S–59S, обсуждение 2486S–7S. дои : 10.1093/jn/131.9.2449S . ПМИД 11533293 .
- ^ Хослер Дж.П., Фергюсон-Миллер С., Миллс Д.А. (2006). «Трансдукция энергии: перенос протонов через дыхательные комплексы» . Ежегодный обзор биохимии . 75 : 165–87. doi : 10.1146/annurev.biochem.75.062003.101730 . ПМЦ 2659341 . ПМИД 16756489 .
- ^ Шульц Б.Е., Чан С.И. (2001). «Структуры и стратегии протонной перекачки митохондриальных дыхательных ферментов» (PDF) . Ежегодный обзор биофизики и биомолекулярной структуры . 30 :23–65. doi : 10.1146/annurev.biophys.30.1.23 . ПМИД 11340051 . Архивировано (PDF) из оригинала 22 января 2020 г. Проверено 11 ноября 2019 г.
- ^ Капальди Р.А., Аггелер Р. (март 2002 г.). «Механизм АТФ-синтазы F (1) F (0)-типа, биологического вращательного двигателя». Тенденции биохимических наук . 27 (3): 154–60. дои : 10.1016/S0968-0004(01)02051-5 . ПМИД 11893513 .
- ^ Фридрих Б., Шварц Э. (1993). «Молекулярная биология утилизации водорода аэробными хемолитотрофами». Ежегодный обзор микробиологии . 47 : 351–83. дои : 10.1146/annurev.mi.47.100193.002031 . ПМИД 8257102 .
- ^ Вебер К.А., Ахенбах Л.А., Коутс Дж.Д. (октябрь 2006 г.). «Микроорганизмы, перекачивающие железо: анаэробное микробное окисление и восстановление железа» . Обзоры природы. Микробиология . 4 (10): 752–64. дои : 10.1038/nrmicro1490 . ПМИД 16980937 . S2CID 8528196 . Архивировано из оригинала 2 мая 2019 года . Проверено 6 октября 2019 г.
- ^ Джеттен М.С., Страус М., ван де Пас-Шоонен К.Т., Шалк Дж., ван Донген У.Г., ван де Грааф А.А. и др. (декабрь 1998 г.). «Анаэробное окисление аммония» . Обзоры микробиологии FEMS . 22 (5): 421–37. дои : 10.1111/j.1574-6976.1998.tb00379.x . ПМИД 9990725 .
- ^ Саймон Дж. (август 2002 г.). «Энзимология и биоэнергетика дыхательной аммонификации нитритов» . Обзоры микробиологии FEMS . 26 (3): 285–309. дои : 10.1111/j.1574-6976.2002.tb00616.x . ПМИД 12165429 .
- ^ Конрад Р. (декабрь 1996 г.). «Почвенные микроорганизмы как регуляторы атмосферных микроэлементов (H2, CO, CH4, OCS, N2O и NO)» . Микробиологические обзоры . 60 (4): 609–40. дои : 10.1128/MMBR.60.4.609-640.1996 . ПМК 239458 . ПМИД 8987358 .
- ^ Бареа Х.М., Посо М.Дж., Азкон Р., Азкон-Агилар К. (июль 2005 г.). «Микробное сотрудничество в ризосфере» . Журнал экспериментальной ботаники . 56 (417): 1761–78. дои : 10.1093/jxb/eri197 . ПМИД 15911555 .
- ^ ван дер Меер М.Т., Схаутен С., Бейтсон М.М., Нюбель У., Виланд А., Кюль М. и др. (июль 2005 г.). «Суточные вариации углеродного метаболизма зелеными несероподобными бактериями в щелочных кремнистых микробных матах горячих источников из Йеллоустонского национального парка» . Прикладная и экологическая микробиология . 71 (7): 3978–86. Бибкод : 2005ApEnM..71.3978V . дои : 10.1128/АЕМ.71.7.3978-3986.2005 . ПМК 1168979 . ПМИД 16000812 .
- ^ Тичи М.А., Табита Ф.Р. (ноябрь 2001 г.). «Интерактивный контроль окислительно-восстановительных систем Rhodobacter capsulatus во время фототрофного метаболизма» . Журнал бактериологии . 183 (21): 6344–54. дои : 10.1128/JB.183.21.6344-6354.2001 . ПМК 100130 . ПМИД 11591679 .
- ^ Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2002). «Преобразование энергии: митохондрии и хлоропласты». Молекулярная биология клетки (4-е изд.). Архивировано из оригинала 15 декабря 2020 года . Проверено 3 июля 2020 г.
- ^ Аллен Дж. П., Уильямс Дж. К. (октябрь 1998 г.). «Фотосинтетические реакционные центры». Письма ФЭБС . 438 (1–2): 5–9. Бибкод : 1998FEBSL.438....5A . дои : 10.1016/S0014-5793(98)01245-9 . ПМИД 9821949 . S2CID 21596537 .
- ^ Мунекаге И., Хашимото М., Мияке С., Томизава К., Эндо Т., Тасака М., Шиканай Т. (июнь 2004 г.). «Циклический поток электронов вокруг фотосистемы I необходим для фотосинтеза». Природа . 429 (6991): 579–82. Бибкод : 2004Natur.429..579M . дои : 10.1038/nature02598 . ПМИД 15175756 . S2CID 4421776 .
- ^ Jump up to: а б Мандал А (26 ноября 2009 г.). «Что такое анаболизм?» . Новости-Medical.net . Архивировано из оригинала 5 июля 2020 года . Проверено 4 июля 2020 г.
- ^ Мизиорко Х.М., Лоример Г.Х. (1983). «Рибулозо-1,5-бисфосфаткарбоксилаза-оксигеназа». Ежегодный обзор биохимии . 52 : 507–35. дои : 10.1146/annurev.bi.52.070183.002451 . ПМИД 6351728 .
- ^ Додд А.Н., Борланд А.М., Хаслам Р.П., Гриффитс Х., Максвелл К. (апрель 2002 г.). «Обмен толстянковых кислот: пластичный, фантастический» . Журнал экспериментальной ботаники . 53 (369): 569–80. дои : 10.1093/jexbot/53.369.569 . ПМИД 11886877 .
- ^ Хюглер М., Вирсен К.О., Фукс Г., Тейлор К.Д., Зиверт С.М. (май 2005 г.). «Доказательства автотрофной фиксации CO2 посредством восстановительного цикла трикарбоновых кислот членами эпсилон-подразделения протеобактерий» . Журнал бактериологии . 187 (9): 3020–7. дои : 10.1128/JB.187.9.3020-3027.2005 . ПМК 1082812 . ПМИД 15838028 .
- ^ Штраус Г., Фукс Г. (август 1993 г.). «Ферменты нового пути автотрофной фиксации CO2 у фототрофной бактерии Chloroflexus aurantiacus, 3-гидроксипропионатного цикла» . Европейский журнал биохимии . 215 (3): 633–43. дои : 10.1111/j.1432-1033.1993.tb18074.x . ПМИД 8354269 .
- ^ Вуд Х.Г. (февраль 1991 г.). «Жизнь с CO или CO2 и H2 как источник углерода и энергии» . Журнал ФАСЭБ . 5 (2): 156–63. дои : 10.1096/fasebj.5.2.1900793 . ПМИД 1900793 . S2CID 45967404 .
- ^ Шивели Дж. М., ван Кеулен Г., Мейер В. Г. (1998). «Что-то из почти ничего: фиксация углекислого газа у хемоавтотрофов». Ежегодный обзор микробиологии . 52 : 191–230. дои : 10.1146/annurev.micro.52.1.191 . ПМИД 9891798 .
- ^ Бойте А., Хесс Б. (июнь 1981 г.). «Дизайн гликолиза» . Философские труды Лондонского королевского общества. Серия Б, Биологические науки . 293 (1063): 5–22. Бибкод : 1981РСТБ.293....5Б . дои : 10.1098/rstb.1981.0056 . ПМИД 6115423 .
- ^ Пилкис С.Дж., Эль-Маграби М.Р., Клаус Т.Х. (июнь 1990 г.). «Фруктозо-2,6-бисфосфат в контроле глюконеогенеза в печени. От метаболитов к молекулярной генетике». Уход при диабете . 13 (6): 582–99. дои : 10.2337/diacare.13.6.582 . ПМИД 2162755 . S2CID 44741368 .
- ^ Jump up to: а б Прапорщик SA (июль 2006 г.). «Возврат к глиоксилатному циклу: альтернативные пути микробной ассимиляции ацетата» . Молекулярная микробиология . 61 (2): 274–6. дои : 10.1111/j.1365-2958.2006.05247.x . ПМИД 16856935 . S2CID 39986630 .
- ^ Финн П.Ф., Дайс Дж.Ф. (2006). «Протеолитические и липолитические реакции на голодание». Питание . 22 (7–8): 830–44. дои : 10.1016/j.nut.2006.04.008 . ПМИД 16815497 .
- ^ Jump up to: а б Корнберг Х.Л., Кребс Х.А. (май 1957 г.). «Синтез компонентов клетки из C2-единиц с помощью модифицированного цикла трикарбоновых кислот». Природа . 179 (4568): 988–91. Бибкод : 1957Natur.179..988K . дои : 10.1038/179988a0 . ПМИД 13430766 . S2CID 40858130 .
- ^ Эванс Р.Д., Хизер Л.К. (июнь 2016 г.). «Метаболические пути и нарушения» . Хирургия (Оксфорд) . 34 (6): 266–272. дои : 10.1016/j.mpsur.2016.03.010 . ISSN 0263-9319 . S2CID 87884121 . Архивировано из оригинала 31 октября 2020 года . Проверено 28 августа 2020 г.
- ^ Фриз Х.Х., Харт Г.В., Шнаар Р.Л. (2015). «Предшественники гликозилирования». В Варки А., Каммингс Р.Д., Эско Дж.Д., Стэнли П. (ред.). Основы гликобиологии (3-е изд.). Колд-Спринг-Харбор (Нью-Йорк): Лабораторное издательство Колд-Спринг-Харбор. doi : 10.1101/glycobiology.3e.005 (неактивен 31 января 2024 г.). ПМИД 28876856 . Архивировано из оригинала 24 февраля 2022 года . Проверено 8 июля 2020 г.
{{cite book}}: CS1 maint: DOI неактивен по состоянию на январь 2024 г. ( ссылка ) - ^ Опденаккер Г., Радд П.М., Понтинг К.П., Двек Р.А. (ноябрь 1993 г.). «Концепции и принципы гликобиологии» . Журнал ФАСЭБ . 7 (14): 1330–7. дои : 10.1096/fasebj.7.14.8224606 . ПМИД 8224606 . S2CID 10388991 .
- ^ МакКонвилл М.Дж., Менон А.К. (2000). «Новейшие достижения в клеточной биологии и биохимии гликозилфосфатидилинозитоллипидов (обзор)» . Молекулярная мембранная биология . 17 (1): 1–16. дои : 10.1080/096876800294443 . ПМИД 10824734 .
- ^ Чирала С.С., Вакил С.Дж. (ноябрь 2004 г.). «Структура и функция синтазы жирных кислот животных». Липиды . 39 (11): 1045–53. дои : 10.1007/s11745-004-1329-9 . ПМИД 15726818 . S2CID 4043407 .
- ^ Уайт С.В., Чжэн Дж., Чжан Ю.М. (2005). «Структурная биология биосинтеза жирных кислот II типа». Ежегодный обзор биохимии . 74 : 791–831. doi : 10.1146/annurev.biochem.74.082803.133524 . ПМИД 15952903 .
- ^ Олрогге Дж.Б., Яворски Дж.Г. (июнь 1997 г.). «Регуляция синтеза жирных кислот». Ежегодный обзор физиологии растений и молекулярной биологии растений . 48 : 109–136. дои : 10.1146/annurev.arplant.48.1.109 . ПМИД 15012259 . S2CID 46348092 .
- ^ Дубей В.С., Бхалла Р., Лутра Р. (сентябрь 2003 г.). «Обзор немевалонатного пути биосинтеза терпеноидов в растениях» (PDF) . Журнал биологических наук . 28 (5): 637–46. дои : 10.1007/BF02703339 . ПМИД 14517367 . S2CID 27523830 . Архивировано из оригинала (PDF) 15 апреля 2007 года.
- ^ Jump up to: а б Кузуяма Т., Сето Х (апрель 2003 г.). «Разнообразие биосинтеза изопреновых единиц». Отчеты о натуральных продуктах . 20 (2): 171–83. дои : 10.1039/b109860h . ПМИД 12735695 .
- ^ Гроховски Л.Л., Сюй Х., Уайт Р.Х. (май 2006 г.). «Methanocaldococcus jannaschii использует модифицированный мевалонатный путь для биосинтеза изопентенилдифосфата» . Журнал бактериологии . 188 (9): 3192–8. дои : 10.1128/JB.188.9.3192-3198.2006 . ПМЦ 1447442 . ПМИД 16621811 .
- ^ Лихтенталер Гонконг (июнь 1999 г.). «1-дезокси-D-ксилулозо-5-фосфатный путь биосинтеза изопреноидов в растениях». Ежегодный обзор физиологии растений и молекулярной биологии растений . 50 : 47–65. doi : 10.1146/annurev.arplant.50.1.47 . ПМИД 15012203 .
- ^ Jump up to: а б Шрёпфер Г.Дж. (1981). «Биосинтез стерола». Ежегодный обзор биохимии . 50 : 585–621. дои : 10.1146/annurev.bi.50.070181.003101 . ПМИД 7023367 .
- ^ Лиз Н.Д., Скэггс Б., Кирш Д.Р., Бард М. (март 1995 г.). «Клонирование поздних генов пути биосинтеза эргостерина Saccharomyces cerevisiae - обзор». Липиды . 30 (3): 221–6. дои : 10.1007/BF02537824 . ПМИД 7791529 . S2CID 4019443 .
- ^ Химмельрайх Р., Гильберт Х., Плагенс Х., Пиркл Э., Ли Б.К., Херрманн Р. (ноябрь 1996 г.). «Полный анализ последовательности генома бактерии Mycoplasma pneumoniae» . Исследования нуклеиновых кислот . 24 (22): 4420–49. дои : 10.1093/нар/24.22.4420 . ПМК 146264 . ПМИД 8948633 .
- ^ Гайтон AC, Холл JE (2006). Учебник медицинской физиологии . Филадельфия: Эльзевир. стр. 855 –6. ISBN 978-0-7216-0240-0 .
- ^ Ибба М., Сёлль Д. (май 2001 г.). «Ренессанс синтеза аминоацил-тРНК» . Отчеты ЭМБО . 2 (5): 382–7. doi : 10.1093/embo-reports/kve095 . ПМЦ 1083889 . ПМИД 11375928 . Архивировано из оригинала 1 мая 2011 года.
- ^ Лендьел П., Сёлль Д. (июнь 1969 г.). «Механизм биосинтеза белка» . Бактериологические обзоры . 33 (2): 264–301. дои : 10.1128/ММБР.33.2.264-301.1969 . ПМК 378322 . ПМИД 4896351 .
- ^ Jump up to: а б Рудольф Ф.Б. (январь 1994 г.). «Биохимия и физиология нуклеотидов» . Журнал питания . 124 (1 доп.): 124S–127S. дои : 10.1093/jn/124.suppl_1.124S . ПМИД 8283301 . Зреннер Р., Ститт М., Зонневальд У., Болдт Р. (2006). «Биосинтез и деградация пиримидинов и пуринов в растениях». Ежегодный обзор биологии растений . 57 : 805–36. doi : 10.1146/annurev.arplant.57.032905.105421 . ПМИД 16669783 .
- ^ Стасолла С., Катахира Р., Торп Т.А., Ашихара Х. (ноябрь 2003 г.). «Обмен пуриновых и пиримидиновых нуклеотидов у высших растений». Журнал физиологии растений . 160 (11): 1271–95. Бибкод : 2003JPPhy.160.1271S . дои : 10.1078/0176-1617-01169 . ПМИД 14658380 .
- ^ Дэвис О., Мендес П., Смоллбоун К., Малис Н. (апрель 2012 г.). «Характеристика множественных субстрат-специфичных (d)ITP/(d)XTPase и моделирование метаболизма дезаминированных пуриновых нуклеотидов» (PDF) . Отчеты БМБ . 45 (4): 259–64. дои : 10.5483/BMBRep.2012.45.4.259 . ПМИД 22531138 . Архивировано (PDF) из оригинала 24 октября 2020 г. Проверено 18 сентября 2019 г.
- ^ Смит Дж.Л. (декабрь 1995 г.). «Ферменты синтеза нуклеотидов». Современное мнение в области структурной биологии . 5 (6): 752–7. дои : 10.1016/0959-440X(95)80007-7 . ПМИД 8749362 .
- ^ Теста Б, Кремер С.Д. (октябрь 2006 г.). «Биохимия метаболизма лекарств. Введение: часть 1. Принципы и обзор». Химия и биоразнообразие . 3 (10): 1053–101. дои : 10.1002/cbdv.200690111 . ПМИД 17193224 . S2CID 28872968 .
- ^ Дэниелсон П.Б. (декабрь 2002 г.). «Суперсемейство цитохрома P450: биохимия, эволюция и метаболизм лекарств у человека». Современный метаболизм лекарств . 3 (6): 561–97. дои : 10.2174/1389200023337054 . ПМИД 12369887 .
- ^ Кинг К.Д., Риос Г.Р., Грин М.Д., Тефли Т.Р. (сентябрь 2000 г.). «УДФ-глюкуронозилтрансферазы». Современный метаболизм лекарств . 1 (2): 143–61. дои : 10.2174/1389200003339171 . ПМИД 11465080 .
- ^ Шихан Д., Мид Дж., Фоли В.М., Дауд Калифорния (ноябрь 2001 г.). «Структура, функции и эволюция глутатионтрансфераз: значение для классификации представителей древнего суперсемейства ферментов, не относящихся к млекопитающим» . Биохимический журнал . 360 (Часть 1): 1–16. дои : 10.1042/0264-6021:3600001 . ПМК 1222196 . ПМИД 11695986 .
- ^ Гальван Т.К., Мон В.В., де Лоренцо V (октябрь 2005 г.). «Изучение генофонда микробной биодеградации и биотрансформации». Тенденции в биотехнологии . 23 (10): 497–506. дои : 10.1016/j.tibtech.2005.08.002 . ПМИД 16125262 .
- ^ Янссен Д.Б., Динкла И.Ю., Поеларендс Г.Дж., Терпстра П. (декабрь 2005 г.). «Бактериальная деградация ксенобиотических соединений: эволюция и распространение новых ферментных активностей» (PDF) . Экологическая микробиология . 7 (12): 1868–82. Бибкод : 2005EnvMi...7.1868J . дои : 10.1111/j.1462-2920.2005.00966.x . ПМИД 16309386 . Архивировано (PDF) из оригинала 11 ноября 2019 года . Проверено 11 ноября 2019 г.
- ^ Дэвис К.Дж. (1995). «Окислительный стресс: парадокс аэробной жизни». Симпозиум Биохимического общества . 61 : 1–31. дои : 10.1042/bss0610001 . ПМИД 8660387 .
- ^ Ту Б.П., Вайсман Дж.С. (февраль 2004 г.). «Окислительное сворачивание белков у эукариот: механизмы и последствия» . Журнал клеточной биологии . 164 (3): 341–6. дои : 10.1083/jcb.200311055 . ПМЦ 2172237 . ПМИД 14757749 .
- ^ Сис Х (март 1997 г.). «Окислительный стресс: оксиданты и антиоксиданты» . Экспериментальная физиология . 82 (2): 291–5. doi : 10.1113/expphysicalol.1997.sp004024 . ПМИД 9129943 . S2CID 20240552 .
- ^ Вертуани С., Ангусти А., Манфредини С. (2004). «Сеть антиоксидантов и проантиоксидантов: обзор». Текущий фармацевтический дизайн . 10 (14): 1677–94. дои : 10.2174/1381612043384655 . ПМИД 15134565 . S2CID 43713549 .
- ^ фон Стокар У, Лю Дж (август 1999 г.). «Всегда ли микробная жизнь питается отрицательной энтропией? Термодинамический анализ роста микробов» . Biochimica et Biophysica Acta (BBA) — Биоэнергетика . 1412 (3): 191–211. дои : 10.1016/S0005-2728(99)00065-1 . ПМИД 10482783 .
- ^ Демирель Ю., Сэндлер С.И. (июнь 2002 г.). «Термодинамика и биоэнергетика» . Биофизическая химия . 97 (2–3): 87–111. дои : 10.1016/S0301-4622(02)00069-8 . ПМИД 12050002 . S2CID 3754065 . Архивировано из оригинала 4 августа 2020 года . Проверено 22 сентября 2019 г.
- ^ Альберт Р. (ноябрь 2005 г.). «Безмасштабные сети в клеточной биологии». Журнал клеточной науки . 118 (Часть 21): 4947–57. arXiv : q-bio/0510054 . Бибкод : 2005q.bio....10054A . дои : 10.1242/jcs.02714 . ПМИД 16254242 . S2CID 3001195 .
- ^ Бренд MD (январь 1997 г.). «Анализ регуляции энергетического обмена» . Журнал экспериментальной биологии . 200 (Часть 2): 193–202. дои : 10.1242/jeb.200.2.193 . ПМИД 9050227 . Архивировано из оригинала 29 марта 2007 года . Проверено 12 марта 2007 г.
- ^ Сойер О.С., Салате М., Бонхеффер С. (январь 2006 г.). «Сети передачи сигналов: топология, реакция и биохимические процессы». Журнал теоретической биологии . 238 (2): 416–25. Бибкод : 2006JThBi.238..416S . дои : 10.1016/j.jtbi.2005.05.030 . ПМИД 16045939 .
- ^ Jump up to: а б Солтер М., Ноулз Р.Г., Погсон К.И. (1994). «Метаболический контроль». Очерки по биохимии . 28 : 1–12. ПМИД 7925313 .
- ^ Вестерхофф Х.В., Гроен А.К., Вандерс Р.Дж. (январь 1984 г.). «Современные теории метаболического контроля и их приложения (обзор)». Отчеты по биологическим наукам . 4 (1): 1–22. дои : 10.1007/BF01120819 . ПМИД 6365197 . S2CID 27791605 .
- ^ Фелл Д.А., Томас С. (октябрь 1995 г.). «Физиологический контроль метаболического потока: необходимость многосайтовой модуляции» . Биохимический журнал . 311 (Часть 1): 35–9. дои : 10.1042/bj3110035 . ПМК 1136115 . ПМИД 7575476 .
- ^ Хендриксон, В.А. (ноябрь 2005 г.). «Передача биохимических сигналов через клеточные мембраны». Ежеквартальные обзоры биофизики . 38 (4): 321–30. дои : 10.1017/S0033583506004136 . ПМИД 16600054 . S2CID 39154236 .
- ^ Коэн П. (декабрь 2000 г.). «Регуляция функции белка путем многосайтового фосфорилирования - обновление за 25 лет». Тенденции биохимических наук . 25 (12): 596–601. дои : 10.1016/S0968-0004(00)01712-6 . ПМИД 11116185 .
- ^ Линхард Г.Е., Слот Дж.В., Джеймс Д.Е., Мюклер М.М. (январь 1992 г.). «Как клетки поглощают глюкозу». Научный американец . 266 (1): 86–91. Бибкод : 1992SciAm.266a..86L . doi : 10.1038/scientificamerican0192-86 . ПМИД 1734513 .
- ^ Роуч Пи Джей (март 2002 г.). «Гликоген и его метаболизм». Современная молекулярная медицина . 2 (2): 101–20. дои : 10.2174/1566524024605761 . ПМИД 11949930 .
- ^ Ньюгард CB, Брэди М.Дж., О'Доэрти Р.М., Салтиел А.Р. (декабрь 2000 г.). «Организация утилизации глюкозы: новая роль субъединиц протеинфосфатазы-1, нацеленных на гликоген» (PDF) . Диабет . 49 (12): 1967–77. дои : 10.2337/диабет.49.12.1967 . ПМИД 11117996 . Архивировано (PDF) из оригинала 19 июня 2007 года . Проверено 25 марта 2007 г.
- ^ Романо А.Х., Конвей Т. (1996). «Эволюция путей метаболизма углеводов» . Исследования в области микробиологии . 147 (6–7): 448–55. дои : 10.1016/0923-2508(96)83998-2 . ПМИД 9084754 .
- ^ Кох А (1998). Как появились бактерии? . Достижения микробной физиологии. Том. 40. С. 353–99. дои : 10.1016/S0065-2911(08)60135-6 . ISBN 978-0-12-027740-7 . ПМИД 9889982 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Узунис С., Кирпидес Н. (июль 1996 г.). «Появление основных клеточных процессов в эволюции» . Письма ФЭБС . 390 (2): 119–23. Бибкод : 1996FEBSL.390..119O . дои : 10.1016/0014-5793(96)00631-X . ПМИД 8706840 . S2CID 39128865 .
- ^ Каэтано-Аноллес Дж., Ким Х.С., Миттенталь Дж.Е. (май 2007 г.). «Происхождение современных метаболических сетей, выведенное на основе филогеномного анализа белковой архитектуры» . Труды Национальной академии наук Соединенных Штатов Америки . 104 (22): 9358–63. Бибкод : 2007PNAS..104.9358C . дои : 10.1073/pnas.0701214104 . ПМК 1890499 . ПМИД 17517598 .
- ^ Шмидт С., Сюняев С., Борк П., Дандекар Т. (июнь 2003 г.). «Метаболиты: рука помощи в эволюции пути?». Тенденции биохимических наук . 28 (6): 336–41. дои : 10.1016/S0968-0004(03)00114-2 . ПМИД 12826406 .
- ^ Лайт С., Краулис П. (февраль 2004 г.). «Сетевой анализ эволюции метаболических ферментов Escherichia coli» . БМК Биоинформатика . 5:15 . дои : 10.1186/1471-2105-5-15 . ПМК 394313 . ПМИД 15113413 . Алвес Р., Шалей Р.А., Штернберг М.Ю. (июль 2002 г.). «Эволюция ферментов метаболизма: сетевая перспектива». Журнал молекулярной биологии . 320 (4): 751–70. дои : 10.1016/S0022-2836(02)00546-6 . ПМИД 12095253 .
- ^ Ким Х.С., Миттенталь Дж.Э., Каэтано-Аноллес Дж. (июль 2006 г.). «MANET: отслеживание эволюции белковой архитектуры в метаболических сетях» . БМК Биоинформатика . 7 : 351. дои : 10.1186/1471-2105-7-351 . ПМЦ 1559654 . ПМИД 16854231 .
- ^ Тейхманн С.А., Райсон С.С., Торнтон Дж.М., Райли М., Гоф Дж., Чотия С. (декабрь 2001 г.). «Низкомолекулярный метаболизм: ферментативная мозаика». Тенденции в биотехнологии . 19 (12): 482–6. дои : 10.1016/S0167-7799(01)01813-3 . ПМИД 11711174 .
- ^ Спирин В., Гельфанд М.С., Миронов А.А., Мирный Л.А. (июнь 2006 г.). «Метаболическая сеть в эволюционном контексте: многоуровневая структура и модульность» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (23): 8774–9. Бибкод : 2006PNAS..103.8774S . дои : 10.1073/pnas.0510258103 . ПМЦ 1482654 . ПМИД 16731630 .
- ^ Лоуренс Дж.Г. (декабрь 2005 г.). «Общие темы в геномных стратегиях патогенов». Текущее мнение в области генетики и развития . 15 (6): 584–8. дои : 10.1016/j.где.2005.09.007 . ПМИД 16188434 . Вернегрин Джей-Джей (декабрь 2005 г.). «К лучшему или к худшему: геномные последствия внутриклеточного мутуализма и паразитизма». Текущее мнение в области генетики и развития . 15 (6): 572–83. дои : 10.1016/j.где.2005.09.013 . ПМИД 16230003 .
- ^ Пал С., Папп Б., Лерчер М.Дж., Чермели П., Оливер С.Г., Херст Л.Д. (март 2006 г.). «Шанс и необходимость в эволюции минимальных метаболических сетей». Природа . 440 (7084): 667–70. Бибкод : 2006Natur.440..667P . дои : 10.1038/nature04568 . ПМИД 16572170 . S2CID 4424895 .
- ^ Ренни MJ (ноябрь 1999 г.). «Введение в использование индикаторов в питании и обмене веществ» . Труды Общества питания . 58 (4): 935–44. дои : 10.1017/S002966519900124X . ПМИД 10817161 .
- ^ Файр Р.Д. (декабрь 1997 г.). «Разработка кинетических моделей в нелинейном мире молекулярно-клеточной биологии» . Метаболизм . 46 (12): 1489–95. дои : 10.1016/S0026-0495(97)90154-2 . ПМИД 9439549 .
- ^ Стерк Л., Ромбаутс С., Вандеполе К., Рузе П., Ван де Пер Ю. (апрель 2007 г.). «Сколько генов у растений (... и почему они там)?». Современное мнение в области биологии растений . 10 (2): 199–203. дои : 10.1016/j.pbi.2007.01.004 . ПМИД 17289424 .
- ^ Бородина И., Нильсен Дж. (июнь 2005 г.). «От геномов к клеткам in silico через метаболические сети». Современное мнение в области биотехнологии . 16 (3): 350–5. doi : 10.1016/j.copbio.2005.04.008 . ПМИД 15961036 .
- ^ Джанчандани Э.П., Бротиган Д.Л., Папин Дж.А. (май 2006 г.). «Системный анализ характеризует интегрированные функции биохимических сетей». Тенденции биохимических наук . 31 (5): 284–91. дои : 10.1016/j.tibs.2006.03.007 . ПМИД 16616498 .
- ^ Дуарте Н.К., Беккер С.А., Джамшиди Н., Тиле И., Мо М.Л., Во Т.Д. и др. (февраль 2007 г.). «Глобальная реконструкция метаболической сети человека на основе геномных и библиомных данных» . Труды Национальной академии наук Соединенных Штатов Америки . 104 (6): 1777–82. Бибкод : 2007PNAS..104.1777D . дои : 10.1073/pnas.0610772104 . ПМК 1794290 . ПМИД 17267599 .
- ^ Го К.И., Кьюсик М.Е., Валле Д., Чайлдс Б., Видал М., Барабаси А.Л. (май 2007 г.). «Сеть болезней человека» . Труды Национальной академии наук Соединенных Штатов Америки . 104 (21): 8685–90. Бибкод : 2007PNAS..104.8685G . дои : 10.1073/pnas.0701361104 . ПМЦ 1885563 . ПМИД 17502601 .
- ^ Ли Д.С., Пак Дж., Кей К.А., Кристакис Н.А., Олваи З.Н., Барабаси А.Л. (июль 2008 г.). «Влияние топологии метаболической сети человека на сопутствующие заболевания» . Труды Национальной академии наук Соединенных Штатов Америки . 105 (29): 9880–5. Бибкод : 2008PNAS..105.9880L . дои : 10.1073/pnas.0802208105 . ПМЦ 2481357 . ПМИД 18599447 .
- ^ Чете М., Дойл Дж. (сентябрь 2004 г.). «Галстуки-бабочки, обмен веществ и болезни». Тенденции в биотехнологии . 22 (9): 446–50. дои : 10.1016/j.tibtech.2004.07.007 . ПМИД 15331224 .
- ^ Ма Х.В., Цзэн А.П. (июль 2003 г.). «Структура связности, гигантский сильный компонент и центральность метаболических сетей». Биоинформатика . 19 (11): 1423–30. CiteSeerX 10.1.1.605.8964 . doi : 10.1093/биоинформатика/btg177 . ПМИД 12874056 .
- ^ Чжао Дж., Ю Х., Луо Дж.Х., Цао З.В., Ли Ю.С. (август 2006 г.). «Иерархическая модульность вложенных галстуков-бабочек в метаболических сетях» . БМК Биоинформатика . 7 : 386. arXiv : q-bio/0605003 . Бибкод : 2006q.bio.....5003Z . дои : 10.1186/1471-2105-7-386 . ПМК 1560398 . ПМИД 16916470 .
- ^ «Макромолекулы: питательные вещества, метаболизм и пищеварительные процессы | Виртуальная средняя школа — KeepNotes» . Keepnotes.com . Архивировано из оригинала 29 декабря 2023 года . Проверено 29 декабря 2023 г.
- ^ Тикаер Дж., Нильсен Дж. (январь 2003 г.). «Метаболическая инженерия производства бета-лактамов». Метаболическая инженерия . 5 (1): 56–69. дои : 10.1016/S1096-7176(03)00003-X . ПМИД 12749845 .
- ^ Гонсалес-Пахуэло М., Мейньяль-Сальес И., Мендес Ф., Андраде Х.К., Васконселос И., Сукай П. (2005). «Метаболическая инженерия Clostridium acetobutylicum для промышленного производства 1,3-пропандиола из глицерина». Метаболическая инженерия . 7 (5–6): 329–36. дои : 10.1016/j.ymben.2005.06.001 . hdl : 10400.14/3388 . ПМИД 16095939 .
- ^ Кремер М., Бонгертс Дж., Бовенберг Р., Кремер С., Мюллер У., Орф С. и др. (октябрь 2003 г.). «Метаболическая инженерия микробного производства шикимовой кислоты». Метаболическая инженерия . 5 (4): 277–83. дои : 10.1016/j.ymben.2003.09.001 . ПМИД 14642355 .
- ^ Коффас М., Роберж С., Ли К., Стефанопулос Г. (1999). «Метаболическая инженерия». Ежегодный обзор биомедицинской инженерии . 1 : 535–57. doi : 10.1146/annurev.bioeng.1.1.535 . ПМИД 11701499 . S2CID 11814282 .
- ^ «Обмен веществ | Происхождение и значение метаболизма в онлайн-этимологическом словаре» . www.etymonline.com . Архивировано из оригинала 21 сентября 2017 года . Проверено 23 июля 2020 г.
- ^ Леруа, Арман Мари (2014). Лагуна: как Аристотель изобрел науку . Блумсбери. стр. 400–401. ISBN 978-1-4088-3622-4 .
- ^ Аль-Руби А.С. (1982). Ибн ан-Нафис как философ . Симпозиум по Ибн ан-Нафису, Вторая Международная конференция по исламской медицине. Кувейт: Исламская медицинская организация.
- ^ Экноян Г (1999). «Санторио Санкториус (1561-1636) - отец-основатель исследований метаболического баланса». Американский журнал нефрологии . 19 (2): 226–33. дои : 10.1159/000013455 . ПМИД 10213823 . S2CID 32900603 .
- ^ Уильямс Х.А. (1904). Современное развитие химических и биологических наук . История науки: в пяти томах. Том. IV. Нью-Йорк: Харпер и братья. стр. 184–185 . Проверено 26 марта 2007 г.
- ^ Манчестер КЛ (декабрь 1995 г.). «Луи Пастер (1822-1895) - случай и подготовленный ум». Тенденции в биотехнологии . 13 (12): 511–5. дои : 10.1016/S0167-7799(00)89014-9 . ПМИД 8595136 .
- ^ Кинне-Сафран Э., Кинне Р.К. (1999). «Витализм и синтез мочевины. От Фридриха Велера до Ганса А. Кребса». Американский журнал нефрологии . 19 (2): 290–4. дои : 10.1159/000013463 . ПМИД 10213830 . S2CID 71727190 .
- ↑ Эдуарда Бюхнера 1907 года. Нобелевская лекция Архивировано 8 июля 2017 года на Wayback Machine на http://nobelprize.org. Архивировано 5 апреля 2006 года на Wayback Machine. Доступ 20 марта 2007 года.
- ^ Корнберг Х (декабрь 2000 г.). «Кребс и его троица циклов». Обзоры природы. Молекулярно-клеточная биология . 1 (3): 225–8. дои : 10.1038/35043073 . ПМИД 11252898 . S2CID 28092593 .
- ^ Кребс Х.А., Хензелайт К. (1932). «Исследования образования мочевины в организме животных». З. Физиол. Хим . 210 (1–2): 33–66. дои : 10.1515/bchm2.1932.210.1-2.33 .
- ^ Кребс Х.А., Джонсон В.А. (апрель 1937 г.). «Метаболизм кетоновых кислот в тканях животных» . Биохимический журнал . 31 (4): 645–60. дои : 10.1042/bj0310645 . ПМК 1266984 . ПМИД 16746382 .
Дальнейшее чтение
[ редактировать ]Вводный
- Роуз С., Милеушник Р. (1999). Химия жизни . Пингвин Пресс Сайенс. ISBN 0-14-027273-9 .
- Шнайдер ЕС, Саган Д. (2005). В прохладу: поток энергии, термодинамика и жизнь . Издательство Чикагского университета. ISBN 0-226-73936-8 .
- Лейн Н (2004). Кислород: молекула, создавшая мир . США: Издательство Оксфордского университета. ISBN 0-19-860783-0 .
Передовой
- Прайс Н., Стивенс Л. (1999). Основы энзимологии: клеточная и молекулярная биология каталитических белков . Издательство Оксфордского университета. ISBN 0-19-850229-Х .
- Берг Дж., Тимочко Дж., Страйер Л. (2002). Биохимия . WH Фриман и компания. ISBN 0-7167-4955-6 .
- Кокс М., Нельсон Д.Л. (2004). Ленингерские принципы биохимии . Пэлгрейв Макмиллан. ISBN 0-7167-4339-6 .
- Брок Т.Д. , Мэдиган М.Р., Мартинко Дж., Паркер Дж. (2002). Биология микроорганизмов Брока . Бенджамин Каммингс. ISBN 0-13-066271-2 .
- Да Силва Джей-Джей, Уильямс Р.Дж. (1991). Биологическая химия элементов: неорганическая химия жизни . Кларендон Пресс. ISBN 0-19-855598-9 .
- Николлс Д.Г., Фергюсон С.Дж. (2002). Биоэнергетика . Academic Press Inc. ISBN 0-12-518121-3 .
- Вуд Х.Г. (февраль 1991 г.). «Жизнь с CO или CO2 и H2 как источник углерода и энергии» . Журнал ФАСЭБ . 5 (2): 156–63. дои : 10.1096/fasebj.5.2.1900793 . ПМИД 1900793 . S2CID 45967404 .
Внешние ссылки
[ редактировать ]Общая информация
- Биохимия метаболизма (архивировано 8 марта 2005 г.)
- Sparknotes SAT biochemistry Обзор биохимии. Школьный уровень.
- Гиперучебник по биологии Массачусетского технологического института. Архивировано 19 мая 2016 года в Португальском веб-архиве. Руководство по молекулярной биологии для студентов.
Метаболизм человека
- Темы медицинской биохимии. Руководство по метаболическим путям человека. Школьный уровень.
- Страница медицинской биохимии. Комплексный ресурс по метаболизму человека.
Базы данных
- Блок-схема метаболических путей в ExPASy
- Таблица метаболических путей IUBMB-Николсона
- SuperCYP: База данных по метаболизму цитохромов лекарств. Архивировано 3 ноября 2011 г. в Wayback Machine.
Метаболические пути
- Справочник по метаболизму Pathway. Архивировано 23 февраля 2009 г. в Wayback Machine.
- Азотный цикл и фиксация азота на Wayback Machine (индекс архива)
- ^ Биби, Джейн А.; Фрей, Перри А. (1 октября 1998 г.). «Галактозомутаротаза: очистка, характеристика и исследование двух важных остатков гистидина» . Биохимия . 37 (42): 14989–14997. дои : 10.1021/bi9816047 . ISSN 0006-2960 .
