Холестерин
 | |
 | |
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Холест-5-ен-3β-ол | |
| Систематическое название ИЮПАК (1R , 3aS , 3bS , 7S , 9aR , 9bS , 11aR ) -9a,11a-Диметил-1-[(2R ) -6-метилгептан-2-ил]-2,3, 3a,3b,4,6,7,8,9,9a,9b,10,11,11a-тетрадекагидро-1 H -циклопента[ a ]фенантрен-7-ол | |
| Другие имена Холестерин, Холестериловый спирт [1] | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.000.321 |
| КЕГГ | |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| С 27 Ч 46 О | |
| Молярная масса | 386.65 g/mol |
| Появление | белый кристаллический порошок [2] |
| Плотность | 1,052 г/см 3 |
| Температура плавления | От 148 до 150 ° C (от 298 до 302 ° F; от 421 до 423 К) [2] |
| Точка кипения | 360 ° C (680 ° F, 633 К) (разлагается) |
| 0,095 мг/л (30 °С) [1] | |
| Растворимость | растворим в ацетоне , бензоле , хлороформе , этаноле , эфире , гексане , изопропилмиристате , метаноле. |
| -284.2·10 −6 см 3 /моль | |
| Опасности | |
| точка возгорания | 209,3 ± 12,4 °С |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
| Виды жиров в пище |
|---|
| Компоненты |
| Промышленные жиры |
Холестерин — основной стерол всех высших животных , распределяющийся в тканях тела , особенно в мозге головном и спинном , а также в животных жирах и маслах . [3] [4]
Холестерин биосинтезируется всеми клетками животных и является важным структурным компонентом мембран животных клеток . У позвоночных . печеночные клетки обычно производят наибольшее количество В мозге астроциты производят холестерин и транспортируют его к нейронам . [5] Он отсутствует среди прокариот ( бактерий и архей ), хотя есть некоторые исключения, например микоплазмы , которым для роста необходим холестерин. [6] Холестерин также служит предшественником биосинтеза стероидных гормонов , желчных кислот. [7] и витамин Д.
Повышенный уровень холестерина в крови, особенно когда он связан с липопротеинами низкой плотности (ЛПНП, часто называемый «плохим холестерином»), может увеличить риск сердечно-сосудистых заболеваний . [8]
Франсуа Пулетье де ла Саль впервые обнаружил холестерин в твердой форме в желчных камнях в 1769 году. В 1815 году химик Мишель Эжен Шеврёль назвал это соединение «холестерином». [9] [10]
Этимология
[ редактировать ]Слово «холестерол» происходит от древнегреческого слова « холе » — « желчь » и «стерео» — «твердый», за которым следует химический суффикс —ол , обозначающий алкоголь .
Физиология
[ редактировать ]Холестерин необходим для жизни всех животных. Хотя большинство клеток способны его синтезировать, большая часть холестерина поглощается или синтезируется гепатоцитами и транспортируется кровью к периферическим клеткам. Уровни холестерина в периферических тканях определяются балансом его поглощения и экспорта. [11] В нормальных условиях холестерин головного мозга отделен от периферического холестерина, т.е. пищевой и печеночный холестерин не проникают через гематоэнцефалический барьер. Скорее, астроциты производят и распределяют холестерин в мозге. [12]
Синтез de novo как в астроцитах, так и в гепатоцитах происходит в результате сложного 37-этапного процесса. Все начинается с пути мевалоната или ГМГ-КоА-редуктазы , мишени статиновых препаратов, который включает первые 18 этапов. За этим следуют 19 дополнительных шагов по превращению полученного ланостерина в холестерин. [13] Мужчина мужского пола весом 68 кг (150 фунтов) обычно синтезирует около 1 грамма (1000 мг) холестерина в день, а его тело содержит около 35 г, в основном содержащихся в клеточных мембранах.
Типичная суточная норма холестерина для мужчины в США составляет 307 мг. [14] Большая часть поступающего с пищей холестерина этерифицируется , что приводит к его плохому всасыванию в кишечнике. Организм также компенсирует поглощение поступившего холестерина за счет снижения собственного синтеза холестерина. [15] По этим причинам холестерин в пище через семь-десять часов после приема практически не влияет на концентрацию холестерина в крови. Удивительно, но у крыс уровень холестерина в крови обратно коррелирует с потреблением холестерина. Чем больше холестерина съедает крыса, тем ниже уровень холестерина в крови. [16] В течение первых семи часов после приема холестерина, когда поглощенные жиры распределяются по организму во внеклеточной воде с помощью различных липопротеинов (которые транспортируют все жиры, содержащиеся в воде, за пределы клеток), концентрации увеличиваются. [17]
Растения производят холестерин в очень небольших количествах. [18] В больших количествах они производят фитостерины , химически подобные вещества, которые могут конкурировать с холестерином за реабсорбцию в кишечном тракте, тем самым потенциально снижая реабсорбцию холестерина. [19] Когда клетки слизистой оболочки кишечника поглощают фитостерины вместо холестерина, они обычно выделяют молекулы фитостерола обратно в желудочно-кишечный тракт , что является важным защитным механизмом. Потребление природных фитостеролов, к которым относятся растительные стеролы и станолы , колеблется в пределах ≈200–300 мг/день в зависимости от привычек питания. [20] Были разработаны специально разработанные вегетарианские экспериментальные диеты с содержанием более 700 мг/день. [21]
Функция
[ редактировать ]Мембраны
[ редактировать ]Холестерин в разной степени присутствует во всех мембранах клеток животных , но отсутствует у прокариот. [22] Он необходим для построения и поддержания мембран и модулирует текучесть мембран в диапазоне физиологических температур. Гидроксильная полярные группа каждой молекулы холестерина взаимодействует с молекулами воды, окружающими мембрану, так же, как и головки мембранных фосфолипидов и сфинголипидов , в то время как объемистый стероид и углеводородная цепь встроены в мембрану вместе с неполярной жирнокислотной цепью холестерина . другие липиды. Взаимодействуя с цепями фосфолипидов и жирных кислот, холестерин увеличивает мембранную упаковку, что одновременно изменяет текучесть мембраны. [23] и поддерживает целостность мембран, поэтому животным клеткам не нужно строить клеточные стенки (как растениям и большинству бактерий). Мембрана остается стабильной и прочной, не будучи жесткой, что позволяет клеткам животных менять форму, а животным - двигаться.
Структура тетрациклического кольца холестерина способствует текучести клеточной мембраны, поскольку молекула находится в транс- конформации, что делает всю цепь холестерина, кроме боковой цепи, жесткой и плоской. [24] Выполняя эту структурную роль, холестерин также снижает проницаемость плазматической мембраны для нейтральных растворенных веществ. [25] ионы водорода и натрия . ионы [26]
Презентация подложки
[ редактировать ]Холестерин регулирует биологический процесс презентации субстрата и ферменты, использующие презентацию субстрата, в качестве механизма их активации. Фосфолипаза D2 ( PLD2 ) является четко определенным примером фермента, активируемого презентацией субстрата. [27] Фермент пальмитоилируется , что приводит к его перемещению к холестерин-зависимым липидным доменам, которые иногда называют « липидными плотами ». Субстратом фосфолипазы D является фосфатидилхолин (ФХ), который является ненасыщенным и содержится в небольшом количестве в липидных рафтах. ПК локализуется в неупорядоченной области клетки вместе с полиненасыщенным липидом фосфатидилинозитол-4,5-бисфосфатом (PIP2). PIP2 PLD2 имеет связывающий домен . Когда концентрация PIP2 в мембране увеличивается, PLD2 покидает холестерин-зависимые домены и связывается с PIP2, где затем получает доступ к своему субстрату PC и начинает катализ, основанный на представлении субстрата.

Сигнализация
[ редактировать ]Холестерин также участвует в процессах передачи сигналов в клетках, способствуя образованию липидных плотов в плазматической мембране , что приводит к сближению рецепторных белков с высокими концентрациями молекул вторичных мессенджеров. [28] В нескольких слоях холестерин и фосфолипиды, оба являются электрическими изоляторами, могут способствовать скорости передачи электрических импульсов по нервной ткани. Для многих нейронных волокон миелиновая оболочка, богатая холестерином, поскольку она образуется из уплотненных слоев шванновских клеток или мембран олигодендроцитов, обеспечивает изоляцию для более эффективного проведения импульсов. [29] Считается, что демиелинизация (потеря миелина) является частью основы рассеянного склероза .
Холестерин связывается и влияет на работу ряда ионных каналов, таких как никотиновый рецептор ацетилхолина , ГАМК А рецептор и калиевый канал внутреннего выпрямителя . [30] Холестерин также активирует эстроген-связанный рецептор альфа ERRα) и может быть эндогенным лигандом рецептора ( . [31] [32] Конститутивно активная природа рецептора может быть объяснена тем фактом, что холестерин присутствует в организме повсеместно. [32] Ингибирование передачи сигналов ERRα за счет снижения выработки холестерина было идентифицировано как ключевой медиатор эффектов статинов и бисфосфонатов на кости , мышцы и макрофаги . [31] [32] На основании этих результатов было предложено деорфанизировать ERRα и классифицировать его как рецептор холестерина. [31] [32]
В качестве химического предшественника
[ редактировать ]Внутри клеток холестерин также является молекулой-предшественником нескольких биохимических путей . Например, это молекула-предшественник синтеза витамина D в метаболизме кальция и всех стероидных гормонов , включая надпочечников гормоны кортизол и альдостерон , а также половые гормоны прогестерон , эстрогены и тестостерон и их производные. [7] [33]
Эпидермис
[ редактировать ]Роговой слой – это самый внешний слой эпидермиса. [34] [35] Он состоит из окончательно дифференцированных и энуклеированных корнеоцитов , которые располагаются внутри липидного матрикса, как «кирпичи и раствор». [34] [35] Вместе с церамидами и свободными жирными кислотами холестерин образует липидный раствор — водонепроницаемый барьер, который предотвращает потерю воды при испарении. Как правило, эпидермальный липидный матрикс состоит из эквимолярной смеси церамидов (≈50% по массе), холестерина (≈25% по массе) и свободных жирных кислот (≈15% по массе) с меньшими количествами. присутствуют и другие липиды. [34] [35] Сульфат холестерина достигает наибольшей концентрации в зернистом слое эпидермиса. Затем стероидсульфатаза снижает свою концентрацию в роговом слое, самом внешнем слое эпидермиса. [36] Относительное содержание сульфата холестерина в эпидермисе варьируется на разных участках тела, при этом на пятке стопы наблюдается самая низкая концентрация. [35]
Метаболизм
[ редактировать ]Холестерин перерабатывается в организме. Печень выделяет холестерин в желчные жидкости, которые затем сохраняются в желчном пузыре , который затем выводит их в неэтерифицированной форме (через желчь) в пищеварительный тракт. Обычно около 50% выведенного холестерина реабсорбируется тонкой кишкой обратно в кровоток.
Биосинтез и регуляция
[ редактировать ]Биосинтез
[ редактировать ]Почти все ткани животных синтезируют холестерин из ацетил-КоА . Все клетки животных (за исключением беспозвоночных) производят холестерин как для мембранных структур, так и для других целей, причем относительная скорость производства варьируется в зависимости от типа клеток и функции органа. Около 80% общего ежедневного производства холестерина происходит в печени и кишечнике ; [37] другие места с более высокой скоростью синтеза включают мозг , надпочечники и репродуктивные органы .
Синтез в организме начинается с мевалонатного пути , при котором две молекулы ацетил-КоА конденсируются с образованием ацетоацетил-КоА . За этим следует вторая конденсация между ацетил-КоА и ацетоацетил-КоА с образованием 3-гидрокси-3-метилглутарил-КоА ( HMG-CoA ). [38]

Затем эта молекула восстанавливается до мевалоната под действием фермента ГМГ-КоА-редуктазы . Производство мевалоната является лимитирующей и необратимой стадией синтеза холестерина и местом действия статинов (класс препаратов, снижающих уровень холестерина).
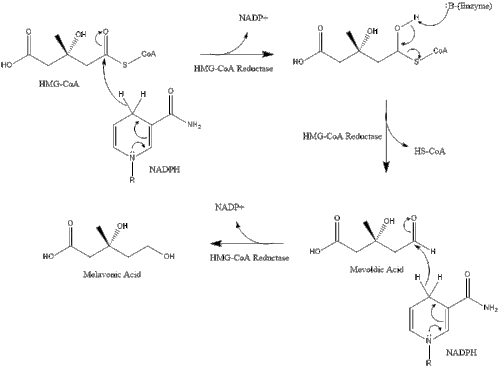
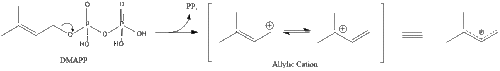
В конечном итоге мевалонат превращается в изопентенилпирофосфат (IPP) посредством двух стадий фосфорилирования и одной стадии декарбоксилирования, для которой требуется АТФ .
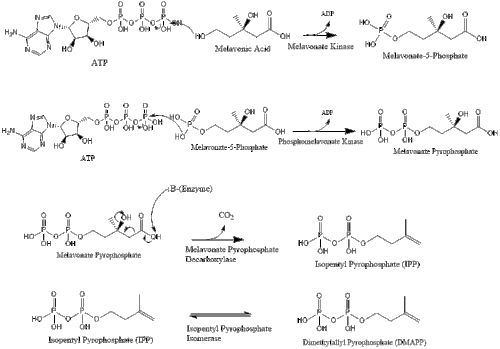
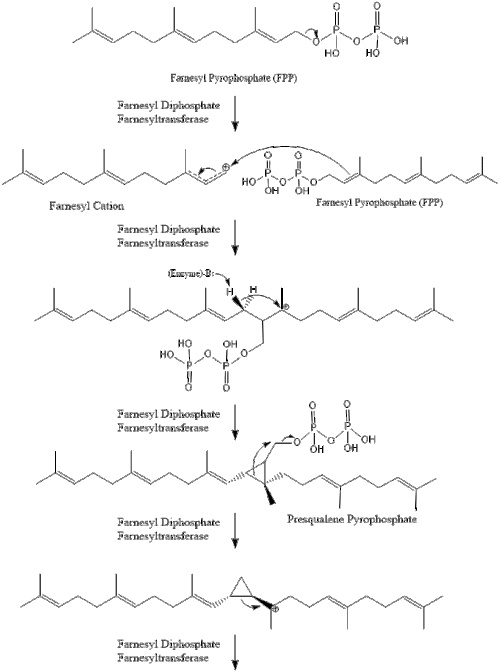
Три молекулы изопентенилпирофосфата конденсируются с образованием фарнезилпирофосфата под действием геранилтрансферазы.

Две молекулы фарнезилпирофосфата затем конденсируются с образованием сквалена под действием скваленсинтазы в эндоплазматическом ретикулуме . [38]
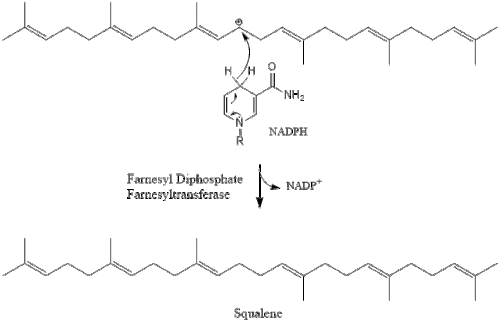
Затем оксидоскваленциклаза циклизирует сквален с образованием ланостерола .
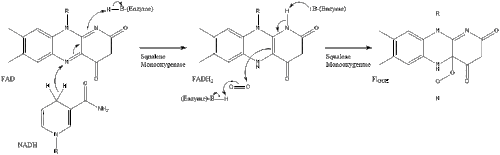
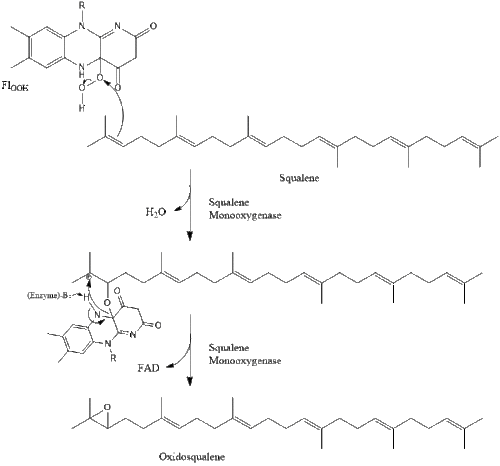
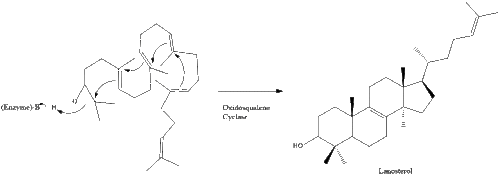
Наконец, ланостерин превращается в холестерин по одному из двух путей: пути Блоха или пути Кандуча-Рассела. [39] [40] [41] [42] [43] Последние 19 шагов к холестерину содержат НАДФН и кислород, которые помогают окислять метильные группы для удаления углерода, мутазы для перемещения алкеновых групп и НАДН , чтобы помочь восстановить кетоны .
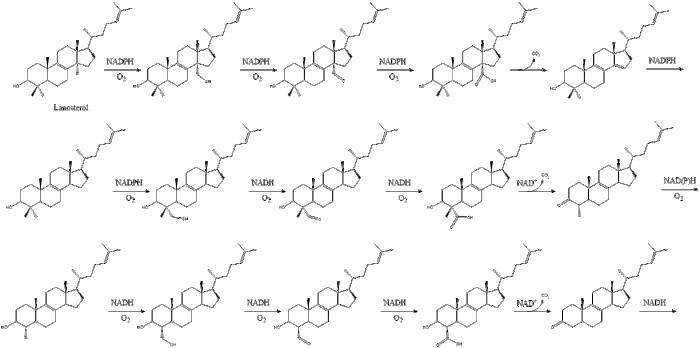

Конрад Блох и Феодор Линен получили Нобелевскую премию по физиологии и медицине в 1964 году за открытия, касающиеся некоторых механизмов и методов регуляции метаболизма холестерина и жирных кислот . [44]
Регуляция синтеза холестерина
[ редактировать ]Биосинтез холестерина напрямую регулируется присутствующим уровнем холестерина, хотя задействованные гомеостатические механизмы понятны лишь частично. Более высокое потребление пищи приводит к чистому снижению эндогенного производства, тогда как более низкое потребление пищи имеет противоположный эффект. Основным регуляторным механизмом является восприятие внутриклеточного холестерина в эндоплазматическом ретикулуме белком (белок , SREBP связывающий регуляторные элементы стеролов 1 и 2). [45] В присутствии холестерина SREBP связывается с двумя другими белками: SCAP (белок, активирующий расщепление SREBP) и INSIG-1 . Когда уровень холестерина падает, INSIG-1 диссоциирует от комплекса SREBP-SCAP, что позволяет комплексу мигрировать в аппарат Гольджи . Здесь SREBP расщепляется S1P и S2P (протеаза сайта 1 и протеаза сайта 2), двумя ферментами, которые активируются SCAP при низком уровне холестерина.
Расщепленный SREBP затем мигрирует в ядро и действует как фактор транскрипции , связываясь с регуляторным элементом стерола (SRE), который стимулирует транскрипцию многих генов. Среди них рецептор липопротеинов низкой плотности ( ЛПНП ) и ГМГ-КоА-редуктаза . Рецептор ЛПНП удаляет циркулирующие ЛПНП из кровотока, тогда как ГМГ-КоА-редуктаза приводит к увеличению эндогенного производства холестерина. [46] Большая часть этого сигнального пути была разъяснена доктором Майклом С. Брауном и доктором Джозефом Л. Гольдштейном в 1970-х годах. В 1985 году за свою работу они получили Нобелевскую премию по физиологии и медицине . Их последующая работа показывает, как путь SREBP регулирует экспрессию многих генов, которые контролируют образование и метаболизм липидов, а также распределение топлива в организме.
Синтез холестерина также может быть отключен при высоком уровне холестерина. HMG-CoA-редуктаза содержит как цитозольный домен (отвечающий за каталитическую функцию), так и мембранный домен. Мембранный домен воспринимает сигналы о своей деградации. Увеличение концентрации холестерина (и других стеринов) вызывает изменение состояния олигомеризации этого домена, что делает его более восприимчивым к разрушению протеасомой . Активность этого фермента также можно снизить за счет фосфорилирования АМФ-активируемой протеинкиназой . Поскольку эта киназа активируется АМФ, который вырабатывается при гидролизе АТФ, из этого следует, что синтез холестерина останавливается при низком уровне АТФ. [47]
Плазменный транспорт и регуляция всасывания
[ редактировать ]
Будучи изолированной молекулой, холестерин лишь минимально растворим в воде или гидрофильен . Из-за этого он растворяется в крови в чрезвычайно малых концентрациях. Для эффективной транспортировки холестерин вместо этого упаковывается в липопротеины , сложные дискоидные частицы с внешними амфифильными белками и липидами, обращенные наружу поверхности которых водорастворимы, а обращенные внутрь поверхности жирорастворимы. Это позволяет ему путешествовать по крови посредством эмульгирования . Несвязанный холестерин, будучи амфипатическим, транспортируется по монослойной поверхности липопротеиновой частицы вместе с фосфолипидами и белками. С другой стороны, эфиры холестерина, связанные с жирными кислотами, транспортируются внутри жирного гидрофобного ядра липопротеина вместе с триглицеридами. [48]
В крови имеется несколько типов липопротеинов. В порядке возрастания плотности это хиломикроны , липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛПНП), липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП). Более низкое соотношение белков и липидов приводит к менее плотным липопротеинам. Холестерин в различных липопротеинах идентичен, хотя некоторые из них переносятся в виде нативной «свободной» спиртовой формы (холестерол-ОН-группа обращена к воде, окружающей частицы), тогда как другие — в виде ациловых эфиров жирных кислот, известных также как эфиры холестерина, внутри частиц. [48]
Частицы липопротеинов организованы сложными аполипопротеинами , обычно состоящими из 80–100 различных белков на частицу, которые могут распознаваться и связываться специфическими рецепторами на клеточных мембранах, направляя свою липидную нагрузку в определенные клетки и ткани, в настоящее время поглощающие эти частицы, транспортирующие жир. Эти поверхностные рецепторы служат уникальными молекулярными сигнатурами, которые затем помогают определить распределение жира по всему телу. [48]
Хиломикроны, наименее плотные частицы, транспортирующие холестерин, содержат аполипопротеин B-48 , аполипопротеин C и аполипопротеин E (основной переносчик холестерина в мозге). [49] ) в своих панцирях. Хиломикроны переносят жиры из кишечника в мышцы и другие ткани, нуждающиеся в жирных кислотах для производства энергии или жира. Неиспользованный холестерин остается в более богатых холестерином остатках хиломикронов и забирается оттуда в кровоток печенью. [48]
Частицы ЛПОНП производятся печенью из триацилглицерина и холестерина, которые не использовались в синтезе желчных кислот. Эти частицы содержат аполипопротеин B100 и аполипопротеин E в своей оболочке и могут расщепляться липопротеинлипазой на стенке артерии до IDL. Расщепление артериальной стенки позволяет абсорбировать триацилглицерин и увеличивает концентрацию циркулирующего холестерина. Частицы ЛПНП затем потребляются в двух процессах: половина метаболизируется ХТГЛ и поглощается рецептором ЛПНП на поверхности клеток печени, в то время как другая половина продолжает терять триацилглицерины в кровотоке, пока они не превращаются в частицы ЛПНП, нагруженные холестерином. [48]
Частицы ЛПНП являются основными переносчиками холестерина в крови. Каждый из них содержит около 1500 молекул эфира холестерина. Оболочки частиц ЛПНП содержат всего одну молекулу аполипопротеина В100 , распознаваемую рецепторами ЛПНП в периферических тканях. При связывании аполипопротеина B100 многие рецепторы ЛПНП концентрируются в ямках, покрытых клатрином . И ЛПНП, и его рецептор образуют везикулы внутри клетки посредством эндоцитоза . Эти везикулы затем сливаются с лизосомой , где фермент лизосомальной кислой липазы гидролизует эфиры холестерина. Холестерин затем можно использовать для мембранного биосинтеза или этерифицировать и хранить внутри клетки, чтобы не мешать клеточным мембранам. [48]
Рецепторы ЛПНП расходуются во время всасывания холестерина, а его синтез регулируется SREBP , тем же белком, который контролирует синтез холестерина de novo , в зависимости от его присутствия внутри клетки. В клетке с избытком холестерина синтез рецепторов ЛПНП блокируется, чтобы предотвратить поглощение нового холестерина в частицах ЛПНП. И наоборот, синтез рецептора ЛПНП происходит, когда клетка испытывает дефицит холестерина. [48]
Когда этот процесс становится нерегулируемым, в крови начинают появляться частицы ЛПНП без рецепторов. Эти частицы ЛПНП окисляются и поглощаются макрофагами , которые набухают и образуют пенистые клетки. Эти пенистые клетки часто задерживаются в стенках кровеносных сосудов и способствуют образованию атеросклеротических бляшек . Различия в гомеостазе холестерина влияют на развитие раннего атеросклероза (толщина интимы-медиа сонных артерий). [50] Эти бляшки являются основной причиной сердечных приступов, инсультов и других серьезных медицинских проблем, приводящих к ассоциации так называемого холестерина ЛПНП (на самом деле липопротеина ) с «плохим» холестерином. [47]
Считается, что частицы ЛПВП переносят холестерин обратно в печень либо для выведения, либо в другие ткани, синтезирующие гормоны, в процессе, известном как обратный транспорт холестерина (RCT). [51] Большое количество частиц ЛПВП коррелирует с лучшими последствиями для здоровья. [52] тогда как низкое количество частиц ЛПВП связано с прогрессированием атероматозного заболевания в артериях. [53]
Метаболизм, переработка и выведение
[ редактировать ]Холестерин подвержен окислению и легко образует кислородсодержащие производные, называемые оксистеринами . Они могут образовываться тремя различными механизмами: автоокислением, вторичным окислением до перекисного окисления липидов и окислением ферментов, метаболизирующих холестерин. Большой интерес к оксистеринам возник, когда было показано, что они оказывают ингибирующее действие на биосинтез холестерина. [54] Это открытие стало известно как «гипотеза оксистерола». Дополнительные роли оксистеролов в физиологии человека включают их участие в биосинтезе желчных кислот, функцию транспортных форм холестерина и регуляцию транскрипции генов. [55]
В биохимических экспериментах используются радиоактивно меченные формы холестерина, такие как тритированный холестерин. Эти производные подвергаются разложению при хранении, и перед использованием важно очищать холестерин. Холестерин можно очистить с помощью небольших колонок Sephadex LH-20. [56]
Холестерин окисляется печенью в различные желчные кислоты . [57] Они, в свою очередь, конъюгированы с глицином , таурином , глюкуроновой кислотой или сульфатом . Смесь конъюгированных и неконъюгированных желчных кислот вместе с самим холестерином выводится из печени в желчь . Примерно 95% желчных кислот реабсорбируется из кишечника, а остальная часть теряется с калом. [58] Экскреция и реабсорбция желчных кислот составляет основу энтерогепатической циркуляции , необходимой для переваривания и всасывания пищевых жиров. При определенных обстоятельствах, когда холестерин более концентрирован, например, в желчном пузыре , он кристаллизуется и является основным компонентом большинства желчных камней ( также встречаются лецитиновые и билирубиновые желчные камни, но реже). [59] Ежедневно в толстую кишку попадает до 1 г холестерина. Этот холестерин поступает из пищи, желчи и слущенных клеток кишечника и может метаболизироваться бактериями толстой кишки. Холестерин превращается в основном в копростанол , неабсорбируемый стерол, который выводится с калом. [ нужна ссылка ]
Хотя холестерин является стероидом, который обычно ассоциируется с млекопитающими, человеческий патоген Mycobacterium Tuberculosis способен полностью расщепить эту молекулу и содержит большое количество генов, которые регулируются его присутствием. [60] Многие из этих генов, регулируемых холестерином, являются гомологами генов жирных кислот β-окисления , но эволюционировали таким образом, что связывают крупные стероидные субстраты, такие как холестерин. [61] [62]
Диетические источники
[ редактировать ]Животные жиры представляют собой сложные смеси триглицеридов с меньшим количеством молекул фосфолипидов и холестерина, из которых построены клеточные мембраны всех животных (и человека). Поскольку все животные клетки производят холестерин, все продукты животного происхождения содержат холестерин в разных количествах. [63] Основные пищевые источники холестерина включают красное мясо , яичные желтки и цельные яйца , печень , почки , потроха , рыбий жир и сливочное масло . [64] Человеческое грудное молоко также содержит значительное количество холестерина. [65]
Растительные клетки синтезируют холестерин в качестве предшественника других соединений, таких как фитостерины и стероидные гликоалкалоиды , при этом холестерин остается в растительной пище лишь в незначительных количествах или отсутствует. [64] [66] Некоторые растительные продукты, такие как авокадо , семена льна и арахис , содержат фитостерины, которые конкурируют с холестерином за всасывание в кишечнике и снижают всасывание как пищевого, так и желчного холестерина. [67] Типичная диета содержит около 0,2 грамма фитостеролов, чего недостаточно, чтобы оказать существенное влияние на блокирование всасывания холестерина. Потребление фитостеринов можно дополнить за счет использования содержащих фитостерол функциональных продуктов питания или пищевых добавок , которые признаны способными снижать уровень холестерина ЛПНП . [68]
Медицинские руководства и рекомендации
[ редактировать ]В 2015 году научная консультативная группа Министерства здравоохранения и социальных служб США и Министерства сельского хозяйства США для версии «Руководства по питанию для американцев» 2015 года снизила ранее рекомендованный предел потребления пищевого холестерина до 300 мг в день, рекомендовав новую рекомендацию: «ешьте как можно меньше пищевого холестерина» и признавая связь между диетой с низким содержанием холестерина и снижением риска сердечно-сосудистых заболеваний. [69]
В отчете Американской кардиологической ассоциации и Американского колледжа кардиологов за 2013 год рекомендуется сосредоточиться на здоровом питании, а не на конкретных ограничениях уровня холестерина, поскольку их сложно внедрить врачам и потребителям. Они рекомендуют DASH и средиземноморскую диету с низким содержанием холестерина. [70] Обзор Американской кардиологической ассоциации, проведенный в 2017 году, рекомендует заменить насыщенные жиры полиненасыщенными жирами, чтобы снизить риск сердечно-сосудистых заболеваний . [71]
В некоторых дополнительных руководствах рекомендованы дозы фитостеролов в диапазоне 1,6–3,0 граммов в день (Health Canada, EFSA, ATP III, FDA). Метаанализ продемонстрировал снижение уровня холестерина ЛПНП на 12% при средней дозе 2,1 грамма в день. [72] Польза диеты с добавлением фитостеролов также подвергается сомнению. [73]
Клиническое значение
[ редактировать ]Гиперхолестеринемия
[ редактировать ]
Согласно липидной гипотезе , повышенный уровень холестерина в крови приводит к атеросклерозу , который может увеличить риск сердечного приступа , инсульта и заболеваний периферических артерий . Поскольку более высокие уровни ЛПНП в крови – особенно более высокие концентрации ЛПНП и меньший размер частиц ЛПНП – способствуют этому процессу больше, чем содержание холестерина в частицах ЛПВП, [8] Частицы ЛПНП часто называют «плохим холестерином». Высокие концентрации функциональных ЛПВП, которые могут удалять холестерин из клеток и атером, обеспечивают защиту и обычно называются «хорошим холестерином». Этот баланс в основном детерминирован генетически, но может быть изменен составом тела, приемом лекарств , диетой. [74] и другие факторы. [75] Исследование 2007 года показало, что уровень общего холестерина в крови оказывает экспоненциальное влияние на сердечно-сосудистую и общую смертность, причем эта связь более выражена у более молодых людей. Поскольку сердечно-сосудистые заболевания относительно редки среди молодого населения, влияние высокого уровня холестерина на здоровье сильнее у пожилых людей. [76]
Повышенные уровни фракций липопротеинов, ЛПНП, ЛПНП и ЛПОНП, а не уровень общего холестерина, коррелируют со степенью и прогрессированием атеросклероза. [77] И наоборот, общий холестерин может находиться в пределах нормы, но состоять в основном из мелких частиц ЛПНП и мелких частиц ЛПВП, при которых скорость роста атеромы высока. Апостериорный анализ проспективных исследований IDEAL и EPIC выявил связь между высокими уровнями холестерина ЛПВП (с поправкой на аполипопротеин AI и аполипопротеин B) и повышенным риском сердечно-сосудистых заболеваний, что ставит под сомнение кардиозащитную роль «хорошего холестерина». [78] [79]
Примерно у одного из 250 человек может быть генетическая мутация рецептора холестерина ЛПНП, которая приводит к семейной гиперхолестеринемии. [80] Наследственный высокий уровень холестерина может также включать генетические мутации в гене PCSK9 и гене аполипопротеина B. [81]
Повышенный уровень холестерина поддается лечению с помощью диеты, которая уменьшает или исключает насыщенные жиры, трансжиры и продукты с высоким содержанием холестерина. [82] [83] часто с последующим применением одного из различных гиполипидемических препаратов , таких как статины , фибраты , ингибиторы абсорбции холестерина, терапия моноклональными антителами ( ингибиторы PCSK9 ), производные никотиновой кислоты или секвестранты желчных кислот. [84] Существует несколько международных рекомендаций по лечению гиперхолестеринемии. [85]
Испытания на людях с использованием ингибиторов редуктазы HMG-CoA , известных как статины , неоднократно подтверждали, что изменение моделей транспорта липопротеинов с нездоровых на более здоровые значительно снижает частоту сердечно-сосудистых заболеваний даже у людей, уровень холестерина в которых в настоящее время считается низким для взрослых. [86] Исследования показали, что снижение уровня холестерина ЛПНП примерно на 38,7 мг/дл с помощью статинов может снизить риск сердечно-сосудистых заболеваний и инсульта примерно на 21%. [87] Исследования также показали, что статины замедляют прогрессирование атеромы. [88] В результате люди с сердечно-сосудистыми заболеваниями в анамнезе могут получить пользу от статинов независимо от уровня холестерина (общий холестерин ниже 5,0 ммоль/л [193 мг/дл]). [89] а у мужчин без сердечно-сосудистых заболеваний полезно снизить аномально высокий уровень холестерина («первичная профилактика»). [90] Первичная профилактика у женщин первоначально практиковалась только путем распространения результатов исследований на мужчин. [91] поскольку у женщин ни одно из крупных исследований статинов, проведенных до 2007 года, не продемонстрировало значительного снижения общей смертности или сердечно-сосудистых осложнений. [92] Мета-анализ продемонстрировал значительное снижение смертности от всех причин и смертности от сердечно-сосудистых заболеваний без значительной гетерогенности по полу. [93]
| Уровень | Интерпретация | |
|---|---|---|
| мг / дл | ммоль / л | |
| < 200 | < 5,2 | Желаемый уровень (меньший риск) |
| 200–240 | 5.2–6.2 | Пограничный высокий риск |
| > 240 | > 6,2 | Высокий риск |
В отчете Национальной образовательной программы по холестерину « Комиссии по лечению взрослых» за 1987 год предполагается, что общий уровень холестерина в крови должен быть: < 200 мг/дл нормального холестерина в крови, 200–239 мг/дл пограничного уровня холестерина, > 240 мг/дл высокого уровня холестерина. [94] Американская кардиологическая ассоциация предоставляет аналогичный набор рекомендаций по общему уровню холестерина в крови (натощак) и риску сердечно-сосудистых заболеваний: [82] Статины эффективны для снижения уровня холестерина ЛПНП и широко используются для первичной профилактики у людей с высоким риском сердечно-сосудистых заболеваний, а также для вторичной профилактики у тех, у кого развились сердечно-сосудистые заболевания. [95] Средний глобальный средний уровень общего холестерина для людей оставался на уровне около 4,6 ммоль/л (178 мг/дл) для мужчин и женщин, как общий, так и стандартизированный по возрасту, в течение почти 40 лет, с 1980 по 2018 год, с некоторыми региональными вариациями и снижением общего уровня холестерина. Холестерин в западных странах. [96]
Более современные методы тестирования определяют холестерин ЛПНП («плохой») и ЛПВП («хороший») отдельно, что позволяет сделать анализ холестерина более детальным. Желательным уровнем ЛПНП считается менее 100 мг/дл (2,6 ммоль /л). [97] [98]

Общий холестерин определяется как сумма ЛПВП, ЛПНП и ЛПОНП. Обычно измеряют только общее количество, ЛПВП и триглицериды. Из соображений стоимости ЛПОНП обычно оценивают как одну пятую триглицеридов, а ЛПНП оценивают по формуле Фридевальда (или ее варианту ): расчетный ЛПНП = [общий холестерин] - [общий ЛПВП] - [оцененный ЛПОНП]. Прямые измерения ЛПНП используются, когда уровень триглицеридов превышает 400 мг/дл. Расчетные значения ЛПОНП и ЛПНП имеют большую погрешность, когда уровень триглицеридов превышает 400 мг/дл. [99]
Во Фрамингемском исследовании сердца каждое увеличение уровня общего холестерина на 10 мг/дл (0,6 ммоль /л) повышало общую 30-летнюю смертность на 5%, а смертность от сердечно-сосудистых заболеваний на 9%. В то время как у пациентов старше 50 лет наблюдалось увеличение общей смертности на 11% и увеличение смертности от сердечно-сосудистых заболеваний на 14% на каждые 1 мг/дл (0,06 ммоль /л) годового снижения уровня общего холестерина. Исследователи объяснили этот феномен другой корреляцией , согласно которой болезнь сама по себе увеличивает риск смерти, а также изменяет множество факторов, таких как потеря веса и неспособность есть, которые снижают уровень холестерина в сыворотке. [100] Этот эффект также был показан у мужчин всех возрастов и женщин старше 50 лет в рамках Программы мониторинга и укрепления здоровья Форарльберга. Эти группы чаще умирали от рака, заболеваний печени и психических заболеваний при очень низком уровне общего холестерина — 186 мг/дл (10,3 ммоль /л) и ниже. Этот результат указывает на то, что эффект низкого уровня холестерина наблюдается даже среди более молодых респондентов, что противоречит предыдущей оценке среди когорт пожилых людей, согласно которой это является маркером слабости, возникающей с возрастом. [101]
Гипохолестеринемия
[ редактировать ]Аномально низкий уровень холестерина называется гипохолестеринемией . Исследования причин этого состояния относительно ограничены, но некоторые исследования предполагают связь с депрессией , раком и кровоизлиянием в мозг . В целом низкий уровень холестерина кажется следствием, а не причиной основного заболевания. [76] Генетический дефект синтеза холестерина вызывает синдром Смита-Лемли-Опитца , который часто связан с низким уровнем холестерина в плазме. Гипертиреоз или любое другое эндокринное нарушение, вызывающее активацию рецептора ЛПНП , может привести к гипохолестеринемии. [102]
Тестирование
[ редактировать ]Американская кардиологическая ассоциация рекомендует проверять уровень холестерина каждые 4–6 лет людям в возрасте 20 лет и старше. [103] В отдельном наборе рекомендаций Американской кардиологической ассоциации, выпущенном в 2013 году, указано, что людям, принимающим статины , следует проверять уровень холестерина через 4–12 недель после первой дозы, а затем каждые 3–12 месяцев после этого. [104] [105] Мужчинам в возрасте от 45 до 65 лет и женщинам в возрасте от 55 до 65 лет тест на холестерин следует проводить каждые 1–2 года, а пожилым людям старше 65 лет тест следует проводить ежегодно. [104]
Образец крови после 12-часового голодания берется медицинским работником руки из вены для измерения липидного профиля : а) общего холестерина, б) холестерина ЛПВП, в) холестерина ЛПНП и г) триглицеридов . [3] [104] Результаты могут быть выражены как «расчетные», что означает расчет общего холестерина, ЛПВП и триглицеридов. [3]
Холестерин тестируется для определения «нормального» или «желательного» уровня, если у человека общий уровень холестерина составляет 5,2 ммоль/л или менее (200 мг/дл), а уровень ЛПВП превышает 1 ммоль/л (40 мг/дл). «чем выше, тем лучше»), значение ЛПНП менее 2,6 ммоль/л (100 мг/дл) и уровень триглицеридов менее 1,7 ммоль/л (150 мг/дл). [104] [3] Уровень холестерина в крови у людей с образом жизни, старением или факторами риска сердечно-сосудистых заболеваний, такими как сахарный диабет , гипертония , семейный анамнез ишемической болезни сердца или стенокардия , оценивается на разных уровнях. [104]
Интерактивная карта маршрутов
[ редактировать ]Нажмите на гены, белки и метаболиты ниже, чтобы перейти к соответствующим статьям. [§ 1]
- ^ Интерактивную карту маршрутов можно редактировать на WikiPathways: «Statin_Pathway_WP430» .
Холестерические жидкие кристаллы
[ редактировать ]Известно, что некоторые производные холестерина (среди других простых холестерических липидов) образуют жидкокристаллическую «холестерическую фазу». Холестерическая фаза по сути является хиральной нематической фазой и меняет цвет при изменении ее температуры. Это делает производные холестерина полезными для индикации температуры в с жидкокристаллическими дисплеями термометрах и в термочувствительных красках. [ нужна ссылка ]
Стереоизомеры
[ редактировать ]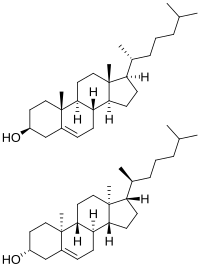
Холестерин имеет 256 стереоизомеров , которые возникают из его восьми стереоцентров, хотя только два из стереоизомеров имеют биохимическое значение ( нат -холестерин и энт -холестерин, для природного и энантиомера соответственно). [106] [107] и только один встречается в природе ( нат -холестерин).
Дополнительные изображения
[ редактировать ]- Перевод единиц холестерина
- Стероидогенез , использование холестерина в качестве строительного материала.
- Модель заполнения пространства молекулы холестерина
- Нумерация стероидных ядер
См. также
[ редактировать ]- Arcus senilis «Холестериновое кольцо» в глазах
- Сердечно-сосудистые заболевания
- Холестериновая эмболия
- Общий синтез холестерина
- Семейная гиперхолестеринемия
- Гиперхолестеринемия «Высокий уровень холестерина»
- Гипохолестеринемия «Низкий уровень холестерина»
- Молекула с лицом Януса
- Список холестерина в продуктах
- Болезнь Нимана-Пика типа C
- оксихолестерин
- Остаточный холестерин
Ссылки
[ редактировать ]- ^ Jump up to: а б «Холестерин, 57-88-5» . PubChem, Национальная медицинская библиотека, Национальные институты здравоохранения США. 9 ноября 2019 года . Проверено 14 ноября 2019 г.
- ^ Jump up to: а б «Данные по безопасности (MSDS) холестерина» . Архивировано из оригинала 12 июля 2007 года . Проверено 20 октября 2007 г.
- ^ Jump up to: а б с д «Холестерин» . MedlinePlus, Национальная медицинская библиотека, Национальные институты здравоохранения США. 10 декабря 2020 г. Проверено 23 августа 2023 г.
- ^ Холестерин Национальной медицинской библиотеки США в медицинских предметных рубриках (MeSH).
- ^ Ван, Хао; Кулас, Джошуа А.; Ван, Чао; Хольцман, Дэвид М.; Феррис, Хизер А.; Хансен, Скотт Б. (17 августа 2021 г.). «Регуляция производства бета-амилоида в нейронах с помощью холестерина, полученного из астроцитов» . Труды Национальной академии наук . 118 (33). Бибкод : 2021PNAS..11802191W . дои : 10.1073/pnas.2102191118 . ПМЦ 8379952 . ПМИД 34385305 .
- ^ Разин С., Талли Дж.Г. (май 1970 г.). «Потребность микоплазм в холестерине» . Журнал бактериологии . 102 (2): 306–110. дои : 10.1128/JB.102.2.306-310.1970 . ПМК 247552 . ПМИД 4911537 .
- ^ Jump up to: а б Ханукоглу I (декабрь 1992 г.). «Стероидогенные ферменты: структура, функции и роль в регуляции биосинтеза стероидных гормонов» . Журнал биохимии стероидов и молекулярной биологии . 43 (8): 779–804. дои : 10.1016/0960-0760(92)90307-5 . ПМИД 22217824 . S2CID 112729 .
- ^ Jump up to: а б Брунцелл Дж.Д., Дэвидсон М., Фурберг К.Д., Голдберг Р.Б., Ховард Б.В., Штейн Дж.Х., Витцтум Дж.Л. (апрель 2008 г.). «Управление липопротеинами у пациентов с кардиометаболическим риском: консенсусное заявление Американской диабетической ассоциации и Фонда Американского колледжа кардиологов» . Уход при диабете . 31 (4): 811–822. дои : 10.2337/dc08-9018 . ПМИД 18375431 .
- ^ Шеврель М.Е. (1816 г.). исследования жировых веществ, и в частности их сочетаний со щелочами. Шестая диссертация. Исследование жиров человека, овцы, говядины, ягуара и гуся" " Химические щелочи. Шестые воспоминания. Исследование человеческого, овечьего, говяжьего, ягуарового и гусиного жира. Анналы химии и физики (на французском языке). 2 : 339–372 [346].
Я назову – – кристаллизованное вещество из желчных камней человека... ]
холестерин от χολη ( желчь ) и στερεος (твердое) - ^ Олсон Р.Э. (февраль 1998 г.). «Открытие липопротеинов, их роли в транспортировке жира и их значение как факторов риска» . Журнал питания . 128 (2 доп.): 439S–443S. дои : 10.1093/jn/128.2.439S . ПМИД 9478044 .
- ^ Ло, Цзе; Ян, Хунъюань; Сун, Бао-Лян (апрель 2020 г.). «Механизмы и регуляция гомеостаза холестерина». Nature Reviews Молекулярно-клеточная биология . 21 (4): 225–245. дои : 10.1038/s41580-019-0190-7 . ПМИД 31848472 . S2CID 209392321 .
- ^ Хансен, Скотт Б.; Ван, Хао (сентябрь 2023 г.). «Общая роль холестерина в нейрональном и периферическом воспалении». Фармакология и терапия . 249 : 108486. doi : 10.1016/j.pharmthera.2023.108486 . ПМИД 37390970 . S2CID 259303593 .
- ^ Пэ, Су-Хан; Ли, Джун Но; Фитцки, Барбара У.; Сон, Джекён; Пайк, Ён-Ки (май 1999 г.). «Биосинтез холестерина из ланостерола» . Журнал биологической химии . 274 (21): 14624–14631. дои : 10.1074/jbc.274.21.14624 . ПМИД 10329655 .
- ^ «Национальное обследование здоровья и питания» (PDF) . Центр США по контролю заболеваний . Проверено 28 января 2012 г.
- ^ Лесерф Ж.М., де Лоржериль М. (июль 2011 г.). «Диетический холестерин: от физиологии к сердечно-сосудистому риску» . Британский журнал питания . 106 (1): 6–14. дои : 10.1017/S0007114511000237 . ПМИД 21385506 .
- ^ Ангел, А; Фаркас, Дж (сентябрь 1974 г.). «Регуляция хранения холестерина в жировой ткани» . Журнал исследований липидов . 15 (5): 491–9. дои : 10.1016/S0022-2275(20)36769-9 . ПМИД 4415522 .
- ^ Дюбуа С., Арманд М., Мекки Н., Португалия Х., Паули А.М., Бернар П.М. и др. (ноябрь 1994 г.). «Влияние увеличения количества пищевого холестерина на постпрандиальную липемию и липопротеины у людей» . Журнал исследований липидов . 35 (11): 1993–2007. дои : 10.1016/S0022-2275(20)39946-6 . ПМИД 7868978 .
- ^ Берман Э.Дж., Гопалан В. (2005). Сковелл В.М. (ред.). «Холестерин и растения». Журнал химического образования . 82 (12): 1791. Бибкод : 2005JChEd..82.1791B . дои : 10.1021/ed082p1791 .
- ^ Джон С., Сорокин А.В., Томпсон П.Д. (февраль 2007 г.). «Фитостеролы и сосудистые заболевания». Современное мнение в липидологии . 18 (1): 35–40. дои : 10.1097/MOL.0b013e328011e9e3 . ПМИД 17218830 . S2CID 29213889 .
- ^ Джеш ЭД, Карр Т.П. (июнь 2017 г.). «Пищевые ингредиенты, ингибирующие всасывание холестерина» . Профилактическое питание и пищевая наука . 22 (2): 67–80. дои : 10.3746/pnf.2017.22.2.67 . ПМК 5503415 . ПМИД 28702423 .
- ^ Агрен Дж. Дж., Твржичка Э., Ненонен М.Т., Хельве Т., Ханнинен О. (февраль 2001 г.). «Различные изменения уровня стеринов в сыворотке крови во время строгой сырой веганской диеты у пациентов с ревматоидным артритом» . Британский журнал питания . 85 (2): 137–139. дои : 10.1079/BJN2000234 . ПМИД 11242480 .
- ^ Биохимия , 7-е изд., Дж. М. Берг, Дж. Л. Тимочко и Л. Страйер, 2010, с. 350.
- ^ Садава Д., Хиллис Д.М., Хеллер Х.К., Беренбаум М.Р. (2011). «Клеточные мембраны». Жизнь: наука биологии (9-е изд.). Сан-Франциско: Фриман. стр. 105–114. ISBN 978-1-4292-4646-0 .
- ^ Охво-Рекиля Х., Рамстедт Б., Леппимяки П., Слотте Дж.П. (январь 2002 г.). «Взаимодействие холестерина с фосфолипидами в мембранах». Прогресс в исследованиях липидов . 41 (1): 66–97. дои : 10.1016/S0163-7827(01)00020-0 . ПМИД 11694269 .
- ^ Йигл PL (октябрь 1991 г.). «Модуляция функции мембран холестерином». Биохимия . 73 (10): 1303–1310. дои : 10.1016/0300-9084(91)90093-G . ПМИД 1664240 .
- ^ Хейнс TH (июль 2001 г.). «Уменьшают ли стерины утечку протонов и натрия через липидные бислои?». Прогресс в исследованиях липидов . 40 (4): 299–324. дои : 10.1016/S0163-7827(01)00009-1 . ПМИД 11412894 . S2CID 32236169 .
- ^ Петерсен Э.Н., Чунг Х.В., Наебосадри А., Хансен С.Б. (декабрь 2016 г.). «Кинетическое разрушение липидных рафтов является механосенсором фосфолипазы D» . Природные коммуникации . 7 : 13873. Бибкод : 2016NatCo...713873P . дои : 10.1038/ncomms13873 . ПМК 5171650 . ПМИД 27976674 .
- ^ Инкардона Дж. П., Итон С. (апрель 2000 г.). «Холестерин в передаче сигнала». Современное мнение в области клеточной биологии . 12 (2): 193–203. дои : 10.1016/S0955-0674(99)00076-9 . ПМИД 10712926 .
- ^ Павлина В., Росс М.В. (2006). «Поддержка клеток нервной системы». Гистология: текст и атлас: с коррелирующей клеточной и молекулярной биологией (5-е изд.). Филадельфия: Липпинкотт Уильямс и Уилкинс. п. 339. ИСБН 978-0-7817-5056-1 .
- ^ Левитан I, Сингх Д.К., Розенхаус-Данцкер А (2014). «Связывание холестерина с ионными каналами» . Границы в физиологии . 5 : 65. дои : 10.3389/fphys.2014.00065 . ПМЦ 3935357 . ПМИД 24616704 .
- ^ Jump up to: а б с Вэй В., Швайд А.Г., Ван X, Ван X, Чен С., Чу Q и др. (март 2016 г.). «Активация лиганда ERRα холестерином опосредует эффекты статинов и бисфосфонатов» . Клеточный метаболизм . 23 (3): 479–491. дои : 10.1016/j.cmet.2015.12.010 . ПМЦ 4785078 . ПМИД 26777690 .
- ^ Jump up to: а б с д Цзо Х, Ван Ю (2017). «Ядерные рецепторы в скелетном гомеостазе» . В Форресте Д., Цай С. (ред.). Ядерные рецепторы в развитии и заболеваниях . Эльзевир Наука. п. 88. ИСБН 978-0-12-802196-5 .
- ^ Пейн А.Х., Хейлз Д.Б. (декабрь 2004 г.). «Обзор стероидогенных ферментов на пути от холестерина к активным стероидным гормонам» . Эндокринные обзоры . 25 (6): 947–70. дои : 10.1210/er.2003-0030 . ПМИД 15583024 .
- ^ Jump up to: а б с Элиас П.М., Фейнгольд КР (2006). «Барьерная функция рогового слоя: определения и широкие понятия». В Элиасе П.М. (ред.). Кожный барьер . Нью-Йорк: Тейлор и Фрэнсис. ISBN 978-0824758158 .
- ^ Jump up to: а б с д Мерлеев А.А., Ле С.Т., Алексанян С., Тусси А., Се Ю, Марусина А.И. и др. (август 2022 г.). «Биогеографические и специфические для заболевания изменения в составе эпидермальных липидов и одноклеточный анализ акральных кератиноцитов» . JCI-инсайт . 7 (16). doi : 10.1172/jci.insight.159762 . ПМЦ 9462509 . ПМИД 35900871 .
- ^ Элиас П.М., Уильямс М.Л., Мэлони М.Е., Бонифас Дж.А., Браун Б.Е., Грейсон С., Эпштейн Э.Х. (октябрь 1984 г.). «Липиды рогового слоя при нарушениях ороговения. Стероидсульфатаза и сульфат холестерина при нормальном десквамации и патогенезе рецессивного Х-сцепленного ихтиоза» . Журнал клинических исследований . 74 (4): 1414–1421. дои : 10.1172/JCI111552 . ПМК 425309 . ПМИД 6592175 .
- ^ «Как это сделано: производство холестерина в вашем организме» . Издательство Гарвардского здравоохранения . Проверено 18 октября 2018 г.
- ^ Jump up to: а б «Биосинтез и регуляция холестерина (с анимацией)» . PharmaXChange.info . 17 сентября 2013 г. Архивировано из оригинала 7 января 2018 г. Проверено 19 сентября 2013 г.
- ^ «Метаболизм холестерина (включает пути Блоха и Кандуча-Рассела) (Mus musculus) – WikiPathways» . www.wikipathways.org . Проверено 2 февраля 2021 г.
- ^ Сингх П., Саксена Р., Шринивас Г., Панде Г., Чаттопадхьяй А. (2013). «Биосинтез холестерина и гомеостаз в регуляции клеточного цикла» . ПЛОС ОДИН . 8 (3): e58833. Бибкод : 2013PLoSO...858833S . дои : 10.1371/journal.pone.0058833 . ПМЦ 3598952 . ПМИД 23554937 .
- ^ «Путь Кандутча-Рассела» . pubchem.ncbi.nlm.nih.gov . Проверено 2 февраля 2021 г.
- ^ Берг Дж (2002). Биохимия . Нью-Йорк: WH Freeman. ISBN 978-0-7167-3051-4 .
- ^ Роудс С.М., Страйер Л., Таскер Р. (1995). Биохимия (4-е изд.). Сан-Франциско: WH Freeman. стр. 280, 703. ISBN. 978-0-7167-2009-6 .
- ^ «Нобелевская премия по физиологии и медицине, 1964 г.» . Нобелевская премия, Нобелевские СМИ.
- ^ Эспеншейд П.Дж., Хьюз А.Л. (2007). «Регуляция синтеза стеринов у эукариот». Ежегодный обзор генетики . 41 : 401–427. дои : 10.1146/annurev.genet.41.110306.130315 . ПМИД 17666007 .
- ^ Браун М.С., Гольдштейн Дж.Л. (май 1997 г.). «Путь SREBP: регуляция метаболизма холестерина путем протеолиза мембраносвязанного фактора транскрипции» . Клетка . 89 (3): 331–340. дои : 10.1016/S0092-8674(00)80213-5 . ПМИД 9150132 . S2CID 17882616 .
- ^ Jump up to: а б Тимочко Дж.Л., Берг Т., Страйер Л., Берг Дж.М. (2002). Биохимия . Сан-Франциско: WH Freeman. стр. 726–727 . ISBN 978-0-7167-4955-4 .
- ^ Jump up to: а б с д и ж г Паттон К.Т., Тибодо Дж.А. (2010). Анатомия и физиология (7-е изд.). Мосби/Эльзевир. ISBN 978-9996057762 . [ нужна страница ]
- ^ Махли RW (июль 2016 г.). «Аполипопротеин Е: от сердечно-сосудистых заболеваний к нейродегенеративным расстройствам» . Журнал молекулярной медицины . 94 (7): 739–746. дои : 10.1007/s00109-016-1427-y . ПМЦ 4921111 . ПМИД 27277824 .
- ^ Вайнгертнер О., Пинсдорф Т., Рогачев К.С., Блёмер Л., Греннер Ю., Гребер С. и др. (октябрь 2010 г.). Федеричи М (ред.). «Взаимосвязь маркеров гомеостаза холестерина с толщиной интимы-медиа сонных артерий» . ПЛОС ОДИН . 5 (10): е13467. Бибкод : 2010PLoSO...513467W . дои : 10.1371/journal.pone.0013467 . ПМЦ 2956704 . ПМИД 20976107 .
- ^ Льюис Г.Ф., Rader DJ (июнь 2005 г.). «Новые данные о регуляции метаболизма ЛПВП и обратном транспорте холестерина». Исследование кровообращения . 96 (12): 1221–1232. дои : 10.1161/01.RES.0000170946.56981.5c . ПМИД 15976321 .
- ^ Гордон Д.Д., Пробстфилд Дж.Л., Гаррисон Р.Дж., Нитон Дж.Д., Кастелли В.П., Нок Дж.Д. и др. (январь 1989 г.). «Холестерин липопротеинов высокой плотности и сердечно-сосудистые заболевания. Четыре проспективных американских исследования» . Тираж . 79 (1): 8–15. дои : 10.1161/01.CIR.79.1.8 . ПМИД 2642759 .
- ^ Миллер Н.Э., Телле Д.С., Форд О.Д., Мьос О.Д. (май 1977 г.). «Исследование сердца в Тромсё. Липопротеины высокой плотности и ишемическая болезнь сердца: проспективное исследование случай-контроль». Ланцет . 1 (8019): 965–968. дои : 10.1016/s0140-6736(77)92274-7 . ПМИД 67464 . S2CID 140204202 .
- ^ Кандуч А.А., Чен Х.В., Хейнигер Х.Дж. (август 1978 г.). «Биологическая активность некоторых кислородсодержащих стеринов». Наука . 201 (4355): 498–501. Бибкод : 1978Sci...201..498K . дои : 10.1126/science.663671 . ПМИД 663671 .
- ^ Рассел Д.В. (декабрь 2000 г.). «Ферменты биосинтеза оксистерола». Biochimica et Biophysical Acta (BBA) - Молекулярная и клеточная биология липидов . 1529 (1–3): 126–35. дои : 10.1016/S1388-1981(00)00142-6 . ПМИД 11111082 .
- ^ Ханукоглу I, Джеффкоат CR (1980). «Отделение прегненолона от холестерина с помощью мини-колонок Sephadex LH-20» . Журнал хроматографии А. 190 (1): 256–262. дои : 10.1016/S0021-9673(00)85545-4 .
- ^ Джавитт Н.Б. (декабрь 1994 г.). «Синтез желчных кислот из холестерина: регуляторные и вспомогательные пути» . Журнал ФАСЭБ . 8 (15): 1308–1311. дои : 10.1096/fasebj.8.15.8001744 . ПМИД 8001744 . S2CID 20302590 .
- ^ Волкофф А.В., Коэн Д.Е. (февраль 2003 г.). «Регуляция желчных кислот в физиологии печени: I. Транспорт желчных кислот гепатоцитами». Американский журнал физиологии. Физиология желудочно-кишечного тракта и печени . 284 (2): G175–G179. дои : 10.1152/ajpgi.00409.2002 . ПМИД 12529265 .
- ^ Маршалл Х.У., Эйнарссон К. (июнь 2007 г.). «Желчнокаменная болезнь» . Журнал внутренней медицины . 261 (6): 529–542. дои : 10.1111/j.1365-2796.2007.01783.x . ПМИД 17547709 . S2CID 8609639 .
- ^ Випперман М.Ф., Сэмпсон Н.С., Томас С.Т. (2014). «Патоген оидной ярости: утилизация холестерина микобактериями туберкулеза» . Критические обзоры по биохимии и молекулярной биологии . 49 (4): 269–293. дои : 10.3109/10409238.2014.895700 . ПМЦ 4255906 . ПМИД 24611808 .
- ^ Томас С.Т., Сэмпсон Н.С. (апрель 2013 г.). «Микобактерия туберкулеза использует уникальную гетеротетрамерную структуру для дегидрирования боковой цепи холестерина» . Биохимия . 52 (17): 2895–2904. дои : 10.1021/bi4002979 . ПМЦ 3726044 . ПМИД 23560677 .
- ^ Випперман М.Ф., Ян М., Томас С.Т., Сэмпсон Н.С. (октябрь 2013 г.). «Сокращение протеома FadE микобактерии туберкулеза: понимание метаболизма холестерина посредством идентификации семейства гетеротетрамерных ацил-коэнзимов А-дегидрогеназ α2β2» . Журнал бактериологии . 195 (19): 4331–4341. дои : 10.1128/JB.00502-13 . ПМЦ 3807453 . ПМИД 23836861 .
- ^ Кристи WW (2003). Липидный анализ: выделение, разделение, идентификация и структурный анализ липидов . Эйр, Шотландия: Oily Press. ISBN 978-0-9531949-5-7 . [ нужна страница ]
- ^ Jump up to: а б «Содержание холестерина в пищевых продуктах, порядок ранжирования на 100 г; В: Базы данных о составе пищевых продуктов Министерства сельского хозяйства США» . Министерство сельского хозяйства США. 2019 . Проверено 4 марта 2019 г. [ мертвая ссылка ]
- ^ Дженсен Р.Г., Хагерти М.М., МакМахон К.Е. (июнь 1978 г.). «Липиды женского молока и детских смесей: обзор» . Американский журнал клинического питания . 31 (6): 990–1016. дои : 10.1093/ajcn/31.6.990 . ПМИД 352132 .
- ^ Сонаване П.Д., Поллиер Дж., Панда С., Шимански Дж., Массалья Х., Йона М. и др. (декабрь 2016 г.). «Путь биосинтеза растительного холестерина перекрывается с метаболизмом фитостеринов». Природные растения . 3 (1): 16205. doi : 10.1038/nplants.2016.205 . ПМИД 28005066 . S2CID 5518449 .
- ^ Де Смет Э., Менсинк Р.П., Плат Дж. (июль 2012 г.). «Влияние растительных стеринов и станолов на метаболизм холестерина в кишечнике: предполагаемые механизмы из прошлого в настоящее». Молекулярное питание и пищевые исследования . 56 (7): 1058–1072. дои : 10.1002/mnfr.201100722 . ПМИД 22623436 .
- ^ Европейское управление по безопасности пищевых продуктов, журнал (2010). «Научное мнение об обосновании утверждений о пользе растительных стеролов и станолов для здоровья и поддержании нормальной концентрации холестерина в крови» .
- ^ «Руководство по питанию на 2015–2020 годы | health.gov» . Health.gov.ua . Проверено 23 августа 2023 г.
- ^ Карсон Дж.А., Лихтенштейн А.Х., Андерсон К.А., Аппель Л.Дж., Крис-Этертон П.М., Мейер К.А. и др. (январь 2020 г.). «Диетический холестерин и сердечно-сосудистый риск: научные рекомендации Американской кардиологической ассоциации» . Тираж . 141 (3): e39–e53. doi : 10.1161/CIR.0000000000000743 . PMID 31838890 .
- ^ Сакс Ф.М., Лихтенштейн А.Х., Ву Дж.Х., Аппель Л.Дж., Крегер М.А., Крис-Этертон П.М. и др. (июль 2017 г.). «Диетические жиры и сердечно-сосудистые заболевания: президентские рекомендации Американской кардиологической ассоциации» . Тираж . 136 (3): е1–е23. doi : 10.1161/CIR.0000000000000510 . ПМИД 28620111 . S2CID 367602 .
- ^ Рас РТ, Гелейнсе Дж.М., Траутвейн Э.А. (июль 2014 г.). «Эффект растительных стеролов и станолов на снижение уровня ЛПНП-холестерина в разных диапазонах доз: метаанализ рандомизированных контролируемых исследований» . Британский журнал питания . 112 (2): 214–219. дои : 10.1017/S0007114514000750 . ПМК 4071994 . ПМИД 24780090 .
- ^ Вайнгертнер О, Бём М, Лауфс У (февраль 2009 г.). «Спорная роль эфиров растительных стеринов в лечении гиперхолестеринемии» . Европейский кардиологический журнал . 30 (4): 404–409. doi : 10.1093/eurheartj/ehn580 . ПМЦ 2642922 . ПМИД 19158117 .
- ^ «Еще больше доказательств средиземноморской диеты» . Министерство здравоохранения (Великобритания), NHS Choices . 8 марта 2011 г. Архивировано из оригинала 29 октября 2020 г. . Проверено 11 ноября 2015 г.
- ^ Даррингтон П. (август 2003 г.). «Дислипидемия». Ланцет . 362 (9385): 717–731. дои : 10.1016/S0140-6736(03)14234-1 . ПМИД 12957096 . S2CID 208792416 .
- ^ Jump up to: а б Левингтон С., Уитлок Дж., Кларк Р., Шерликер П., Эмберсон Дж., Хэлси Дж. и др. (декабрь 2007 г.). «Холестерен в крови и сосудистая смертность по возрасту, полу и артериальному давлению: метаанализ отдельных данных 61 проспективного исследования с 55 000 случаев смерти от сосудов». Ланцет . 370 (9602): 1829–1839. дои : 10.1016/S0140-6736(07)61778-4 . ПМИД 18061058 . S2CID 54293528 .
- ^ «Выявление, оценка и лечение повышенного уровня холестерина в крови у взрослых (Группа лечения взрослых III) Итоговый отчет» (PDF) . Национальные институты здравоохранения. Национальный институт сердца, легких и крови. 1 сентября 2002 года . Проверено 27 октября 2008 г.
- ^ ван дер Стеег В.А., Холм И., Боехолдт С.М., Ларсен М.Л., Линдал С., Строес Е.С. и др. (февраль 2008 г.). «Холестерин липопротеинов высокой плотности, размер частиц липопротеинов высокой плотности и аполипопротеин AI: значение для сердечно-сосудистого риска: исследования IDEAL и EPIC-Норфолк». Журнал Американского колледжа кардиологов . 51 (6): 634–642. дои : 10.1016/j.jacc.2007.09.060 . ПМИД 18261682 .
- ^ Робинсон Дж.Г., Ван С., Джейкобсон Т.А. (ноябрь 2012 г.). «Метаанализ сравнения эффективности снижения аполипопротеина B по сравнению с холестерином липопротеинов низкой плотности и холестерина липопротеинов низкой плотности для снижения сердечно-сосудистого риска в рандомизированных исследованиях». Американский журнал кардиологии . 110 (10): 1468–1476. дои : 10.1016/j.amjcard.2012.07.007 . ПМИД 22906895 .
- ^ Акиоямен Л.Е., Дженест Дж., Шан С.Д., Рил Р.Л., Альбаум Дж.М., Чу А., Ту Дж.В. (сентябрь 2017 г.). «Оценка распространенности гетерозиготной семейной гиперхолестеринемии: систематический обзор и метаанализ» . БМЖ Опен . 7 (9): e016461. doi : 10.1136/bmjopen-2017-016461 . ПМЦ 5588988 . ПМИД 28864697 .
- ^ «Семейная гиперхолестеринемия (СГ)» . www.heart.org . Проверено 2 августа 2019 г.
- ^ Jump up to: а б «Профилактика и лечение высокого уровня холестерина (гиперлипидемии)» . Американская кардиологическая ассоциация. 2023 . Проверено 23 августа 2023 г.
- ^ «Холестерин: лучшие продукты для улучшения показателей» . Клиника Майо. 2023 . Проверено 23 августа 2023 г.
- ^ Национальный институт здравоохранения и клинического мастерства . Клиническое руководство 67: Модификация липидов . Лондон, 2008.
- ^ Манну Г.С., Заман М.Дж., Гупта А., Рехман Х.У., Мьинт П.К. (октябрь 2012 г.). «Обновленная информация о рекомендациях по лечению гиперхолестеринемии». Экспертный обзор сердечно-сосудистой терапии . 10 (10): 1239–1249. дои : 10.1586/erc.12.94 . ПМИД 23190064 . S2CID 5451203 .
- ^ Кайзер Дж.Р., Мадиас С., Вилнер Б., Воан С.Дж., Мушлин А.И., Трушин П. и др. (май 2010 г.). «Связь различных показателей холестерина липопротеинов низкой плотности с риском ишемической болезни сердца и смерти в мета-регрессионном анализе крупномасштабных исследований терапии статинами» . Американский журнал кардиологии . 105 (9): 1289–1296. дои : 10.1016/j.amjcard.2009.12.051 . ПМЦ 2917836 . ПМИД 20403481 .
- ^ Гранди С.М., Стоун Нью-Джерси, Бейли А.Л., Бим С., Биртчер К.К., Блюменталь Р.С. и др. (июнь 2019 г.). «Руководство AHA/ACC/AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA 2018 года по контролю уровня холестерина в крови: отчет Американского колледжа кардиологов/Специальной группы Американской кардиологической ассоциации по клинической практике» Рекомендации» . Тираж . 139 (25): е1082–е1143. doi : 10.1161/CIR.0000000000000625 . ПМК 7403606 . ПМИД 30586774 .
- ^ Николлс С.Дж. (август 2008 г.). «Розувастатин и прогрессирование атеросклероза». Экспертный обзор сердечно-сосудистой терапии . 6 (7): 925–933. дои : 10.1586/14779072.6.7.925 . ПМИД 18666843 . S2CID 46419583 .
- ^ Совместная группа по исследованию защиты сердца (июль 2002 г.). «Исследование MRC/BHF Heart Protection по снижению уровня холестерина с помощью симвастатина у 20 536 лиц из группы высокого риска: рандомизированное плацебо-контролируемое исследование». Ланцет . 360 (9326): 7–22. дои : 10.1016/S0140-6736(02)09327-3 . ПМИД 12114036 . S2CID 35836642 .
- ^ Шепард Дж., Кобб С.М., Форд И., Айлс К.Г., Лоример А.Р., Макфарлейн П.В. и др. (ноябрь 1995 г.). «Профилактика ишемической болезни сердца с помощью правастатина у мужчин с гиперхолестеринемией. Исследовательская группа по профилактике ишемической болезни сердца Западной Шотландии» . Медицинский журнал Новой Англии . 333 (20): 1301–1307. дои : 10.1056/NEJM199511163332001 . ПМИД 7566020 .
- ^ Гранди СМ (май 2007 г.). «Следует ли предлагать женщинам препараты, снижающие уровень холестерина, для профилактики сердечно-сосудистых заболеваний? Да» . БМЖ . 334 (7601): 982. doi : 10.1136/bmj.39202.399942.AD . ПМЦ 1867899 . ПМИД 17494017 .
- ^ Кендрик М. (май 2007 г.). «Следует ли предлагать женщинам препараты, снижающие уровень холестерина, для предотвращения сердечно-сосудистых заболеваний? Нет» . БМЖ . 334 (7601): 983. doi : 10.1136/bmj.39202.397488.AD . ПМЦ 1867901 . ПМИД 17494018 .
- ^ Бругтс Дж.Дж., Йетгин Т., Хукс С.Е., Готто А.М., Шепард Дж., Вестендорп Р.Г. и др. (июнь 2009 г.). «Преимущества статинов у людей без установленных сердечно-сосудистых заболеваний, но с факторами риска сердечно-сосудистых заболеваний: метаанализ рандомизированных контролируемых исследований» . БМЖ . 338 : b2376. дои : 10.1136/bmj.b2376 . ПМК 2714690 . ПМИД 19567909 .
- ^ «Отчет экспертной группы Национальной образовательной программы по холестерину по выявлению, оценке и лечению повышенного уровня холестерина в крови у взрослых. Экспертная группа». Архив внутренней медицины . 148 (1): 36–69. Январь 1988 г. doi : 10.1001/archinte.148.1.36 . ПМИД 3422148 .
- ^ Аленгат Ф.Дж., Дэвис А.М. (февраль 2019 г.). «Управление холестерином в крови» . ДЖАМА . 321 (8): 800–801. дои : 10.1001/jama.2019.0015 . ПМК 6679800 . ПМИД 30715135 .
- ^ «Глобальные оценки тенденций среднего общего уровня холестерина» . Всемирная организация здравоохранения . Проверено 27 апреля 2024 г.
- ^ «Как проверить уровень холестерина» . Американская кардиологическая ассоциация. 2023 . Проверено 23 августа 2023 г.
- ^ «О холестерине» . Центры США по контролю и профилактике заболеваний. 20 марта 2023 г. Проверено 23 августа 2023 г.
- ^ Уорник Г.Р., Кнопп Р.Х., Фитцпатрик В., Брэнсон Л. (январь 1990 г.). «Оценка холестерина липопротеинов низкой плотности по уравнению Фридевальда достаточна для классификации пациентов на основе рекомендуемых на национальном уровне пороговых значений» . Клиническая химия . 36 (1): 15–19. дои : 10.1093/клинчем/36.1.15 . ПМИД 2297909 .
- ^ Андерсон К.М., Кастелли В.П., Леви Д. (24 апреля 1987 г.). «Холестерин и смертность. 30 лет наблюдения во Фрамингемском исследовании» . ДЖАМА . 257 (16): 2176–2180. дои : 10.1001/jama.1987.03390160062027 . ПМИД 3560398 .
- ^ Улмер Х., Келлехер С., Дием Г., Концин Х. (2004). «Почему Ева не Адам: проспективное наблюдение за 149 650 женщинами и мужчинами по уровню холестерина и другим факторам риска, связанным с сердечно-сосудистой смертностью и смертностью от всех причин». Журнал женского здоровья . 13 (1): 41–53. дои : 10.1089/154099904322836447 . ПМИД 15006277 .
- ^ Ризос К.В., Элисаф М.С., Либеропулос Э.Н. (24 февраля 2011 г.). «Влияние дисфункции щитовидной железы на липидный профиль» . Открытый журнал сердечно-сосудистой медицины . 5 (1): 76–84. дои : 10.2174/1874192401105010076 . ПМК 3109527 . ПМИД 21660244 .
- ^ «Как проверить уровень холестерина» . Американская кардиологическая ассоциация . Проверено 10 июля 2013 г.
- ^ Jump up to: а б с д и «Тест на холестерин» . Клиника Майо. 15 мая 2021 г. Проверено 2 сентября 2023 г.
- ^ Стоун, Нью-Джерси, Робинсон Дж., Гофф, округ Колумбия (2013). «Ознакомление с Руководством» . Американский колледж кардиологии. Архивировано из оригинала 7 июля 2014 года . Проверено 2 апреля 2014 г.
- ^ Вестовер Э.Дж., Кови Д.Ф., Брокман Х.Л., Браун Р.Э., Пайк Л.Дж. (декабрь 2003 г.). «Истощение холестерина приводит к сайт-специфическому увеличению фосфорилирования рецепторов эпидермального фактора роста из-за эффектов на мембранном уровне. Исследования энантиомеров холестерина» . Журнал биологической химии . 278 (51): 51125–51133. дои : 10.1074/jbc.M304332200 . ПМЦ 2593805 . ПМИД 14530278 .
- ^ Кристиана И., Луу В., Стивенсон Дж., Картланд С., Джессап В., Белани Дж.Д. и др. (сентябрь 2012 г.). «Холестерин зазеркальем: способность его энантиомера также вызывать гомеостатические реакции» . Журнал биологической химии . 287 (40): 33897–33904. дои : 10.1074/jbc.M112.360537 . ПМК 3460484 . ПМИД 22869373 .
Внешние ссылки
[ редактировать ] СМИ, связанные с холестерином, на Викискладе?
СМИ, связанные с холестерином, на Викискладе?