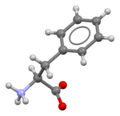
Фенилаланин
 Скелетная формула L - фенилаланина
| |||
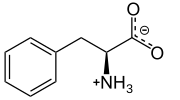 L -фенилаланин при физиологическом pH
| |||
| |||
| Имена | |||
|---|---|---|---|
| Произношение | США : / ˌ f ɛ n əl ˈ æ l ə n iː n / ; Великобритания : / ˌ f iː n aɪ l -/ | ||
| Название ИЮПАК
Фенилаланин
| |||
| Систематическое название ИЮПАК
( S )-2-амино-3-фенилпропановая кислота | |||
| Идентификаторы | |||
3D model ( JSmol )
|
|||
| КЭБ |
| ||
| ХЭМБЛ |
| ||
| ХимическийПаук | |||
| Лекарственный Банк |
| ||
| Информационная карта ECHA | 100.000.517 | ||
| |||
| КЕГГ |
| ||
ПабХим CID
|
|||
| НЕКОТОРЫЙ |
| ||
Панель управления CompTox ( EPA )
|
|||
| Характеристики | |||
| С 9 Н 11 Н О 2 | |||
| Молярная масса | 165.192 g·mol −1 | ||
| 9,97 г/л при 0 °C 14,11 г/л при 25 °C | |||
| Кислотность ( pKa ) | 1,83 (карбоксил), 9,13 (амино) [ 2 ] | ||
| Опасности | |||
| NFPA 704 (огненный алмаз) | |||
| Страница дополнительных данных | |||
| Фенилаланин (страница данных) | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |||
Фенилаланин (символ Phe или F ) [ 3 ] незаменимая α аминокислота формулы C -
99Ч
11 НЕТ
2 . Его можно рассматривать как бензильную группу, , или фенильную группу замещающую метильную группу аланина вместо концевого водорода аланина. Эта незаменимая аминокислота классифицируется как нейтральная и неполярная из-за инертной и гидрофобной природы бензильной боковой цепи. L , -изомер используется для биохимического образования белков кодируемых ДНК . Фенилаланин является предшественником тирозина , моноаминовых нейротрансмиттеров дофамина , норадреналина (норадреналина) и адреналина (адреналина), а также биологического пигмента меланина . Он кодируется кодонами информационной РНК UUU и UUC.
Фенилаланин естественным образом содержится в молоке млекопитающих . Он используется при производстве продуктов питания и напитков и продается в качестве пищевой добавки, поскольку является прямым предшественником нейромодулятора фенэтиламина . Являясь незаменимой аминокислотой, фенилаланин не синтезируется de novo у людей и других животных, которым приходится потреблять фенилаланин или содержащие фенилаланин белки.
Однобуквенный символ F был присвоен фенилаланину из-за его фонетического сходства. [ 4 ]
История
[ редактировать ]Первое описание фенилаланина было сделано в 1879 году, когда Шульце и Барбьери идентифицировали соединение с брутто-формулой C 9 H 11 NO 2 в проростках люпина желтого ( Lupinus luteus ). В 1882 году Эрленмейер и Липп впервые синтезировали фенилаланин из фенилацетальдегида , цианистого водорода и аммиака . [ 5 ] [ 6 ]
Генетический кодон фенилаланина был впервые обнаружен Дж. Генрихом Маттеем и Маршаллом В. Ниренбергом в 1961 году. Они показали, что, используя мРНК для вставки нескольких повторов урацила в геном бактерии , E. coli они могут заставить бактерию производить полипептид, состоящий исключительно из повторяющихся аминокислот фенилаланина. Это открытие помогло установить природу кодирующих отношений, которые связывают информацию, хранящуюся в геномной нуклеиновой кислоте, с экспрессией белка в живой клетке.
Диетические источники
[ редактировать ]Хорошими источниками фенилаланина являются яйца, курица, печень, говядина, молоко и соевые бобы. [ 7 ] Другим распространенным источником фенилаланина является все, что подслащено искусственным подсластителем аспартамом , например, диетические напитки , диетические продукты и лекарства; соединения метаболизм аспартама приводит к образованию фенилаланина как одного из метаболитов . [ 8 ]
Диетические рекомендации
[ редактировать ]Совет по продовольствию и питанию (FNB) Медицинского института США установил рекомендуемые диетические нормы (RDA) для незаменимых аминокислот в 2002 году. Для фенилаланина плюс тирозин для взрослых 19 лет и старше — 33 мг/кг массы тела в день. [ 9 ] В 2005 году DRI установлена на уровне 27 мг/кг в день (без тирозина), рекомендация ФАО / ВОЗ / УООН от 2007 года составляет 25 мг/кг в день (без тирозина). [ 10 ]
Другие биологические роли
[ редактировать ]L -фенилаланин биологически превращается в L - тирозин , еще одну аминокислоту, кодируемую ДНК. L -тирозин, в свою очередь, превращается в L -ДОФА , которая далее превращается в дофамин , норадреналин (норадреналин) и адреналин (адреналин). Последние три известны как катехоламины .
Фенилаланин использует тот же активный транспортный канал, что и триптофан, для преодоления гематоэнцефалического барьера . В чрезмерных количествах добавки могут мешать выработке серотонина и других ароматических аминокислот. [ 11 ] а также оксид азота из-за чрезмерного использования (в конечном итоге ограниченной доступности) связанных кофакторов, железа или тетрагидробиоптерина . [ нужна ссылка ] Соответствующими ферментами для этих соединений являются семейство гидроксилаз ароматических аминокислот и синтаза оксида азота .
В растениях
[ редактировать ]Фенилаланин является исходным соединением, используемым синтезе флавоноидов в . Лигнан является производным фенилаланина и тирозина . Фенилаланин превращается в коричную кислоту под действием фермента фенилаланинаммиаклиазы . [ 15 ]
Биосинтез
[ редактировать ]Фенилаланин биосинтезируется по шикиматному пути .
Фенилкетонурия
[ редактировать ]Генетическое заболевание фенилкетонурия (ФКУ) представляет собой неспособность метаболизировать фенилаланин из-за отсутствия фермента фенилаланингидроксилазы . Лица с этим расстройством известны как «фенилкетонурики», и им необходимо регулировать потребление фенилаланина. Пациенты с фенилкетонурией часто используют анализы крови для контроля количества фенилаланина в крови. Результаты лабораторных исследований могут указывать на уровни фенилаланина в мг/дл или мкмоль/л. Один мг/дл фенилаланина примерно эквивалентен 60 мкмоль/л.
(Редкая) «вариантная форма» фенилкетонурии, называемая гиперфенилаланинемией, вызвана неспособностью синтезировать кофактор , называемый тетрагидробиоптерином , который можно дополнять. У беременных женщин с гиперфенилаланинемией могут проявляться сходные симптомы заболевания (высокий уровень фенилаланина в крови), но эти показатели обычно исчезают в конце беременности. Беременные женщины с фенилкетонурией должны контролировать уровень фенилаланина в крови, даже если плод гетерозиготен по дефектному гену, поскольку на плод может отрицательно повлиять незрелость печени. [ нужна медицинская ссылка ]
Непищевым источником фенилаланина является искусственный подсластитель аспартам . Это соединение метаболизируется в организме с образованием нескольких химических побочных продуктов, включая фенилаланин. Проблемы распада фенилкетонуриков, связанные с накоплением фенилаланина в организме, также возникают при приеме аспартама, хотя и в меньшей степени. Соответственно, все продукты в Австралии, США и Канаде, содержащие аспартам, должны иметь маркировку: «Фенилкетонурия: содержит фенилаланин». В Великобритании на продуктах, содержащих аспартам, должны быть указаны ингредиенты, на которых указано наличие «аспартама или E951». [ 16 ] и на них должно быть предупреждение: «Содержит источник фенилаланина». В Бразилии маркировка «Contém Fenilalanina» (по-португальски «Содержит фенилаланин») также обязательна для продуктов, содержащих его. Эти предупреждения помещены, чтобы помочь людям избегать таких продуктов.
D- , L- и DL -фенилаланин
[ редактировать ]Стереоизомер энантиомера D -фенилаланин (ДФА) может быть получен обычным органическим синтезом либо в виде отдельного , либо в виде компонента рацемической смеси. Он не участвует в биосинтезе белков, хотя в небольших количествах обнаруживается в белках, особенно в старых белках и пищевых белках, подвергшихся обработке . Биологические функции D -аминокислот остаются неясными, хотя D -фенилаланин обладает фармакологической активностью в отношении ниацинового рецептора 2 . [ 17 ]
DL -фенилаланин (DLPA) продается как пищевая добавка из-за предполагаемого обезболивающего и антидепрессивного действия, подтвержденного клиническими испытаниями. [ 18 ] [ 19 ] [ 20 ] DL -фенилаланин представляет собой смесь D -фенилаланина и L -фенилаланина. Предполагаемая анальгетическая активность DL -фенилаланина может быть объяснена возможной блокировкой D фенилаланином энкефалина расщепления ферментом карбоксипептидазой А. - [ 21 ] [ 22 ] Энкефалины действуют как агонисты мю- и дельта -опиоидных рецепторов , а агонисты этих рецепторов, как известно, оказывают антидепрессивное действие. [ 23 ] Механизм предполагаемой антидепрессивной активности DL -фенилаланина также можно частично объяснить ролью L предшественника - фенилаланина в синтезе нейротрансмиттеров норадреналина и дофамина , хотя клинические испытания не обнаружили антидепрессивного эффекта только от L -фенилаланина. [ 18 ] Считается, что повышенный уровень норадреналина и дофамина в мозге оказывает антидепрессивное действие. D -Фенилаланин всасывается из тонкого кишечника и транспортируется в печень через портальное кровообращение . Небольшое количество D -фенилаланина, по-видимому, превращается в L -фенилаланин. D -Фенилаланин распределяется по различным тканям организма через системный кровоток . По-видимому, он преодолевает гематоэнцефалический барьер менее эффективно, чем L -фенилаланин, поэтому небольшое количество принятой внутрь дозы D -фенилаланина выводится с мочой, не проникая в центральную нервную систему. [ 24 ]
L -фенилаланин является антагонистом α 2 δ Ca. 2+ кальциевые каналы с K i 980 нМ. [ 25 ]
В мозге L -фенилаланин является конкурентным антагонистом участка глицина связывания рецептора NMDA. [ 26 ] и в глутамата сайте связывания рецептора AMPA . [ 27 ] В глицина сайте связывания рецептора NMDA L -фенилаланин имеет кажущуюся равновесную константу диссоциации (K B ) 573 мкМ, оцененную с помощью регрессии Шильда. [ 28 ] что значительно ниже концентрации L -фенилаланина в мозге, наблюдаемой при нелеченной фенилкетонурии человека . [ 29 ] L -фенилаланин также ингибирует высвобождение нейромедиатора в глутаматергических синапсах в гиппокампе и коре головного мозга с IC 50 , равной 980 мкМ, концентрация в мозге, наблюдаемая при классической фенилкетонурии , тогда как D -фенилаланин оказывает значительно меньший эффект. [ 27 ]
Коммерческий синтез
[ редактировать ]L -фенилаланин производится в больших количествах для медицинских, кормовых и пищевых целей, таких как аспартам , с использованием бактерии Escherichia coli , которая естественным образом производит ароматические аминокислоты, такие как фенилаланин. Количество L -фенилаланина, производимого в коммерческих целях, было увеличено с помощью генной инженерии E. coli , например, путем изменения регуляторных промоторов или амплификации числа генов, контролирующих ферменты, ответственные за синтез аминокислоты. [ 30 ]
Производные
[ редактировать ]Боронофенилаланин (БФА) представляет собой дигидроксиборильное производное фенилаланина, используемое в нейтронозахватной терапии .
4-Азидо- L -фенилаланин представляет собой встроенную в белок неприродную аминокислоту, используемую в качестве инструмента для биоконъюгации в области химической биологии .
Ссылки
[ редактировать ]- ^ Перейти обратно: а б Ихлефельдт Ф.С., Петтерсен Ф.Б., фон Бонин А., Завадска М., Гёрбиц ПК (2014). «Полиморфы L-фенилаланина». Энджью. хим. Эд. 53 (49): 13600–13604. дои : 10.1002/anie.201406886 . ПМИД 25336255 .
- ^ Доусон Р.М. и др. (1959). Данные для биохимических исследований . Оксфорд: Кларендон Пресс.
- ^ «Номенклатура и символика аминокислот и пептидов» . Совместная комиссия IUPAC-IUB по биохимической номенклатуре. 1983. Архивировано из оригинала 9 октября 2008 года . Проверено 5 марта 2018 г.
- ^ «Комиссия IUPAC-IUB по биохимической номенклатуре. Однобуквенное обозначение аминокислотных последовательностей» . Журнал биологической химии . 243 (13): 3557–3559. 10 июля 1968 г. doi : 10.1016/S0021-9258(19)34176-6 .
- ^ Торп Т.Э. (1913). Словарь прикладной химии . Лонгманс, Грин и Ко, стр 191–193 . . Проверено 4 июня 2012 г.
- ^ Плиммер Р.Х. (1912) [1908]. Пламмер Р.Х., Хопкинс Ф.Г. (ред.). Химический состав белков . Монографии по биохимии. Том. Часть I. Анализ (2-е изд.). Лондон: Longmans, Green and Co., стр. 93–97 . Проверено 4 июня 2012 г.
- ^ Росс Х.М., Рот Дж. (1 апреля 1991 г.). Диета для контроля настроения: 21 день, чтобы победить депрессию и усталость . Саймон и Шустер. п. 59. ИСБН 978-0-13-590449-7 .
- ^ Зерацкий К. «Фенилаланин в диетической газировке: вреден ли он?» . Клиника Мэйо . Проверено 30 апреля 2019 г.
- ^ Медицинский институт (2002). «Белки и аминокислоты» . Справочная норма потребления энергии, углеводов, клетчатки, жиров, жирных кислот, холестерина, белков и аминокислот . Вашингтон, округ Колумбия: Издательство национальных академий. стр. 589–768. дои : 10.17226/10490 . ISBN 978-0-309-08525-0 .
- ^ Эланго Р., Болл Р.О., Пенчарц П.Б. (август 2012 г.). «Последние достижения в определении потребности человека в белках и аминокислотах» . Британский журнал питания . 108 (С2): С22–С30. дои : 10.1017/S0007114512002504 . ISSN 0007-1145 . ПМИД 23107531 .
- ^ Эрикссон Ю.Г., Гуццарди М.А., Иоццо П., Каянтие Э., Каутиайнен Х., Салонен М.К. (01.01.2017). «Более высокая концентрация фенилаланина в сыворотке связана с более быстрым укорочением теломер у мужчин» . Американский журнал клинического питания . 105 (1): 144–150. дои : 10.3945/ajcn.116.130468 . ISSN 0002-9165 . ПМИД 27881392 .
- ^ Бродли К.Дж. (март 2010 г.). «Сосудистые эффекты следовых аминов и амфетаминов». Фармакология и терапия . 125 (3): 363–375. doi : 10.1016/j.pharmthera.2009.11.005 . ПМИД 19948186 .
- ^ Линдеманн Л., Хонер MC (май 2005 г.). «Ренессанс следовых аминов, вдохновленный новым семейством GPCR». Тенденции в фармакологических науках . 26 (5): 274–281. дои : 10.1016/j.tips.2005.03.007 . ПМИД 15860375 .
- ^ Ван X, Ли Дж, Донг Дж, Юэ Дж (февраль 2014 г.). «Эндогенные субстраты CYP2D мозга». Европейский журнал фармакологии . 724 : 211–218. дои : 10.1016/j.ejphar.2013.12.025 . ПМИД 24374199 .
- ^ Нельсон Д.Л., Кокс М.М. (2000). Ленинджер, Принципы биохимии (3-е изд.). Нью-Йорк: Стоит публикации. ISBN 1-57259-153-6 .
- ^ «Аспартам» . Великобритания: Агентство по пищевым стандартам. Архивировано из оригинала 21 февраля 2012 г. Проверено 19 июня 2007 г.
- ^ «D-Фенилаланин: Биологическая активность» . Руководство IUPHAR/BPS по ФАРМАКОЛОГИИ . Проверено 27 декабря 2018 г.
- ^ Перейти обратно: а б Вуд Д.Р., Раймхерр Ф.В., Вендер П.Х. (1985). «Лечение синдрома дефицита внимания DL-фенилаланином». Психиатрические исследования . 16 (1). Эльзевир Б.В.: 21–26. дои : 10.1016/0165-1781(85)90024-1 . ISSN 0165-1781 . ПМИД 3903813 . S2CID 3077060 .
- ^ Бекманн Х., Штраус М.А., Людольф Э. (1977). «DL-Фенилаланин у пациентов с депрессией: открытое исследование». Журнал нейронной передачи . 41 (2–3). ООО «Спрингер Сайенс энд Бизнес Медиа»: 123–134. дои : 10.1007/bf01670277 . ISSN 0300-9564 . ПМИД 335027 . S2CID 5849451 .
- ^ Бекманн Х., Афины Д., Олтяну М., Циммер Р. (1979). «DL-фенилаланин по сравнению с имипрамином: двойное слепое контролируемое исследование». Архив психиатрии и нервных болезней . 227 (1). ООО «Спрингер Сайенс и Бизнес Медиа»: 49-58. дои : 10.1007/bf00585677 . ISSN 0003-9373 . ПМИД 387000 . S2CID 23531579 .
- ^ «Д-Фенилаланин: Клинические данные» . Руководство IUPHAR/BPS по ФАРМАКОЛОГИИ . Проверено 27 декабря 2018 г.
- ^ Кристиансон Д.В. , Мангани С., Шохам Дж., Липскомб В.Н. (август 1989 г.). «Связывание D-фенилаланина и D-тирозина с карбоксипептидазой А» (PDF) . Журнал биологической химии . 264 (22): 12849–12853. дои : 10.1016/S0021-9258(18)51564-7 . ПМИД 2568989 .
- ^ Джелен Л.А., Стоун Дж.М., Янг А.Х., Мехта М.А. (2022). «Опиоидная система при депрессии» . Неврологические и биоповеденческие обзоры . 140 . Elsevier BV: 104800. doi : 10.1016/j.neubiorev.2022.104800 . ISSN 0149-7634 . ПМЦ 10166717 . ПМИД 35914624 . S2CID 251163234 .
- ^ Леманн В.Д., Теобальд Н., Фишер Р., Генрих Х.К. (14 марта 1983 г.). «Стереоспецифичность кинетики и гидроксилирования фенилаланина в плазме у человека после перорального применения меченной стабильными изотопами псевдорацемической смеси L- и D-фенилаланина». Клиника Химика Акта; Международный журнал клинической химии . 128 (2–3): 181–198. дои : 10.1016/0009-8981(83)90319-4 . ISSN 0009-8981 . ПМИД 6851137 .
- ^ Мортелл К.Х., Андерсон Д.Д., Линч Дж.Дж., Нельсон С.Л., Саррис К., Макдональд Х. и др. (март 2006 г.). «Взаимосвязь между структурой и активностью альфа-аминокислотных лигандов субъединицы альфа2дельта потенциалзависимых кальциевых каналов». Письма по биоорганической и медицинской химии . 16 (5): 1138–4111. дои : 10.1016/j.bmcl.2005.11.108 . ПМИД 16380257 .
- ^ Глушаков А.В., Деннис Д.М., Мори Т.Е., Самнерс С., Куккьяра Р.Ф., Зойберт К.Н. и др. (2002). «Специфическое ингибирование функции рецептора N -метил-D-аспартата в нейронах гиппокампа крысы L-фенилаланином в концентрациях, наблюдаемых при фенилкетонурии» . Молекулярная психиатрия . 7 (4): 359–367. дои : 10.1038/sj.mp.4000976 . ПМИД 11986979 .
- ^ Перейти обратно: а б Глушаков А.В., Деннис Д.М., Самнерс С., Зойберт К.Н., Мартынюк А.Е. (апрель 2003 г.). «L-фенилаланин избирательно подавляет токи в глутаматергических возбуждающих синапсах». Журнал нейробиологических исследований . 72 (1): 116–124. дои : 10.1002/jnr.10569 . ПМИД 12645085 . S2CID 42087834 .
- ^ Глушаков А.В., Глушакова О., Варшни М., Байпай Л.К., Самнерс С., Лайпис П.Дж. и др. (февраль 2005 г.). «Длительные изменения глутаматергической синаптической передачи при фенилкетонурии» . Мозг . 128 (Часть 2): 300–307. дои : 10.1093/brain/awh354 . ПМИД 15634735 .
- ^ Мёллер Х.Э., Веглаге Дж., Бик У., Видерманн Д., Фельдманн Р., Ульрих К. (декабрь 2003 г.). «Визуализация мозга и протонная магнитно-резонансная спектроскопия у пациентов с фенилкетонурией». Педиатрия . 112 (6, ч. 2): 1580–1583. дои : 10.1542/peds.112.S4.1580 . hdl : 11858/00-001M-0000-0010-A24A-C . ПМИД 14654669 . S2CID 2198040 .
- ^ Шпренгер Г.А. (2007). «Ароматические аминокислоты». Биосинтез аминокислот: пути, регуляция и метаболическая инженерия (1-е изд.). Спрингер. стр. 106–113. ISBN 978-3-540-48595-7 .