Рецептор эстрогена
| рецептор эстрогена 1 (ER-альфа) | |||
|---|---|---|---|
 Димер лиганд-связывающей области ERα ( рендеринг PDB на основе 3erd ). | |||
| Идентификаторы | |||
| Символ | СОЭ1 | ||
| Альт. символы | ЭР-α, NR3A1 | ||
| ген NCBI | 2099 | ||
| HGNC | 3467 | ||
| МОЙ БОГ | 133430 | ||
| ПДБ | 1ЕРЕ | ||
| RefSeq | НМ_000125 | ||
| ЮниПрот | P03372 | ||
| Другие данные | |||
| Локус | 6 q24-q27 | ||
| |||
| рецептор эстрогена 2 (ER-бета) | |||
|---|---|---|---|
 Димер лиганд-связывающей области ERβ ( рендеринг PDB на основе 1u3s ). | |||
| Идентификаторы | |||
| Символ | СОЭ2 | ||
| Альт. символы | ER-β, NR3A2 | ||
| ген NCBI | 2100 | ||
| HGNC | 3468 | ||
| МОЙ БОГ | 601663 | ||
| ПДБ | 1QKM | ||
| RefSeq | НМ_001040275 | ||
| ЮниПрот | Q92731 | ||
| Другие данные | |||
| Локус | Хр. 14 q21-q22 | ||
| |||
Рецепторы эстрогена ( ЭР ) представляют собой группу белков , находящихся внутри клеток . Это рецепторы , которые активируются гормоном эстрогеном ( 17β -эстрадиол ). [ 1 ] Существуют два класса ER: ядерные рецепторы эстрогена ( ERα и ERβ ), которые являются членами семейства рецепторов ядерных внутриклеточных рецепторов, и мембранные рецепторы эстрогена (mER) ( GPER (GPR30), ER-X и Gq - mER ). , которые в основном представляют собой рецепторы, связанные с G-белком . В этой статье речь идет о первом (ER).
После активации эстрогеном ЭР способен перемещаться в ядро и связываться с ДНК, регулируя активность различных генов (т.е. он является ДНК-связывающим транскрипционным фактором ). Однако он также имеет дополнительные функции, независимые от связывания ДНК. [ 2 ]
В качестве гормональных рецепторов половых стероидов ( рецепторы стероидных гормонов ) ER, рецепторы андрогенов (AR) и рецепторы прогестерона (PR) играют важную роль в половом созревании и беременности .
Протеомика
[ редактировать ]Существуют две разные формы рецептора эстрогена, обычно называемые α и β , каждая из которых кодируется отдельным геном ( ESR1 и ESR2 соответственно). Гормонально-активируемые рецепторы эстрогена образуют димеры , и, поскольку эти две формы совместно экспрессируются во многих типах клеток, рецепторы могут образовывать гомодимеры ERα (αα) или ERβ (ββ) или гетеродимеры ERαβ (αβ). [ 3 ] Рецепторы эстрогена альфа и бета демонстрируют значительную общую гомологию последовательностей, и оба состоят из пяти доменов, обозначенных от A/B до F (перечислены от N-до C-конца; номера аминокислотных последовательностей относятся к ER человека). [ нужна ссылка ]
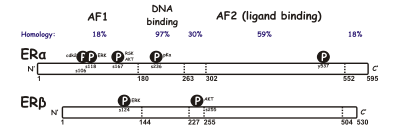
домен N-концевой A/B способен трансактивировать транскрипцию гена в отсутствие связанного лиганда (например, гормона эстрогена). Хотя эта область способна активировать транскрипцию гена без лиганда, эта активация слабая и более селективная по сравнению с активацией, обеспечиваемой доменом Е. Домен C, также известный как ДНК-связывающий домен , связывается с элементами ответа на эстроген в ДНК. Домен D представляет собой шарнирную область, соединяющую домены C и E. Домен Е содержит полость для связывания лиганда, а также сайты связывания для белков- коактиваторов и корепрессоров . Е-домен в присутствии связанного лиганда способен активировать транскрипцию гена. Функция C-концевого F-домена не совсем ясна и имеет переменную длину. [ нужна ссылка ]
|
| ||||||||||||||||||||||||||||
Известно, что благодаря альтернативному сплайсингу РНК существует несколько изоформ ЭР. Идентифицированы по крайней мере три изоформы ERα и пять изоформ ERβ. Подтипы рецепторов изоформ ERβ могут трансактивировать транскрипцию только тогда, когда образуется гетеродимер с функциональным рецептором ERβ1 массой 59 кДа. Рецептор ERß3 был обнаружен на высоких уровнях в семенниках. Две другие изоформы ERα имеют массу 36 и 46 кДа. [ 4 ] [ 5 ]
Только у рыб, но не у человека, описан рецептор ERγ. [ 6 ]
Генетика
[ редактировать ]У человека две формы рецептора эстрогена кодируются разными генами , ESR1 и ESR2 на шестой и четырнадцатой хромосоме (6q25.1 и 14q23.2) соответственно.
Распределение
[ редактировать ]Оба ЭР широко экспрессируются в разных типах тканей, однако существуют некоторые заметные различия в характере их экспрессии: [ 7 ]
- ERα клетках обнаруживается в эндометрии , рака молочной железы , стромальных клетках яичников и гипоталамусе . [ 8 ] У мужчин белок ERα обнаруживается в эпителии выносящих протоков . [ 9 ]
- Экспрессия белка ERβ была зарегистрирована в клетках гранулезы яичников , почках , головном мозге , костях , сердце , [ 10 ] легкие , кишечника слизистая оболочка , простата и эндотелиальные клетки.
ЭР считаются цитоплазматическими рецепторами в их несвязанном состоянии, но исследования визуализации показали, что лишь небольшая часть ЭР находится в цитоплазме, причем большая часть ЭР конститутивно находится в ядре. [ 11 ] Первичный транскрипт «ERα» дает начало нескольким альтернативно сплайсированным вариантам неизвестной функции. [ 12 ]
Лиганды
[ редактировать ]Агонисты
[ редактировать ]- Эндогенные эстрогены (например, эстрадиол , эстрон , эстриол , эстетрол )
- Природные эстрогены (например, конъюгированные эстрогены )
- Синтетические эстрогены (например, этинилэстрадиол , диэтилстильбэстрол )
Смешанный (агонистический и антагонистический способ действия).
[ редактировать ]- Фитоэстрогены (например, куместрол , даидзеин , генистеин , мироэстрол )
- Селективные модуляторы рецепторов эстрогена (например, тамоксифен , кломифен , ралоксифен )
Антагонисты
[ редактировать ]- Антиэстрогены (например, фулвестрант , ICI-164384 , этамокситрифетол )
Родство
[ редактировать ]Связывание и функциональная селективность
[ редактировать ]Домен спирали 12 ER играет решающую роль в определении взаимодействий с коактиваторами и корепрессорами и, следовательно, соответствующего агонистического или антагонистического эффекта лиганда. [ 13 ] [ 14 ]
Различные лиганды могут различаться по сродству к альфа- и бета-изоформам рецептора эстрогена:
- эстрадиол одинаково хорошо связывается с обоими рецепторами [ 15 ]
- Эстрон и ралоксифен преимущественно связываются с альфа-рецептором. [ 15 ]
- эстриол и генистеин к бета-рецепторам [ 15 ]
подтипа Селективные модуляторы эстрогеновых рецепторов преимущественно связываются либо с α-, либо с β-подтипом рецептора. Кроме того, различные комбинации рецепторов эстрогена могут по-разному реагировать на различные лиганды, что может выражаться в тканеселективных агонистических и антагонистических эффектах. [ 16 ] Было высказано предположение, что соотношение концентрации альфа- и бета-подтипов играет роль в некоторых заболеваниях. [ 17 ]
Концепция селективных модуляторов рецепторов эстрогена основана на способности стимулировать взаимодействие ER с различными белками, такими как транскрипции коактиваторы или корепрессоры . Более того, соотношение коактиватора и корепрессора варьируется в разных тканях. [ 18 ] Как следствие, один и тот же лиганд может быть агонистом в некоторых тканях (где преобладают коактиваторы) и антагонистом в других тканях (где доминируют корепрессоры). Тамоксифен, например, является антагонистом молочной железы и поэтому используется для рака молочной железы. лечения [ 19 ] но агонист ER в костях (тем самым предотвращая остеопороз ) и частичный агонист в эндометрии (повышающий риск рака матки ).
Преобразование сигнала
[ редактировать ]Поскольку эстроген является стероидным гормоном , он может проходить через фосфолипидные мембраны клетки, и поэтому рецепторам не обязательно быть мембраносвязанными, чтобы связываться с эстрогеном. [ нужна ссылка ]
геномный
[ редактировать ]В отсутствие гормона рецепторы эстрогена в основном расположены в цитозоле. Связывание гормона с рецептором запускает ряд событий, начиная с миграции рецептора из цитозоля в ядро, димеризации рецептора и последующего связывания димера рецептора со специфическими последовательностями ДНК, известными как элементы гормонального ответа . Затем комплекс ДНК/рецептор рекрутирует другие белки, которые отвечают за транскрипцию последующей ДНК в мРНК и, наконец, белок, что приводит к изменению функции клетки. Рецепторы эстрогена также встречаются в ядре клетки , и оба подтипа рецепторов эстрогена имеют ДНК -связывающий домен и могут функционировать как факторы транскрипции, регулируя выработку белков . [ нужна ссылка ]
Рецептор также взаимодействует с белком-активатором 1 и Sp-1, способствуя транскрипции, через несколько коактиваторов, таких как PELP-1 . [ 2 ]
супрессор опухоли Киназа- LKB1 коактивирует ERα в ядре клетки посредством прямого связывания, при котором она рекрутируется на промотор генов, чувствительных к ERα. Каталитическая активность LKB1 усиливает трансактивацию ERα по сравнению с мутантами с каталитическим дефицитом LKB1. [ 20 ]
Прямое ацетилирование альфа-рецептора эстрогена по остаткам лизина в шарнирной области с помощью p300 регулирует трансактивацию и чувствительность к гормонам. [ 21 ]
Негеномный
[ редактировать ]Некоторые рецепторы эстрогена связаны с мембраной клеточной поверхности и могут быстро активироваться при воздействии на клетки эстрогена. [ 22 ] [ 23 ]
Кроме того, некоторые ЭР могут связываться с клеточными мембранами путем прикрепления к кавеолину-1 и образовывать комплексы с G-белками , стриатином , рецепторными тирозинкиназами (например, EGFR и IGF-1 ) и нерецепторными тирозинкиназами (например, Src ). [ 2 ] [ 22 ] Через стриатин часть этого мембраносвязанного ЭР может приводить к повышению уровня Са. 2+ и оксид азота (NO). [ 24 ] Через рецепторные тирозинкиназы сигналы передаются в ядро через путь митоген-активируемой протеинкиназы (MAPK/ERK) и фосфоинозитид-3-киназы (Pl3K/ AKT ). путь [ 25 ] Киназа гликогенсинтазы-3 ядерного ER путем ингибирования фосфорилирования серина (GSK)-3β ингибирует транскрипцию 118 ядерного ERα. Фосфорилирование GSK-3β устраняет его ингибирующий эффект, и этого можно достичь с помощью пути PI3K/AKT и пути MAPK/ERK через rsk . [ нужна ссылка ]
Было показано, что 17β-эстрадиол активирует связанный с G-белком рецептор GPR30 . [ 26 ] Однако субклеточная локализация и роль этого рецептора до сих пор остаются предметом споров. [ 27 ]
Отличия и неисправности
[ редактировать ]

Рак
[ редактировать ]Рецепторы эстрогена сверхэкспрессируются примерно в 70% случаев рака молочной железы , называемого « ER-позитивным », и их можно выявить в таких тканях с помощью иммуногистохимии . Были предложены две гипотезы, объясняющие, почему это вызывает онкогенез , и имеющиеся данные свидетельствуют о том, что оба механизма способствуют:
- Во-первых, связывание эстрогена с ЭР стимулирует пролиферацию клеток молочной железы , что приводит к увеличению деления клеток и репликации ДНК , что приводит к мутациям.
- Во-вторых, метаболизм эстрогена производит генотоксичные отходы.
Результатом обоих процессов является нарушение клеточного цикла , апоптоза и восстановления ДНК , что увеличивает вероятность образования опухоли. ERα, безусловно, связан с более дифференцированными опухолями, хотя доказательства участия ERβ противоречивы. разные версии гена ESR1 Были идентифицированы (с однонуклеотидными полиморфизмами ) и связаны с разными рисками развития рака молочной железы. [ 19 ]
Эстроген и ЭР также участвуют в развитии рака молочной железы , рака яичников , рака толстой кишки , рака простаты и рака эндометрия . Распространенный рак толстой кишки связан с потерей ERβ, преобладающего ER в ткани толстой кишки, а рак толстой кишки лечат с помощью ERβ-специфичных агонистов. [ 28 ]
Эндокринная терапия рака молочной железы включает селективные модуляторы рецепторов эстрогена (SERMS), такие как тамоксифен , которые действуют как антагонисты ER в тканях молочной железы, или ингибиторы ароматазы , такие как анастрозол . Статус ER используется для определения чувствительности поражений рака молочной железы к тамоксифену и ингибиторам ароматазы. [ 29 ] Другой СЭРМ, ралоксифен , использовался в качестве профилактической химиотерапии для женщин, у которых, по оценкам, имеется высокий риск развития рака молочной железы. [ 30 ] Другой химиотерапевтический антиэстроген, ICI 182,780 (Фаслодекс), который действует как полный антагонист, также способствует деградации рецептора эстрогена.
Однако резистентность de novo к эндокринной терапии подрывает эффективность использования конкурентных ингибиторов, таких как тамоксифен. Гормональная депривация посредством использования ингибиторов ароматазы также оказывается бесполезной. [ 31 ] Массивно-параллельное секвенирование генома выявило частое наличие точечных мутаций в ESR1 , которые являются движущими силами устойчивости и способствуют формированию агонистической конформации ERα без связанного лиганда . Такая конститутивная, независимая от эстрогена активность обусловлена специфическими мутациями, такими как мутации D538G или Y537S/C/N, в лиганд-связывающем домене ESR1 и способствует пролиферации клеток и прогрессированию опухоли без гормональной стимуляции. [ 32 ]
Менопауза
[ редактировать ]Метаболические эффекты эстрогена у женщин в постменопаузе связаны с генетическим полиморфизмом бета-рецептора эстрогена (ER-β) . [ 33 ]
Старение
[ редактировать ]Исследования на мышах-самках показали, что уровень альфа-рецептора эстрогена в преоптическом гипоталамусе снижается по мере старения. Самки мышей, которым в течение большей части жизни давали диету с ограничением калорий , поддерживали более высокие уровни ERα в преоптическом гипоталамусе, чем их коллеги без ограничения калорий. [ 8 ]
Ожирение
[ редактировать ]Впечатляющая демонстрация важности эстрогенов в регуляции отложения жира была продемонстрирована на примере трансгенных мышей , которые были генетически модифицированы и лишены функционального гена ароматазы . Эти мыши имеют очень низкий уровень эстрогена и страдают ожирением. [ 34 ] Ожирение также наблюдалось у самок мышей с дефицитом эстрогена, лишенных рецептора фолликулостимулирующего гормона . [ 35 ] Влияние низкого уровня эстрогена на увеличение ожирения связано с рецептором эстрогена альфа. [ 36 ]
СЭРМ для других лечебных целей
[ редактировать ]СЭРМ также изучаются для лечения миомы матки. [ 37 ] [ нужно обновить ] и эндометриоз . [ 38 ]
Синдром нечувствительности к эстрогенам
[ редактировать ]Синдром нечувствительности к эстрогену — редкое интерсексуальное заболевание: зарегистрировано 5 случаев, при которых рецепторы эстрогена не функционируют. Фенотип . приводит к маскулинизации обширной В отличие от синдрома нечувствительности к андрогенам , EIS не приводит к смене пола фенотипа . Встречается невероятно редко и является аналогом АИС и форм гиперплазии надпочечников . Причина, по которой АИС встречается часто, а ЭИС исключительно редко, заключается в том, что XX АИС не приводит к бесплодию и, следовательно, может передаваться по материнской линии , в то время как ЭИС всегда приводит к бесплодию, независимо от кариотипа . При ЭИС также возникает петля отрицательной обратной связи между эндокринной системой , при которой гонады производят заметно более высокие уровни эстрогена у людей с ЭИС (119–272 пг/мл XY и 750–3500 пг/мл XX, см . средние уровни ). возникают феминизирующие эффекты. [ 39 ] [ 40 ]
Открытие
[ редактировать ]Рецепторы эстрогена были впервые идентифицированы Элвудом В. Дженсеном из Чикагского университета в 1958 году. [ 41 ] [ 42 ] за что Дженсен был удостоен премии Ласкера . [ 43 ] Ген второго рецептора эстрогена (ERβ) был идентифицирован в 1996 году Kuiper et al. в предстательной железе и яичниках крыс с использованием вырожденных праймеров ERalpha. [ 44 ]
См. также
[ редактировать ]- Мембранный рецептор эстрогена
- Синдром нечувствительности к эстрогенам
- Дефицит ароматазы
- Синдром избытка ароматазы
Ссылки
[ редактировать ]- ^ Дальман-Райт К., Кавайлес В., Фукуа С.А., Джордан В.К., Каценелленбоген Дж.А., Корах К.С. и др. (декабрь 2006 г.). «Международный союз фармакологии. LXIV. Рецепторы эстрогена». Фармакологические обзоры . 58 (4): 773–81. дои : 10.1124/пр.58.4.8 . ПМИД 17132854 . S2CID 45996586 .
- ^ Перейти обратно: а б с Левин Э.Р. (август 2005 г.). «Интеграция внеядерного и ядерного действия эстрогенов» . Молекулярная эндокринология . 19 (8): 1951–9. дои : 10.1210/me.2004-0390 . ПМЦ 1249516 . ПМИД 15705661 .
- ^ Ли X, Хуан Дж., Йи П, Бамбара Р.А., Хильф Р., Муян М. (сентябрь 2004 г.). «Одноцепочечные рецепторы эстрогена (ER) показывают, что гетеродимер ERalpha/beta имитирует функции димера ERalpha в геномных путях передачи сигналов эстрогена» . Молекулярная и клеточная биология . 24 (17): 7681–94. дои : 10.1128/MCB.24.17.7681-7694.2004 . ПМК 506997 . ПМИД 15314175 .
- ^ Нильссон С., Макела С., Тройтер Э., Туджаге М., Томсен Дж., Андерссон Г. и др. (октябрь 2001 г.). «Механизмы действия эстрогенов». Физиологические обзоры . 81 (4): 1535–65. дои : 10.1152/physrev.2001.81.4.1535 . ПМИД 11581496 . S2CID 10223568 .
- ^ Люнг Ю.К., Мак П., Хасан С., Хо С.М. (август 2006 г.). «Бета-изоформы эстрогенового рецептора (ER): ключ к пониманию передачи сигналов ER-бета» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (35): 13162–7. Бибкод : 2006PNAS..10313162L . дои : 10.1073/pnas.0605676103 . ПМК 1552044 . ПМИД 16938840 .
- ^ Хокинс М.Б., Торнтон Дж.В., Крюс Д., Скиппер Дж.К., Дотте А., Томас П. (сентябрь 2000 г.). «Идентификация третьего отдельного рецептора эстрогена и реклассификация рецепторов эстрогена у костистых рыб» . Труды Национальной академии наук Соединенных Штатов Америки . 97 (20): 10751–6. Бибкод : 2000PNAS...9710751H . дои : 10.1073/pnas.97.20.10751 . ПМК 27095 . ПМИД 11005855 .
- ^ Коуз Дж. Ф., Линдзи Дж., Грандьен К., Густафссон Дж. А., Корах К. С. (ноябрь 1997 г.). «Распределение в тканях и количественный анализ рибонуклеиновой кислоты рецептора-альфа эстрогена (ERalpha) и рибонуклеиновой кислоты рецептора-бета эстрогена у мышей дикого типа и мышей с нокаутом ERalpha» . Эндокринология . 138 (11): 4613–21. дои : 10.1210/en.138.11.4613 . ПМИД 9348186 .
- ^ Перейти обратно: а б Ягмаи Ф., Саид О., Гаран С.А., Фрейтаг В., Тимирас П.С., Штернберг Х. (июнь 2005 г.). «Ограничение калорий уменьшает потерю клеток и поддерживает иммунореактивность альфа-рецептора эстрогена в преоптическом гипоталамусе самок мышей B6D2F1» (PDF) . Письма по нейроэндокринологии . 26 (3): 197–203. ПМИД 15990721 .
- ^ Гесс Р.А. (июль 2003 г.). «Эстроген в репродуктивном тракте взрослого мужчины: обзор» . Репродуктивная биология и эндокринология . 1 (52): 52. дои : 10.1186/1477-7827-1-52 . ПМК 179885 . ПМИД 12904263 .
- ^ Бабикер Ф.А., Де Виндт Л.Дж., ван Эйкельс М., Гроэ С., Мейер Р., Довенданс П.А. (февраль 2002 г.). «Действие эстрогенных гормонов в сердце: регуляторная сеть и функции» . Сердечно-сосудистые исследования . 53 (3): 709–19. дои : 10.1016/S0008-6363(01)00526-0 . ПМИД 11861041 .
- ^ Хтун Х., Холт Л.Т., Уокер Д., Дэви-младший, Хагер Г.Л. (февраль 1999 г.). «Прямая визуализация альфа-рецептора эстрогена человека показывает роль лиганда в ядерном распределении рецептора» . Молекулярная биология клетки . 10 (2): 471–86. дои : 10.1091/mbc.10.2.471 . ПМК 25181 . ПМИД 9950689 .
- ^ Пфеффер У., Фекаротта Э., Видали Г. (май 1995 г.). «Коэкспрессия множественных информационных РНК вариантов рецепторов эстрогена в нормальных и неопластических тканях молочной железы и в клетках MCF-7». Исследования рака . 55 (10): 2158–65. ПМИД 7743517 .
- ^ Асенци П., Бочеди А., Марино М. (август 2006 г.). «Структурно-функциональная связь альфа- и бета-рецепторов эстрогена: влияние на здоровье человека». Молекулярные аспекты медицины . 27 (4): 299–402. дои : 10.1016/j.mam.2006.07.001 . ПМИД 16914190 .
- ^ Бурге В., Жермен П., Гронемейер Х. (октябрь 2000 г.). «Лигандсвязывающие домены ядерных рецепторов: трехмерные структуры, молекулярные взаимодействия и фармакологические последствия». Тенденции в фармакологических науках . 21 (10): 381–8. дои : 10.1016/S0165-6147(00)01548-0 . ПМИД 11050318 .
- ^ Перейти обратно: а б с Чжу Б.Т., Хан Г.З., Шим Ю.И., Вэнь Ю., Цзян Х.Р. (сентябрь 2006 г.). «Количественная взаимосвязь между структурой и активностью различных эндогенных метаболитов эстрогена для альфа- и бета-подтипов эстрогеновых рецепторов человека: понимание структурных детерминант, способствующих дифференциальному связыванию подтипов». Эндокринология . 147 (9): 4132–50. дои : 10.1210/en.2006-0113 . ПМИД 16728493 .
- ^ Кансра С., Ямагата С., Снид Л., Фостер Л., Бен-Джонатан Н. (июль 2005 г.). «Дифференциальное влияние антагонистов рецепторов эстрогена на пролиферацию лактотрофов гипофиза и высвобождение пролактина». Молекулярная и клеточная эндокринология . 239 (1–2): 27–36. дои : 10.1016/j.mce.2005.04.008 . ПМИД 15950373 . S2CID 42052008 .
- ^ Бакас П., Лиапис А., Влахопулос С., Гинер М., Логотети С., Креатсас Г. и др. (ноябрь 2008 г.). «Эстрогеновые рецепторы альфа и бета при миоме матки: основа измененной чувствительности к эстрогену» . Фертильность и бесплодие . 90 (5): 1878–85. doi : 10.1016/j.fertnstert.2007.09.019 . hdl : 10442/7330 . ПМИД 18166184 .
- ^ Шан Ю, Браун М (март 2002 г.). «Молекулярные детерминанты тканевой специфичности SERM». Наука . 295 (5564): 2465–8. Бибкод : 2002Sci...295.2465S . дои : 10.1126/science.1068537 . ПМИД 11923541 . S2CID 30634073 .
- ^ Перейти обратно: а б Деру Б.Дж., Корах К.С. (март 2006 г.). «Эстрогеновые рецепторы и болезни человека» . Журнал клинических исследований . 116 (3): 561–70. дои : 10.1172/JCI27987 . ПМК 2373424 . ПМИД 16511588 .
- ^ Нат-Сейн С., Мариньяни, Пенсильвания (15 апреля 2009 г.). «Каталитическая активность LKB1 способствует передаче сигналов альфа-рецептора эстрогена» . Молекулярная биология клетки . 20 (11): 2785–2795. дои : 10.1091/MBC.E08-11-1138 . ПМЦ 2688557 . ПМИД 19369417 .
- ^ Ван С., Фу М., Анджелетти Р.Х., Сиконолфи-Баез Л., Ройтенс А.Т., Альбанезе С. и др. (май 2001 г.). «Прямое ацетилирование альфа-шарнирной области эстрогенового рецептора с помощью p300 регулирует трансактивацию и чувствительность к гормонам» . Журнал биологической химии . 276 (21): 18375–83. дои : 10.1074/jbc.M100800200 . ПМИД 11279135 .
- ^ Перейти обратно: а б Живадинович Д., Гаметчу Б., Уотсон К.С. (2005). «Уровни мембранного рецептора эстрогена-альфа в клетках рака молочной железы MCF-7 предсказывают реакцию цАМФ и пролиферацию» . Исследование рака молочной железы . 7 (1): Р101–12. дои : 10.1186/bcr958 . ПМК 1064104 . ПМИД 15642158 .
- ^ Бьорнстрем Л., Сьоберг М. (июнь 2004 г.). «Эстрогензависимая рецептор-зависимая активация AP-1 посредством негеномной передачи сигналов» . Ядерный рецептор . 2 (1): 3. дои : 10.1186/1478-1336-2-3 . ПМК 434532 . ПМИД 15196329 .
- ^ Лу Кью, Паллас, округ Колумбия, Суркс Х.К., Баур В.Е., Мендельсон М.Е., Карас Р.Х. (декабрь 2004 г.). «Стриатин собирает мембранный сигнальный комплекс, необходимый для быстрой негеномной активации эндотелиальной NO-синтазы рецептором альфа эстрогена» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (49): 17126–31. Бибкод : 2004PNAS..10117126L . дои : 10.1073/pnas.0407492101 . ПМК 534607 . ПМИД 15569929 .
- ^ Като С., Эндо Х., Масухиро Ю., Китамото Т., Утияма С., Сасаки Х. и др. (декабрь 1995 г.). «Активация рецептора эстрогена посредством фосфорилирования митоген-активируемой протеинкиназой». Наука . 270 (5241): 1491–4. Бибкод : 1995Sci...270.1491K . дои : 10.1126/science.270.5241.1491 . ПМИД 7491495 . S2CID 4662264 .
- ^ Просниц Э.Р., Артерберн Дж.Б., Склар Л.А. (февраль 2007 г.). «GPR30: рецептор эстрогена, связанный с белком AG» . Молекулярная и клеточная эндокринология . 265–266: 138–42. дои : 10.1016/j.mce.2006.12.010 . ПМЦ 1847610 . ПМИД 17222505 .
- ^ Отто С., Роде-Шульц Б., Шварц Г., Фукс И., Клевер М., Бриттен Д. и др. (октябрь 2008 г.). «Рецептор 30, связанный с G-белком, локализуется в эндоплазматическом ретикулуме и не активируется эстрадиолом» . Эндокринология . 149 (10): 4846–56. дои : 10.1210/en.2008-0269 . ПМИД 18566127 .
- ^ Харрис Х.А., Альберт Л.М., Летерби Ю., Маламас М.С., Мьюшоу Р.Э., Миллер К.П. и др. (октябрь 2003 г.). «Оценка бета-агониста рецептора эстрогена на животных моделях заболеваний человека» . Эндокринология . 144 (10): 4241–9. дои : 10.1210/en.2003-0550 . ПМИД 14500559 .
- ^ Клемонс М., Дэнсон С., Хауэлл А. (август 2002 г.). «Тамоксифен («Нолвадекс»): обзор». Обзоры лечения рака . 28 (4): 165–80. дои : 10.1016/s0305-7372(02)00036-1 . ПМИД 12363457 .
- ^ Фабиан Си Джей, Кимлер Б. Ф. (март 2005 г.). «Селективные модуляторы эстрогеновых рецепторов для первичной профилактики рака молочной железы» . Журнал клинической онкологии . 23 (8): 1644–55. дои : 10.1200/JCO.2005.11.005 . ПМИД 15755972 .
- ^ Остеррайх С., Дэвидсон Н.Е. (декабрь 2013 г.). «Поиск мутаций ESR1 при раке молочной железы» . Природная генетика . 45 (12): 1415–6. дои : 10.1038/ng.2831 . ПМЦ 4934882 . ПМИД 24270445 .
- ^ Ли С., Шен Д., Шао Дж., Краудер Р., Лю В., Прат А. и др. (сентябрь 2013 г.). «Устойчивые к эндокринной терапии варианты ESR1, выявленные путем геномной характеристики ксенотрансплантатов, полученных из рака молочной железы» . Отчеты по ячейкам . 4 (6): 1116–30. дои : 10.1016/j.celrep.2013.08.022 . ПМК 3881975 . ПМИД 24055055 .
- ^ Дараби М., Ани М., Панджехпур М., Раббани М., Мовахедиан А., Зареан Э. (2011). «Влияние полиморфизма рецептора эстрогена β A1730G на реакцию экспрессии гена ABCA1 на заместительную гормональную терапию в постменопаузе». Генетическое тестирование и молекулярные биомаркеры . 15 (1–2): 11–5. дои : 10.1089/gtmb.2010.0106 . ПМИД 21117950 .
- ^ Хьюитт К.Н., Бун У.К., Мурата Ю., Джонс М.Э., Симпсон Э.Р. (сентябрь 2003 г.). «У мышей с нокаутом ароматазы наблюдается половое диморфное нарушение гомеостаза холестерина» . Эндокринология . 144 (9): 3895–903. дои : 10.1210/en.2003-0244 . ПМИД 12933663 .
- ^ Данилович Н., Бабу П.С., Син В., Гердес М., Кришнамурти Х., Сайрам М.Р. (ноябрь 2000 г.). «Дефицит эстрогена, ожирение и аномалии скелета у самок мышей с нокаутом рецепторов фолликулостимулирующего гормона (FORKO)» . Эндокринология . 141 (11): 4295–308. дои : 10.1210/endo.141.11.7765 . ПМИД 11089565 .
- ^ Олссон С., Хеллберг Н., Парини П., Видал О., Болули-Ю.М., Болули М. и др. (ноябрь 2000 г.). «Ожирение и нарушенный профиль липопротеинов у самцов мышей с дефицитом рецептора альфа эстрогена». Связь с биохимическими и биофизическими исследованиями . 278 (3): 640–5. дои : 10.1006/bbrc.2000.3827 . ПМИД 11095962 .
- ^ Линся X, Тайсян W, Сяоянь С (апрель 2007 г.). Се Л (ред.). «Селективные модуляторы рецепторов эстрогена (СЭРМ) при лейомиоме матки». Кокрейновская база данных систематических обзоров (2): CD005287. дои : 10.1002/14651858.cd005287.pub2 . ПМИД 17443581 .
- ^ ван Хозель М.Х., Чен Ю.Л., Чжэн А., Ван К., Мурад С.М. и др. (Кокрейновская группа по гинекологии и фертильности) (май 2021 г.). «Селективные модуляторы рецепторов эстрогена (СЭРМ) при эндометриозе» . Кокрановская база данных систематических обзоров . 2021 (5): CD011169. дои : 10.1002/14651858.CD011169.pub2 . ПМК 8130989 . ПМИД 33973648 .
- ^ Томас Л. Лемке, Дэвид А. Уильямс (24 января 2012 г.). Принципы медицинской химии Фоя . Липпинкотт Уильямс и Уилкинс. стр. 1392–. ISBN 978-1-60913-345-0 .
- ^ Смит Э.П., Бойд Дж., Фрэнк Г.Р., Такахаши Х., Коэн Р.М., Спекер Б. и др. (октябрь 1994 г.). «Эстрогенрезистентность, вызванная мутацией гена рецептора эстрогена у мужчины» . Медицинский журнал Новой Англии . 331 (16): 1056–61. дои : 10.1056/NEJM199410203311604 . ПМИД 8090165 .
- ^ Дженсен Э.В., Джордан ВК (июнь 2003 г.). «Рецептор эстрогена: модель для молекулярной медицины» (аннотация) . Клинические исследования рака . 9 (6): 1980–9. ПМИД 12796359 .
- ^ Дженсен Э (2011). «Разговор с Элвудом Дженсеном. Интервью Дэвида Д. Мура» . Ежегодный обзор физиологии . 74 : 1–11. doi : 10.1146/annurev-psyol-020911-153327 . ПМИД 21888507 .
- ^ Дэвид Брейси, 2004 г. « Ученый Калифорнийского университета получает американскую Нобелевскую премию за исследования ». Пресс-релиз Университета Цинциннати.
- ^ Койпер Г.Г., Энмарк Э., Пелто-Хуикко М., Нильссон С., Густафссон Дж.А. (июнь 1996 г.). «Клонирование нового рецептора, экспрессируемого в простате и яичниках крыс» . Труды Национальной академии наук Соединенных Штатов Америки . 93 (12): 5925–30. дои : 10.1073/pnas.93.12.5925 . ПМК 39164 . ПМИД 8650195 .
Внешние ссылки
[ редактировать ]- Рецепторы эстрогена Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)
- Дэвид С. Гудселл (1 сентября 2003 г.). «Рецептор эстрогена» . Банк данных по белкам , Исследовательская лаборатория структурной биоинформатики (RCSB). Архивировано из оригинала 11 марта 2006 года . Проверено 15 марта 2008 г.