Хлороформ
| |||
 | |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК Трихлорметан | |||
| Другие имена | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| Сокращения | Р-20, ТЦМ | ||
| ЧЭБИ | |||
| ЧЕМБЛ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.000.603 | ||
| Номер ЕС |
| ||
| КЕГГ | |||
ПабХим CID | |||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
| Число | 1888 | ||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| CH Cl3 | |||
| Молярная масса | 119.37 g·mol −1 | ||
| Появление | Бесцветная жидкость с высокой преломляющей способностью. | ||
| Запах | Сладкий, мятный, приятный | ||
| Плотность | 1,564 г/см 3 (−20 °С) 1,489 г/см 3 (25 °С) 1,394 г/см 3 (60 °С) | ||
| Температура плавления | -63,5 ° C (-82,3 ° F; 209,7 К) | ||
| Точка кипения | 61,15 ° С (142,07 ° F; 334,30 К) разлагается при 450 °C | ||
| 10,62 г/л (0 °С) 8,09 г/л (20 °С) 7,32 г/л (60 °С) | |||
| Растворимость | Растворим в бензоле Смешивается с диэтиловым эфиром , маслами , лигроином , спиртом , CCl 4 , CS 2. | ||
| Растворимость в ацетоне | ≥ 100 г/л (19 °C) | ||
| Растворимость в диметилсульфоксиде | ≥ 100 г/л (19 °C) | ||
| Давление пара | 0,62 кПа (-40 °С) 7,89 кПа (0 °С) 25,9 кПа (25 °С) 313 кПа (100 °С) 2,26 МПа (200 °С) | ||
Закон Генри постоянная ( k H ) | 3,67 л·атм/моль (24 °C) | ||
| Кислотность ( pKa ) | 15,7 (20 °С) | ||
| УФ-видимое излучение (λ макс .) | 250 нм, 260 нм, 280 нм | ||
| −59.30·10 −6 см 3 /моль | |||
| Теплопроводность | 0,13 Вт/(м·К) (20 °C) | ||
Показатель преломления ( n D ) | 1,4459 (20 °С) | ||
| Вязкость | 0,563 сП (20 °С) | ||
| Структура | |||
| Тетраэдрический | |||
| 1,15 Д | |||
| Термохимия | |||
Теплоемкость ( С ) | 114,25 Дж/(моль·К) | ||
Стандартный моляр энтропия ( S ⦵ 298 ) | 202,9 Дж/(моль·К) | ||
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | −134,3 кДж/моль | ||
Свободная энергия Гиббса (Δ f G ⦵ ) | −71,1 кДж/моль | ||
Стандартная энтальпия горение (Δ c H ⦵ 298 ) | 473,21 кДж/моль | ||
| Фармакология | |||
| N01AB02 ( ВОЗ ) | |||
| Опасности [9] | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Основные опасности | Разлагается на чрезвычайно токсичный фосген и хлористый водород в присутствии света – возможно канцерогенно – Репродуктивная токсичность – гепатотоксично [3] [4] [5] | ||
| СГС Маркировка : | |||
   | |||
| Опасность | |||
| Х302 , Х315 , Х319 , Х331 , Х336 , Х351 , Х361д , Х372 | |||
| P201 , P202 , P235 , P260 , P264 , P270 , P271 , P280 , P281 , P301+P330+P331 , P302+P352 , P304+P340 , P305+P351+P338 , P308+P313 , P310 , П311 , П314 , П332+ П313 , П337+П313 , П362 , П403+П233 , П405 , П501 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | негорючий | ||
| Летальная доза или концентрация (LD, LC): | |||
ЛД 50 ( средняя доза ) | 704 мг/кг (мышь, кожный) [6] | ||
ЛК 50 ( средняя концентрация ) | 47 702 мг/м 3 (крыса, 4 часа) [7] | ||
LC Lo ( самый низкий из опубликованных ) |
| ||
| NIOSH (пределы воздействия на здоровье в США): | |||
МЕХ (Допускается) | 50 частей на миллион (240 мг/м 3 ) [4] | ||
РЕЛ (рекомендуется) | Ca ST 2 ppm (9,78 мг/м 3 ) [60 минут] [4] | ||
IDLH (Непосредственная опасность) | 500 частей на миллион [4] [ нужны разъяснения ] | ||
| Паспорт безопасности (SDS) | [1] | ||
| Родственные соединения | |||
Родственные соединения |
| ||
| Страница дополнительных данных | |||
| Хлороформ (страница данных) | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
хлороформ , [10] или трихлорметан (часто сокращенно TCM ), представляет собой хлорорганический соединения с формулой CHCl обычный 3 и растворитель . Это очень летучая, бесцветная, плотная жидкость с сильным запахом, производимая в больших масштабах в качестве предшественника хладагентов и ПТФЭ . [11] Хлороформ — это тригалометан , который служит мощным общим анестетиком , эйфориантом , анксиолитиком и седативным средством при вдыхании или проглатывании. По этой причине хлороформ использовался в качестве ингаляционного анестетика в период с 19 века по первую половину 20 века. [12] [13] Он смешивается со многими растворителями, но очень мало растворим в воде (всего 8 г/л при 20°C).
Структура и название
[ редактировать ]Молекула принимает тетраэдрическую молекулярную геометрию с C3v симметрией . [14] Молекулу хлороформа можно рассматривать как молекулу метана , в которой три атома водорода заменены тремя атомами хлора, в результате чего остается один атом водорода.
Название «хлороформ» представляет собой ( третичного смесь терхлорида хлорида, трихлорида) и формила , устаревшего названия метилилиденового радикала (СН), полученного из муравьиной кислоты .
Естественное явление
[ редактировать ]Общий глобальный поток хлороформа через окружающую среду составляет примерно 660 000 тонн в год. [15] и около 90% выбросов имеют естественное происхождение. Многие виды морских водорослей производят хлороформ, а грибы , как полагают, производят хлороформ в почве. [16] Считается, что абиотические процессы также способствуют естественному производству хлороформа в почвах, хотя механизм до сих пор неясен. [17]
Поскольку хлороформ является летучим органическим соединением, [18] он легко рассеивается из почвы и поверхностных вод и подвергается разложению на воздухе с образованием фосгена , дихлорметана , формилхлорида , оксида углерода , диоксида углерода и хлористого водорода . Период его полураспада в воздухе колеблется от 55 до 620 дней. Биодеградация в воде и почве происходит медленно. Хлороформ незначительно биоаккумулируется в водных организмах. [19]
История
[ редактировать ]Хлороформ был синтезирован независимо несколькими исследователями c. 1831 :
- Молденхауэр, немецкий фармацевт из Франкфурта-на-Одере , по-видимому, получил хлороформ в 1830 году, смешав хлорированную известь с этанолом ; однако он принял его за хлорэтер (хлорный эфир, 1,2-дихлорэтан ). [20] [21]
- Сэмюэл Гатри , американский врач из Сакетс-Харбор, штат Нью-Йорк , также, по-видимому, получил хлороформ в 1831 году путем реакции хлорированной извести с этанолом и отметил его анестезирующие свойства; однако он также считал, что приготовил хлорный эфир. [22] [23] [24]
- Либих осуществил щелочное расщепление хлораля Юстус фон . Либих ошибочно утверждает, что эмпирическая формула хлороформа была C 2 Cl 5 и назвал его « Хлорколенстофф » («хлорид углерода»). [25] [26]
- Эжен Суберан получил это соединение действием хлорного отбеливателя на этанол и ацетон . [27]
В 1834 году французский химик Жан-Батист Дюма определил эмпирическую формулу хлороформа и назвал ее: [28] « Es scheint mir также erweisen, dass die von mir analysirte Substanz, … zur Formel Hat: C 2 H 2 Cl 6 . » (Таким образом, мне кажется, это показывает, что вещество, которое я анализировал… имеет [свою эмпирическую] формулу: C 2 H 2 Cl 6 .). [Примечание: коэффициенты его эмпирической формулы следует уменьшить вдвое.] ... « Diess Hat mich veranlasst diese Substanz mit dem Namen 'Chloroform' zu belegen». (Это побудило меня назвать это вещество «хлороформом» [ т.е. формилхлорид или хлорид муравьиной кислоты].)
В 1835 году Дюма получил вещество щелочным расщеплением трихлоруксусной кислоты .
В 1842 году Роберт Мортимер Гловер в Лондоне обнаружил анестезирующие свойства хлороформа на лабораторных животных. [29]
В 1847 году шотландский акушер Джеймс Ю. Симпсон первым продемонстрировал анестезирующие свойства хлороформа у людей, предоставленные местным фармацевтом Уильямом Флокхартом из компании «Дункан, Флокхарт и компания». [30] и помог популяризировать препарат для использования в медицине. [31]
К 1850-м годам хлороформ производился на коммерческой основе. В Великобритании к 1895 году производилось около 750 000 доз в неделю. [32] с использованием процедуры Либиха, которая сохраняла свое значение до 1960-х годов. Сегодня хлороформ, наряду с дихлорметаном , получают исключительно и в массовых масштабах путем хлорирования метана и хлорметана. [11]
Производство
[ редактировать ]В промышленности хлороформ получают путем нагревания смеси хлора и метилхлорида ( CH 3 Cl ) или метан ( СН 4 ). [11] При 400–500 ° C происходит свободнорадикальное галогенирование , превращающее эти предшественники во все более хлорированные соединения:
Хлороформ подвергается дальнейшему хлорированию с образованием четыреххлористого углерода ( CCl4 ) :
- CHCl 3 + Cl 2 → CCl 4 + HCl
Результатом этого процесса является смесь четырех хлорметанов: хлорметана , метиленхлорида (дихлорметана), трихлорметана (хлороформа) и тетрахлорметана (четыреххлористого углерода). Затем их можно разделить перегонкой . [11]
Хлороформ также можно производить в небольших масштабах посредством галоформной реакции между ацетоном и гипохлоритом натрия :
- 3 NaOCl + (CH 3 ) 2 CO → CHCl 3 + 2 NaOH + CH 3 COONa
Дейтерохлороформ
[ редактировать ]Дейтерированный хлороформ представляет собой изотополог хлороформа с одним атомом дейтерия . CDCl 3 является распространенным растворителем, используемым в ЯМР-спектроскопии . Дейтерохлороформ получают реакцией гексахлорацетона с тяжелой водой . [33] Галоформный процесс в настоящее время устарел для производства обычного хлороформа. Дейтерохлороформ также можно получить путем взаимодействия дейтерооксида натрия с хлоралгидратом . [34] [35]
Непреднамеренное образование хлороформа
[ редактировать ]Галоформная реакция может также произойти случайно в домашних условиях. Отбеливание гипохлоритом приводит к образованию галогенированных соединений в побочных реакциях; хлороформ является основным побочным продуктом. [36] Раствор гипохлорита натрия ( хлорный отбеливатель ), смешанный с обычными бытовыми жидкостями, такими как ацетон , метилэтилкетон , этанол или изопропиловый спирт , может производить некоторое количество хлороформа в дополнение к другим соединениям, таким как хлорацетон или дихлорацетон . [ нужна ссылка ]
Использование
[ редактировать ]С точки зрения масштаба наиболее важной реакцией хлороформа является реакция с фтористым водородом с образованием монохлордифторметана (ГХФУ-22), прекурсора в производстве политетрафторэтилена ( тефлона ) и других фторполимеров: [11]
- CHCl 3 + 2 HF → CHClF 2 + 2 HCl
Реакцию проводят в присутствии каталитического количества смешанных галогенидов сурьмы . Хлордифторметан затем преобразуется в тетрафторэтилен , основной предшественник тефлона . [37]
Растворитель
[ редактировать ]Водород , присоединенный к углероду в хлороформе, участвует в образовании водородных связей, [38] [39] что делает его хорошим растворителем для многих материалов.
Во всем мире хлороформ также используется в составах пестицидов, как растворитель липидов восков , каучука , алкалоидов , для зерна , , гуттаперчи и смол , как чистящее средство, как фумигант в огнетушителях и в резиновой промышленности. [19] [40] CDCl 3 является распространенным растворителем, используемым в ЯМР-спектроскопии . [41]
Хладагент
[ редактировать ]Хлороформ используется в качестве прекурсора для производства R-22 (хлордифторметана). Это делается путем взаимодействия его с раствором плавиковой кислоты (HF), который фторирует Молекула CHCl 3 и в качестве побочного продукта выделяет соляную кислоту. [42] До вступления в силу Монреальского протокола большая часть хлороформа, производимого в США, использовалась для производства хлордифторметана . Однако его производство остается высоким, поскольку он является ключевым предшественником ПТФЭ. [43]
Хотя хлороформ обладает такими свойствами, как низкая температура кипения и низкий потенциал глобального потепления, составляющий всего 31 (по сравнению с 1760 R-22), что является привлекательным свойством для хладагента, имеется мало информации, позволяющей предположить, что он получил широкое распространение. использовать в качестве хладагента в любых потребительских товарах. [44]
кислота Льюиса
[ редактировать ]В растворителях, таких как CCl 4 и алканы, хлороформ образуют водородные связи с различными основаниями Льюиса. HCCl 3 классифицируется как жесткая кислота , а в модели ECW ее кислотные параметры указаны как E A = 1,56 и CA = 0,44.
Реагент
[ редактировать ]В качестве реагента хлороформ служит источником дихлоркарбена. промежуточного ССl 2 . [45] Он реагирует с водным гидроксидом натрия , обычно в присутствии катализатора межфазного переноса , с образованием дихлоркарбена . ССl 2 . [46] [47] Этот реагент вызывает орто-формилирование активированных ароматических колец , таких как фенолы , с образованием арилальдегидов в реакции, известной как реакция Реймера-Тимана . Альтернативно, карбен может быть захвачен алкеном с образованием производного циклопропана . При присоединении Хараша хлороформ образует • Свободный радикал CHCl 2, присоединяющийся к алкенам. [ нужна ссылка ]
Анестетик
[ редактировать ]
Анестезирующие свойства хлороформа были впервые описаны в 1842 году в диссертации Роберта Мортимера Гловера , получившей за этот год золотую медаль Гарвейского общества . [48] [49] Гловер также провел практические эксперименты на собаках, чтобы доказать свои теории, усовершенствовал свои теории и представил их в своей докторской диссертации в Эдинбургском университете летом 1847 года.
Шотландский акушер Джеймс Янг Симпсон был одним из тех, кто должен был прочитать диссертацию, но позже заявил, что никогда не читал ее и пришел к своим собственным выводам независимо. [ нужна ссылка ] 4 ноября 1847 года Симпсон заявил, что обнаружил анестезирующие свойства хлороформа у людей. Он и двое его коллег развлекались, испытывая действие различных веществ, и таким образом выявили потенциал хлороформа в медицинских процедурах. [30]

Несколько дней спустя, во время стоматологической процедуры в Эдинбурге , Фрэнсис Броди Имлак стал первым человеком, применившим хлороформ к пациенту в клиническом контексте. [50]
В мае 1848 года Роберт Холлидей Ганнинг выступил перед Медико-хирургическим обществом Эдинбурга после серии лабораторных экспериментов на кроликах , которые подтвердили выводы Гловера, а также опровергли заявления Симпсона об оригинальности. Лабораторные эксперименты, доказавшие опасность хлороформа, по большей части игнорировались. [51]
Использование хлороформа во время операций в Европе быстро распространилось; например, в 1850-х годах врач Джон Сноу использовал хлороформ при рождении королевы Виктории, двух последних детей Леопольда и Беатрис . [52] В США хлороформ начал заменять эфир в качестве анестетика в начале 20 века; [ нужна ссылка ] от него отказались в пользу эфира после открытия его токсичности, особенно его способности вызывать фатальные сердечные аритмии, аналогичные тому, что сейчас называют « внезапной смертью нюхача ». Некоторые люди использовали хлороформ в качестве рекреационного наркотика или для попытки самоубийства. [53] Одним из возможных механизмов действия хлороформа является то, что он увеличивает движение ионов калия через определенные типы калиевых каналов в нервных клетках . [54] Хлороформ также можно смешивать с другими анестетиками, такими как эфир для получения смеси CE или эфир и спирт для получения смеси ACE . [ нужна ссылка ]
В 1848 году Ханна Гринер, 15-летняя девочка, которой удаляли инфицированный ноготь на ноге, умерла после анестезии. [55] Ее вскрытие, устанавливающее причину смерти, было проведено Джоном Файфом при содействии Роберта Мортимера Гловера . [29] Несколько физически здоровых пациентов умерли после его вдыхания. Однако в 1848 году Джон Сноу разработал ингалятор, который регулировал дозировку и таким образом успешно снизил количество смертей. [56]
Противники и сторонники хлороформа разошлись во мнениях по вопросу о том, были ли медицинские осложнения вызваны нарушением дыхания или хлороформ оказал специфическое воздействие на сердце. Между 1864 и 1910 годами многочисленные комиссии в Великобритании изучали хлороформ, но не смогли прийти к каким-либо четким выводам. Лишь в 1911 году Леви в экспериментах на животных доказал, что хлороформ может вызывать фибрилляцию желудочков. [ нужна ссылка ] Несмотря на это, между 1865 и 1920 годами хлороформ использовался в 80–95% всех наркотических мероприятий, проводимых в Великобритании и немецкоязычных странах. В Германии комплексные исследования смертности во время анестезии были проведены Гурльтом в период с 1890 по 1897 год. [ нужна ссылка ] В то же время в Великобритании медицинский журнал The Lancet провел анкетный опрос. [57] и составил отчет с подробным описанием многочисленных побочных реакций на анестетики, включая хлороформ. [58] В 1934 году Киллиан собрал все статистические данные, собранные к тому времени, и обнаружил, что вероятность возникновения смертельных осложнений при использовании эфира составляла от 1:14 000 до 1:28 000, тогда как при использовании хлороформа шансы были от 1:3 000 до 1:6 000. [ нужна ссылка ] Распространение газовой анестезии с использованием закиси азота , усовершенствование оборудования для введения анестетиков и открытие гексобарбитала в 1932 году привели к постепенному упадку хлороформного наркоза. [59]
Последние сообщения об использовании хлороформа в качестве анестезирующего средства в западном мире относятся к 1987 году, когда последний врач, использовавший его, вышел на пенсию, примерно через 140 лет после его первого применения. [60]
Преступное использование
[ редактировать ]Хлороформ использовался преступниками, чтобы вырубить, ошеломить или даже убить жертву. Джозефу Харрису в 1894 году было предъявлено обвинение в использовании хлороформа для ограбления людей. [61] Серийный убийца Х. Х. Холмс использовал передозировку хлороформа, чтобы убить своих жертв-женщин. В сентябре 1900 года хлороформ был замешан в убийстве американского бизнесмена Уильяма Марша Райса . Хлороформ был признан виновником предполагаемого убийства женщины в 1991 году, когда она задохнулась во сне. [62] В 2002 году 13-летнюю Кейси Вуди ввели хлороформ, когда она была похищена Дэвидом Фуллером и в то время, когда она была у него, прежде чем он застрелил ее. [63] В ходе сделки о признании вины в 2007 году мужчина признался в использовании электрошокеров и хлороформа для сексуального насилия над несовершеннолетними. [64]
Использование хлороформа в качестве выводящего из строя агента получило широкое признание, граничащее с клише , благодаря использованию авторами криминальной фантастики сюжетов, в которых преступники используют пропитанные хлороформом тряпки для приведения жертв в бессознательное состояние. Однако вывести из строя человека, использующего хлороформ, таким способом практически невозможно. [65] Для того чтобы человек потерял сознание, требуется не менее пяти минут вдыхания хлороформа. Большинство уголовных дел, связанных с хлороформом, связаны с одновременным приемом другого наркотика, например, алкоголя или диазепама , или соучастием жертвы в его применении. После того, как человек потерял сознание из-за вдыхания хлороформа, необходимо вводить непрерывный объем и поддерживать подбородок, чтобы язык не перекрывал дыхательные пути, - сложная процедура, обычно требующая навыков анестезиолога . В 1865 году, как прямой результат криминальной репутации хлороформа, медицинский журнал «Ланцет» предложил «постоянную научную репутацию» любому, кто мог продемонстрировать «мгновенную нечувствительность», то есть потерю сознания, с помощью хлороформа. [66]
Безопасность
[ редактировать ]Контакт
[ редактировать ]Хлороформ образуется как побочный продукт хлорирования воды вместе с рядом других побочных продуктов дезинфекции и поэтому часто присутствует в городской водопроводной воде и плавательных бассейнах. Сообщаемые диапазоны значительно различаются, но, как правило, ниже действующего санитарного стандарта для общего содержания тригалометанов (ТГМ) в 100 мкг/л. [67] Однако, если рассматривать их в сочетании с другими тригалометанами, часто присутствующими в питьевой воде, концентрация ТГМ часто превышает рекомендуемый предел воздействия. [68]
Хотя в немногих исследованиях оценивались риски, связанные с воздействием хлороформа через питьевую воду в отдельности от других ТГМ, многие исследования показали, что воздействие общей категории ТГМ, включая хлороформ, связано с повышенным риском рака мочевого пузыря или нижних отделов желудочно-кишечного тракта. тракт. [69]
Исторически воздействие хлороформа могло быть выше из-за его широкого использования в качестве анестетика, ингредиента сиропов от кашля и компонента табачного дыма , где ДДТ ранее использовался в качестве фумиганта . [70]
Фармакология
[ редактировать ]Хлороформ хорошо всасывается, метаболизируется и быстро выводится из млекопитающих после перорального, ингаляционного или кожного воздействия. Случайное попадание брызг в глаза вызвало раздражение. [19] Длительное воздействие на кожу может привести к развитию язв в результате обезжиривания . Выведение происходит преимущественно через легкие в виде хлороформа и углекислого газа; менее 1% выводится с мочой. [40]
Хлороформ метаболизируется в печени ферментами цитохрома Р-450 путем окисления до хлорметанола и восстановления до дихлорметильного свободного радикала . Другие метаболиты хлороформа включают соляную кислоту и диглутатионилдитиокарбонат, причем углекислый газ . преобладающим конечным продуктом метаболизма является [71]
большинство других общих анестетиков и седативно-снотворных средств, хлороформ является аллостерическим модулятором рецепторов ГАМК А. положительным Как и [72] Хлороформ вызывает угнетение центральной нервной системы (ЦНС), что в конечном итоге приводит к глубокой коме и угнетению дыхательного центра. [71] При попадании в организм хлороформ вызывает симптомы, аналогичные тем, которые наблюдаются при вдыхании. При приеме внутрь 7,5 г (0,26 унции) возникло серьезное заболевание. Средняя смертельная пероральная доза для взрослого оценивается в 45 г (1,6 унции). [19]
Применение анестетика хлороформа было прекращено, поскольку он вызывал смерть от дыхательной недостаточности и сердечной аритмии. После анестезии, вызванной хлороформом, у некоторых пациентов наблюдались тошнота , рвота , гипертермия , желтуха и кома из-за нарушения функции печени . При вскрытии некроз и дегенерация печени. наблюдались [19]
Хлороформ вызывает опухоли печени у мышей и опухоли почек у мышей и крыс. [19] Считается, что гепатотоксичность и нефротоксичность хлороформа обусловлены главным образом фосгеном , одним из его метаболитов. [71]
Превращение в фосген
[ редактировать ]Хлороформ медленно превращается в присутствии ультрафиолетового света и воздуха в чрезвычайно ядовитый газ фосген ( COCl 2 ), выделяя HCl . при этом [73]
- 2 CHCl 3 + O 2 → 2 COCl 2 + 2 HCl
Чтобы предотвратить несчастные случаи, коммерческий хлороформ стабилизируют этанолом или амиленом , но восстановленные или высушенные образцы больше не содержат стабилизатора. Было обнаружено, что амилен неэффективен, а фосген может влиять на аналиты в образцах, липиды и нуклеиновые кислоты, растворенные в хлороформе или экстрагированные им. [74] Фосген и HCl можно удалить из хлороформа промыванием насыщенными водными растворами карбонатов , например бикарбоната натрия . Эта процедура проста и приводит к получению безвредных продуктов. Фосген реагирует с водой с образованием углекислого газа и HCl. [75] а карбонатная соль нейтрализует образующуюся кислоту. [76]
Подозрительные образцы можно проверить на наличие фосгена с помощью фильтровальной бумаги, которая при обработке 5% дифениламина , 5% диметиламинобензальдегидом в этаноле , а затем высушенной, становится желтой в присутствии паров фосгена. [77] Существует несколько колориметрических и флуориметрических реагентов для определения фосгена, его также можно определить количественно с помощью масс-спектрометрии . [78]
Регулирование
[ редактировать ]хлороформ подозревается в вызывании рака (т.е. он, возможно, канцерогенен , группа 2B IARC ). Согласно монографиям Международного агентства по исследованию рака (IARC), [79]
Он классифицируется как чрезвычайно опасное вещество в Соединенных Штатах, как это определено в разделе 302 Закона США о чрезвычайном планировании и праве общества на информацию (42 USC 11002), и на него распространяются строгие требования к отчетности со стороны предприятий, которые производят, хранят или использовать его в значительных количествах. [80]
Биоремедиация хлороформа
[ редактировать ]Некоторые анаэробные бактерии используют хлороформ для дыхания, называемого галогенорганическим дыханием , превращая его в дихлорметан . [81] [82]
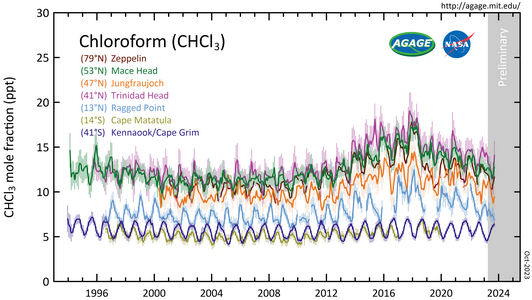
Галерея
[ редактировать ]- CHCl 3 измерен в рамках Расширенного глобального эксперимента по атмосферным газам ( AGAGE ) в нижних слоях атмосферы ( тропосфере ) на станциях по всему миру. Численность дана как среднемесячная мольная доля незагрязненных территорий в частях на триллион (ppt).
Ссылки
[ редактировать ]- ^ Грегори, Уильям, Справочник по органической химии (третье издание, исправленное и значительно расширенное), 1852, стр. 177.
- ^ Дэниел Перейра Гарднер, Медицинская химия для использования студентами и профессией: руководство по науке с ее приложениями к токсикологии, физиологии, терапии, гигиене и т. д. (1848), стр. 271
- ^ «Часть 3. Опасности для здоровья» (PDF) . Согласованная на глобальном уровне система классификации и маркировки химических веществ (СГС) . Второе исправленное издание. Объединенные Нации. Архивировано (PDF) из оригинала 4 марта 2019 года . Проверено 30 сентября 2017 г.
- ^ Перейти обратно: а б с д Карманный справочник NIOSH по химическим опасностям. «#0127» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Токсичность на PubChem. Архивировано 17 августа 2018 г. в Wayback Machine.
- ^ Льюис, Ричард Дж. (2012). Опасные свойства промышленных материалов Сакса (12-е изд.). Уайли. ISBN 978-0-470-62325-1 .
- ^ «Хлороформ» (PDF) . Агентство по охране окружающей среды . Сентябрь 2016 года . Проверено 19 февраля 2024 г.
- ^ «Хлороформ» . Непосредственно опасные для жизни и здоровья концентрации (IDLH) . Национальный институт охраны труда и здоровья (NIOSH).
- ^ «PubChem: Безопасность и опасности – Классификация СГС» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США. Архивировано из оригинала 17 августа 2018 года . Проверено 17 августа 2018 г.
- ^ «Фронт материи». Номенклатура органической химии: рекомендации ИЮПАК и предпочтительные названия 2013 г. (Синяя книга) . Кембридж: Королевское химическое общество . 2014. с. 661. doi : 10.1039/9781849733069-FP001 (неактивен 26 апреля 2024 г.). ISBN 978-0-85404-182-4 .
Сохраненные названия «бромоформ» для HCBr 3 , «хлороформ» для HCCl 3 и «йодоформ» для HCl 3 приемлемы в общей номенклатуре. Предпочтительные имена IUPAC являются замещающими именами.
{{cite book}}: CS1 maint: DOI неактивен по состоянию на апрель 2024 г. ( ссылка ) - ^ Перейти обратно: а б с д и Россберг, М.; и др. «Хлорированные углеводороды». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a06_233.pub2 . ISBN 978-3527306732 .
- ^ «Эфир и хлороформ» . Архивировано из оригинала 24 марта 2018 года . Проверено 24 апреля 2018 г.
- ^ «Хлороформ [Ценностная документация МАК, 2000]». МАК-Сборник по охране труда . 2012. стр. 20–58. дои : 10.1002/3527600418.mb6766e0014 . ISBN 978-3-527-60041-0 .
- ^ «Иллюстрированный словарь органической химии - хлороформ» . www.chem.ucla.edu . Проверено 29 декабря 2022 г.
- ^ Гриббл, Гордон В. (2004). «Природные органогалогены: новый рубеж для лекарственных средств?». Журнал химического образования . 81 (10): 1441. Бибкод : 2004JChEd..81.1441G . дои : 10.1021/ed081p1441 .
- ^ Каппеллетти, М. (2012). «Микробная деградация хлороформа». Прикладная микробиология и биотехнология . 96 (6): 1395–409. дои : 10.1007/s00253-012-4494-1 . ПМИД 23093177 . S2CID 12429523 .
- ^ Цзяо, И; и др. (2018). «Выбросы галогенуглеродов из деградировавших лесных водно-болотных угодий в прибрежной части Южной Каролины, пострадавших от повышения уровня моря». АСУ Химия Земли и Космоса . 2 (10): 955–967. Бибкод : 2018ESC.....2..955J . doi : 10.1021/acsearthspacechem.8b00044 . S2CID 134649348 .
- ^ «Полный список ЛОС» .
- ^ Перейти обратно: а б с д и ж Хлороформ (PDF) , CICAD , том. 58, Всемирная организация здравоохранения , 2004 г., заархивировано (PDF) из оригинала 31 июля 2020 г.
- ^ Молденхауэр (1830 г.). «Способ освобождения этанола из сивушного масла простым способом». Журнал для аптеки . 8 (31): 222–227. Архивировано из оригинала 29 июля 2020 года . Проверено 6 мая 2016 г.
- ^ Дефальк, Рэй Дж.; Райт, Эй Джей (2000). «Производился ли хлороформ до 1831 года?» . Анестезиология . 92 (1): 290–291. дои : 10.1097/00000542-200001000-00060 . ПМИД 10638939 .
- ^ Гатри, Сэмюэл (1832). «Новый способ приготовления спиртового раствора хлорного эфира» . Американский журнал науки и искусства . 21 : 64–65 и 405–408. Архивировано из оригинала 29 июля 2020 года . Проверено 6 мая 2016 г.
- ^ Гатри, Оссиан (1887). Мемуары доктора Сэмюэля Гатри и история открытия хлороформа . Чикаго: Джордж К. Хэзлитт и компания, с. 1 .
- ^ Стратманн, Линда (2003). «Глава 2» . Хлороформ: В поисках забвения . Страуд: издательство Sutton Publishing. ISBN 978-0-7524-9931-4 . Архивировано из оригинала 29 июля 2020 года . Проверено 6 мая 2016 г.
- ^ Либих, Юстус фон (1831). «О разложении спирта хлором» . Анналы физики и химии . 99 (11): 444. Бибкод : 1831АнП....99..444Л . дои : 10.1002/andp.18310991111 . Архивировано из оригинала 10 мая 2017 года . Проверено 6 мая 2016 г.
- ^ Либих, Юстус фон (1832). «О соединениях, образующихся при реакции хлора со спиртом [ этанолом], эфиром [диэтиловым эфиром], нефтеобразующим газом [этиленом] и уксусным спиртом [ацетоном]». Анналы физики и химии . 100 (2): 243–295. Бибкод : 1832АнП...100..243Л . дои : 10.1002/andp.18321000206 .
На страницах 259–265 Либих описывает Хлорколенстофа («хлорид углерода», хлороформ), но на стр. 264, Либих ошибочно утверждает, что брутто-формула хлороформа — C 2 Cl 5 . - ^ Субейран, Эжен (1831). «Исследования некоторых соединений хлора» . Анналы химии и физики . Серия 2. 48 : 113–157. Архивировано из оригинала 10 мая 2017 года . Проверено 6 мая 2016 г.
- Перепечатано в Субейран, Эжен (1831). «Исследование некоторых соединений хлора» . Журнал фармации и смежных наук . 17 :657–672. Архивировано из оригинала 29 июля 2020 года . Проверено 6 мая 2016 г.
- Перепечатано в Субейран, Эжен (1832). «Продолжение исследований некоторых соединений хлора» . Журнал фармации и смежных наук . 18 :1–24. Архивировано из оригинала 29 июля 2020 года . Проверено 6 мая 2016 г.
- ^ Дюма, Ж.-Б. (1834). «Исследования по действию хлора на спирт» [Опыты по действию хлора на спирт]. Институт, Общий журнал обществ и научных работ во Франции и за рубежом . 2 : 106–108 и 112–115.
- Перепечатано в Дюма, Ж.-Б. (1834 г.). «Исследование действия хлора на спирт» . Анналы физики и химии . 107 (42): 657–673. Бибкод : 1834АнП...107..657Д . дои : 10.1002/andp.18341074202 . Архивировано из оригинала 10 мая 2017 года . Проверено 12 мая 2016 г.
На стр. 653, Дюма приводит эмпирическую формулу хлороформа:
- «Поэтому мне кажется, что вещество, которое я проанализировал... имеет следующую формулу: C 2 H 2 Cl 6 ». (Таким образом, мне кажется, это показывает, что вещество, [которое] анализировалось мной… имеет [свою эмпирическую] формулу: C 2 H 2 Cl 6 .) [Примечание: коэффициенты его эмпирической формулы необходимо уменьшить вдвое.]
- хлороформа Затем Дюма отмечает, что простая эмпирическая формула напоминает формулу муравьиной кислоты . Кроме того, если хлороформ кипятить с гидроксидом калия , одним из продуктов будет формиат калия . На стр. 654, Дюма называет хлороформ:
- «Это побудило меня дать этому веществу название «хлороформ». (Это побудило меня дать этому веществу название «хлороформ» [т. е. формилхлорид или хлорид муравьиной кислоты].)
- Перепечатано в Дюма, Ж.-Б. (1835). «О действии хлора на спирт» . Анналы аптеки . 16 (2): 164–171. дои : 10.1002/jlac.18350160213 . Архивировано из оригинала 10 мая 2017 года . Проверено 12 мая 2016 г.
- Перепечатано в Дюма, Ж.-Б. (1834 г.). «Исследование действия хлора на спирт» . Анналы физики и химии . 107 (42): 657–673. Бибкод : 1834АнП...107..657Д . дои : 10.1002/andp.18341074202 . Архивировано из оригинала 10 мая 2017 года . Проверено 12 мая 2016 г.
- ^ Перейти обратно: а б Дефальк, Р.Дж.; Райт, Эй Джей (2004). «Короткая трагическая жизнь Роберта М. Гловера» (PDF) . Анестезия . 59 (4): 394–400. дои : 10.1111/j.1365-2044.2004.03671.x . ПМИД 15023112 . S2CID 46428403 . Архивировано (PDF) из оригинала 9 марта 2016 г.
- ^ Перейти обратно: а б Гордон, Х. Лэнг (ноябрь 2002 г.). Сэр Джеймс Янг Симпсон и хлороформ (1811–1870) . Группа Минерва. стр. 106–109. ISBN 978-1-4102-0291-8 . Архивировано из оригинала 6 мая 2016 года . Проверено 5 января 2016 г.
- ^ «Сэр Джеймс Янг Симпсон» . Британская энциклопедия . Архивировано из оригинала 27 июля 2013 года . Проверено 23 августа 2013 г.
- ^ Уорлинг, премьер-министр (1998). «Дункан и Флокхарт: история двух мужчин и аптеки». Историк фармацевтики . 28 (2): 28–33. ПМИД 11620310 .
- ^ Полсен, П.Дж.; Кук, У.Д. (1 сентября 1963 г.). «Приготовление дейтерированных растворителей для спектрометрии ядерного магнитного резонанса». Аналитическая химия . 35 (10): 1560. doi : 10.1021/ac60203a072 .
- ^ Брейер, Ф.В. (1935). «Хлороформ-д (Дейтериохлороформ)1». Журнал Американского химического общества . 57 (11): 2236–2237. дои : 10.1021/ja01314a058 .
- ^ Клюгер, Рональд (1964). «Удобное получение хлороформа-d1». Журнал органической химии . 29 (7): 2045–2046. дои : 10.1021/jo01030a526 .
- ^ Милый, Ганс Ульрих. «Отбеливание». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. ISBN 978-3527306732 .
- ^ «Хлордифторметан | химическое соединение» . Британская энциклопедия . Архивировано из оригинала 17 июля 2021 года . Проверено 8 сентября 2021 г.
- ^ Уайли, Греция; Миллер, С.И. (1972). «Термодинамические параметры водородной связи хлороформа с основаниями Льюиса в циклогексане. Исследование протонного магнитного резонанса». Журнал Американского химического общества . 94 (10): 3287–3293. дои : 10.1021/ja00765a001 .
- ^ Квак, К.; Розенфельд, Делавэр; Чанг, Дж. К.; Файер, доктор медицины (2008). «Динамика комплексного переключения растворенного вещества-растворителя хлороформа между ацетоном и диметилсульфоксидом - двумерная ИК-спектроскопия химического обмена» . Журнал физической химии Б. 112 (44): 13906–13915. дои : 10.1021/jp806035w . ПМК 2646412 . ПМИД 18855462 .
- ^ Перейти обратно: а б Лейкин, Джеррольд Б.; Палоучек, Фрэнк П., ред. (2008). "Хлороформ". Справочник по отравлениям и токсикологии (4-е изд.). Информация. п. 774.
- ^ Фулмер, Грегори Р.; Миллер, Александр Дж. М.; Шерден, Натаниэль Х.; Готлиб, Хьюго Э.; Нудельман, Авраам; Штольц, Брайан М.; Беркоу, Джон Э.; Гольдберг, Карен И. (2010). «Химические сдвиги следовых примесей ЯМР: обычные лабораторные растворители, органика и газы в дейтерированных растворителях, имеющие отношение к химику-металлорганику» (PDF) . Металлоорганические соединения . 29 (9): 2176–2179. дои : 10.1021/om100106e . S2CID 2755004 .
- ^ «Хлороформ (ЧЕБИ:35255)» .
- ^ «Производство, импорт/экспорт, использование и утилизация» (PDF) . atsdr.cdc.gov . Проверено 5 апреля 2023 г.
- ^ «Хлороформ как загрязнитель» . Энциклопедия мировых проблем .
- ^ Сребник, М.; Лалоэ, Э. (2001). "Хлороформ". Энциклопедия реагентов для органического синтеза . Уайли. дои : 10.1002/047084289X.rc105 . ISBN 978-0-471-93623-7 .
- ^ Фогель, Э.; Клюг, В.; Брейер, А. (1988). «1,6-Метано[10]аннулен» . Органические синтезы ; Сборник томов , т. 6, с. 731 .
- ^ Гокель, ГВ; Видера, Р.П.; Вебер, WP (1988). «Фазовая реакция карбиламина Гофмана: трет -бутилизоцианид» . Органические синтезы ; Сборник томов , т. 6, с. 232 .
- ^ Перкинс-Маквей, Мэтью (10 ноября 2023 г.). « «Новый порядок ядовитых веществ»: возвращаясь к диссертации Роберта М. Гловера о физиологических эффектах соединений брома, хлора и йода» . Архив фармакологии Наунина-Шмидеберга . 397 (5): 3343–3350. дои : 10.1007/s00210-023-02820-y . ПМИД 37947840 . Проверено 27 января 2024 г.
- ^ Гловер, Роберт М. (1 октября 1842 г.). «О физиологических и медицинских свойствах брома и его соединений; также об аналогиях между физиологическими и медицинскими свойствами этих тел, а также свойствами хлора и йода с их соответствующими соединениями; эссе на премию Гарвея за 1842 год» . Эдинбургский медицинский и хирургический журнал . 58 (153): 335–364. ПМК 5789197 . ПМИД 30330609 .
- ^ Дингуолл (апрель 2004 г.). «Новаторская история: стоматология и Королевский колледж хирургов Эдинбурга» (PDF) . Historyofdentistry.co.uk . Архивировано из оригинала (PDF) 1 февраля 2013 года.
- ^ Бэйли, ТВ (2003). «Роберт Холлидей Ганнинг и юбилейная премия Виктории» (PDF) . Шотландский медицинский журнал . 48 (2): 54–57. дои : 10.1177/003693300304800209 . ПМИД 12774598 . S2CID 10998512 . Архивировано из оригинала (PDF) 22 августа 2016 года . Проверено 18 августа 2016 г.
- ^ «Анестезия и королева Виктория» . ph.ucla.edu . Архивировано из оригинала 16 июля 2012 года . Проверено 13 августа 2012 г.
- ^ Мартин, Уильям (3 июля 1886 г.). «Случай отравления хлороформом. Выздоровление» . Британский медицинский журнал . 2 (1331): 16–17. дои : 10.1136/bmj.2.1331.16-а . ПМК 2257365 . ПМИД 20751619 .
- ^ Патель, Аманда Дж.; Оноре, Эрик; Лесаж, Флориан; Финк, Мишель; Роми, Жорж; Лаздунски, Мишель (май 1999 г.). «Ингаляционные анестетики активируют двухпоровый фон К + каналы». Nature Neuroscience . 2 . doi : 10.1038/8084 . PMID 10321245. S2CID (5): 422–426 23092576 .
- ^ Найт, Пол Р. III; Бэкон, Дуглас Р. (2002). «Необъяснимая смерть: Ханна Гринер и хлороформ» . Анестезиология . 96 (5): 1250–1253. дои : 10.1097/00000542-200205000-00030 . ПМИД 11981167 . S2CID 12865865 .
- ^ Сноу, Джон (1858). О хлороформе и других анестетиках, их действии и применении . Лондон: Джон Черчилль. стр. 82–85. Архивировано из оригинала 23 ноября 2015 года.
- ^ Аноним. (1890). «Ланцетное исследование смертности под наркозом». Ланцет . 145 (3472): 612–13.
- ^ Аноним. (1893). «Отчет комиссии журнала Lancet, назначенной для расследования вопроса применения хлороформа и других анестетиков с клинической точки зрения». Ланцет . 141 (3629): 629–38.
- ^ Ваверсик, Дж. (1997). «История хлороформного наркоза». Анестезиология и реанимация . 22 (6): 144–152. ПМИД 9487785 .
- ^ Стратманн, Линда (2003). Хлороформ: В поисках забвения . Страуд: издательство Sutton Publishing. ISBN 978-0-7524-9931-4 .
- ^ «Нокаут и хлороформ» . Филадельфийский рекорд . 9 февраля 1894 года. Архивировано из оригинала 20 января 2022 года . Проверено 31 марта 2011 г.
- ^ «Проводится повторное рассмотрение дела о хлороформе» . Рекорд-Журнал . 7 июля 1993 года. Архивировано из оригинала 6 ноября 2021 года . Проверено 31 марта 2011 г.
- ^ Кэти Фрай - Арканзасский демократический вестник (17 декабря 2003 г.). «Но не забыт» . www.arkansasonline.com . Архивировано из оригинала 7 декабря 2021 года . Проверено 7 декабря 2021 г.
- ^ «Мужчина признался, что изнасиловал дочерей друзей» . США сегодня . 6 ноября 2007 года. Архивировано из оригинала 29 апреля 2011 года . Проверено 31 марта 2011 г.
- ^ Пейн, JP (июль 1998 г.). «Преступное использование хлороформа» . Анестезия . 53 (7): 685–690. дои : 10.1046/j.1365-2044.1998.528-az0572.x . ПМИД 9771177 . S2CID 1718276 .
- ^ «Медицинская аннотация: хлороформ среди воров». Ланцет . 2 (2200): 490–491. 1865. doi : 10.1016/s0140-6736(02)58434-8 .
- ^ Ньювенхейсен, MJ; Толедано, МБ; Эллиотт, П. (8 августа 2000 г.). «Поглощение побочных продуктов дезинфекции хлорированием; обзор и обсуждение его последствий для оценки воздействия в эпидемиологических исследованиях» . Журнал анализа воздействия и экологической эпидемиологии . 10 (6, часть 1): 586–99. doi : 10.1038/sj.jea.7500139 . ПМИД 11140442 .
- ^ Группа, Экологическая работа. «База данных водопроводной воды EWG: загрязняющие вещества в вашей воде» . www.ewg.org . Проверено 8 августа 2023 г.
- ^ «Цели общественного здравоохранения в отношении тригалометанов в питьевой воде» (PDF) . oehha.ca.gov . п. 93 . Проверено 8 августа 2023 г.
- ^ Инь-Так Ву, Дэвид Ю. Лай, Джозеф К. Аркос Алифатические и полигалогенированные канцерогены: структурные основы и биологические данные. Архивировано 5 июня 2018 г. в Wayback Machine.
- ^ Перейти обратно: а б с Фан, Анна М. (2005). "Хлороформ". Энциклопедия токсикологии . Том. 1 (2-е изд.). Эльзевир. стр. 561–565.
- ^ Дженкинс, Эндрю; Гринблатт, Эрик П.; Фолкнер, Ховард Дж.; Бертаччини, Эдвард; Свет, Адам; Лин, Одри; Андреасен, Элисон; Винер, Анна; Труделл, Джеймс Р.; Харрисон, Нил Л. (15 марта 2001 г.). «Доказательства наличия общей полости для связывания трех общих анестетиков внутри рецептора ГАМКА» . Журнал неврологии . 21 (6): RC136. doi : 10.1523/JNEUROSCI.21-06-j0002.2001 . ISSN 0270-6474 . ПМК 6762625 . ПМИД 11245705 .
- ^ «Хлороформ и фосген, химическая гигиена и безопасность» . Эрлхемский колледж . Архивировано из оригинала 19 августа 2017 года . Проверено 17 августа 2017 г.
- ^ Терк, Эрик (2 марта 1998 г.). «Фосген из хлороформа» . Новости химии и техники . 76 (9): 6. doi : 10.1021/cen-v076n009.p006 . Архивировано из оригинала 24 июля 2008 года . Проверено 13 августа 2012 г.
- ^ «фосген (химическое соединение)» . Британская энциклопедия . Архивировано из оригинала 5 июня 2013 года . Проверено 16 августа 2013 г.
- ^ Маног, Вашингтон; Пигфорд, Р.Л. (сентябрь 1960 г.). «Кинетика поглощения фосгена водой и водными растворами» . Журнал Айше . 6 (3): 494–500. Бибкод : 1960АИЧЕ...6..494М . дои : 10.1002/aic.690060329 . ISSN 0001-1541 .
- ^ «Американское химическое общество: Письма о химической и технической безопасности» . pubsapp.acs.org . Проверено 18 марта 2024 г.
- ^ Ченг, Сюэхэн; Гао, Цюаньинь; Смит, Ричард Д.; Симанек, Эрик Э.; Маммен, Матаи; Уайтсайдс, Джордж М. (1996). «Характеристика агрегатов с водородными связями в хлороформе методом ионизационной масс-спектрометрии электрораспылением» . Журнал органической химии . 61 (6): 2204–2206. дои : 10.1021/jo951345g . ISSN 0022-3263 . Архивировано из оригинала 31 июля 2022 года.
- ^ «Хлороформ» (PDF) . Проверено 5 декабря 2023 г.
- ^ «40 CFR: Приложение A к Части 355 — Список чрезвычайно опасных веществ и их пороговые плановые количества» (PDF) . Свод федеральных правил (изд. от 1 июля 2008 г.). Государственная типография . Архивировано из оригинала (PDF) 25 февраля 2012 года . Проверено 29 октября 2011 г.
- ^ Шуйцюань Тан; Элизабет А. Эдвардс (2013). «Идентификация редуктивных дегалогеназ Dehalobacter, катализирующих дехлорирование хлороформа, 1,1,1-трихлорэтана и 1,1-дихлорэтана» . Philos Trans R Soc Lond B Biol Sci . 368 (1616): 20120318. doi : 10.1098/rstb.2012.0318 . ПМЦ 3638459 . ПМИД 23479748 .
- ^ Джагдер, Бат-Эрдэне; Эртан, Халук; Вонг, Йе Куан; Брейди, Нэди; Мейнфилд, Майкл; Маркиз, Кристофер П.; Ли, Мэтью (10 августа 2016 г.). «Геномный, транскриптомный и протеомный анализ Dehalobacter UNSWDHB в ответ на хлороформ». Отчеты по экологической микробиологии . 8 (5): 814–824. Бибкод : 2016EnvMR...8..814J . дои : 10.1111/1758-2229.12444 . ISSN 1758-2229 . ПМИД 27452500 .
Внешние ссылки
[ редактировать ]- Хлороформ «Молекулярный спасатель» - статья в Оксфордском университете, в которой представлены факты о хлороформе.
- Введение хлороформа - короткометражный фильм о применении анестезирующего хлороформа, снятый в 1930-х годах.
- Краткий международный документ по химической оценке 58
- Резюме и оценки IARC: Том. 1 (1972) , Том. 20 (1979) , Доп. 7 (1987) , Том. 73 (1999)
- Международная карта химической безопасности 0027
- Карманный справочник NIOSH по химическим опасностям. «#0127» . Национальный институт охраны труда и здоровья (NIOSH).
- Стандартная справочная база данных NIST
- Эндокринные разрушители
- хлоралканы
- Галометаны
- Общие анестетики
- Опасные загрязнители воздуха
- Галогенированные растворители
- Галогенсодержащие натуральные продукты
- Гепатотоксины
- Положительные аллостерические модуляторы ГАМКА-рецепторов
- Агонисты глициновых рецепторов
- Сладко пахнущие химикаты
- Трихлорметильные соединения