Фармакокинетика прогестерона
Фармакокинетика прогестерона касается фармакодинамики , фармакокинетики и различных введения прогестерона путей . [ 17 ] [ 18 ]
Прогестерон — это природный и биоидентичный прогестаген или агонист рецептора прогестерона , биологической мишени прогестагенов , таких как эндогенный прогестерон . [ 17 ] Прогестерон также обладает антиминералокортикоидной и ингибирующей нейростероидной активностью, тогда как он, по-видимому, обладает незначительной глюкокортикоидной или антиандрогенной активностью или вообще не обладает ею и не обладает андрогенной активностью. [ 17 ] Благодаря своей прогестагенной активности прогестерон оказывает функциональное антиэстрогенное действие на определенные ткани, такие как матка , шейка матки и влагалище . [ 17 ] Кроме того, прогестерон оказывает антигонадотропное действие благодаря своей прогестагенной активности и может подавлять фертильность и подавлять половых гормонов выработку . [ 17 ] Прогестерон отличается от прогестинов ( синтетических прогестагенов ), таких как медроксипрогестерона ацетат и норэтистерон , что влияет на фармакодинамику и фармакокинетику , а также на эффективность , переносимость и безопасность . [ 17 ]
Прогестерон можно принимать перорально , через влагалище , инъекцией в мышцы или жир и другими способами. [ 17 ] прогестероновое вагинальное кольцо и прогестероновая внутриматочная спираль . В качестве фармацевтических продуктов также доступны [ 19 ] [ 20 ]
Нормальные уровни
[ редактировать ]Прогестерон используется как часть заместительной гормональной терапии у людей с низким уровнем прогестерона и по другим причинам. Для сравнения с нормальными физиологическими условиями уровни прогестерона в лютеиновой фазе составляют от 4 до 30 нг/мл, в то время как уровни прогестерона в фолликулярной фазе составляют от 0,02 до 0,9 нг/мл, уровни прогестерона в менопаузе составляют от 0,03 до 0,3 нг/мл, а уровни прогестерона у мужчин — 0,12–0,3 нг/мл. [ 21 ] [ 22 ] Во время беременности уровни прогестерона в первые 4–8 недель составляют от 25 до 75 нг/мл, а при доношенном сроке уровни обычно составляют от 140 до 200 нг/мл. [ 23 ] [ 21 ] Производство прогестерона в организме на поздних сроках беременности составляет примерно 250 мг в сутки, 90% которого попадает в кровоток матери. [ 24 ]
-
Уровни прогестерона в течение менструального цикла у женщин с нормальным циклом и овуляцией . [ 25 ] Пунктирные горизонтальные линии — это средние интегральные уровни для каждой кривой, а пунктирная вертикальная линия — середина цикла (примерно в момент наступления овуляции).
-
Уровни эстрогена и прогестерона в детстве и подростковом возрасте, включая период полового созревания , у девочек. [ 26 ] [ 27 ] [ 28 ] Пунктирная вертикальная линия — средний возраст менархе (первая менструация и начало менструального цикла ).
-
Уровни эстрогена, прогестерона и 17α-гидроксипрогестерона (17α-OHP) во время беременности у женщин. [ 29 ] Пунктирные вертикальные линии разделяют триместры .
Пути введения
[ редактировать ]| Маршрут | Форма | Доза | С макс. (нг/мл) |
Т макс. (часы) |
т 1/2 (часы) | ||
|---|---|---|---|---|---|---|---|
| Оральный | Капсула | 200 мг | 4.3–11.7 | 2–2.5 | ? | ||
| Сублингвальный | Таблетка [ а ] | 100 мг | 13.5 | 1–4 | ~6–7 | ||
| Приостановка | 100 мг | 17.6 | 0.5–1 | ? | |||
| Вагинальный | Таблетка [ а ] | 100 мг | 10.9 | 6–7 | 13.7 | ||
| Капсула | 100 мг | 9.7 | 1–3 | ? | |||
| Внутримышечный инъекция |
Масляный раствор | 50 мг | 14.3 | 8.7 | ? | ||
| 100 мг | 113 | 6.7 | 22.3 | ||||
| Ак. решение [ б ] | 100 мг | 440 | 0.88 | 14.3 | |||
| Подкожный инъекция |
Ак. решение [ б ] | 25 мг | 57.8 | 0.92 | 13.1 | ||
| 50 мг | 103 | 0.92 | 17.2 | ||||
| 100 мг | 235–300 | 0.92 | 17.2–17.6 | ||||
| |||||||
| Маршрут | Форма | Доза | Название бренда | Доступность [ б ] |
|---|---|---|---|---|
| Оральный | Капсула | 100, 200, 300 мг | Прометрий [ с ] | Широко распространенный |
| Таблетки ( СР ) | 200, 300, 400 мг | Дубажест СР [ с ] | Индия | |
| Сублингвальный | Таблетка | 10, 25, 50, 100 мг | ЛЮТЕИН [ с ] | Европа [ д ] |
| Трансдермальный | Гель [ и ] | 1% (25 мг) | Прогестогель | Европа |
| Вагинальный | Капсула | 100, 200 мг | Утрожестан | Широко распространенный |
| Таблетка | 100 мг | Эндометрий [ с ] | Широко распространенный | |
| Гель | 4,8% (45,90 мг) | Кринон [ с ] | Широко распространенный | |
| Суппозиторий | 200, 400 мг | Циклогест | Европа | |
| Кольцо | 10 мг/день [ ж ] | Фертиринг [ с ] | Южная Америка [ г ] | |
| Ректальный | Суппозиторий | 200, 400 мг | Циклогест | Европа |
| маточный | ВМС | 38 мг | Прогестасерт | Снято с производства |
| Внутримышечный инъекция |
Масляный раствор | 2, 5, 10, 20, 25, 50, 100 мг/мл |
Пролутон [ с ] | Широко распространенный |
| Ак. подозрение | 12,5, 30, 100 мг/мл | Аголут [ с ] | Европа [ ч ] | |
| Эмульсия | 5, 10, 25 мг/мл | Ди-Про-Эмульсия | Снято с производства | |
| Микросф. | 20, 100 мг/мл | ПроСфера [ с ] | Мексика | |
| Подкожный | Ак. раствор. ( инж. ) | 25 мг/флакон | Пролютекс | Европа |
| Имплантат | 50, 100 мг | Пролутон [ с ] | Снято с производства | |
| внутривенный | Ак. раствор. ( инж. ) | 20 мг/мл | Примолют | Снято с производства |
Источники и сноски: | ||||
Фармакокинетика прогестерона зависит от пути его введения . Препарат одобрен в форме маслом наполненных капсул, содержащих микронизированный прогестерон для перорального применения , называемых «микронизированный прогестерон для перорального применения» («OMP») или просто «прогестерон для перорального применения». [ 41 ] Он также доступен в форме вагинальных или ректальных суппозиториев , вагинальных гелей , масляных растворов для внутримышечных инъекций и водных растворов для подкожных инъекций и других. [ 41 ] [ 13 ] [ 42 ]
Пути введения прогестерона включают пероральные , интраназальные , трансдермальные , вагинальные , ректальные , внутримышечные , подкожные и внутривенные инъекции . [ 13 ] Было обнаружено, что пероральный прогестерон уступает вагинальному и внутримышечному прогестерону с точки зрения абсорбции (низкая) и скорости клиренса (быстрая). [ 13 ] Вагинальный прогестерон доступен в форме прогестеронового геля , колец , суппозиториев или пессариев . [ 13 ] Преимущества интравагинального прогестерона перед пероральным введением включают высокую биодоступность , быструю абсорбцию , отсутствие метаболизма первого прохождения , устойчивые концентрации в плазме и местный эффект на эндометрий , в то время как преимущества интравагинального прогестерона по сравнению с внутримышечными инъекциями включают большее удобство и отсутствие боли в месте инъекции. [ 13 ]
Интраназальный прогестерон в виде назального спрея эффективен для достижения терапевтического уровня и не вызывает раздражения носа, но связан с неприятным вкусом спрея. [ 13 ] Ректальный, внутримышечный и внутривенный пути введения могут быть неудобными, особенно при длительном лечении. [ 13 ] Уровни прогестерона в плазме после вагинального и ректального введения одинаковы, несмотря на разные пути введения, а ректальное введение является альтернативой вагинальному прогестерону в условиях вагинальной инфекции , цистита , недавних родов или при барьерных методов контрацепции . использовании [ 13 ] Внутримышечная инъекция прогестерона может обеспечить гораздо более высокие уровни прогестерона, чем нормальные концентрации в лютеиновой фазе и уровни, достигаемые другими путями. [ 13 ]
Пероральное введение
[ редактировать ]Методологические проблемы в исследованиях
[ редактировать ]Знания о фармакокинетике перорального прогестерона осложняются использованием ошибочных аналитических методов . [ 43 ] [ 44 ] [ 45 ] При пероральном приеме прогестерона из-за метаболизма первого прохождения очень высокие уровни его метаболитов . возникают [ 43 ] [ 44 ] [ 45 ] В большинстве предыдущих исследований для измерения уровня прогестерона использовался метод, известный как иммуноанализ (IA). [ 43 ] [ 44 ] [ 45 ] Однако ИА без хроматографического разделения (ХС) обладает высокой перекрестной реактивностью и не способен дифференцировать прогестерон и его метаболиты, такие как аллопрегнанолон и прегнанолон . [ 43 ] [ 44 ] [ 45 ] В результате исследования, оценивавшие фармакокинетику перорального прогестерона с использованием IA, сообщили о ложно высоких уровнях прогестерона и неточных зависимых фармакокинетических параметрах. [ 43 ] [ 44 ] [ 45 ]
Сравнительные исследования с использованием надежных и точных методов, таких как жидкостная хроматография-масс-спектрометрия (ЖХ-МС) и ИА в сочетании с адекватным ХС, показали, что ИА без ХС завышает уровень прогестерона в 5-8 раз. [ 43 ] [ 44 ] [ 45 ] По этой причине использование надежных методов анализа является обязательным при изучении фармакокинетики перорального прогестерона, а понимание этих методологических вопросов также важно для точного понимания фармакокинетики перорального прогестерона. [ 43 ] [ 44 ] [ 45 ] И наоборот, те же проблемы не применимы к парентеральным путям введения прогестерона, таким как вагинальное введение и внутримышечные инъекции, поскольку эти пути не подлежат первому прохождению и образуются относительно низкие уровни метаболитов прогестерона. [ 43 ] [ 44 ] [ 45 ]
Абсорбция, биодоступность и уровни
[ редактировать ]биодоступность Пероральная прогестерона очень низкая. [ 46 ] Исследования с использованием IA обычно показали, что биодоступность перорального прогестерона составляет менее 10%. [ 46 ] при этом в одном исследовании сообщалось о значениях от 6,2 до 8,6%. [ 47 ] [ 12 ] Однако эти значения являются завышенными; исследование с использованием ЖХ-МС показало, что биодоступность перорального прогестерона составляет всего 2,4% по сравнению с вагинальным гелем прогестерона. [ 1 ] Более того, это не было связано со стандартом прогестерона для внутримышечных инъекций, который имеет гораздо более высокую биодоступность, чем вагинальный прогестерон. [ 48 ] [ 4 ] Очень низкая биодоступность перорального прогестерона обусловлена тем, что он плохо всасывается из желудочно-кишечного тракта и подвергается массивному метаболизму , приводящему к практически полной инактивации при первом прохождении через печень . [ 46 ] [ 49 ] Из-за его плохой биодоступности при пероральном приеме для достижения значительных уровней прогестерона в крови необходимо применять очень высокие дозы прогестерона перорально. [ 46 ] Кроме того, сегодня пероральный прогестерон всегда микронизируется и суспендируется в масле. [ 46 ] [ 41 ] [ 48 ] [ 50 ] Это значительно улучшает биодоступность перорального прогестерона по сравнению с обычным измельченным прогестероном и позволяет использовать его в практических дозах. [ 46 ] Когда используется термин «пероральный прогестерон», в клинической практике и почти всегда имеется в виду, если не указано иное, микронизированный прогестерон, суспендированный в масле . [ 46 ] [ 17 ] [ 43 ]
Микронизация – это процесс уменьшения среднего диаметра частиц материала твердого . [ 33 ] Путем микронизации прогестерона его частицы становятся меньше (в основном <10 мкм), а площадь его поверхности увеличивается, тем самым улучшая всасывание из кишечника . [ 46 ] [ 33 ] Суспензия и частичная солюбилизация [ 51 ] Содержание прогестерона в масле, содержащем со средней и длинной цепью, жирные кислоты также улучшает биодоступность перорального прогестерона. [ 17 ] [ 52 ] [ 53 ] Прогестерон является липофильным соединением, и было высказано предположение, что суспензия прогестерона в масле может улучшить его всасывание лимфатической системой , тем самым позволяя части перорального прогестерона обойти первое прохождение через печень и, следовательно, повысить его биодоступность. [ 46 ] [ 54 ] [ 55 ] [ 56 ] По сравнению с просто измельченным прогестероном пиковые уровни прогестерона после однократного перорального приема 200 мг увеличивались в 1,4 раза при микронизации, в 1,2 раза при применении суспензии в масле и в 3,2 раза при сочетании микронизации и суспензии в масле. [ 56 ] Пероральный микронизированный прогестерон, суспендированный в масле, быстро и почти полностью всасывается из кишечника. [ 14 ] Существует широкая индивидуальная вариабельность биодоступности перорального прогестерона. [ 17 ] [ 12 ] Поскольку прогестерон не применялся перорально в течение многих десятилетий из-за его плохой биодоступности (до появления в 1980 году перорального микронизированного прогестерона в желатиновых капсулах, наполненных маслом), [ 48 ] пероральные прогестины ( синтетические прогестагены) с улучшенной метаболической стабильностью и высокой пероральной биодоступностью. Были разработаны и вместо этого использовались в клинической практике [ 57 ]
Когда пероральный прогестерон используется в типичных клинических дозах, с помощью надежных методов измеряется только очень низкий уровень прогестерона. [ 43 ] [ 44 ] [ 45 ] После однократного перорального приема прогестерона пиковые уровни прогестерона составляли от 1,5 до 2,4 нг/мл при приеме 100 мг и от 2,8 до 4,7 нг/мл при приеме 200 мг с помощью ЖХ-МС, жидкостной хроматографии-тандемной масс-спектрометрии (ЖХ-МС/ЖХ-МС/ЖХ-МС). MS) и IA с адекватным CS. [ 43 ] [ 58 ] [ 1 ] В одном из таких исследований, хотя пиковые уровни прогестерона составляли 2,2 нг/мл после однократного перорального приема 100 мг прогестерона, уровни прогестерона оставались значительно повышенными в течение менее чем 4 часов, а средние уровни прогестерона в течение 24 часов составляли всего 0,14 нг/мл. [ 45 ] [ 1 ] Для сравнения, нормальный уровень прогестерона во время лютеиновой фазы менструального цикла с помощью ЖХ-МС/МС составляет от 6,7 до 22,2 нг/мл. [ 59 ] Когда для измерения уровня прогестерона при пероральном применении использовался только IA, после однократного приема 100, 200 и 32,3–49,8 нг/мл наблюдались гораздо более высокие пиковые уровни: от 6,5 до 10,2 нг/мл, от 13,8 до 19,9 нг/мл и от 32,3 до 49,8 нг/мл. Дозы 300 мг соответственно. [ 47 ] [ 12 ] В одном исследовании, проведенном на базе IA, даже сообщалось о максимальном уровне прогестерона от 16 до 626 нг/мл (в среднем 247 нг/мл) при однократном пероральном приеме прогестерона в дозе 300 мг. [ 60 ] [ 61 ]
Когда пероральный прогестерон принимается во время еды, а не натощак, пиковые и общие уровни прогестерона значительно выше. [ 8 ] [ 12 ] [ 7 ] Исследование с использованием ЖХ-МС/МС показало, что при пероральном приеме 100 мг прогестерона в течение 30 минут после приема пищи с высоким содержанием жиров пиковые уровни прогестерона были в 2,6 раза выше, а уровни площади под кривой - в 1,8 раза. выше по сравнению с приемом натощак. [ 8 ] В другом исследовании пиковые уровни прогестерона увеличивались в 5 раз, а уровни площади под кривой — в 2 раза, когда 200 мг прогестерона перорально принимались во время еды. [ 12 ] Однако в этом исследовании использовался ненадежный метод IA для количественного определения уровня прогестерона. [ 12 ] Хотя биодоступность перорального прогестерона увеличивается, если его принимать с пищей, его общая биодоступность все еще низкая, даже если ее измерять с помощью IA. [ 18 ] Было высказано предположение, что улучшение уровня прогестерона при пероральном приеме прогестерона с пищей может быть связано с усилением лимфатической абсорбции, что позволяет пероральному прогестерону частично обходить метаболизм первого прохождения. [ 12 ] [ 46 ] [ 54 ] [ 55 ]
Устранение и продолжительность
[ редактировать ]Уровни прогестерона при пероральном приеме прогестерона были измерены ненадежным методом IA и оставались повышенными в течение 12–24 часов. [ 1 ] [ 41 ] Независимо от метода анализа, пиковые уровни прогестерона после перорального приема прогестерона наблюдаются примерно через 1–3 часа. [ 44 ] Период полувыведения прогестерона из кровотока очень короткий и составляет от 3 до 90 минут. [ 14 ] Предыдущие исследования с использованием IA сообщали о завышенном периоде полувыведения перорального прогестерона, составлявшем около 16–18 часов. [ 41 ] Последующие надежные исследования с использованием высокоэффективной жидкостной хроматографии – тандемной масс-спектрометрии (ВЭЖХ-МС/МС) и подобных методов сообщили о периоде полувыведения прогестерона при пероральном приеме прогестерона примерно от 4,6 до 5,2 часов и 9,98 часа при его приеме с пищей. [ 7 ] [ 8 ] Из-за короткого периода полувыведения и продолжительности действия перорального прогестерона его можно принимать разделенными дозами два или три раза в день. [ 41 ] [ 62 ] [ 63 ]
Эффект первого прохождения и нейростероиды
[ редактировать ]
Прогестерон метаболизируется в аллопрегнанолон и прегнанолон, которые являются нейростероидами и мощными ГАМК А. рецептора потенциаторами [ 65 ] [ 66 ] Превращение прогестерона в эти метаболиты катализируется ферментами 5α- и - 5β редуктазой и 3α-гидроксистероиддегидрогеназой и происходит преимущественно в печени , но также происходит в репродуктивных эндокринных тканях , коже , мозге и других тканях. [ 67 ] Из-за интенсивного метаболизма первого прохождения при пероральном прогестероне около 80–90% или более прогестерона быстро трансформируются в эти метаболиты, в результате чего образуются огромные количества этих нейростероидов, которые циркулируют по всему телу и мозгу. [ 68 ] [ 69 ] [ 70 ] [ 71 ] Именно по этой причине часто сообщаемые побочные эффекты перорального прогестерона включают головокружение , сонливость , седативный эффект , сонливость и усталость . [ 65 ] [ 66 ] Как пероральные, так и достаточно высокие дозы прогестерона внутримышечно могут оказывать седативный эффект. [ 72 ] [ 73 ] [ 74 ] Однако по сравнению с пероральным прогестероном уровни этих нейростероидов оказались очень низкими при парентеральном введении, таком как вагинальный и внутримышечный прогестерон. [ 64 ] [ 75 ] Как и в случае с биодоступностью перорального прогестерона, существует высокая межиндивидуальная вариабельность образования и уровней аллопрегнанолона и прегнанолона с пероральным прогестероном. [ 17 ] В результате некоторые люди могут испытывать значительные центральные депрессивные эффекты при пероральном приеме прогестерона, тогда как у других такие эффекты могут быть минимальными. [ 17 ]
При пероральном применении прогестерона аллопрегнанолон и прегнанолон циркулируют в более высоких концентрациях, чем прогестерон. [ 17 ] [ 64 ] Эти нейростероидные метаболиты прогестерона имеют относительно короткий биологический период полураспада в кровообращении . [ 76 ] [ 77 ] Из-за этого наблюдаются резкие и весьма супрафизиологические скачки концентрации аллопрегнанолона и прегнанолона, за которыми следует резкое снижение при каждом пероральном приеме прогестерона. [ 69 ] [ 70 ] [ 64 ] Таким образом, уровни нейростероидов существенно колеблются (например, в 15 раз в случае аллопрегнанолона) и нефизиологично при пероральной терапии прогестероном. [ 69 ] [ 71 ] Кроме того, употребление пищи с пероральным прогестероном увеличивает его абсорбцию в 2 раза, что также может дополнительно усиливать колебания уровня нейростероидов, особенно если прием пищи с прогестероном не является постоянным от дозы к дозе. [ 12 ]
В отличие от перорального введения, парентеральное введение прогестерона, например, при вагинальном введении, позволяет избежать эффекта первого прохождения и не связано с супрафизиологическими уровнями метаболитов нейростероидов, а также со скачками или заметными колебаниями уровней нейростероидов. [ 69 ] Вместо перорального введения можно использовать парентеральный путь, чтобы избежать побочных эффектов, связанных с колебаниями уровня нейростероидов, если они окажутся проблематичными. [ 71 ] [ 17 ] Более низкие дозы перорального прогестерона (например, 100 мг/день) также связаны с относительно сниженным образованием метаболитов нейростероидов и также могут помочь облегчить такие побочные эффекты. [ 17 ] Кроме того, было обнаружено, что ингибитор 5α-редуктазы дутастерид , который блокирует выработку аллопрегнанолона (но не прегнанолона) из прогестерона, уменьшает симптомы предменструального синдрома. [ 78 ]
Прегненолон , отпускаемая без рецепта добавка и близкий аналог прогестерона, широко превращается в нейростероиды, такие как аллопрегнанолон и прегнанолон, при пероральном приеме аналогично прогестерону. [ 79 ] [ 80 ] [ 81 ] [ 82 ] И наоборот, этого не наблюдалось при чрескожном введении прегненолона. [ 82 ]
Клиническая прогестагенная активность и эффекты
[ редактировать ]Из-за исследований, в которых использовался IA, в течение многих лет ошибочно полагали, что пероральный прогестерон может легко достичь уровней прогестерона в лютеиновой фазе или выше и может оказывать значительное прогестагенное действие. [ 43 ] [ 44 ] [ 45 ] В действительности, очень низкие уровни прогестерона при пероральном введении, измеренные надежными методами, такими как ЖХ-МС, кажутся недостаточными для устойчивого прогестагенного эффекта. [ 45 ] [ 1 ] Об этом свидетельствует тот факт, что, в отличие почти от всех прогестинов, повышенный риск рака эндометрия при сочетании перорального прогестерона с эстрогеном при гормональной терапии в менопаузе. наблюдается [ 45 ] [ 1 ] Эти данные позволяют предположить, что типичные клинические дозы перорального прогестерона могут быть недостаточными для полной защиты эндометрия. [ 45 ] [ 1 ] Однако, несмотря на очень низкие уровни прогестерона, типичные клинические дозы перорального прогестерона эффективны для предотвращения эстроген-индуцированной гиперплазии эндометрия . [ 43 ] [ 44 ] С другой стороны, пероральный прогестерон не обеспечивает полной секреторной трансформации эндометрия и считается непригодным для использования в вспомогательных репродуктивных технологиях , тогда как вагинальный и внутримышечный прогестерон эффективны. [ 83 ] [ 68 ] Даже пероральный прогестерон в дозе 600 мг/день, что является очень высокой дозой, не вызывает полных изменений лютеиновой фазы эндометрия. [ 71 ] хотя, как сообщается, дозы прогестерона от 300 до 600 мг/день перорально использовались для поддержки лютеина при вспомогательных репродуктивных технологиях. [ 68 ] Исследования о том, оказывает ли пероральный немикронизированный прогестерон термогенный эффект, показали противоречивые результаты в различных исследованиях. [ 84 ]
Низкие уровни прогестерона при пероральном приеме прогестерона могут также объяснить его различия в риске рака молочной железы и венозной тромбоэмболии по сравнению с прогестагенами при добавлении к терапии эстрогенами у женщин в постменопаузе. [ 45 ] Такие риски повышаются прогестинами, которые являются агонистами PR, сходными с прогестероном, но было обнаружено, что они повышаются в меньшей степени или вообще не повышаются при пероральном прогестероне. [ 44 ] [ 45 ] Поскольку типичные клинические дозы перорального прогестерона достигают очень низких уровней прогестерона, а прогестероновая терапия с уровнями прогестерона в лютеиновой фазе никогда не оценивалась должным образом в достаточно крупных клинических исследованиях, было высказано мнение, что прогестерон каким-то образом отличается от прогестинов и не повышает уровень прогестерона. риск рака молочной железы или венозной тромбоэмболии необоснован. [ 44 ] [ 45 ] [ 58 ] Более того, при отсутствии достаточных данных об обратном было бы разумно рассматривать прогестерон, по крайней мере, эквивалентный прогестинам, как потенциальный фактор риска таких осложнений. [ 44 ] [ 45 ] [ 58 ] Действительно, доклинические исследования предполагают канцерогенную роль прогестерона в молочной железе . [ 85 ] а французское исследование E3N выявило значительно более высокий риск рака молочной железы при терапии эстрогенами и пероральным прогестероном у женщин в постменопаузе после длительного (>5 лет) приема. [ 44 ] [ 45 ] Это потенциально согласуется со слабым пролиферативным эффектом перорального прогестерона на молочные железы, так что для проявления увеличения риска рака молочной железы может потребоваться более длительная продолжительность воздействия. [ 44 ] [ 45 ]
Препарат с пролонгированным высвобождением
[ редактировать ]Таблетированная форма перорального микронизированного прогестерона с пролонгированным высвобождением (также известная как «пероральный натуральный микронизированный прогестерон с замедленным высвобождением» или «пероральный NMP SR») продается в Индии под торговыми марками Dubagest SR, Gestofit SR и Susten SR, среди других. [ 86 ] [ 87 ] [ 88 ] [ 89 ] [ 90 ] [ 91 ] [ 92 ] [ 93 ] [ 94 ] Он демонстрирует медленный и плавный профиль высвобождения прогестерона в течение 24 часов и имеет период полувыведения 18 часов. [ 86 ] [ 93 ] Это приводит к более стабильному и устойчивому уровню прогестерона, а также к минимизации связанных с нейростероидами побочных эффектов перорального прогестерона, таких как седативный эффект. [ 86 ] [ 93 ]
Галерея
[ редактировать ]-
Уровни прогестерона, измеренные методом ЖХ-МС/МС, после однократного приема или непрерывного приема 100 мг перорального микронизированного прогестерона в дозе 100 мг с пищей в течение 7 дней у женщин в постменопаузе. [ 95 ] Горизонтальная пунктирная линия представляет собой средний интегральный уровень за 24 часа. [ 95 ]
-
Уровни прогестерона, измеренные с помощью РИА или ЖХ-МС, после однократного приема 100 мг микронизированного прогестерона перорально или вагинально у женщин в постменопаузе. [ 1 ] [ 44 ] Уровни перорального прогестерона, измеренные с помощью РИА, являются ложно высокими из-за перекрестной реактивности, тогда как уровни, измеренные с помощью ЖХ-МС, являются надежными и точными. [ 96 ]
Buccal administration
[edit]Progesterone has been studied for use by buccal administration.[17][99][100][101][102][103][104] The medication has been marketed in the form of buccal tablets under the brand names Progesterone Lingusorbs, Lutocylol, Membrettes, and Syngestrets, although these products are no longer available.[105][106] The clinical dosage of buccal progesterone has been described as 10 to 50 mg/day relative to 5 to 60 mg/day in the case of intramuscular injection.[105]
Sublingual administration
[edit]
A micronized tablet formulation of progesterone marketed under the brand name Luteina is indicated for use by sublingual administration in addition to the vaginal route and is approved for use in Poland and Ukraine.[109] Sublingual progesterone may also be available from compounding pharmacies in countries like the United States.[110] Progesterone is used by the sublingual route at dosages of 50 to 150 mg three to four times per day.[109][9] A single 100 mg sublingual dose of Luteina has been found to reach mean peak progesterone levels of 13.5 ng/mL after 1 to 4 hours, with an elimination half-life of about 6 to 7 hours.[109][9]
A number of other studies have also investigated the use of progesterone by sublingual administration.[111][112][113][108] Older studies have also explored sublingual progesterone.[114][115][116][117] A study of sublingual progesterone for luteal support in patients undergoing embryo transfer found that after sublingual administration of 50 or 100 mg progesterone dissolved in a 1 mL suspension, peak levels of progesterone were reached in 30 to 60 minutes and were on average 17.61 ± 3.78 ng/mL with the 100-mg dose.[111][112] However, the duration was short, with levels of less than 5 ng/mL at 6 hours, and re-administration had to be done two or three times per day for adequate circulating levels of progesterone to be maintained throughout the day.[111][112] Another study found that sublingual progesterone had to be administered at a dose of 400 mg every 8 hours to achieve circulating levels similar to those produced by 100 mg/day intramuscular progesterone.[111] One study administered 400 mg sublingual progesterone three times per day and achieved mean progesterone levels of 57.8 ± 37.4 ng/mL, which were similar to those produced by 50 mg/day intramuscular progesterone.[112]
Intranasal administration
[edit]Progesterone has been evaluated by the intranasal route, in the form of a nasal spray, in one study.[111][17][118][119] Progesterone levels were low and insufficient in terms of endometrial changes.[71]
Transdermal administration
[edit]Progesterone for transdermal administration is not approved by the FDA in the United States.[120][121][58] Multiple pharmaceutical companies have pursued the development of systemic transdermal progesterone formulations, but ultimately none have successfully been developed and introduced for clinical use.[122] Although no formulations of transdermal progesterone are approved for systemic use, a 1% topical gel formulation of progesterone for local use on the breasts is approved to treat breast pain under the brand name Progestogel in various countries.[123][48][124]
Although no formulations of transdermal progesterone are approved for systemic use, transdermal progesterone is available in the form of creams and gels from custom compounding pharmacies in some countries, and is also available over-the-counter without a prescription in the United States.[120][121][58] Transdermal progesterone has been used by thousands of women as a component of menopausal hormone therapy in the United States and Europe.[120] However, these products are unregulated and have not been clinically tested, often with little being known about their pharmacokinetics.[120] In addition, the absorption of transdermal progesterone may differ significantly from formulation to formulation due to widely varying ingredients.[121] Moreover, the systemic effectiveness of transdermal progesterone in producing therapeutic progestogenic effects, most importantly adequate endometrial protection against estrogens, is controversial.[120][121]
Some unregulated transdermal progesterone products contain "wild yam extract" derived from Dioscorea villosa, but there is no evidence that the human body can convert its active ingredient (diosgenin, the plant steroid that is chemically converted to produce progesterone industrially)[125] into progesterone.[126][127]
Absorption and distribution
[edit]
The skin permeability of a compound is based on its physicochemical properties, particularly lipophilicity and hydrophilicity.[17][128] In general, the more polar groups, for instance hydroxyl groups, that are present in a steroid, and hence the more hydrophilic and less lipophilic it is, the lower its skin permeability.[17][128] For this reason, progesterone and estrone have higher skin permeability, estradiol has moderate skin permeability, and estriol and cortisol have lower skin permeability.[17] The transdermal bioavailability of progesterone applied to the breasts is approximately 10%.[122][129][130][131] This is roughly the same as that of the general transdermal absorption of estradiol and testosterone, although applied to other skin sites.[122][132][133][134] The site of application of transdermal progesterone may influence its absorption.[121] A study observed a significant increase in circulating levels of progesterone shortly after administration when it was applied as a transdermal ointment to the breasts but not when it was applied to other areas like the thigh or abdomen.[121]
Whereas estradiol circulates at levels in the picomolar range (pg/mL), progesterone circulates at concentrations in the nanomolar range (ng/mL), and a relatively large dose is required to produce these levels.[135][71] The body synthesizes about 25 mg of progesterone per day on average during the luteal phase.[18][111][71] This relatively large quantity by weight has been claimed to require around 50% of the body to be used as a surface of absorption to deliver a similar quantity of progesterone on the basis of its absorption mechanics.[18][111] As such, the transdermal route cannot easily achieve adequate circulating progesterone levels, and this makes transdermal progesterone impractical for systemic therapy.[18][111][135][71] Clinical studies have found only very low circulating levels of progesterone with the use of transdermal progesterone, and these levels are thought to be insufficient to confer endometrial protection against estrogens.[120][121] The range of circulating levels of progesterone that has been observed in clinical studies with various formulations and doses of transdermal progesterone is 0.38 to 3.5 ng/mL.[48][120]
Although very low levels of progesterone have been observed in venous blood with transdermal progesterone, very high and in fact greatly supraphysiological levels of progesterone have unexpectedly been found in saliva and capillary blood.[120][121][136] In one study, the levels of progesterone in saliva and capillary blood were 10- and 100-fold greater than levels in venous blood, respectively.[120][121][136] Levels of salivary progesterone that have been observed have ranged from 2.9 to 2,840 ng/mL.[48] The high salivary and capillary blood levels of progesterone suggest that despite low circulating levels of progesterone, systemic distribution of progesterone and considerable exposure of some tissues to the hormone may be occurring with transdermal progesterone somehow.[120][121][136] However, the few clinical studies that have assessed the effects of transdermal progesterone on the endometrium have had mixed findings, and further research is needed to determine whether it can confer adequate endometrial protection as a component of menopausal hormone therapy.[120][121]
Transdermal progesterone is usually supplied in the form of creams and water-based gels, and the studies in which very low levels of progesterone in circulation were observed with transdermal progesterone used these formulations.[120][121] One study of 100 mg/day transdermal progesterone in the form of an alcohol-based gel found relatively high concentrations of progesterone in circulation that corresponded to luteal-phase levels.[120][121] The peak levels of progesterone were 8 ng/mL and were theoretically sufficient to confer endometrial protection.[120][121] These findings, although based on a single study, suggest that alcohol-based progesterone gels might yield relatively high levels of circulating progesterone.[120][121] One possible explanation for the difference is that progesterone creams are more lipophilic and may have a preference for uptake into the fatty layer under the skin.[121] Conversely, alcohol-based gels are more water-soluble and may rapidly distribute into the microcirculation of the skin and then into the general circulation.[121] However, in another study that investigated the pharmacokinetics of transdermal progesterone using either a hydrophilic-, lipophilic-, or emulsion-type base, it was found that in all three cases that the time to peak concentrations was around 4 hours and the venous blood levels observed were very low.[11]
High levels in saliva and capillary blood
[edit]On the basis of the very low levels of progesterone observed in venous blood with transdermal progesterone, some researchers have concluded that transdermal progesterone is not well-absorbed and will not allow for adequate endometrial protection.[136][121] However, in spite of very low levels of progesterone in circulation, studies that have measured levels of progesterone in saliva and/or capillary blood with transdermal progesterone have found that they are dramatically elevated and in fact greatly supraphysiological.[120][121][136] In one study that used an oil-based cream or water-based gel, salivary and fingertip capillary blood levels of progesterone were found to be approximately 10-fold and 100-fold greater than venous blood levels, respectively.[120][136] The exact levels of progesterone were 4 to 12 ng/mL in saliva and 62 to 96 ng/mL in capillary blood; the reference ranges of progesterone in saliva and capillary blood from a cited laboratory were 0.75 to 2.5 ng/mL and 3.3 to 22.5 ng/mL for premenopausal women in the luteal phase and 0.12 to 1.0 ng/mL and 0.1 to 0.8 ng/mL in postmenopausal women, respectively.[120][136] As such, these data confirm distribution of progesterone to at least certain tissues with transdermal progesterone in spite of very low levels of progesterone in circulation and indicate that progesterone levels in venous blood cannot necessarily be used as an index of tissue exposure to progesterone with this route of administration.[120][121] These findings provide a possible explanation for how some studies found antiproliferative and atrophic changes in the endometrium with transdermal progesterone.[136][121] However, elevated levels of progesterone in the endometrium with transdermal progesterone have yet to be demonstrated.[121]
Concern has been raised regarding transdermal progesterone in that the effects of such supraphysiological levels of progesterone in tissues are unknown and hence the potential for adverse effects has not been ruled out.[120] Salivary monitoring of progesterone levels in women using transdermal progesterone and adjustment of dosage as necessary has been suggested as a possible means to help prevent potential adverse effects.[120]
The mechanism by which transdermal progesterone in cream and water-based gel produces very high salivary and capillary blood levels in spite of low circulating levels is not well-understood.[120] However, at least two hypotheses have been proposed.[121][137] Steroid hormones including progesterone have been found to be transported by red blood cells in addition to serum carrier proteins like albumin, sex hormone-binding globulin, and corticosteroid-binding globulin, and as much as 15 to 35% of total steroid hormone content in whole blood may be confined to red blood cells.[121] According to the hypothesis, very high local concentrations of progesterone occur in skin capillaries after transdermal application and are taken up by red blood cells.[121] The transit time of red blood cells from capillaries and the release of steroid hormones from red blood cells are both very rapid, so it is suggested that progesterone is delivered through circulation to tissues via red blood cells without having time to equilibrate with systemic blood.[121] This could potentially explain the low levels of progesterone in venous blood in spite of very high levels in capillary blood and saliva.[121] However, one study assessed progesterone levels in red blood cells with transdermal progesterone and found that they were significantly increased but still very low.[121] Nonetheless, according to other authors, "[a]lthough the investigators of that study concluded that the progesterone levels in red blood cells were too low to be important in the delivery of progesterone to target tissues, it should be realized that even small amounts of progesterone taken up by red blood cells might be important because the transit time of red blood cells from capillaries is very rapid. [...] However, the role of red blood cells in steroid hormone transport has not been studied thoroughly, and such studies are warranted."[121]
An in vitro study using porcine skin and several formulations of transdermal progesterone found that only minute quantities of progesterone penetrated through the skin but that there was significant partitioning of progesterone in the skin tissues.[137] According to the researchers, the results suggested that lymphatic circulation in the skin might account for systemic distribution of transdermal progesterone.[137]
Metabolism and elimination
[edit]5α-Reductase is a major enzyme involved in the metabolism of progesterone and is known to be expressed in skin in high amounts.[138][121] For this reason, it has been suggested that rapid metabolism of progesterone by 5α-reductase could account for the low levels of circulating progesterone produced by transdermal application.[121] Studies of progesterone have reported that when progesterone is administered transdermally, 80% is metabolized in the skin and only 20% is likely to pass the skin barrier.[139][140] Along these lines, a study of radiolabeled progesterone found that 5β-reduced pregnanediol excretion was 8-fold higher than 5α-reduced allopregnanediol excretion with intravenous progesterone yet allopregnanediol excretion was slightly higher than pregnanediol excretion with transdermal progesterone.[141] The metabolites of progesterone in the skin seem to have no hormonal activity.[139] In addition to 5α-reductase, other enzymes, such as 20α-hydroxysteroid dehydrogenase, metabolize progesterone in the skin.[138] Progesterone and/or its metabolites such as 5α-dihydroprogesterone act as 5α-reductase inhibitors and inhibitors of 3α- and 3β-hydroxysteroid dehydrogenases in the skin.[138]
On the other hand, other research has cast doubt on the notion that progesterone is robustly metabolized in the skin.[121] One study reported that transdermal progesterone in an alcohol-based gel produced high levels of circulating progesterone.[121] This suggests that formulation rather than metabolism might be a critical limiting factor for the bioavailability of transdermal progesterone.[121] A study assessed urinary levels of pregnanediol glucuronide, the major metabolite of progesterone in urine, and found that although circulating progesterone levels and urinary levels of pregnanediol glucuronide increased after treatment with transdermal progesterone, the levels of both nonetheless remained in the range of the follicular phase and hence were very low.[121] A case report found that the 5α-reductase inhibitor finasteride did not increase the circulating progesterone levels or urinary pregnanediol glucuronide levels produced by transdermal progesterone.[121] Likewise, a study found that the 5α-reductase inhibitor dutasteride resulted in only slightly higher progesterone levels with transdermal progesterone.[142][143][144][48] Finally, 5α-reductase is also a major enzyme involved in the metabolism of testosterone, yet transdermal testosterone is approved for androgen replacement therapy and is very effective in raising testosterone levels.[145]
In terms of elimination, a study that investigated the pharmacokinetics of transdermal progesterone using either a hydrophilic-, lipophilic-, or emulsion-type base found that in all three cases the elimination half-life was in the range of 30 to 40 hours.[11]
Systemic clinical effectiveness
[edit]At least seven studies have assessed transdermal progesterone.[120][121] In these studies, different formulations of transdermal progesterone including creams and water-based gels (brand names Pro-Gest, Progestelle, and Pro-Femme, as well as compounded) were used, with different sample sizes (n = 6 to n = 40), at different dosages (15 to 80 mg per day), and for different durations of treatment (1.4 to 24 weeks).[120][121] Venous blood progesterone levels were assessed and reported in five of the studies and in all cases were low and found not to exceed 3.5 ng/mL.[120][121] It is generally accepted that progesterone levels of 5 ng/mL are necessary to inhibit mitosis and induce secretory changes in the endometrium,[120] although some researchers have been disputed this contention.[121] Effects on the endometrium of transdermal progesterone were assessed in three of the studies via endometrial biopsy and the results were mixed.[120][121] In one study, there was no effect; in another, antiproliferative effects were observed; and in the last study, an atrophic state was observed but only in 28 of 40 (70%) of the women.[120][121] Circulating progesterone levels were reported as less than 3.5 ng/mL in the first study, low and widely variable in the second study, and were not given in the third study.[120][121] Moreover, the duration of the study in which no effect was observed was short at only 2 weeks, and a longer treatment period of 4 to 6 weeks is necessary to produce endometrial changes.[120][121] It has also been suggested that the dosage of estrogen used may have been insufficient to allow for proper priming of the endometrium for progesterone to act.[121] Taken together, further studies are required to adequately establish a protective effect of transdermal progesterone on the endometrium.[120]
Local application to the breasts
[edit]Transdermal application of progesterone with the intention of systemic therapy should not be equated with local treatment.[48] The site of application of transdermal progesterone has been found to significantly influence its absorption.[121] When transdermal progesterone is applied to the breasts, high concentrations within breast tissue have been observed.[122] In one study, a 3- to 5-fold increase in local progesterone levels in the breast was observed with 50 mg transdermal progesterone in an alcohol/water-based gel applied to each breast in premenopausal women.[122][129][146] In another study, a 70- to 110-fold increase in local concentrations of progesterone in the breasts was measured with application of a hydroalcoholic gel to the breasts in premenopausal women.[147][148] A study observed a significant increase in circulating levels of progesterone when it was applied as a topical ointment to the breasts but not when it was applied to other areas like the thigh or abdomen.[121] However, two other studies observed no apparent increase in circulating levels of progesterone with transdermal application of progesterone to the breasts.[147][129] On the basis of its 10% transdermal bioavailability when applied to the breasts, a 50 mg dose of progesterone applied transdermally may result in a local concentration of progesterone in the breasts equivalent to 5 mg.[122][146]
While transdermal progesterone is not approved for use in menopausal hormone therapy or as a systemic medication, it is registered in some countries under the brand name Progestogel as a 1% gel (10 mg/g) for direct local application to the breasts to treat premenstrual breast pain.[123][48][131] The medication has been found in clinical studies to inhibit estrogen-induced proliferation of breast epithelial cells, to be highly effective in the treatment of benign breast disease, to significantly decrease breast nodularity, and to almost completely alleviate breast pain and tenderness in women with the condition.[48][122][129][131] Conversely, transdermal progesterone has been found to be almost completely ineffective in fibrocystic breast disease, breast cysts, and breast fibroadenomas, whereas oral progestins were found to be significantly effective.[122] The effectiveness of progesterone and other progestogens in the treatment of breast disorders may be due to their functional antiestrogenic effects in the breasts.[122][129]
Vaginal administration
[edit]
Progesterone is available for vaginal administration in the form of capsules (Utrogestan), gels (Crinone, Prochieve), suppositories (Cyclogest), inserts/tablets (Endometrin, Lutinus), and rings (Fertiring, Progering).[150][151][152] In addition, oral micronized progesterone capsules have been administered vaginally with success.[153]
The bioavailability of vaginal micronized progesterone insert is about 4 to 8%.[2][3][4] Vaginal absorption of progesterone is lower in postmenopausal women with vaginal atrophy.[149] Following administration of a single 25, 50, or 100 mg vaginal progesterone suppository in women, maximal circulating levels of progesterone occurred within 2 to 3 hours and were 7.27 ± 2.8 ng/mL, 8.84 ± 3.14 ng/mL, and 9.82 ± 9.8 ng/mL, respectively.[149] After peak levels, progesterone levels decreased gradually, with an elimination half-life of 6 to 12 hours.[149] Progesterone levels were less than 3 ng/mL for all three doses after 24 hours.[149] The researchers concluded that the 25 and 50 mg doses would be appropriate for administration three times per day while the 100 mg dose would be appropriate for administration twice per day.[149]
The bioavailability of vaginal progesterone gel is about 40-fold greater than that of oral progesterone.[154][1] Gel bioavailability does not seem to vary between the "Crinone 8%" formulation and two experimental generic formulations of different strengths, peaking at about 10 ng/mL after 90 mg of gel within 7 hours (with a large standard deviation).[155] There is no precise pharmacokinetics data for vaginal gel compared to intramuscular standard, though it is understood to be less powerful for a number of indications compared to IM.[48]
There is a uterine first-pass effect with vaginal progesterone, such that progesterone levels are far greater in the uterus than in the circulation.[48] Full secretory transformation of the endometrium was produced by vaginal progesterone administration that resulted in circulating progesterone levels of 1 to 3 ng/mL, whereas other parenteral routes (intramuscular and intranasal) were less effective in comparison.[149] The difference can be attributed to the endometrial first-pass effect with vaginal progesterone.[149]
Rectal administration
[edit]Progesterone can be taken by rectal administration.[156][18][22] A suppository sold under the brand name Cyclogest is indicated for rectal use in addition to the vaginal route.[33][157][158] Daily rectal administration of progesterone is inconvenient and poorly accepted for long-term therapy.[47][156] Nonetheless, rectal progesterone can be a useful alternative to the vaginal route in the context of vaginal infection, cystitis, recent childbirth, or when barrier contraception methods are used.[156]
A number of studies have assessed progesterone by the rectal route.[159][160][161][162][163][118][164][165] Levels of progesterone following rectal administration have been found to be 6.4 ng/mL after a single 25 mg suppository, 22.5 ng/mL after a single 100 mg suppository, and 20.0 ng/mL after a single 200 mg suppository.[156][162] The absorption of the rectal route is variable, with a wide range of maximal concentrations of 15 to 52 ng/mL progesterone after a single rectal dose of 100 mg progesterone.[18][161] Levels of progesterone peak after 6 to 8 hours and then gradually decrease.[18][156] Progesterone levels have been found to be similar and non-significantly different after administration of rectal and vaginal suppositories in several studies.[156]
Progesterone is delivered directly into the circulation when it is absorbed by the lower portion of the rectum and transported by the inferior and middle rectal veins.[18] Conversely, if it is absorbed by the upper portion of the rectum, progesterone is subject to hepatic first-pass metabolism due to entry into the hepatic portal system via the superior rectal vein.[18] As such, although rectal administration is a parenteral route, it may still be subject to some first-pass metabolism similarly to oral progesterone.[18]
Intramuscular injection
[edit]| Compound | Form | Dose for specific uses (mg)[c] | DOA[d] | |||
|---|---|---|---|---|---|---|
| TFD[e] | POICD[f] | CICD[g] | ||||
| Algestone acetophenide | Oil soln. | - | – | 75–150 | 14–32 d | |
| Gestonorone caproate | Oil soln. | 25–50 | – | – | 8–13 d | |
| Hydroxyprogest. acetate[h] | Aq. susp. | 350 | – | – | 9–16 d | |
| Hydroxyprogest. caproate | Oil soln. | 250–500[i] | – | 250–500 | 5–21 d | |
| Medroxyprog. acetate | Aq. susp. | 50–100 | 150 | 25 | 14–50+ d | |
| Megestrol acetate | Aq. susp. | - | – | 25 | >14 d | |
| Norethisterone enanthate | Oil soln. | 100–200 | 200 | 50 | 11–52 d | |
| Progesterone | Oil soln. | 200[i] | – | – | 2–6 d | |
| Aq. soln. | ? | – | – | 1–2 d | ||
| Aq. susp. | 50–200 | – | – | 7–14 d | ||
|
Notes and sources: | ||||||
Oil solutions
[edit]When used by intramuscular injection, progesterone bypasses first-pass metabolism in the intestines and liver and achieves very high circulating progesterone levels.[17][48] Levels of progesterone with 100 mg/day intramuscular progesterone were substantially higher than with 800 mg/day vaginal progesterone (about 70 ng/mL and 12 ng/mL, respectively), although local progesterone levels in the uterus were 10 times higher with the vaginal route due to a uterine first-pass effect (around 1.5 ng/mL and almost 12 ng/mL, respectively).[48] The duration of progesterone is extended by the intramuscular route due to a depot effect in which it is stored locally in adipose tissue, and can be administered once every 1 to 3 days.[18] The half-life of intramuscular progesterone is significantly longer when it is injected into the gluteal muscles of the buttocks rather than the deltoid muscle of the upper arm.[18] Intramuscular progesterone has traditionally been the most popular form of progesterone used for luteal support in assisted reproduction in the United States, although vaginal progesterone is also used and effective.[48][18]
With intramuscular injection of 10 mg progesterone in vegetable oil, maximum plasma concentrations (Cmax) are reached at approximately 8 hours after administration, and serum levels remain above baseline for about 24 hours.[42] Doses of 10, 25, and 50 mg via intramuscular injection have been found to result in average maximal concentrations of 7, 28, and 50 ng/mL, respectively.[42] With intramuscular injection, a dose of 25 mg results in normal luteal phase serum levels of progesterone within 8 hours, and a 100 mg dose produces mid-pregnancy levels of 40 to 80 ng/mL at peak.[22] At these doses, levels of progesterone remain elevated above baseline for at least 48 hours (6 ng/mL at this point for 100 mg),[22] with an elimination half-life of about 22 hours.[13]
Due to the high concentrations achieved, progesterone by intramuscular injection at the usual clinical dose range is able to suppress gonadotropin secretion from the pituitary gland, demonstrating antigonadotropic efficacy (and therefore suppression of gonadal sex steroid production).[42]
Intramuscular progesterone often causes pain when injected.[18] It irritates tissues and is associated with injection site reactions such as changes in skin color, pain, redness, transient indurations (due to inflammation), ecchymosis (bruising/discoloration), and others.[185][18] Rarely, sterile abscesses can occur.[18] Large doses of progesterone by intramuscular injection, for instance 100 mg, are associated with moderate-to-severe injection site reactions.[186]
Aqueous suspensions
[edit]Progesterone has been found to have a considerably longer duration of action by intramuscular injection when administered in the form of a microcrystalline aqueous suspension (crystal sizes of 0.02–0.1 mm) than as an oil solution.[187][188][189][190][191] Whereas a single intramuscular injection of 25 to 350 mg progesterone in oil solution has a duration of 2 to 6 days in terms of clinical biological effect in the uterus in women, a single intramuscular injection of 50 to 300 mg microcrystalline progesterone in aqueous suspension has a duration of 7 to 14 days.[172][169][166] As a result, intramuscular progesterone in oil solution is given once every 1 to 3 days at typical clinical doses,[18] whereas intramuscular microcrystalline progesterone in aqueous suspension can be given once weekly or at even longer intervals.[172][166][192] The duration of microcrystalline aqueous suspensions is dependent both on drug concentration and on crystal size.[193][194][195][196] A larger needle size is needed for aqueous suspensions of steroids to allow the crystals to pass through the needle lumen.[197] A 20- or 21-gauge needle has been reported to be suitable for the injection of aqueous suspensions of microcrystalline progesterone.[198]
Formulations of microcrystalline progesterone in aqueous suspension for long-lasting depot use via intramuscular injection were on the market in the 1950s under a variety of brand names including Flavolutan, Luteosan, Lutocyclin M, and Lutren.[199] Another preparation is Agolutin Depot, which was introduced by 1960 and appears to remain marketed in the Czech Republic and Slovakia today.[200][201][202][190][203] Sistocyclin was the brand name of a product containing 10 mg microcrystalline estradiol benzoate and 200 mg microcrystalline progesterone in an aqueous suspension which was marketed in the 1950s.[204][205][206][207] The medication was reported to have a duration of action of 10 to 12 days in terms of the progestogen component, relative to a duration of only 2 days for estradiol benzoate and progesterone in oil solution.[208][207] Unfortunately, intramuscular injections of aqueous suspensions of progesterone and other steroids is painful, often severely so.[209][210][211] As a result, they were largely discontinued in favor of other preparations, such as progesterone in oil solution and longer-acting progestins.[209][174][211]
Progesterone in aqueous suspensions by intramuscular injection appears to be more potent in terms of progestogenic effects than progesterone in oil solutions by intramuscular injection.[212] Whereas 25 mg doses of progesterone as microcrystals were needed to induce decidualization in women, doses of 35 to 50 mg were needed of progesterone in oil.[212] This was attributed to the steadier and longer-lasting progesterone levels with aqueous suspensions relative to oil solutions.[212]
Medroxyprogesterone acetate (brand names Depo-Provera, Depo-SubQ Provera 104), a progestin and structural modification of progesterone with a methyl group at the C6α position and an acetoxy group at the C17α position, is formulated as a microcrystalline aqueous suspension for use by intramuscular or subcutaneous injection.[213][214] As with progesterone, the formulation of medroxyprogesterone acetate in this way dramatically extends its duration.[213][177] It has a duration of 16 to 50 days at a dose of 50 mg,[172] while its duration with a 150 mg dose is at least 3 months and as long as 6 to 9 months.[213][177]
Emulsions
[edit]Water-in-oil emulsions of steroids were studied in the late 1940s and in the 1950s.[195][215][216][217][218][219][220][221] Long-acting emulsions of progesterone were introduced for use by intramuscular injection alone under the brand name Progestin and with estradiol benzoate under the brand name Di-Pro-Emulsion by the 1950s.[199][222][223][224][225] Steroid emulsions by intramuscular injection are reported to have similar properties, such as duration, as aqueous suspensions.[195][215][216]
Microspheres
[edit]An aqueous suspension of progesterone encapsulated in microspheres is marketed for use by intramuscular injection under the brand name ProSphere in Mexico.[185][226][227] It is administered once weekly or once monthly, depending on the indication.[185] For instance, the medication is administered at a dose of 100 to 300 mg by intramuscular injection once every 7 days for the treatment of threatened miscarriage.[36] The microspheres range in size from 33 to 75 μg and are delivered using pre-filled syringes with a 20-gauge 38 mm needle.[185] Peak levels of progesterone after a single 100 or 200 mg intramuscular injection of ProSphere occur after about 1.5 days.[36] The elimination half-life of progesterone with this formulation is about 8 days.[36] A single 200 mg intramuscular injection maintains progesterone levels of more than 10 ng/mL for 5 to 7 days.[36] ProSphere is well tolerated in terms of injection site reactions.[185]
A combination of both estradiol and progesterone encapsulated within microspheres as an aqueous suspension for use by intramuscular injection has been marketed under the brand name Juvenum in Mexico.[228][229][230] Studies of this formulation have been published.[231][232]
Estradiol and progesterone encapsulated in microspheres has been studied for use as a once-a-month combined injectable contraceptive but has not been further developed nor introduced for medical use.[233][234][235][236][237][238]
Gallery
[edit]-
Progesterone levels with a single intramuscular injection of 25, 50, or 100 mg progesterone (P4) in oil solution in postmenopausal women.[75]
-
Progesterone levels with a single intramuscular injection of 10, 25, 50, or 100 mg progesterone in oil solution in women.[163]
-
Progesterone levels following a single intramuscular or subcutaneous injection of 100 mg progesterone in an aqueous solution (Prolutex) or oil solution (Prontogest) in postmenopausal women.[13]
Subcutaneous injection
[edit]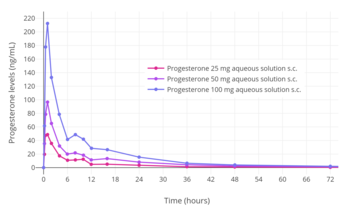
Progesterone can be administered by subcutaneous injection, with Prolutex, an aqueous solution of progesterone marketed in Europe, being intended for once-daily administration by this route.[13][239][240] This formulation is rapidly absorbed and has been found to result in higher peak levels of progesterone relative to progesterone in oil solution by intramuscular injection.[240] In addition, subcutaneous injection of progesterone is considered to be easier, safer due less risk of injection site reactions, and less painful compared to intramuscular injection of progesterone.[240] The elimination half-life of this formulation is 13 to 18 hours,[13] compared to 20 to 28 hours for intramuscular injection of progesterone in oil solution.[12][10][13]
Subcutaneous implantation
[edit]
Progesterone was previously marketed in the 1950s and 1960s in the form of 50 and 100 mg subcutaneous pellet implants under the brand names Flavolutan, Luteosid, Lutocyclin, and Proluton.[199][242] However, in contrast to estradiol and testosterone implants, which remain available as pharmaceutical products today,[243] progesterone implant products have been discontinued and appear to no longer be available pharmaceutically.[94] Progesterone implants may be available from some compounding pharmacies however, although such products are not regulated for quality or effectiveness.[244][245][246]
Early studies of progesterone implants in humans were conducted in the 1930s to 1950s.[247][248][249][250][251][252][253][254] Subcutaneous implants of progesterone were found to be poorly tolerated, with sterile abscesses and extrusion occurring in 15 to 20% of implantations.[255] However, a study found that different manufacturing processes gave different rates of extrusion.[241] Progesterone implants were also studied as a form of long-lasting hormonal birth control in women in the 1980s, but ultimately were never marketed.[256][257][258][259] Implantation of six pellets containing 100 mg progesterone each (600 mg total) has been found to result in relatively low mean progesterone levels of about 3 ng/mL, with progesterone levels sustained for about five months.[257][258][259][241] Subcutaneous implantation of progesterone has been studied in animals as well.[260] Subcutaneous pellet implants are most practical when the medication is active at very low doses.[194]
Although progesterone implants are not available as pharmaceutical preparations, subcutaneous implants of progestins, such as etonogestrel (Implanon/Nexplanon) and levonorgestrel (Jadelle/Norplant), are available as pharmaceutical products.[261][262] They are used as forms of long-lasting hormonal birth control.[261][262]
Intrauterine administration
[edit]A one-year progesterone intrauterine device (IUD) for hormonal birth control was previously available in the United States and a few other countries under the brand name Progestasert.[263][264] It was marketed between 1976 and 2001.[263] The IUD was never widely used due to a relatively high contraceptive failure rate of 2.9% and the requirement of annual replacement.[263] It contained 38 mg progesterone and released 65 μg progesterone into the uterus per day (totaling up to about 35 mg after one year).[263][264] For comparison, a woman's body produces on average about 25 mg progesterone per day during the luteal phase.[18][111] While effective as a form of contraception and for decreasing menstrual bleeding and discomfort, long-lived IUDs can fundamentally only deliver small amounts of progesterone per day, and hence intrauterine progesterone cannot achieve adequate circulating progesterone levels and is unsuitable as a form of systemic therapy.[111] Aside from progesterone, IUDs of progestins, such as levonorgestrel (Mirena/Levosert/Skyla), are available as well.[265]
Intravenous injection
[edit]Progesterone has a very short elimination half-life of about 3 to 90 minutes when given by intravenous injection.[14]
An aqueous solution of progesterone for use by intravenous injection was once marketed by Schering AG under the brand name Primolut Intravenous.[38][39]
General
[edit]Absorption
[edit]The absorption of progesterone varies depending on the route of administration.[17]
Distribution
[edit]Progesterone crosses the blood–brain barrier.[266] In terms of plasma protein binding, progesterone is 98 to 99% protein-bound in the circulation.[5][6] It is bound 80% to albumin, 18% to corticosteroid-binding globulin, and less than 1% to sex hormone-binding globulin, with the remaining fraction of 1 to 2% circulating freely or unbound.[5][6]
Metabolism
[edit]With oral administration, progesterone is rapidly metabolized in the gastrointestinal tract and liver.[123] As many as 30 different metabolites have been found to be formed from progesterone with oral ingestion.[123] Regardless of the route of administration, 5α-reductase is the major enzyme involved in the metabolism of progesterone and is responsible for approximately 60 to 65% of its metabolism.[69] 5β-Reductase is also a major enzyme in the metabolism of progesterone.[69] 5α-Reduction of progesterone occurs predominantly in the intestines (specifically the duodenum), whereas 5β-reduction occurs almost exclusively in the liver.[69] The metabolites of progesterone produced by 5α-reductase and 5β-reductase (after further transformation by 3α-hydroxysteroid dehydrogenase) are allopregnanolone and pregnanolone, respectively.[123] With oral administration of progesterone, they occur in circulation at very high and in fact supraphysiological concentrations that are well in excess of those of progesterone itself (peak concentrations of 30 ng/mL for allopregnanolone and 60 ng/mL for pregnanolone versus 12 ng/mL for progesterone at 4 hours after a single 200-mg oral dose of progesterone).[123] In one study, a single 200-mg oral dose of progesterone resulted in peak levels of 20α-dihydroprogesterone of around 1 ng/mL after 2 hours.[98]
The percentage constitutions of progesterone and its metabolites as reflected in serum levels have been determined for a single 100 mg dose of oral or vaginal progesterone.[71] With oral administration, progesterone accounts for less than 20% of the dose in circulation while 5α- and 5β-reduced products like allopregnanolone and pregnanolone account for around 80%.[71] With vaginal administration, progesterone accounts for around 50% of the dose and 5α- and 5β-reduced metabolites for around 40%.[71]
A small amount of progesterone is converted by 21-hydroxylase into 11-deoxycorticosterone.[267][69] Increases in levels of 11-deoxycorticosterone are markedly higher when progesterone is given orally as opposed to via parenteral routes like vaginal or intramuscular injection.[69] The conversion of progesterone into 11-deoxycorticosterone occurs in the intestines (specifically the duodenum) and in the kidneys.[267][69] 21-Hydroxylase appears to be absent in the liver, so conversion of progesterone into 11-deoxycorticosterone is thought not to occur in this part of the body.[69]
Endogenous progesterone is metabolized approximately 50% into 5α-dihydroprogesterone in the corpus luteum, 35% into 3β-dihydroprogesterone in the liver, and 10% into 20α-dihydroprogesterone.[61]
Metabolites of progesterone with one or more available hydroxyl groups are conjugated via glucuronidation and/or sulfation and excreted.[268][33]
The biological half-life of progesterone in the circulation is very short; with intravenous injection, its half-life has ranged widely from 3 to 90 minutes in various studies.[14] The metabolic clearance rate of progesterone ranges between 2,100 and 2,800 L/day, and is constant across the menstrual cycle.[14][211]
Elimination
[edit]Progesterone is eliminated in bile and urine.[15][16]
See also
[edit]- Pharmacodynamics of progesterone
- Pharmacokinetics of estradiol
- Pharmacodynamics of estradiol
- Pharmacokinetics of testosterone
References
[edit]- ^ Jump up to: a b c d e f g h i j k l m n Levine H, Watson N (March 2000). "Comparison of the pharmacokinetics of Crinone 8% administered vaginally versus Prometrium administered orally in postmenopausal women(3)". Fertil. Steril. 73 (3): 516–21. doi:10.1016/S0015-0282(99)00553-1. PMID 10689005.
- ^ Jump up to: a b Griesinger G, Tournaye H, Macklon N, Petraglia F, Arck P, Blockeel C, van Amsterdam P, Pexman-Fieth C, Fauser BC (February 2019). "Dydrogesterone: pharmacological profile and mechanism of action as luteal phase support in assisted reproduction". Reprod. Biomed. Online. 38 (2): 249–259. doi:10.1016/j.rbmo.2018.11.017. PMID 30595525.
- ^ Jump up to: a b Pandya MR, Gopeenathan P, Gopinath PM, Das SK, Sauhta M, Shinde V (2016). "Evaluating the clinical efficacy and safety of progestogens in the management of threatened and recurrent miscarriage in early pregnancy-A review of the literature". Indian Journal of Obstetrics and Gynecology Research. 3 (2): 157. doi:10.5958/2394-2754.2016.00043.6. ISSN 2394-2746.
- ^ Jump up to: a b c Paulson RJ, Collins MG, Yankov VI (November 2014). "Progesterone pharmacokinetics and pharmacodynamics with 3 dosages and 2 regimens of an effervescent micronized progesterone vaginal insert". J. Clin. Endocrinol. Metab. 99 (11): 4241–9. doi:10.1210/jc.2013-3937. PMID 24606090.
- ^ Jump up to: a b c Fritz MA, Speroff L (28 March 2012). Clinical Gynecologic Endocrinology and Infertility. Lippincott Williams & Wilkins. pp. 44–. ISBN 978-1-4511-4847-3.
- ^ Jump up to: a b c Marshall WJ, Bangert SK (2008). Clinical Chemistry. Elsevier Health Sciences. pp. 192–. ISBN 978-0-7234-3455-9.
- ^ Jump up to: a b c Pickar JH, Bon C, Amadio JM, Mirkin S, Bernick B (December 2015). "Pharmacokinetics of the first combination 17β-estradiol/progesterone capsule in clinical development for menopausal hormone therapy". Menopause. 22 (12): 1308–16. doi:10.1097/GME.0000000000000467. PMC 4666011. PMID 25944519.
- ^ Jump up to: a b c d "BIJUVA (estradiol and progesterone) capsules" (PDF). TherapeuticsMD, Inc. U.S. Food and Drug Adminsration. October 2018.
- ^ Jump up to: a b c d e Khomyak NV, Mamchur VI, Khomyak EV (2014). "Клинико-фармакологические особенности современных лекарственных форм микронизированного прогестерона, применяющихся во время беременности" [Clinical and pharmacological features of modern dosage forms of micronized progesterone used during pregnancy.] (PDF). Здоровье женщины (Women's Health) (in Russian) (4): 40–45.
- ^ Jump up to: a b c "Crinone® 4% and Crinone® 8% (progesterone gel)" (PDF). Watson Pharma, Inc. U.S. Food and Drug Administration. August 2013.
- ^ Jump up to: a b c Mircioiu C, Perju A, Griu E, Calin G, Neagu A, Enachescu D, Miron DS (1998). "Pharmacokinetics of progesterone in postmenopausal women: 2. Pharmacokinetics following percutaneous administration". European Journal of Drug Metabolism and Pharmacokinetics. 23 (3): 397–402. doi:10.1007/bf03192300. PMID 9842983. S2CID 32772029.
- ^ Jump up to: a b c d e f g h i j k l m Simon JA, Robinson DE, Andrews MC, Hildebrand JR, Rocci ML, Blake RE, Hodgen GD (July 1993). "The absorption of oral micronized progesterone: the effect of food, dose proportionality, and comparison with intramuscular progesterone". Fertility and Sterility. 60 (1): 26–33. doi:10.1016/S0015-0282(16)56031-2. PMID 8513955.
- ^ Jump up to: a b c d e f g h i j k l m n o p q r Cometti B (November 2015). "Pharmaceutical and clinical development of a novel progesterone formulation". Acta Obstetricia et Gynecologica Scandinavica. 94 (Suppl 161): 28–37. doi:10.1111/aogs.12765. PMID 26342177.
- ^ Jump up to: a b c d e f Aufrère MB, Benson H (June 1976). "Progesterone: an overview and recent advances". Journal of Pharmaceutical Sciences. 65 (6): 783–800. doi:10.1002/jps.2600650602. PMID 945344.
- ^ Jump up to: a b "PROMETRIUM (progesterone, USP)" (PDF). Solvay Pharmaceuticals, Inc. U.S. Food and Drug Administration. 1998.
- ^ Jump up to: a b "Progesterone injection" (PDF). Watson Laboratories, Inc. U.S. Food and Drug Administration. January 2007.
- ^ Jump up to: a b c d e f g h i j k l m n o p q r s t u v Kuhl H (August 2005). "Pharmacology of estrogens and progestogens: influence of different routes of administration" (PDF). Climacteric. 8 (Suppl 1): 3–63. doi:10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
- ^ Jump up to: a b c d e f g h i j k l m n o p q r s Unfer V, di Renzo GC, Gerli S, Casini ML (2006). "The Use of Progesterone in Clinical Practice: Evaluation of its Efficacy in Diverse Indications Using Different Routes of Administration". Current Drug Therapy. 1 (2): 211–219. doi:10.2174/157488506776930923.
- ^ Whitaker A, Gilliam M (2014). Contraception for Adolescent and Young Adult Women. Springer. p. 98. ISBN 9781461465799.
- ^ Chaudhuri SK (2007). Practice Of Fertility Control: A Comprehensive Manual (7th ed.). Elsevier India. p. 153. ISBN 978-81-312-1150-2.
- ^ Jump up to: a b Josimovich JB (11 November 2013). Gynecologic Endocrinology. Springer Science & Business Media. pp. 9, 25–29, 139. ISBN 978-1-4613-2157-6.
- ^ Jump up to: a b c d Sampson GA (1981). "An appraisal of the role of progesterone in the therapy of premenstrual syndrome". In van Keep PA, Utian WH (eds.). The Premenstrual Syndrome: Proceedings of a workshop held during the Sixth International Congress of Psychosomatic Obstetrics and Gynecology, Berlin, September 1980. pp. 51–69. doi:10.1007/978-94-011-6255-5_4. ISBN 978-94-011-6257-9.
- ^ Strauss JF, Barbieri RL (2009). Yen and Jaffe's Reproductive Endocrinology: Physiology, Pathophysiology, and Clinical Management. Elsevier Health Sciences. pp. 807–. ISBN 978-1-4160-4907-4.
- ^ Blackburn S (14 April 2014). "Amnion and Chorion". Maternal, Fetal, & Neonatal Physiology. Elsevier Health Sciences. pp. 92–. ISBN 978-0-323-29296-2.
- ^ Stricker R, Eberhart R, Chevailler MC, Quinn FA, Bischof P, Stricker R (2006). "Establishment of detailed reference values for luteinizing hormone, follicle stimulating hormone, estradiol, and progesterone during different phases of the menstrual cycle on the Abbott ARCHITECT analyzer". Clin. Chem. Lab. Med. 44 (7): 883–7. doi:10.1515/CCLM.2006.160. PMID 16776638. S2CID 524952.
- ^ Sizonenko PC (July 1978). "Endocrinology in Preadolescents and Adolescents". American Journal of Diseases of Children. 132 (7): 704–12. doi:10.1001/archpedi.1978.02120320064015. ISSN 0002-922X. PMID 149498.
- ^ Sizonenko PC (1984). "Endocrine Aspects of Normal Pubertal Development". Paediatric Endocrinology in Clinical Practice. pp. 175–182. doi:10.1007/978-94-009-5610-0_11. ISBN 978-94-010-8974-6.
- ^ Gerhard I, Heinrich U (1994). "Die Pubertät und ihre Störungen" [Puberty and its Disorders]. Gynäkologische Endokrinologie und Fortpflanzungsmedizin [Gynecological Endocrinology and Reproductive Medicine]. pp. 263–303. doi:10.1007/978-3-662-07635-4_6. ISBN 978-3-662-07636-1.
- ^ Tulchinsky D, Hobel CJ, Yeager E, Marshall JR (April 1972). "Plasma estrone, estradiol, estriol, progesterone, and 17-hydroxyprogesterone in human pregnancy. I. Normal pregnancy". Am. J. Obstet. Gynecol. 112 (8): 1095–100. doi:10.1016/0002-9378(72)90185-8. PMID 5025870.
- ^ "Drugs@FDA: FDA Approved Drug Products". United States Food and Drug Administration. Retrieved 26 July 2018.
- ^ Engel J, Kleemann A, Kutscher B, Reichert D (14 May 2014). Pharmaceutical Substances, 5th Edition, 2009: Syntheses, Patents and Applications of the most relevant APIs. Thieme. pp. 1145–. ISBN 978-3-13-179275-4.
- ^ Becker KL (2001). Principles and Practice of Endocrinology and Metabolism. Lippincott Williams & Wilkins. pp. 2168–. ISBN 978-0-7817-1750-2.
- ^ Jump up to: a b c d e Anita MV, Jain S, Goel N (31 July 2018). Use of Progestogens in Clinical Practice of Obstetrics and Gynecology. JP Medical Ltd. pp. 4–. ISBN 978-93-5270-218-3.
- ^ Sauer MV (1 March 2013). Principles of Oocyte and Embryo Donation. Springer Science & Business Media. pp. 7, 117–118. ISBN 978-1-4471-2392-7.
- ^ Elder K, Dale B (2 December 2010). In-Vitro Fertilization. Cambridge University Press. pp. 26–. ISBN 978-1-139-49285-0.
- ^ Jump up to: a b c d e "PROSPHERE CARNOT". Archived from the original on 2019-12-30.
- ^ Heinrich Kahr (8 March 2013). Konservative Therapie der Frauenkrankheiten: Anzeigen, Grenzen und Methoden Einschliesslich der Rezeptur. Springer-Verlag. pp. 21–. ISBN 978-3-7091-5694-0.
- ^ Jump up to: a b Basic Sex Hormone Therapy. Schering A.G. 1962. p. 96.
- ^ Jump up to: a b Current Medicine and Drugs. 1962. p. 40.
Primolut Intravenous (Schering A.G. Berlin)
- ^ Haleem S, Khan MI (March 2015). "Changing Indian Market Trends of NMP: A Review" (PDF). International Journal of Pharma Research & Review. 4 (3): 28–30. ISSN 2278-6074. S2CID 74224514.
- ^ Jump up to: a b c d e f Zutshi V, Rathore AM, Sharma K (2005). Hormones in Obstetrics and Gynaecology. Jaypee Brothers, Medical Publishers. pp. 74–75. ISBN 978-81-8061-427-9. Archived from the original on 2020-05-01. Retrieved 2018-12-20.
It has been observed that micronized progesterone has no suppressive effects on high-density lipoprotein-cholesterol (HDL-C). Jensen et al have proved that oral micronized progesterone has no adverse effect on serum lipids. These preparations have the same antiestrogenic and antimineralocorticoid effect but no androgenic action. It does not affect aldosterone synthesis, blood pressure, carbohydrate metabolism or mood changes. No side effects have been reported as far as lipid profile, coagulation factors and blood pressure are concerned.
- ^ Jump up to: a b c d Progesterone - Drugs.com, retrieved 2015-08-23
- ^ Jump up to: a b c d e f g h i j k l m Kuhl H (2011). "Pharmacology of Progestogens" (PDF). Journal für Reproduktionsmedizin und Endokrinologie-Journal of Reproductive Medicine and Endocrinology. 8 (1): 157–177.
- ^ Jump up to: a b c d e f g h i j k l m n o p q r s t u v Kuhl H, Schneider HP (August 2013). "Progesterone – promoter or inhibitor of breast cancer". Climacteric. 16 (Suppl 1): 54–68. doi:10.3109/13697137.2013.768806. PMID 23336704. S2CID 20808536.
- ^ Jump up to: a b c d e f g h i j k l m n o p q r s t Davey DA (March 2018). "Menopausal hormone therapy: a better and safer future". Climacteric. 21 (5): 454–461. doi:10.1080/13697137.2018.1439915. PMID 29526116. S2CID 3850275.
- ^ Jump up to: a b c d e f g h i j Fotherby K (August 1996). "Bioavailability of orally administered sex steroids used in oral contraception and hormone replacement therapy". Contraception. 54 (2): 59–69. doi:10.1016/0010-7824(96)00136-9. PMID 8842581.
Progesterone is rapidly metabolized which leads to a low bioavailability and the necessity for high doses (200 mg); its pharmacological actions, except upon reproductive processes, are weak. [...] For many years after its isolation and synthesis, progesterone could only be used therapeutically by intramuscular injection of large doses since it was quickly recognized that, after oral administration, progesterone was poorly absorbed and rapidly metabolized in the gastrointestinal tract, liver and most tissues, and then eliminated. However, like estradiol, the absorption of progesterone can be improved by micronization.16 This led to the development of formulations of progesterone, mainly of particle size <10 μg, dissolved in oil in a gelatin capsule. [...] five formulations differing in particle size and vehicle were compared; all led to significant absorption of progesterone and with similar plasma progesterone concentrations 6 hours after administration, but only the micronized or oil vehicle preparations improved absorption (probably by increasing lymphatic absorption and thus avoiding some of the first-pass effect). [...] Plasma progesterone concentrations may be higher when the formulation is administered with food but, even under the best conditions, bioavailability appears to be very low since the AUC after intramuscular injection of progesterone is at least ten times higher than after oral intake.21
- ^ Jump up to: a b c de Lignières B (1999). "Oral micronized progesterone". Clin Ther. 21 (1): 41–60, discussion 1–2. doi:10.1016/S0149-2918(00)88267-3. PMID 10090424.
- ^ Jump up to: a b c d e f g h i j k l m n o Ruan X, Mueck AO (November 2014). "Systemic progesterone therapy—oral, vaginal, injections and even transdermal?". Maturitas. 79 (3): 248–55. doi:10.1016/j.maturitas.2014.07.009. PMID 25113944.
- ^ Wecker L (31 May 2018). Brody's Human Pharmacology E-Book. Elsevier Health Sciences. pp. 419–. ISBN 978-0-323-59662-6.
- ^ Anita MV, Jain S, Goel N (31 July 2018). Use of Progestogens in Clinical Practice of Obstetrics and Gynecology. JP Medical Ltd. pp. 4, 15–20. ISBN 978-93-5270-218-3.
Progesterone is also available in the forms of vaginal or rectal suppositories or pessaries (Cyclogest), [...]
- ^ Hauss DJ (8 June 2007). Oral Lipid-Based Formulations: Enhancing the Bioavailability of Poorly Water-Soluble Drugs. CRC Press. pp. 17–. ISBN 978-1-4200-1726-7.
- ^ Micozzi MS, Dog TL (19 August 2004). Women's Health in Complementary and Integrative Medicine E-Book: A Clinical Guide. Elsevier Health Sciences. pp. 69–. ISBN 0-7020-3598-X.
- ^ Porter CJ, Pouton CW, Cuine JF, Charman WN (March 2008). "Enhancing intestinal drug solubilisation using lipid-based delivery systems". Adv. Drug Deliv. Rev. 60 (6): 673–91. doi:10.1016/j.addr.2007.10.014. PMID 18155801.
- ^ Jump up to: a b Humberstone AJ, Charman WN (1997). "Lipid-based vehicles for the oral delivery of poorly water soluble drugs". Advanced Drug Delivery Reviews. 25 (1): 103–128. doi:10.1016/S0169-409X(96)00494-2. ISSN 0169-409X.
- ^ Jump up to: a b Kincl FA, Ciaccio LA, Benagiano G (January 1978). "Increasing oral bioavailability of progesterone by formulation". J. Steroid Biochem. 9 (1): 83–4. doi:10.1016/0022-4731(78)90106-1. PMID 628211.
- ^ Jump up to: a b c Hargrove JT, Maxson WS, Wentz AC (October 1989). "Absorption of oral progesterone is influenced by vehicle and particle size". Am. J. Obstet. Gynecol. 161 (4): 948–51. doi:10.1016/0002-9378(89)90759-X. PMID 2801843.
- ^ Schindler AE, Campagnoli C, Druckmann R, Huber J, Pasqualini JR, Schweppe KW, Thijssen JH (2008). "Classification and pharmacology of progestins" (PDF). Maturitas. 61 (1–2): 171–80. doi:10.1016/j.maturitas.2008.11.013. PMID 19434889.[permanent dead link]
- ^ Jump up to: a b c d e f Hermann AC, Nafziger AN, Victory J, Kulawy R, Rocci ML, Bertino JS (2005). "Over-the-counter progesterone cream produces significant drug exposure compared to a food and drug administration-approved oral progesterone product". J Clin Pharmacol. 45 (6): 614–9. doi:10.1177/0091270005276621. PMID 15901742. S2CID 28399314.
- ^ Jameson JL, De Groot LJ (25 February 2015). Endocrinology: Adult and Pediatric E-Book. Elsevier Health Sciences. pp. 2660–. ISBN 978-0-323-32195-2.
- ^ McAuley JW, Kroboth FJ, Kroboth PD (1996). "Oral administration of micronized progesterone: a review and more experience". Pharmacotherapy. 16 (3): 453–7. doi:10.1002/j.1875-9114.1996.tb02977.x. PMID 8726605. S2CID 30344212.
- ^ Jump up to: a b Anderson GD, Odegard PS (October 2004). "Pharmacokinetics of estrogen and progesterone in chronic kidney disease". Adv Chronic Kidney Dis. 11 (4): 357–60. doi:10.1053/j.ackd.2004.07.001. PMID 15492972.
- ^ Integrative Medicine. Elsevier Health Sciences. 2012. p. 343. ISBN 978-1-4377-1793-8.
- ^ Shoham Z, Kopernik G (June 2004). "Tools for making correct decisions regarding hormone therapy. part I: background and drugs". Fertil. Steril. 81 (6): 1447–57. doi:10.1016/j.fertnstert.2003.10.052. PMID 15193460.
- ^ Jump up to: a b c d e de Lignieres B, Dennerstein L, Backstrom T (April 1995). "Influence of route of administration on progesterone metabolism". Maturitas. 21 (3): 251–7. doi:10.1016/0378-5122(94)00882-8. PMID 7616875.
- ^ Jump up to: a b Wang-Cheng R, Neuner JM, Barnabei VM (2007). Menopause. ACP Press. p. 97. ISBN 978-1-930513-83-9.
- ^ Jump up to: a b Bergemann N, Ariecher-Rössler A (27 December 2005). Estrogen Effects in Psychiatric Disorders. Springer Science & Business Media. p. 179. ISBN 978-3-211-27063-9.
- ^ Reddy DS (2010). "Neurosteroids". Sex Differences in the Human Brain, their Underpinnings and Implications. Progress in Brain Research. Vol. 186. pp. 113–37. doi:10.1016/B978-0-444-53630-3.00008-7. ISBN 9780444536303. PMC 3139029. PMID 21094889.
- ^ Jump up to: a b c Alam V, Vega M, Rísquez F (2001). "Luteal phase support". Reprod. Biomed. Online. 3 (3): 250–262. doi:10.1016/S1472-6483(10)62044-5. PMID 12513863.
- ^ Jump up to: a b c d e f g h i j k Nahoul K, Dehennin L, Jondet M, Roger M (May 1993). "Profiles of plasma estrogens, progesterone and their metabolites after oral or vaginal administration of estradiol or progesterone". Maturitas. 16 (3): 185–202. doi:10.1016/0378-5122(93)90064-O. PMID 8515718.
- ^ Jump up to: a b Warren MP, Shantha S (1999). "Uses of progesterone in clinical practice". Int J Fertil Womens Med. 44 (2): 96–103. PMID 10338267.
- ^ Jump up to: a b c d e f g h i j k de Ziegler D, Fanchin R (2000). "Progesterone and progestins: applications in gynecology". Steroids. 65 (10–11): 671–9. doi:10.1016/s0039-128x(00)00123-9. PMID 11108875. S2CID 5867301.
- ^ Söderpalm AH, Lindsey S, Purdy RH, Hauger R, Wit de H (2004). "Administration of progesterone produces mild sedative-like effects in men and women". Psychoneuroendocrinology. 29 (3): 339–54. doi:10.1016/s0306-4530(03)00033-7. PMID 14644065. S2CID 21796848.
- ^ de Wit H, Schmitt L, Purdy R, Hauger R (2001). "Effects of acute progesterone administration in healthy postmenopausal women and normally-cycling women". Psychoneuroendocrinology. 26 (7): 697–710. doi:10.1016/s0306-4530(01)00024-5. PMID 11500251. S2CID 20611661.
- ^ van Broekhoven F, Bäckström T, Verkes RJ (2006). "Oral progesterone decreases saccadic eye velocity and increases sedation in women". Psychoneuroendocrinology. 31 (10): 1190–9. doi:10.1016/j.psyneuen.2006.08.007. PMID 17034954. S2CID 40466952.
- ^ Jump up to: a b de Wit H, Schmitt L, Purdy R, Hauger R (October 2001). "Effects of acute progesterone administration in healthy postmenopausal women and normally-cycling women". Psychoneuroendocrinology. 26 (7): 697–710. doi:10.1016/s0306-4530(01)00024-5. PMID 11500251. S2CID 20611661.
- ^ Turkmen S, Backstrom T, Wahlstrom G, Andreen L, Johansson IM (2011). "Tolerance to allopregnanolone with focus on the GABA-A receptor". Br. J. Pharmacol. 162 (2): 311–27. doi:10.1111/j.1476-5381.2010.01059.x. PMC 3031054. PMID 20883478.
- ^ Timby E, Balgård M, Nyberg S, Spigset O, Andersson A, Porankiewicz-Asplund J, Purdy RH, Zhu D, Bäckström T, Poromaa IS (2006). "Pharmacokinetic and behavioral effects of allopregnanolone in healthy women". Psychopharmacology. 186 (3): 414–24. doi:10.1007/s00213-005-0148-7. PMID 16177884. S2CID 16928783.
- ^ Pearlstein T (2016). "Treatment of Premenstrual Dysphoric Disorder: Therapeutic Challenges". Expert Rev Clin Pharmacol. 9 (4): 1–4. doi:10.1586/17512433.2016.1142371. PMID 26766596. S2CID 12172042.
A recent study with a 5α-reductase inhibitor dutasteride, that blocks the conversion of progesterone to ALLO, reported that dutasteride 2.5 mg daily decreased several premenstrual symptoms [7].
- ^ Sripada RK, Marx CE, King AP, Rampton JC, Ho SS, Liberzon I (2013). "Allopregnanolone elevations following pregnenolone administration are associated with enhanced activation of emotion regulation neurocircuits". Biol. Psychiatry. 73 (11): 1045–53. doi:10.1016/j.biopsych.2012.12.008. PMC 3648625. PMID 23348009.
- ^ Ducharme N, Banks WA, Morley JE, Robinson SM, Niehoff ML, Mattern C, Farr SA (2010). "Brain distribution and behavioral effects of progesterone and pregnenolone after intranasal or intravenous administration". Eur. J. Pharmacol. 641 (2–3): 128–34. doi:10.1016/j.ejphar.2010.05.033. PMC 3008321. PMID 20570588.
- ^ Saudan C, Desmarchelier A, Sottas PE, Mangin P, Saugy M (2005). "Urinary marker of oral pregnenolone administration". Steroids. 70 (3): 179–83. doi:10.1016/j.steroids.2004.12.007. PMID 15763596. S2CID 25490229.
- ^ Jump up to: a b Piper T, Schlug C, Mareck U, Schänzer W (2011). "Investigations on changes in ¹³C/¹²C ratios of endogenous urinary steroids after pregnenolone administration". Drug Test Anal. 3 (5): 283–90. doi:10.1002/dta.281. PMID 21538944.
- ^ Sauer MV (1 March 2013). Principles of Oocyte and Embryo Donation. Springer Science & Business Media. pp. 117–. ISBN 978-1-4471-2392-7.
- ^ Frank R, Guterman HS (1954). "Comparison of progesterone preparations in secondary amenorrhea". Fertil. Steril. 5 (4): 374–81. doi:10.1016/S0015-0282(16)31687-9. PMID 13183192.
- ^ Trabert B, Sherman ME, Kannan N, Stanczyk FZ (September 2019). "Progesterone and breast cancer". Endocr. Rev. 41 (2): 320–344. doi:10.1210/endrev/bnz001. PMC 7156851. PMID 31512725.
- ^ Jump up to: a b c Malik S, Krishnaprasad K (February 2016). "Natural Micronized Progesterone Sustained Release (SR) and Luteal Phase: Role Redefined!!". Journal of Clinical and Diagnostic Research. 10 (2): QE01-4. doi:10.7860/JCDR/2016/17278.7212. PMC 4800604. PMID 27042538.
- ^ Purandare AC, Hajare A, Krishnaprasad K, Bhargava A (2014). "Prescription event monitoring study to assess the safety profile of oral natural micronized progesterone sustained release in India". International Journal of Medical Research & Health Sciences. 3 (4): 975. doi:10.5958/2319-5886.2014.00034.4. ISSN 2319-5886.
- ^ Haleem S, Khan MI (March 2015). "Changing Indian Market Trends of NMP: A Review" (PDF). International Journal of Pharma Research & Review. 4 (3): 28–30. ISSN 2278-6074. S2CID 74224514. Archived from the original (PDF) on 2020-08-19.
- ^ Nigam A (2018). "Luteal Phase Support: Why, When and How" (PDF). Pan Asian Journal of Obstetrics & Gynecology. 1 (2): 79–83. Archived from the original (PDF) on 2020-08-19.
- ^ Malhotra J, Krishnaprasad K (January 2016). "Open-label, Prospective, Investigator Initiated Study to Assess the Clinical Role of Oral Natural or Synthetic Progesterone During Stimulated IUI Cycles for Unexplained Infertility". Journal of Clinical and Diagnostic Research. 10 (1): QC08-10. doi:10.7860/JCDR/2016/17058.7106. PMC 4740654. PMID 26894126.
- ^ Prabhat P, Korukonda K (2018). "A Drug Utilisation Surveillance Study to Assess the Clinical Utility and Safety of Oral Natural Micronized Progesterone SR in High Risk Pregnancies: NAP-DELAY Study". Journal of Clinical and Diagnostic Research. doi:10.7860/JCDR/2018/34886.12118. ISSN 2249-782X.
- ^ Singh N, Reddy A (April–June 2015). "Current Concepts in Management of Preterm Labour - A Review Article". Indian Obstetrics and Gynaecology. 5 (2).
- ^ Jump up to: a b c Kirk EP, Serat S, Burrows LJ, Mott LA, Yeo KJ, Fitzmaurice T, Lewis LD (1997). "A pharmacokinetic study of micronized natural progesterone extended release tablets". Restore Health. Archived from the original on 2019-03-04.
- ^ Jump up to: a b "Progesterone".
- ^ Jump up to: a b Lobo RA, Liu J, Stanczyk FZ, Constantine GD, Pickar JH, Shadiack AM, Bernick B, Mirkin S (July 2019). "Estradiol and progesterone bioavailability for moderate to severe vasomotor symptom treatment and endometrial protection with the continuous-combined regimen of TX-001HR (oral estradiol and progesterone capsules)". Menopause. 26 (7): 720–727. doi:10.1097/GME.0000000000001306. PMC 6636803. PMID 30694918.
- ^ Jump up to: a b c d Davey DA (March 2018). "Menopausal hormone therapy: a better and safer future". Climacteric. 21 (5): 454–461. doi:10.1080/13697137.2018.1439915. PMID 29526116. S2CID 3850275.
- ^ Davey DA (October 2018). "Menopausal hormone therapy: a better and safer future". Climacteric. 21 (5): 454–461. doi:10.1080/13697137.2018.1439915. PMID 29526116. S2CID 3850275.
- ^ Jump up to: a b Sitruk-Ware R, Bricaire C, De Lignieres B, Yaneva H, Mauvais-Jarvis P (October 1987). "Oral micronized progesterone. Bioavailability pharmacokinetics, pharmacological and therapeutic implications--a review". Contraception. 36 (4): 373–402. doi:10.1016/0010-7824(87)90088-6. PMID 3327648.
- ^ Wren BG, Day RO, McLachlan AJ, Williams KM (June 2003). "Pharmacokinetics of estradiol, progesterone, testosterone and dehydroepiandrosterone after transbuccal administration to postmenopausal women". Climacteric. 6 (2): 104–11. doi:10.1080/cmt.6.2.104.111. PMID 12841880. S2CID 26455195.
- ^ Jain SK, Jain A, Gupta Y, Kharya A (February 2008). "Design and development of a mucoadhesive buccal film bearing progesterone". Pharmazie. 63 (2): 129–35. doi:10.1691/ph.2008.7114. PMID 18380399.
- ^ Whitelaw MJ (January 1955). "Effects of Parenteral, Oral, Buccal, and Vaginal Progesterone on the Endometrium". Journal of Clinical Endocrinology & Metabolism. 15 (7): 881–882. ISSN 0021-972X.
- ^ Soule SD, Yanow M (July 1953). "Recovery of pregnanediol from urine following administration of oral anhydrohydroxyprogesterone, buccal progesterone, and intramuscular progesterone". Obstet Gynecol. 2 (1): 68–72. PMID 13073082.
- ^ Maddox DH, Burnside BA, Keith AD (1990). "Buccal delivery of progesterone". Proceedings of the International Symposium on Controlled Release of Bioactive Materials. Vol. 17. pp. 291–292.
- ^ Voorspoels J, Comhaire F, De Sy W, Remon JP (1997). "Buccal absorption of progesterone in the dog". Proceedings of the International Symposium on Controlled Release of Bioactive Materials. Vol. 24. pp. 185–186.
- ^ Jump up to: a b Hager HH, Kern W, List PH, Roth HJ (1969). "Hormone". Hagers Handbuch der Pharmazeutischen Praxis: Für Apotheker, Arzneimittelhersteller, Ärzte und Medizinalbeamte: Wirkstoffgruppen II Chemikalien und Drogen (A-AL). Springer-Verlag. pp. 178–. ISBN 978-3-662-25655-8.
- ^ Welsh AL (1951). Dermatological Formulary: A Guide for Medical Students and Resident Physicians in Dermatology. Educational Publishers. p. 155.
- ^ Jump up to: a b Chakmakjian ZH, Zachariah NY (June 1987). "Bioavailability of progesterone with different modes of administration". The Journal of Reproductive Medicine. 32 (6): 443–8. PMID 3612635.
- ^ Jump up to: a b Villanueva B, Casper RF, Yen SS (April 1981). "Intravaginal administration of progesterone: enhanced absorption after estrogen treatment". Fertil. Steril. 35 (4): 433–7. doi:10.1016/S0015-0282(16)45439-7. PMID 7215569.
- ^ Jump up to: a b c Zygmunt M, Sapa Y (2017). "Progesterone – a new look at an old drug". Reproductive Endocrinology (33): 17–25. doi:10.18370/2309-4117.2017.33.17-25. ISSN 2411-1295.
[In other pharmacokinetic studies it has been proven that after administration of 100 mg of progesterone the hormone reached its maximum concentration in the plasma after 1-4 hours, which was on average 13.5 ng/mL.]
- ^ Bhavnani BR, Stanczyk FZ (March 2012). "Misconception and concerns about bioidentical hormones used for custom-compounded hormone therapy". J Clin Endocrinol Metab. 97 (3): 756–9. doi:10.1210/jc.2011-2492. PMID 22205711. S2CID 39181410.
- ^ Jump up to: a b c d e f g h i j Unfer V, Casini ML, Marelli G, Costabile L, Gerli S, Di Renzo GC (2005). "Different routes of progesterone administration and polycystic ovary syndrome: a review of the literature". Gynecol. Endocrinol. 21 (2): 119–27. doi:10.1080/09513590500170049. PMID 16109599. S2CID 24890723.
- ^ Jump up to: a b c d Stovall DW, Van Voorhis BJ, Mattingly KL, Sparks AE, Chapler FK, Syrop CH (May 1996). "The effectiveness of sublingual progesterone administration during cryopreserved embryo transfer cycles: results of a matched follow-up study". Fertil. Steril. 65 (5): 986–91. doi:10.1016/S0015-0282(16)58274-0. PMID 8612862.
- ^ Chakmakjian ZH, Zachariah NY (June 1987). "Bioavailability of progesterone with different modes of administration". J Reprod Med. 32 (6): 443–8. ISSN 0024-7758. PMID 3612635.
- ^ Bickers W (August 1949). "Progesterone; a comparison of intramuscular, oral and sublingual routes of administration". J. Clin. Endocrinol. Metab. 9 (8): 736–42. doi:10.1210/jcem-9-8-736. PMID 18133494.
- ^ Corner GW (1944). "The Absorption of Steroid Hormones from the Oral Mucous Membranes, with Special Reference to the Sublingual Administration of Progesterone". American Journal of Obstetrics and Gynecology. 47 (5): 670–677. doi:10.1016/S0002-9378(16)40321-2.
- ^ Greenblatt RB (1944). "Sublingual Absorption of Progesterone and Anhydrohydroxyprogesterone". The Journal of Clinical Endocrinology & Metabolism. 4 (4): 156–158. doi:10.1210/jcem-4-4-156. ISSN 0021-972X.
- ^ Greenblatt RB (1944). "Perlingual Absorption of Progesterone and Anhydrohydroxyprogesterone". The Journal of Clinical Endocrinology & Metabolism. 4 (7): 321–325. doi:10.1210/jcem-4-7-321. ISSN 0021-972X.
- ^ Jump up to: a b Steege JF, Rupp SL, Stout AL, Bernhisel M (October 1986). "Bioavailability of nasally administered progesterone". Fertil. Steril. 46 (4): 727–9. doi:10.1016/S0015-0282(16)49661-5. PMID 3758397.
- ^ Posaci C, Smitz J, Camus M, Osmanagaoglu K, Devroey P (June 2000). "Progesterone for the luteal support of assisted reproductive technologies: clinical options". Hum. Reprod. 15 (Suppl 1): 129–48. doi:10.1093/humrep/15.suppl_1.129. PMID 10928425.
- ^ Jump up to: a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae Stanczyk FZ (2014). "Treatment of postmenopausal women with topical progesterone creams and gels: are they effective?". Climacteric. 17 (Suppl 2): 8–11. doi:10.3109/13697137.2014.944496. PMID 25196424. S2CID 20019151.
- ^ Jump up to: a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at au Stanczyk FZ, Paulson RJ, Roy S (2005). "Percutaneous administration of progesterone: blood levels and endometrial protection". Menopause. 12 (2): 232–7. doi:10.1097/00042192-200512020-00019. PMID 15772572. S2CID 10982395.
- ^ Jump up to: a b c d e f g h i Sitruk-Ware R (January 1989). "Transdermal delivery of steroids". Contraception. 39 (1): 1–20. doi:10.1016/0010-7824(89)90012-7. PMID 2642780.
- ^ Jump up to: a b c d e f Bińkowska M, Woroń J (June 2015). "Progestogens in menopausal hormone therapy". Przeglad Menopauzalny = Menopause Review. 14 (2): 134–43. doi:10.5114/pm.2015.52154. PMC 4498031. PMID 26327902.
- ^ "Progestogel". Drugs.com. Archived from the original on 2009-06-03.
- ^ Marker RE, Krueger J (1940). "Sterols. CXII. Sapogenins. XLI. The Preparation of Trillin and its Conversion to Progesterone". J. Am. Chem. Soc. 62 (12): 3349–3350. doi:10.1021/ja01869a023.
- ^ Zava DT, Dollbaum CM, Blen M (March 1998). "Estrogen and progestin bioactivity of foods, herbs, and spices". Proceedings of the Society for Experimental Biology and Medicine. 217 (3): 369–78. doi:10.3181/00379727-217-44247. PMID 9492350. S2CID 20673587.
- ^ Komesaroff PA, Black CV, Cable V, Sudhir K (June 2001). "Effects of wild yam extract on menopausal symptoms, lipids and sex hormones in healthy menopausal women". Climacteric. 4 (2): 144–50. doi:10.1080/713605087. PMID 11428178.
- ^ Jump up to: a b Sitruk-Ware R (February 1993). "Percutaneous and transdermal oestrogen replacement therapy". Annals of Medicine. 25 (1): 77–82. doi:10.3109/07853899309147862. PMID 8435193.
- ^ Jump up to: a b c d e Mauvais-Jarvis P, Sitruk-Ware R, Kuttenn F (1981). "Benign Breast Disease". Breast Cancer 4. pp. 51–94. doi:10.1007/978-1-4615-6571-0_3. ISBN 978-1-4615-6573-4.
- ^ De Boever J, Verheugen C, van Maele G, Vandekerckhove D (1983). "Steroid Concentrations in Serum, Glandular Breast Tissue, and Breast Cyst Fluid of Control and Progesterone-Treated Patients" (PDF). In Alberto Angeli (ed.). Endocrinology of Cystic Breast Disease. Raven Press. pp. 93–99.
- ^ Jump up to: a b c Taubert HD (1989). "Lokaltherapie mit Sexualsteroiden". Gießener Gynäkologische Fortbildung 1989. pp. 214–224. doi:10.1007/978-3-642-50217-0_25. ISBN 978-3-540-51234-9.
- ^ Wiedersberg S, Guy RH (September 2014). "Transdermal drug delivery: 30+ years of war and still fighting!" (PDF). Journal of Controlled Release. 190: 150–6. doi:10.1016/j.jconrel.2014.05.022. PMID 24852092. S2CID 13842061.
- ^ Jones H (25 September 2008). Testosterone Deficiency in Men. OUP Oxford. pp. 89–. ISBN 978-0-19-954513-1.
- ^ Rastrelli G, Reisman Y, Ferri S, Prontera O, Sforza A, Maggi M, Corona G (2019). "Testosterone Replacement Therapy". Sexual Medicine. pp. 79–93. doi:10.1007/978-981-13-1226-7_8. ISBN 978-981-13-1225-0. S2CID 240176927.
- ^ Jump up to: a b Potts RO, Lobo RA (May 2005). "Transdermal drug delivery: clinical considerations for the obstetrician-gynecologist". Obstet Gynecol. 105 (5 Pt 1): 953–61. doi:10.1097/01.AOG.0000161958.70059.db. PMID 15863530. S2CID 23411589.
- ^ Jump up to: a b c d e f g h Du JY, Sanchez P, Kim L, Azen CG, Zava DT, Stanczyk FZ (2013). "Percutaneous progesterone delivery via cream or gel application in postmenopausal women: a randomized cross-over study of progesterone levels in serum, whole blood, saliva, and capillary blood". Menopause. 20 (11): 1169–75. doi:10.1097/GME.0b013e31828d39a2. PMID 23652031. S2CID 33857615.
- ^ Jump up to: a b c Heustess A, Asbill S, Eagerton D, Arnold J (2014). "In vitro skin penetration and skin content of progesterone from various topical formulations". Int J Pharm Compd. 18 (6): 512–5. PMID 25906629.
- ^ Jump up to: a b c Wright F, Mauvais-Jarvis P (1989). "Metabolism of Sex Steroids". Pharmacology of the Skin I. Handbook of Experimental Pharmacology. Vol. 87. pp. 247–255. doi:10.1007/978-3-642-73797-8_15. ISBN 978-3-642-73799-2. ISSN 0171-2004.
- ^ Jump up to: a b Mauvais-Jarvis P, Kuttenn F, Ohlgiesser C (April 1974). "Résultats du traitement de mastodynies et de mastopathies par la progestérone percutanée" [Results of treating mastodynias and mastopathies with percutaneous progesterone]. Nouv Presse Med (in French). 3 (16): 1027–8. PMID 4836479.
- ^ Mauvais-Jarvis P, Kuttenn F, Baudot N (January 1974). "Inhibition of testosterone conversion to dihydrotestosterone in men treated percutaneously by progesterone". J. Clin. Endocrinol. Metab. 38 (1): 142–7. doi:10.1210/jcem-38-1-142. PMID 4809637.
- ^ Mauvais-Jarvis P, Baudot N, Bercovici JP (December 1969). "In vivo studies on progesterone metabolism by human skin". J. Clin. Endocrinol. Metab. 29 (12): 1580–5. doi:10.1210/jcem-29-12-1580. PMID 5347688.
- ^ Zargar-Shoshtari S, Wahhabaghei H, Mehrsai A, Wen J, Alany R (2010). "Transdermal delivery of bioidentical progesterone using dutasteride (A 5α-reductase inhibitor): a pilot study". J Pharm Pharm Sci. 13 (4): 626–36. doi:10.18433/j3rw2h. PMID 21486536.
- ^ Wahhabaghei H, Mehrsai A, Wen J, Alany R (2011). "Transdermal Delivery of Bioidentical Progesterone with a Steroid 5α-Reductase Inhibitor (Dutasteride): a Pilot Study". Journal of Pharmacy & Pharmaceutical Sciences. 13 (4): 626–36. doi:10.18433/J3RW2H. ISSN 1482-1826. PMID 21486536.
- ^ Zargar-Shoshtari S (2011). Transdermal Delivery of Progesterone (PhD thesis). The University of Auckland. hdl:2292/8199.
- ^ Rakel D (2012). Integrative Medicine. Elsevier Health Sciences. pp. 330–. ISBN 978-1-4377-1793-8.
- ^ Jump up to: a b De Boever J, Desmet B, Vandekerckhove D (1980). "Variation of progesterone, 20α-dihydroprogesterone and oestradiol concentrations in human mammary tissue and blood after topical administration of progesterone". In Mauvais-Jarvis P, Vichers CF, Wepierre J (eds.). Percutaneous absorption of steroids. Academic Press. pp. 259–265. ISBN 9780124806801.
- ^ Jump up to: a b Чанг К.Дж., Ли Т.Т., Линарес-Крус Дж., Фурнье С., де Линьер Б. (апрель 1995 г.). «Влияние чрескожного введения эстрадиола и прогестерона на цикл эпителиальных клеток молочной железы человека in vivo» . Плодородный. Стерильный . 63 (4): 785–91. дои : 10.1016/S0015-0282(16)57482-2 . ПМИД 7890063 .
- ^ Спайсер Д.В., Урсин Дж., Пайк MC (май 1996 г.). «Концентрация прогестерона – физиологическая или фармакологическая?» . Плодородный. Стерильный . 65 (5): 1077–8. дои : 10.1016/s0015-0282(16)58295-8 . ПМИД 8612843 .
- ^ Jump up to: а б с д и ж г час фон Ай Корлета Х, Капп Э, Феррейра МБ (2004). «Фармакокинетика натуральных вагинальных суппозиториев прогестерона». Гинекол. Обстет. Инвестируйте . 58 (2): 105–8. дои : 10.1159/000078842 . ПМИД 15192285 . S2CID 46611378 .
- ^ Рао К., Карп Х.Дж., Фишер Р. (30 сентября 2013 г.). Принципы и практика вспомогательных репродуктивных технологий (3 тома) . JP Medical Ltd. с. 1025–. ISBN 978-93-5090-736-8 .
Вагинальное введение прогестерона может осуществляться разными способами, например, с помощью микронизированных вагинальных суппозиториев (например, Утрожестана или Циклогеста по 600 мг в день), пенообразующих вагинальных вкладышей (Эндометрин) или вагинальных гелей (8% гель Кринона, содержащий 90 мг микронизированного прогестерона, одно или два применения в день).
- ^ Янушпольский Э.Х. (7 июня 2011 г.). «Доказательное использование прогестерона во время ЭКО» . В Раковски С., Шлегель П.Н., Фаузер BC, Барнард Л. (ред.). Двухгодичный обзор бесплодия . Springer Science & Business Media. стр. 84–85. ISBN 978-1-4419-8456-2 .
В настоящее время имеются три стандартизированные формы вагинального прогестерона, коммерчески доступные для использования при ЭКО. Капсулы микронизированного прогестерона (Утрожестан/Прометрий) доступны и широко используются в Европе и Южной Америке, но не одобрены FDA для использования при ЭКО/ВРТ в США. Двумя формами прогестерона, одобренными FDA для использования при ЭКО, являются вагинальный гель Crinone 8% и, с недавних пор, эндометрин 100 мг (натуральный прогестерон в капсулах).
- ^ Друг ДР (октябрь 2016 г.). «Развитие систем контролируемого высвобождения за последние 50 лет в области контрацепции». J Контрольный релиз . 240 : 235–241. дои : 10.1016/j.jconrel.2015.12.043 . ПМИД 26732558 .
- ^ Майлз Р.А., Полсон Р.Дж., Лобо Р.А., Пресс М.Ф., Дамуш Л., Зауэр М.В. (сентябрь 1994 г.). «Фармакокинетика и уровни прогестерона в ткани эндометрия после введения внутримышечным и вагинальным путем: сравнительное исследование» . Плодородный. Стерильный . 62 (3): 485–90. дои : 10.1016/s0015-0282(16)56935-0 . ПМИД 8062942 .
- ^ Шмидт Дж.В., Воллнер Д., Курсио Дж., Ридлингер Дж., Ким Л.С. (октябрь 2006 г.). «Заместительная гормональная терапия у женщин в менопаузе: прошлые проблемы и будущие возможности». Гинекол. Эндокринол . 22 (10): 564–77. дои : 10.1080/09513590600927017 . ПМИД 17135036 . S2CID 11567574 .
- ^ Ву Дж., Чен Дж., Ху Х., Чжоу Х., Лю Дж., Лев Д. и др. (2017). «Фармакокинетические свойства трех форм вагинального прогестерона, вводимых в однократной или многократной дозе здоровым китайским женщинам в постменопаузе» . Границы в фармакологии . 8 : 212. дои : 10.3389/fphar.2017.00212 . ПМК 5397408 . ПМИД 28473770 .
- ^ Jump up to: а б с д и ж Голетиани Н.В., Кейт Д.Р., Горский С.Дж. (октябрь 2007 г.). «Прогестерон: обзор безопасности клинических исследований». Exp Clin Психофармакол . 15 (5): 427–44. дои : 10.1037/1064-1297.15.5.427 . ПМИД 17924777 .
- ^ Силлс ES (7 сентября 2015 г.). Скрининг одиночного эуплоидного эмбриона: молекулярная генетика в репродуктивной медицине . Спрингер. стр. 276–277. ISBN 978-3-319-16892-0 .
- ^ Татфорд EP (6 декабря 2012 г.). Проблемы гинекологии . Springer Science & Business Media. стр. 100-1 85–. ISBN 978-94-009-4125-0 .
Прогестерон также можно назначать ректально или вагинально в виде суппозиториев (Циклогест) в дозе 400 мг в день.
- ^ Агса М.М., Рахманпур Х., Багери М., Давари-Танха Ф., Наср Р. (октябрь 2012 г.). «Рандомизированное сравнение эффективности, побочных эффектов и удобства для пациентов при вагинальном и ректальном введении Циклогеста (®) при использовании для поддержки лютеиновой фазы при лечении ИКСИ». Архив гинекологии и акушерства . 286 (4): 1049–54. дои : 10.1007/s00404-012-2410-7 . ПМИД 22714063 . S2CID 12892111 .
- ^ Хруф М., Слимани С., Хруф М.Р., Брахам М., Буяхия М., Берджеб К.К. и др. (2016). «Прогестерон для поддержки лютеиновой фазы при экстракорпоральном оплодотворении: сравнение вагинальных и ректальных пессариев с вагинальными капсулами: рандомизированное контролируемое исследование» . Клиническая медицина. Женское здоровье . 9 : 43–47. дои : 10.4137/CMWH.S32156 . ПМК 5217976 . ПМИД 28096703 .
- ^ Jump up to: а б Тэй П.Ю., Лентон Э.А. (июнь 2005 г.). «Влияние лютеиновой добавки на исход беременности после циклов стимулированного ЭКО» (PDF) . Медицинский журнал Малайзии . 60 (2): 151–7. ПМИД 16114155 .
- ^ Jump up to: а б ван дер Меер Ю.Г., ван Лоенен AC, Лондерслут EW, Ясманн LJ (октябрь 1982 г.). «Уровень прогестерона в плазме после использования суппозиториев в высоких дозах. Предварительный отчет». Фармацевтический еженедельник. Научное издание . 4 (5): 135–6. дои : 10.1007/BF01959031 . ПМИД 7145597 . S2CID 19671703 .
- ^ Jump up to: а б с Ниллиус С.Дж., Йоханссон Э.Д. (июнь 1971 г.). «Уровни прогестерона в плазме после вагинального, ректального или внутримышечного введения прогестерона». Американский журнал акушерства и гинекологии . 110 (4): 470–7. дои : 10.1016/0002-9378(71)90686-7 . ПМИД 5582003 .
- ^ Гамбургер С (1965). «Применение прогестерона в форме суппозиториев». Акта Эндокринологика . 49 (3_Дополнение): S101. дои : 10.1530/acta.0.049S101 . ISSN 0804-4643 .
- ^ Ван дер Меер Ю.Г., Бенедек-Ясманн Л.Дж., Ван Лоенен AC (2009). «Влияние высоких доз прогестерона на предменструальный синдром; двойное слепое перекрестное исследование». Журнал психосоматического акушерства и гинекологии . 2 (4): 220–222. дои : 10.3109/01674828309088321 . ISSN 0167-482X .
- ^ Jump up to: а б с Кнёрр К., Беллер ФК, Лауритцен С (17 апреля 2013 г.). Учебник гинекологии . Издательство Спрингер. стр. 214–. ISBN 978-3-662-00942-0 .
- ^ Кнёрр К., Кнёрр-Гертнер Х., Беллер Ф.К., Лауритцен К. (8 марта 2013 г.). Акушерство и гинекология: физиология и патология репродукции . Издательство Спрингер. стр. 583–. ISBN 978-3-642-95583-9 .
- ^ Лабхарт А. (6 декабря 2012 г.). Клиническая эндокринология: теория и практика . Springer Science & Business Media. стр. 554–. ISBN 978-3-642-96158-8 .
- ^ Jump up to: а б Горский Ю, Пресль Ю (1981). «Гормональное лечение нарушений менструального цикла» . В Горский Дж., Пресл К. (ред.). Функция яичников и ее нарушения: диагностика и терапия . Springer Science & Business Media. стр. 309–332. дои : 10.1007/978-94-009-8195-9_11 . ISBN 978-94-009-8195-9 .
- ^ Уфер Дж (1969). Принципы и практика гормональной терапии в гинекологии и акушерстве . де Грюйтер. п. 49. ИСБН 9783110006148 .
17α-Гидроксипрогестерона капроат представляет собой депо-прогестаген, полностью не имеющий побочных действий. Доза, необходимая для индукции секреторных изменений в примированном эндометрии, составляет около 250 мг. за менструальный цикл.
- ^ Пширембель В. (1968). Практическая гинекология: для студентов и врачей . Вальтер де Грюйтер. стр. 598, 601. ISBN. 978-3-11-150424-7 .
- ^ Jump up to: а б с д Ферин Дж. (сентябрь 1972 г.). «Эффекты, продолжительность действия и метаболизм у человека» . В Тауске М (ред.). Фармакология эндокринной системы и родственных препаратов: прогестерон, гестагенные препараты и средства против бесплодия . Том. II. Пергамон Пресс. стр. 13–24. ISBN 978-0080168128 . OCLC 278011135 .
- ^ Хенцль М.Р., Эдвардс Дж.А. (10 ноября 1999 г.). «Фармакология прогестинов: производные 17α-гидроксипрогестерона и прогестины первого и второго поколения». В Sitruk-Ware R, Mishell DR (ред.). Прогестины и антипрогестины в клинической практике . Тейлор и Фрэнсис. стр. 101–132. ISBN 978-0-8247-8291-7 .
- ^ Jump up to: а б Браттон Дж (1976). Фармакология половых гормонов . Академическая пресса. п. 114. ИСБН 978-0-12-137250-7 .
- ^ Санг Г.В. (апрель 1994 г.). «Фармакодинамические эффекты комбинированных инъекционных контрацептивов, принимаемых один раз в месяц». Контрацепция . 49 (4): 361–385. дои : 10.1016/0010-7824(94)90033-7 . ПМИД 8013220 .
- ^ Топпозада МК (апрель 1994 г.). «Существующие комбинированные инъекционные контрацептивы разового приема в месяц». Контрацепция . 49 (4): 293–301. дои : 10.1016/0010-7824(94)90029-9 . ПМИД 8013216 .
- ^ Jump up to: а б с Гебельсманн Ю (1986). «Фармакокинетика противозачаточных стероидов у человека» . В Грегуаре А.Т., Блай Р.П. (ред.). Противозачаточные стероиды: фармакология и безопасность . Springer Science & Business Media. стр. 67–111. дои : 10.1007/978-1-4613-2241-2_4 . ISBN 978-1-4613-2241-2 .
- ^ Беккер Х., Дюстерберг Б., Клостерхалфен Х. (1980). «[Биодоступность ципротерона ацетата после перорального и внутримышечного применения у мужчин (перевод автора)]» [Биодоступность ципротерона ацетата после перорального и внутримышечного применения у мужчин]. Международная урология . 35 (6): 381–385. дои : 10.1159/000280353 . ПМИД 6452729 .
- ^ Мольц Л., Хаазе Ф., Шварц У., Хаммерштейн Дж. (май 1983 г.). «[Лечение вирилизированных женщин внутримышечным введением ципротерона ацетата]» [Эффективность внутримышечного применения ципротерона ацетата при гиперандрогении]. Geburtshilfe und Frauenheilkunde . 43 (5): 281–287. дои : 10.1055/s-2008-1036893 . ПМИД 6223851 .
- ^ Райт Джей Си, Берджесс диджей (29 января 2012 г.). Инъекции длительного действия и имплантаты . Springer Science & Business Media. стр. 114–. ISBN 978-1-4614-0554-2 .
- ^ Чу Ю. Х., Ли Ц, Чжао З. Ф. (апрель 1986 г.). «Фармакокинетика мегестрола ацетата у женщин, получающих внутримышечные инъекции инъекционного контрацептива длительного действия эстрадиол-мегестрол» . Китайский журнал клинической фармакологии .
Результаты показали, что после инъекции концентрация МА в плазме быстро увеличивалась. Среднее время пикового уровня МА в плазме приходилось на 3-й день, наблюдалась линейная зависимость между log концентрации МА в плазме и временем (днями) после введения у всех субъектов, период полувыведения t1/2β = 14,35 ± 9,1 дня.
- ^ Руннебаум БК, Рабе Т, Кизель Л (6 декабря 2012 г.). Женская контрацепция: последние новости и тенденции . Springer Science & Business Media. стр. 429–. ISBN 978-3-642-73790-9 .
- ^ Артини П.Г., Дженаццани А.Р., Петралья Ф (11 декабря 2001 г.). Достижения гинекологической эндокринологии . ЦРК Пресс. стр. 105–. ISBN 978-1-84214-071-0 .
- ^ Кинг Т.Л., Брукер М.К., Крибс Дж.М., Фэйи Дж.О. (21 октября 2013 г.). Акушерство Варни . Издательство Джонс и Бартлетт. стр. 495–. ISBN 978-1-284-02542-2 .
- ^ Jump up to: а б с д и Бернардо-Эскудеро Р., Кортес-Бонилья М., Алонсо-Камперо Р., Франсиско-Досе М.Т., Чаварин-Гонсалес Х., Пиментель-Мартинес С., Самбрано-Тапия Л. (2012). «Наблюдательное исследование местной переносимости инъекционных микросфер прогестерона». Гинекол. Обстет. Инвестируйте . 73 (2): 124–9. дои : 10.1159/000330711 . ПМИД 21997608 . S2CID 5163167 .
- ^ Тайлер Э.Т., Олсон Х.Дж. (апрель 1959 г.). «Стимулирующее и подавляющее фертильность действие новых стероидных гормональных веществ». J Am Med Assoc . 169 (16): 1843–54. дои : 10.1001/jama.1959.03000330015003 . ПМИД 13640942 .
- ^ Ферин Дж. (сентябрь 1972 г.). «Эффекты, продолжительность действия и метаболизм у человека». В Тауске М (ред.). Фармакология эндокринной системы и родственных препаратов: прогестерон, гестагенные препараты и средства против бесплодия . Том. II. Пергамон Пресс. стр. 13–24. ISBN 978-0080168128 . OCLC 278011135 .
- ^ Горский Ю, Пресль Ю (1981). «Гормональное лечение нарушений менструального цикла» . В Дж. Горском, Дж. Пресле (ред.). Функция яичников и ее нарушения . Springer Science & Business Media. стр. 309–332. дои : 10.1007/978-94-009-8195-9_11 . ISBN 978-94-009-8195-9 .
- ^ Кнёрр К., Беллер ФК, Лауритцен С (17 апреля 2013 г.). Учебник гинекологии . Издательство Спрингер. стр. 214–. ISBN 978-3-662-00942-0 .
- ^ Jump up to: а б Хенцль М., Хорски Дж., Пресл Дж. (1965). «Рациональное лечение гестагенами в гинекологии». Чехословацкая гинекология (на чешском языке). 30 (1/2): 10–16. ISSN 0374-6852 .
Рациональные показания к применению чистого прогестерона и некоторых гестагенов. Это депо-микрокристаллические препараты (Аголютин депо), Неолютин и новые, эффективные для перорального применения гестагены (нор-стероиды, Суперлютин). [...]
• Хенцл М., Хорски Дж., Пресл Дж. (1979). «Рациональное лечение гестагенами в гинекологии». Чехословацкая гинекология (на чешском языке). 44 . ISSN 0374-6852 . - ^ Обер К.Г., Кляйн И., Вебер М. (1954). «[Проблема терапии прогестероном; экспериментальные исследования по тесту Хукера-Форбса и клинические наблюдения над кристаллическими суспензиями]» [К вопросу о лечении прогестероном: экспериментальные исследования по тесту Хукера-Форбса и клинические наблюдения с кристаллическими суспензиями]. Архив гинекологии . 184 (5): 543–616. дои : 10.1007/BF00976991 . ПМИД 13198154 . S2CID 42832785 .
- ^ Энгелькинг Э (13 марта 2013 г.). Немецкое офтальмологическое общество: Мюнхен, 1950 г. [ Немецкое офтальмологическое общество: Мюнхен, 1950 г. ]. Издательство Спрингер. стр. 145–146. ISBN 978-3-642-47081-3 .
Внутримышечные инъекции масляных растворов прогестерона достигают высокого ударного эффекта, однако стойкий эффект незначителен. Эффект от инъекции 10 мг [внутримышечно] в тяжелых случаях глаукомы может исчезнуть примерно через 6 часов. В результате снова повышается глазное давление. Чтобы уровень гормона не упал слишком быстро и в то же время добиться шокового эффекта, мы любим смешивать масляный раствор с кристаллической суспензией. Обычно мы делаем уколы в дельтовидную мышцу. При использовании суспензий гормональных кристаллов вам потребуются довольно толстые иглы, и лучше всего использовать шприц емкостью 1 куб.см. Последний вид депо-терапии наиболее приемлем для офтальмологической практики. В более тяжелых случаях с хроническим высоким повышением давления, [например] при использовании [ампулы] с 30 мг [кристаллической суспензии] первые инъекции действуют лишь в течение нескольких дней; Однако по мере увеличения продолжительности лечения интервалы между отдельными инъекциями могут увеличиваться до нескольких недель. Большинство пациентов отчетливо замечают, что эффект депо прекращается, и спонтанно делают новую инъекцию. [...] депо: кристаллическая суспензия флаволутана (Boehringer & Söhne) и 30 мг.
- ^ Ширман Р.П. (июнь 1975 г.). «Разработка депо контрацептивов». Журнал биохимии стероидов . 6 (6): 899–902. дои : 10.1016/0022-4731(75)90323-4 . ПМИД 1177432 .
- ^ Jump up to: а б Эдкинс Р.П. (1959). «Изменение продолжительности действия лекарств». Журнал фармации и фармакологии . 11 (С1): 54Т–66Т. дои : 10.1111/j.2042-7158.1959.tb10412.x . ISSN 0022-3573 . S2CID 78850713 .
- ^ Jump up to: а б с Ленс Дж., Овербек Г.А., Полдерман Дж. (1949). «Действие половых гормонов в некоторых органических растворителях, эмульгированных в воде». Акта Эндокринологика . 2 (4): 396–404. дои : 10.1530/acta.0.0020396 . ПМИД 18140399 .
- ^ Херрманн У (1958). «Зависимость кровотечения отмены, вызванного кристаллами эстрогена и прогестерона, от размера зерен». Гинекологическое и акушерское обследование . 146 (4): 318–323. дои : 10.1159/000306607 . ISSN 1423-002X .
- ^ Раппапорт Ф., Ласс Н. (август 1947 г.). «Инъекционные кристаллические гормоны». Ланцет . 2 (6469): 296–297. дои : 10.1016/s0140-6736(47)92066-7 . ПМИД 20344499 .
- ^ Мастерс WH, Гроди М.Х., Магаллон Д.Т. (ноябрь 1952 г.). «Прогестерон в водной кристаллической суспензии и прогестерон в масле; сравнение с помощью тестов на кровотечение отмены у женщин» . Журнал клинической эндокринологии и метаболизма . 12 (11): 1445–53. doi : 10.1210/jcem-12-11-1445 . ПМИД 12999984 .
- ^ Jump up to: а б с Кар Х (8 марта 2013 г.). Консервативная терапия женских заболеваний: показания, пределы и методы, включая назначение . Издательство Спрингер. стр. 20–21. ISBN 978-3-7091-5694-0 .
- ^ «Краткая информация о продукте: Аголютин Депо» [Краткая информация о продукте: Аголютин Депо] (PDF) . Биотика АС (на чешском языке). zvxcess-date=15 января 2022 г. Архивировано из оригинала (PDF) 19 мая 2019 г.
- ^ Статьи в чешских журналах . Государственная библиотека Чехословакии. 1960. стр. 1601, 1642.
- ^ Пльзенский лекарственный сборник. Дополнение . 1961. с. 169.
- ^ Обзор чехословацкой медицины . Avicenum - Чехословацкая медицинская пресса. 1973. с. 5.
Прогестерон, водная микрокристаллическая суспензия (Аголютин Депо СПОФА).
- ^ Шор Дж (1968). «Терапевтическое применение прогестагенов у людей» [Терапевтическое использование прогестагенов у людей]. Гестагены [ прогестагены ]. Издательство Спрингер. стр. 1026–1124. дои : 10.1007/978-3-642-99941-3_7 . ISBN 978-3-642-99941-3 .
C. Дисфункциональные маточные кровотечения. [...] 1. депо-инъекции. 1. Оригинальный метод по КАУФМАНУ и ОБЕРУ. Вводят 1 амп. с 200 мг прогестерона и 10 мг монобензоата эстрадиола в виде кристаллической суспензии (систоциклина) [676, 678, 679, 295, 482, 365, 434, 563, 400]. [...] примеры. КАУФМАНН и др. [485]: 400 мг прогестерона + 20 мг кристаллической суспензии монобензоата эстрадиола. ELERT [224] U. HERRMANN [363]: 200 мг прогестерона + 10 мг кристаллической суспензии монобензоата эстрадиола.
- ^ Симпозиум Сиба . Сиба. 1957.
Ассортимент гормональных препаратов ЦИБА расширился с появлением «Систоциклина», одна ампула которого содержит 200 мг прогестерона и 10 мг монобензоата эстрадиола в кристаллической суспензии; таким образом, он отвечает требованиям – в соответствии с последними данными клиники КАУФМАН – для случаев, отмеченных дефицитом гормона желтого тела, например, при функциональном кровотечении, таком как геморрагическая метропатия.
- ^ Ciba Zeitschrift . 1957. с. 3001.
Систоциклин - микрокристаллическая суспензия, содержащая 200 мг прогестерона и 10 мг монобензоата эстрадиола на ампулу - стал особенно полезен при лечении так называемых функциональных [...]
- ^ Jump up to: а б Пширембель В. (1968). «Таблицы наиболее распространенных гормональных препаратов» . Практическая гинекология: для студентов и врачей . Вальтер де Грюйтер. стр. 601–. ISBN 978-3-11-150424-7 .
- ^ Шор Дж (1960). Гормональная терапия в гинекологии: основы и практика . Грютер. п. 153. ИСБН 9783111138770 .
- ^ Jump up to: а б Свайер Г.И. (январь 1960 г.). «Прогестагены и их клиническое применение: Часть I» . Бр Мед Дж . 1 (5165): 48–9. дои : 10.1136/bmj.1.5165.48 . ЧВК 1966392 . ПМИД 13836156 .
- ^ Браттон Дж (1976). Фармакология половых гормонов . Академическая пресса. п. 38. ISBN 978-0-12-137250-7 .
- ^ Jump up to: а б с Фрейзер И.С. (1998). Эстрогены и прогестагены в клинической практике . Черчилль Ливингстон. стр. 13, 92. ISBN. 978-0-443-04706-0 .
- ^ Jump up to: а б с Брэдбери Дж. Т., Лонг Р. К., Дарем, WC (1953). «Требования к прогестерону и эстрогену для индукции и поддержания децидуальной оболочки». Плодородный. Стерильный . 4 (1): 63–75. дои : 10.1016/s0015-0282(16)31145-1 . ПМИД 13021207 .
- ^ Jump up to: а б с Мишель Д.Р. (май 1996 г.). «Фармакокинетика депо-контрацепции ацетата медроксипрогестерона» . Журнал репродуктивной медицины . 41 (5 дополнений): 381–90. PMID 8725700 . Архивировано из оригинала 29 июля 2020 г. Проверено 19 мая 2019 г.
- ^ Гебельсманн Ю (1986). «Фармакокинетика противозачаточных стероидов у человека» . В Грегуаре А.Т., Блай Р.П. (ред.). Контрацептивные стероиды . Springer Science & Business Media. стр. 67–111. дои : 10.1007/978-1-4613-2241-2_4 . ISBN 978-1-4613-2241-2 .
- ^ Jump up to: а б Ферин Дж. (январь 1952 г.). «Относительная продолжительность действия натуральных и синтетических эстрогенов, вводимых парентерально у женщин с дефицитом эстрогенов». Журнал клинической эндокринологии и метаболизма . 12 (1): 28–35. doi : 10.1210/jcem-12-1-28 . ПМИД 14907837 .
- ^ Jump up to: а б Овербек, Калифорния (1952). «Некоторые данные об эмульсиях стероидных гормонов». Симпозиум Фонда Ciba - Назначение стероидных гормонов (Книга II коллоквиумов по эндокринологии, том 3) . Симпозиумы Фонда Новартис. стр. 254–262. дои : 10.1002/9780470715154.ch2 . ISBN 9780470715154 . ISSN 1935-4657 .
- ^ Гамбургер С (1952). «Выделение 17-кетостероидов и способы введения препаратов тестостерона». Симпозиум Фонда Ciba - Назначение стероидных гормонов (Книга II коллоквиумов по эндокринологии, том 3) . Симпозиумы Фонда Новартис. стр. 304–322. дои : 10.1002/9780470715154.ch7 . ISBN 9780470715154 . ISSN 1935-4657 .
- ^ Гамбургер С (1949). «Лечение тестостероном и выведение 17-кетостероидов; введение пропионата тестостерона, эмульгированного в воде». Акта Эндокринологика . 3 (2): 119–28, ил. дои : 10.1530/acta.0.0030119 . ПМИД 15397391 .
- ^ Eversole WJ, Leathem JH, Schraer H (декабрь 1950 г.). «Препараты тестостерона пролонгированного действия». Эндокринология . 47 (6): 448–53. дои : 10.1210/endo-47-6-448 . ПМИД 14802345 .
- ^ Гамбургер С., Биркет-Смит Э., Кэи С. (январь 1952 г.). «Лечение тестостероном и выведение 17-кетостероидов. III. Сравнение времени всасывания и выведения пропионата тестостерона, тестостерон-изобутирата и тестостерон-н-валерата». Акта Эндокринологика . 9 (1): 79–98. дои : 10.1530/acta.0.0090079 . ПМИД 14932696 .
- ^ Гамбургер С (август 1956 г.). «Лечение тестостероном и выведение 17-кетостероидов. IV. Введение бета-циклопентилпропионата тестостерона, фураната тестостерона и энантата тестостерона». Акта Эндокринологика . 22 (4): 379–89. дои : 10.1530/acta.0.0220379 . ПМИД 13354228 .
- ^ Ширрен С. (14 марта 2013 г.). «Половые гормоны» . В Киммиге Дж. (ред.). Терапия кожных и венерических заболеваний . Издательство Спрингер. стр. 508–. ISBN 978-3-642-94850-3 .
- ^ Хорес А., Новаковски Х (1960). Практика эндокринологии . Г. Тиме. стр. 295.
- ^ Фон Нумерс С (1951). «Одновременное лечение вторичной аменореи эстрогеном и прогестероном». Акта Эндокринологика . 6 (1): 67–89. дои : 10.1530/acta.0.0060067 . ПМИД 14810456 .
- ^ «Новые специальности». Клинический еженедельник . 36 (17): 833. 1958. doi : 10.1007/BF01481957 . ISSN 0023-2173 . S2CID 42166026 .
- ^ Тобиас ГМ, Усабиага Р.А., Рианьо Х.Д., Эспиноза А.Б., Товар С.Р., Мартинес Э.Р. (2008). «Прогестерон в микросферах для лечения бесплодия» (PDF) . Медицинская карта группы Анхелес . 6 (1): 8.
- ^ Тобиас ГМ, Мартинес ЭР (2009). «Методика применения препаратов с микросферами в суспензии» (PDF) . Медицинская карта группы Анхелес . 7 (1): 13.
- ^ «Ювенум (эстрадиол/прогестерон) – Медикаментос ПЛМ» . Медикаментос ПЛМ . Архивировано из оригинала 18 сентября 2018 г. Проверено 17 сентября 2018 г.
- ^ «Инъекции эстрадиола/прогестерона — Laboratorios Carnot — AdisInsight» .
- ^ «Ювенум — Drugs.com» . Архивировано из оригинала 23 декабря 2017 г. Проверено 19 мая 2019 г.
- ^ Кортес-Бонилья М., Алонсо-Камперо Р., Бернардо-Эскудеро Р., Франциско-Досе М.Т., Чаварин-Гонсалес Х., Перес-Куэвас Р., Чедрауи П. (октябрь 2016 г.). «Улучшение качества жизни и симптомов менопаузы у женщин в климактерическом периоде, получавших низкие дозы ежемесячных парентеральных форм неполимерных микросфер 17β-эстрадиола/прогестерона». Гинекол. Эндокринол . 32 (10): 831–834. дои : 10.1080/09513590.2016.1183628 . ПМИД 27187320 . S2CID 22688585 .
- ^ Кортес-Бонилья М, Бернардо-Эскудеро Р, Алонсо-Камперо Р, Франсиско-Твелв МТ, Эрнандес-Валенсия М, Селис-Гонсалес К, Маркес-Оньяте Р, Чедрауи П., Урибе ХА (июль 2015 г.). «Лечение симптомов менопаузы с помощью трех низких доз непрерывного последовательного парентерального введения 17β-эстрадиола/прогестерона ежемесячно с использованием новой технологии неполимерных микросфер» . Гинекол. Эндокринол . 31 (7): 552–9. дои : 10.3109/09513590.2015.1019853 . ПМЦ 4776687 . ПМИД 26062108 .
- ^ Топпозада МК (апрель 1994 г.). «Существующие комбинированные инъекционные контрацептивы разового приема в месяц». Контрацепция . 49 (4): 293–301. дои : 10.1016/0010-7824(94)90029-9 . ПМИД 8013216 .
- ^ Гарса-Флорес Дж. (апрель 1994 г.). «Фармакокинетика инъекционных контрацептивов для приема один раз в месяц». Контрацепция . 49 (4): 347–59. дои : 10.1016/0010-7824(94)90032-9 . ПМИД 8013219 .
- ^ Багаде О, Павар В, Патель Р, Патель Б, Авасаркар В, Дивате С (2014). «Расширение использования обратимой контрацепции длительного действия: безопасный, надежный и экономически эффективный контроль над рождаемостью» (PDF) . World J Pharm Pharm Sci . 3 (10): 364–392. ISSN 2278-4357 . Архивировано из оригинала (PDF) 10 августа 2017 г. Проверено 19 мая 2019 г.
- ^ Ньютон-младший, Д'Арканг К, Холл П.Е. (1994). «Обзор «раз в месяц» комбинированных инъекционных контрацептивов». J Obstet Gynaecol (Лахор) . 4 (Приложение 1): С1–34. дои : 10.3109/01443619409027641 . ПМИД 12290848 .
- ^ Гарса-Флорес Дж., Фатиникун Т., Эрнандес Л., Рамос И., Карденас М., Менхивар М. (июль 1991 г.). «Пилотное исследование по оценке прогестерона/эстрадиола замедленного высвобождения в качестве инъекционного контрацептива для приема один раз в месяц». Контрацепция . 44 (1): 45–59. дои : 10.1016/0010-7824(91)90105-О . ПМИД 1893701 .
- ^ Гарса-Флорес Дж., Холл П.Е., Перес-Паласиос Дж. (1991). «Гормональные контрацептивы пролонгированного действия для женщин». J. Стероидная биохимия. Мол. Биол . 40 (4–6): 697–704. дои : 10.1016/0960-0760(91)90293-E . ПМИД 1958567 . S2CID 26021562 .
- ^ Локвуд Дж., Гризингер Г., Кометти Б. (2014). «Подкожный прогестерон по сравнению с вагинальным гелем прогестерона для поддержки лютеиновой фазы при экстракорпоральном оплодотворении: рандомизированное контролируемое исследование не меньшей эффективности» . Плодородный. Стерильный . 101 (1): 112–119.е3. doi : 10.1016/j.fertnstert.2013.09.010 . hdl : 11568/831754 . ПМИД 24140033 .
- ^ Jump up to: а б с Бейкер В.Л., Джонс К.А., Дуди К., Фулк Р., Йи Б., Адамсон Г.Д., Кометти Б., ДеВейн Г., Хьюберт Г., Тревизан С., Холер Ф., Джонс С., Соулз М. (2014). «Рандомизированное контролируемое исследование, сравнивающее эффективность и безопасность водного подкожного введения прогестерона с вагинальным прогестероном для поддержки лютеиновой фазы экстракорпорального оплодотворения» . Хм. Репродукция . 29 (10): 2212–20. дои : 10.1093/humrep/deu194 . ПМЦ 4164149 . ПМИД 25100106 .
- ^ Jump up to: а б с Крохатто Х.Б., Диас С., Перальта О., Хуэс Г., Эррерос К., Касадо М., Сальватьерра А., Миранда П. (1984). «Подкожные имплантаты прогестерона для регулирования фертильности у кормящих женщин». В Затучный Г.И., Голдсмит А., Шелтон Дж.Д., Шарра Дж.Дж. (ред.). Системы контрацепции длительного действия: материалы международного семинара по системам контрацепции длительного действия, 31 мая – 3 июня 1983 г., Новый Орлеан, Луизиана . Филадельфия: Харпер и Роу. стр. 543–549. ISBN 978-0-06-142905-7 . OCLC 1022572860 .
- ^ Киммиг Дж (1962). Терапия кожных и венерических заболеваний . Издательство Спрингер. стр. 507–. ISBN 978-3-642-94850-3 .
- ^ Лобо Р.А., Келси Дж., Маркус Р. (22 мая 2000 г.). Менопауза: биология и патобиология . Академическая пресса. стр. 619–. ISBN 978-0-08-053620-0 .
- ^ Пинкертон СП, Пикар Дж. Х. (февраль 2016 г.). «Обновленная информация по медицинским и нормативным вопросам, касающимся сложных и одобренных FDA лекарств, включая гормональную терапию» . Менопауза . 23 (2): 215–23. doi : 10.1097/GME.0000000000000523 . ПМЦ 4927324 . ПМИД 26418479 .
- ^ Санторо Н., Браунштейн Г.Д., Баттс К.Л., Мартин К.А., Макдермотт М., Пинкертон Дж.В. (апрель 2016 г.). «Составные биоидентичные гормоны в эндокринологической практике: научное заявление эндокринного общества» . Дж. Клин. Эндокринол. Метаб . 101 (4): 1318–43. дои : 10.1210/jc.2016-1271 . ПМИД 27032319 . S2CID 33802990 .
- ^ СП Пинкертона (декабрь 2014 г.). «Какие опасения вызывает индивидуально составленная «биоидентичная» гормональная терапия?». Менопауза . 21 (12): 1298–300. дои : 10.1097/GME.0000000000000376 . ПМИД 25387347 .
- ^ Мишель ДР (1941). «Клиническое исследование терапии прогестероном путем имплантации гранул». Американский журнал акушерства и гинекологии . 41 (4): 687–693. дои : 10.1016/S0002-9378(41)90665-8 . ISSN 0002-9378 .
- ^ Епископ П.М. (1944). «Эндокринная терапия в гинекологии и акушерстве». BJOG: Международный журнал акушерства и гинекологии . 51 (1): 51–63. дои : 10.1111/j.1471-0528.1944.tb07317.x . ISSN 1470-0328 . S2CID 71319436 .
- ^ Фосс Г.Л. (1943). «Имплантация таблеток половых гормонов мужчине». Британский медицинский бюллетень . 1 (2): 21–22. doi : 10.1093/oxfordjournals.bmb.a070135 . ISSN 1471-8391 .
- ^ Гринблатт Р.Б., Hair LQ (1945). «Поглощение гранул прогестерона». Журнал клинической эндокринологии и метаболизма . 5 (1): 38–39. doi : 10.1210/jcem-5-1-38 .
- ^ Гринблатт Р.Б., Суран Р.Р. (февраль 1949 г.). «Показания к применению гормональных таблеток в терапии эндокринных и гинекологических заболеваний». Являюсь. Дж. Обстет. Гинекол . 57 (2): 294–301. дои : 10.1016/0002-9378(49)90429-9 . ПМИД 18123090 .
- ^ Епископ П.М., Ричардс Н.А., Долл Р. (июль 1950 г.). «Привычный аборт; профилактическое значение имплантации гранул прогестерона» . Бр Мед Дж . 2 (4671): 130–3. дои : 10.1136/bmj.2.4671.130 . ПМК 2038208 . ПМИД 15434335 .
- ^ Епископ П.М., Фолли С.Дж. (август 1951 г.). «Абсорбция гормональных имплантатов у человека». Ланцет . 2 (6676): 229–32. дои : 10.1016/S0140-6736(51)93237-0 . ПМИД 14862159 .
- ^ Епископ П.М., Ричардс Н.А. (февраль 1952 г.). «Привычный аборт; дальнейшие наблюдения о профилактической ценности имплантации гранул прогестерона» . Бр Мед Дж . 1 (4752): 244–6. дои : 10.1136/bmj.1.4752.244 . ПМК 2022587 . ПМИД 14896102 .
- ^ Скоу Р.О., Эблинг Ф.Дж., Хендерсон И.В. (1973). Эндокринология: материалы Четвертого Международного конгресса эндокринологов, Вашингтон, округ Колумбия, 18-24 июня 1972 г. Отрывок Медика. п. 978. ИСБН 978-90-219-0166-4 .
Подкожные имплантаты. Другой способ добиться продолжительной активности — использование подкожных имплантатов, изготовленных путем сжатия кристаллических гормонов. Однако гранулы прогестерона плохо переносятся и примерно в 15—20% случаев могут возникать стерильные абсцессы или экструзии (Greenblatt, личное сообщение, 1969). По этой причине представляется, что имплантаты, изготовленные из чистых гестагенных стероидов, имеют мало шансов найти применение в противозачаточной терапии. [...]
- ^ Кроксато Х.Б., Диас С. (1987). «Место прогестерона в контрацепции человека». Дж. Стероидная биохимия . 27 (4–6): 991–4. дои : 10.1016/0022-4731(87)90179-8 . ПМИД 3320572 .
- ^ Jump up to: а б Шаабан М.М. (1991). «Контрацепция гестагенами и прогестероном в период лактации». J. Стероидная биохимия. Мол. Биол . 40 (4–6): 705–10. дои : 10.1016/0960-0760(91)90294-F . ПМИД 1835650 . S2CID 25152238 .
- ^ Jump up to: а б Крохатто Х.Б., Диас С., Перальта О, Хуэс Дж., Касадо М.Э., Сальватьерра А.М., Дуран Э. (сентябрь 1982 г.). «Регуляция фертильности у кормящих женщин. II. Сравнительная эффективность имплантатов прогестерона по сравнению с плацебо и медью Т». Ам. Дж. Обстет. Гинекол . 144 (2): 201–8. дои : 10.1016/0002-9378(82)90628-7 . ПМИД 7114130 .
- ^ Jump up to: а б Диас С., Перальта О., Хуэс Г., Эррерос К., Касадо М.Э., Сальватьерра А.М., Миранда П., Кроксато Х.Б. (октябрь 1984 г.). «Регуляция фертильности у кормящих женщин. VI. Контрацептивная эффективность подкожного имплантата прогестерона». Контрацепция . 30 (4): 311–25. дои : 10.1016/S0010-7824(84)80023-2 . ПМИД 6509984 .
- ^ Маннино, Калифорния, Южный СМ, Интурриси CE, Хинонес-Дженаб V (декабрь 2005 г.). «Фармакокинетика и эффекты имплантатов 17бета-эстрадиола и прогестерона у крыс с удаленными яичниками» . Джей Пейн . 6 (12): 809–16. дои : 10.1016/j.jpain.2005.07.007 . ПМИД 16326369 .
- ^ Jump up to: а б Бенаджиано Дж., Габельник Х., Фаррис М. (сентябрь 2008 г.). «Контрацептивные средства: системы подкожной доставки». Устройства Expert Rev Med . 5 (5): 623–37. дои : 10.1586/17434440.5.5.623 . ПМИД 18803473 . S2CID 207201811 .
- ^ Jump up to: а б Фриман С., Шульман Л.П. (февраль 2010 г.). «Соображения по использованию контрацептивов, содержащих только прогестин». Журнал Американской академии практикующих медсестер . 22 (2): 81–91. дои : 10.1111/j.1745-7599.2009.00473.x . ПМИД 20132366 . S2CID 36724865 .
- ^ Jump up to: а б с д Фальконе Т., Херд WW (1 января 2007 г.). Клиническая репродуктивная медицина и хирургия . Elsevier Науки о здоровье. стр. 406–. ISBN 978-0-323-03309-1 .
- ^ Jump up to: а б Слоан Э (2002). Биология женщин . Cengage Обучение. стр. 445–. ISBN 0-7668-1142-5 .
- ^ Эйкен А.Р., Трасселл Дж. (2014). «Последние достижения в области контрацепции» . F1000Премьер Представитель . 6 : 113. дои : 10.12703/P6-113 . ПМК 4251416 . ПМИД 25580267 .
- ^ Лобо РА (5 июня 2007 г.). Лечение женщин в постменопаузе: основные и клинические аспекты . Эльзевир. стр. 210–. ISBN 978-0-08-055309-2 .
- ^ Jump up to: а б Саймон Дж. А. (декабрь 1995 г.). «Микронизированный прогестерон: вагинальное и пероральное применение». Клиническая акушерство и гинекология . 38 (4): 902–14. дои : 10.1097/00003081-199538040-00024 . ПМИД 8616985 .
- ^ Станчик Ф.З., Хэпгуд Дж.П., Винер С., Мишелл Д.Р. (апрель 2013 г.). «Прогестагены, используемые в гормональной терапии в постменопаузе: различия в их фармакологических свойствах, внутриклеточном действии и клинических эффектах» . Эндокр. Преподобный . 34 (2): 171–208. дои : 10.1210/er.2012-1008 . ПМК 3610676 . ПМИД 23238854 .
- ^ Офрер МБ, Бенсон Х (июнь 1976 г.). «Прогестерон: обзор и последние достижения». Журнал фармацевтических наук . 65 (6): 783–800. дои : 10.1002/jps.2600650602 . ПМИД 945344 .
Дальнейшее чтение
[ редактировать ]- Лангекер Х (1968). «Абсорбция, распределение и выведение прогестагенов». Гестагены [ Прогестагены ]. Издательство Спрингер. стр. 264–351. дои : 10.1007/978-3-642-99941-3_3 . ISBN 978-3-642-99941-3 .
- Ситрук-Уэр Р., Брикер С., Де Линьер Б., Янева Х., Мове-Джарвис П. (октябрь 1987 г.). «Микронизированный прогестерон для перорального применения. Фармакокинетика биодоступности, фармакологические и терапевтические последствия - обзор». Контрацепция . 36 (4): 373–402. дои : 10.1016/0010-7824(87)90088-6 . ПМИД 3327648 .
- Саймон Дж. А. (декабрь 1995 г.). «Микронизированный прогестерон: вагинальное и пероральное применение». Клиническая акушерство и гинекология . 38 (4): 902–14. дои : 10.1097/00003081-199538040-00024 . ПМИД 8616985 .
- Руан X, Муек АО (ноябрь 2014 г.). «Системная терапия прогестероном — пероральная, вагинальная, инъекционная и даже трансдермальная?». Матуритас . 79 (3): 248–55. дои : 10.1016/j.maturitas.2014.07.009 . ПМИД 25113944 .

![Уровни прогестерона на протяжении менструального цикла у женщин с нормальным циклом и овуляцией.[25] Пунктирные горизонтальные линии — это средние интегральные уровни для каждой кривой, а пунктирная вертикальная линия — середина цикла (примерно в момент наступления овуляции).](http://upload.wikimedia.org/wikipedia/commons/thumb/b/bd/Progesterone_levels_across_the_normal_menstrual_cycle_in_women.png/300px-Progesterone_levels_across_the_normal_menstrual_cycle_in_women.png)
![Уровни эстрогена и прогестерона в детстве и подростковом возрасте, включая период полового созревания, у девочек.[26][27][28] Пунктирная вертикальная линия — средний возраст менархе (первая менструация и начало менструального цикла).](http://upload.wikimedia.org/wikipedia/commons/thumb/c/c3/Estrogen_and_progesterone_levels_by_age_during_childhood_and_adolescence_in_girls.png/300px-Estrogen_and_progesterone_levels_by_age_during_childhood_and_adolescence_in_girls.png)
![Уровни эстрогена, прогестерона и 17α-гидроксипрогестерона (17α-OHP) во время беременности у женщин.[29] Пунктирные вертикальные линии разделяют триместры.](http://upload.wikimedia.org/wikipedia/commons/thumb/a/aa/Estrogen_and_progesterone_levels_during_pregnancy_in_women.png/300px-Estrogen_and_progesterone_levels_during_pregnancy_in_women.png)
![Уровни прогестерона, измеренные методом ЖХ-МС/МС, после однократного приема или непрерывного приема 100 мг перорального микронизированного прогестерона в дозе 100 мг с пищей в течение 7 дней у женщин в постменопаузе.[95] Горизонтальная пунктирная линия представляет собой средний интегральный уровень за 24 часа.[95]](http://upload.wikimedia.org/wikipedia/commons/thumb/5/58/Progesterone_levels_with_100_mg_oral_progesterone_in_postmenopausal_women.png/285px-Progesterone_levels_with_100_mg_oral_progesterone_in_postmenopausal_women.png)
![Уровни прогестерона, измеренные с помощью РИА или ЖХ-МС, после однократного приема 100 мг микронизированного прогестерона перорально или вагинально у женщин в постменопаузе.[1][44] Уровни перорального прогестерона, измеренные с помощью РИА, являются ложно высокими из-за перекрестной реактивности, тогда как уровни, измеренные с помощью ЖХ-МС, являются надежными и точными.[96]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b1/Progesterone_levels_following_a_single_dose_of_oral_or_vaginal_micronized_progesterone_determined_with_RIA_or_LC%E2%80%93MS_in_postmenopausal_women.png/258px-Progesterone_levels_following_a_single_dose_of_oral_or_vaginal_micronized_progesterone_determined_with_RIA_or_LC%E2%80%93MS_in_postmenopausal_women.png)
![Уровни прогестерона, измеренные методом РИА, после однократного перорального приема микронизированного прогестерона в дозе 100, 200 или 300 мг у женщин в постменопаузе.[12] Горизонтальные пунктирные линии представляют собой средние интегральные уровни за 24 часа.[12] Уровни завышены из-за перекрестной реактивности с РИА.[1][44][97]](http://upload.wikimedia.org/wikipedia/commons/thumb/3/33/Progesterone_levels_with_different_doses_of_oral_micronized_progesterone_in_postmenopausal_women.png/283px-Progesterone_levels_with_different_doses_of_oral_micronized_progesterone_in_postmenopausal_women.png)
![Уровни прогестерона, измеренные методом РИА, после однократного перорального приема 100 мг различных препаратов порошка прогестерона, содержащихся в желатиновых капсулах, у людей-добровольцев.[56] Уровни завышены из-за перекрестной реактивности с РИА.[1][44][96]](http://upload.wikimedia.org/wikipedia/commons/thumb/4/4f/Progesterone_levels_with_different_preparations_of_oral_progesterone_in_human_volunteers.png/300px-Progesterone_levels_with_different_preparations_of_oral_progesterone_in_human_volunteers.png)
![Progesterone levels with RIA after a single oral dose of 200 mg progesterone at different particle sizes in postmenopausal women.[98] Levels are overestimated due to cross-reactivity with RIA.[1][44][96]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/be/Progesterone_levels_with_oral_progesterone_at_different_particle_sizes_in_postmenopausal_women.png/300px-Progesterone_levels_with_oral_progesterone_at_different_particle_sizes_in_postmenopausal_women.png)
![Progesterone levels with RIA after a single dose of 200 mg oral progesterone with or without food in postmenopausal women.[12] Levels are overestimated due to cross-reactivity with RIA.[1][44][96]](http://upload.wikimedia.org/wikipedia/commons/thumb/2/27/Progesterone_levels_measured_via_RIA_after_a_single_oral_dose_of_200_mg_progesterone_with_or_without_food_in_postmenopausal_women.png/294px-Progesterone_levels_measured_via_RIA_after_a_single_oral_dose_of_200_mg_progesterone_with_or_without_food_in_postmenopausal_women.png)
![Progesterone levels with vaginal or rectal administration of a suppository containing 100 mg progesterone (P4) in women.[107]](http://upload.wikimedia.org/wikipedia/commons/thumb/6/6e/Progesterone_levels_with_100_mg_rectal_or_vaginal_progesterone_in_women.png/291px-Progesterone_levels_with_100_mg_rectal_or_vaginal_progesterone_in_women.png)
![Progesterone levels with rectal administration of a suppository containing 25 or 100 mg progesterone (P4) in women.[163]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b4/Progesterone_levels_with_a_single_25_or_100_mg_rectal_suppository_in_women.png/251px-Progesterone_levels_with_a_single_25_or_100_mg_rectal_suppository_in_women.png)
![Progesterone levels with a single intramuscular injection of 25, 50, or 100 mg progesterone (P4) in oil solution in postmenopausal women.[75]](http://upload.wikimedia.org/wikipedia/commons/thumb/5/5e/Levels_of_progesterone_after_a_single_intramuscular_injection_of_different_doses_of_progesterone_in_postmenopausal_women.png/293px-Levels_of_progesterone_after_a_single_intramuscular_injection_of_different_doses_of_progesterone_in_postmenopausal_women.png)
![Progesterone levels with a single intramuscular injection of 10, 25, 50, or 100 mg progesterone in oil solution in women.[163]](http://upload.wikimedia.org/wikipedia/commons/thumb/e/ef/Progesterone_levels_with_single_intramuscular_injections_of_different_doses_of_progesterone_in_oil_solution_in_women.png/300px-Progesterone_levels_with_single_intramuscular_injections_of_different_doses_of_progesterone_in_oil_solution_in_women.png)
![Progesterone levels following a single intramuscular or subcutaneous injection of 100 mg progesterone in an aqueous solution (Prolutex) or oil solution (Prontogest) in postmenopausal women.[13]](http://upload.wikimedia.org/wikipedia/commons/thumb/2/26/Progesterone_levels_after_a_single_intramuscular_or_subcutaneous_injection_of_100_mg_progesterone_in_an_aqueous_or_oil_solution_in_postmenopausal_women.png/300px-Progesterone_levels_after_a_single_intramuscular_or_subcutaneous_injection_of_100_mg_progesterone_in_an_aqueous_or_oil_solution_in_postmenopausal_women.png)
