Закись азота

| |

| |
| Имена | |
|---|---|
| IUPAC names | |
| Systematic IUPAC name
Oxodiazen-2-ium-1-ide | |
Other names
| |
| Identifiers | |
3D model (JSmol)
|
|
| 8137358 | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.030.017 |
| E number | E942 (glazing agents, ...) |
| 2153410 | |
| KEGG | |
PubChem CID
|
|
| RTECS number |
|
| UNII | |
| UN number | 1070 (compressed) 2201 (liquid) |
CompTox Dashboard (EPA)
|
|
| Properties | |
| N 2O | |
| Molar mass | 44.013 g/mol |
| Appearance | colourless gas |
| Density | 1.977 g/L (gas) |
| Melting point | −90.86 °C (−131.55 °F; 182.29 K) |
| Boiling point | −88.48 °C (−127.26 °F; 184.67 K) |
| 1.5 g/L (15 °C) | |
| Solubility | soluble in alcohol, ether, sulfuric acid |
| log P | 0.35 |
| Vapor pressure | 5150 kPa (20 °C) |
| −18.9·10−6 cm3/mol | |
Refractive index (nD)
|
1.000516 (0 °C, 101.325 kPa) |
| Viscosity | 14.90 μPa·s[3] |
| Structure | |
| linear, C∞v | |
| 0.166 D | |
| Thermochemistry | |
Std molar
entropy (S⦵298) |
219.96 J/(K·mol) |
Std enthalpy of
formation (ΔfH⦵298) |
+82.05 kJ/mol |
| Pharmacology | |
| N01AX13 (WHO) | |
| Inhalation | |
| Pharmacokinetics: | |
| 0.004% | |
| 5 minutes | |
| Respiratory | |
| Hazards | |
| GHS labelling: | |
 
| |
| Danger | |
| H270, H280, H281 | |
| P220, P244, P282, P317, P336, P370+P376, P403, P410+P403 | |
| NFPA 704 (fire diamond) | |
| Flash point | Nonflammable |
| Safety data sheet (SDS) | Ilo.org, ICSC 0067 |
| Related compounds | |
| Nitric oxide Dinitrogen trioxide Nitrogen dioxide Dinitrogen tetroxide Dinitrogen pentoxide | |
Related compounds
|
Ammonium nitrate Azide |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
Закись азота (оксид азота или монооксид динитрогена), широко известный как веселящий газ , азот , нитро или NO , [ 4 ] соединение химическое , азота формулы N оксид
2 О. При комнатной температуре это бесцветный негорючий газ со слегка сладковатым запахом и вкусом. [ 5 ] При повышенных температурах закись азота является мощным окислителем, подобным молекулярному кислороду.
Закись азота имеет широкое медицинское применение , особенно в хирургии и стоматологии , из-за ее анестезирующего и обезболивающего действия. [ 6 ] Его разговорное название «веселящий газ», придуманное Хамфри Дэви , связано с эйфорическим эффектом при его вдыхании, свойством, которое привело к его рекреационному использованию в качестве диссоциативного анестетика. [ 6 ] Он включен в Список основных лекарственных средств Всемирной организации здравоохранения . [ 7 ] Он также используется в качестве окислителя в ракетном топливе и в для увеличения выходной мощности двигателей автоспорте .
Nitrous oxide's atmospheric concentration reached 333 parts per billion (ppb) in 2020, increasing at a rate of about 1 ppb annually.[8][9] It is a major scavenger of stratospheric ozone, with an impact comparable to that of CFCs.[10] About 40% of human-caused emissions are from agriculture.[11][12] Nitrogen is added to the soil via animal urine and dung, and synthetic fertilisers: micro-organisms then release it in nitrous oxide.[13] Being the third most important greenhouse gas, nitrous oxide substantially contributes to global warming.[14][15] Reduction of emissions is a popular topic in the politics of climate change.[16]
Nitrous oxide is used as a propellant, and has a variety of applications from rocketry to making whipped cream. It is used as a recreational drug for its potential to induce a brief "high". When used chronically, nitrous oxide has the potential to cause neurological damage through inactivation of vitamin B12.
Uses
[edit]Rocket motors
[edit]Nitrous oxide may be used as an oxidiser in a rocket motor. It has advantages over other oxidisers in that it is much less toxic, and because of its stability at room temperature, it is also easier to store and relatively safe to carry on a flight. As a secondary benefit, it may be decomposed readily to form breathing air. Its high density and low storage pressure (when maintained at low temperatures) enable it to be highly competitive with stored high-pressure gas systems.[17]
In a 1914 patent, American rocket pioneer Robert Goddard suggested nitrous oxide and gasoline as possible propellants for a liquid-fuelled rocket.[18] Nitrous oxide has been the oxidiser of choice in several hybrid rocket designs (using solid fuel with a liquid or gaseous oxidiser). The combination of nitrous oxide with hydroxyl-terminated polybutadiene fuel has been used by SpaceShipOne and others. It also is notably used in amateur and high power rocketry with various plastics as the fuel.
Nitrous oxide also may be used in a monopropellant rocket. In the presence of a heated catalyst, N
2O will decompose exothermically into nitrogen and oxygen, at a temperature of approximately 1,070 °F (577 °C).[19] Because of the large heat release, the catalytic action rapidly becomes secondary, as thermal autodecomposition becomes dominant. In a vacuum thruster, this may provide a monopropellant specific impulse (Isp) of as much as 180 s. While noticeably less than the Isp available from hydrazine thrusters (monopropellant or bipropellant with dinitrogen tetroxide), the decreased toxicity makes nitrous oxide an option worth investigating.
Nitrous oxide is said to deflagrate at approximately 600 °C (1,112 °F) at a pressure of 309 psi (21 atmospheres).[20] At 600 psi, for example, the required ignition energy is only 6 joules, whereas N
2O at 130 psi a 2,500-joule ignition energy input is insufficient.[21][22]
Internal combustion engine
[edit]In vehicle racing, nitrous oxide (often called "nitrous") allows the engine to burn more fuel by providing more oxygen during combustion. The increase in oxygen allows an increase in the injection of fuel, allowing the engine to produce more engine power. The gas is not flammable at a low pressure/temperature, but it delivers more oxygen than atmospheric air by breaking down at elevated temperatures, about 570 degrees F (~300C). Therefore, it often is mixed with another fuel that is easier to deflagrate. Nitrous oxide is a strong oxidising agent, roughly equivalent to hydrogen peroxide, and much stronger than oxygen gas.
Nitrous oxide is stored as a compressed liquid; the evaporation and expansion of liquid nitrous oxide in the intake manifold causes a large drop in intake charge temperature, resulting in a denser charge, further allowing more air/fuel mixture to enter the cylinder. Sometimes nitrous oxide is injected into (or prior to) the intake manifold, whereas other systems directly inject, right before the cylinder (direct port injection) to increase power.
The technique was used during World War II by Luftwaffe aircraft with the GM-1 system to boost the power output of aircraft engines. Originally meant to provide the Luftwaffe standard aircraft with superior high-altitude performance, technological considerations limited its use to extremely high altitudes. Accordingly, it was only used by specialised planes such as high-altitude reconnaissance aircraft, high-speed bombers and high-altitude interceptor aircraft. It sometimes could be found on Luftwaffe aircraft also fitted with another engine-boost system, MW 50, a form of water injection for aviation engines that used methanol for its boost capabilities.
One of the major problems of using nitrous oxide in a reciprocating engine is that it can produce enough power to damage or destroy the engine. Very large power increases are possible, and if the mechanical structure of the engine is not properly reinforced, the engine may be severely damaged or destroyed during this type of operation. It is important with nitrous oxide augmentation of petrol engines to maintain proper operating temperatures and fuel levels to prevent "pre-ignition",[23] or "detonation" (sometimes referred to as "knock"). Most problems that are associated with nitrous oxide do not come from mechanical failure due to the power increases. Since nitrous oxide allows a much denser charge into the cylinder, it dramatically increases cylinder pressures. The increased pressure and temperature can cause problems such as melting the pistons or valves. It also may crack or warp the piston or cylinder head and cause pre-ignition due to uneven heating.
Automotive-grade liquid nitrous oxide differs slightly from medical-grade nitrous oxide. A small amount of sulfur dioxide (SO
2) is added to prevent substance abuse.[24]
Aerosol propellant
[edit]
2O whipped-cream chargers
The gas is approved for use as a food additive (E number: E942), specifically as an aerosol spray propellant. Its most common uses in this context are in aerosol whipped cream canisters and cooking sprays.
The gas is extremely soluble in fatty compounds. In aerosol whipped cream, it is dissolved in the fatty cream until it leaves the can, when it becomes gaseous and thus creates foam. Used in this way, it produces whipped cream which is four times the volume of the liquid, whereas whipping air into cream only produces twice the volume. If air were used as a propellant, oxygen would accelerate rancidification of the butterfat, but nitrous oxide inhibits such degradation. Carbon dioxide cannot be used for whipped cream because it is acidic in water, which would curdle the cream and give it a seltzer-like "sparkling" sensation.
The whipped cream produced with nitrous oxide is unstable, and will return to a more liquid state within half an hour to one hour.[25] Thus, the method is not suitable for decorating food that will not be served immediately.
In December 2016, some manufacturers reported a shortage of aerosol whipped creams in the United States due to an explosion at the Air Liquide nitrous oxide facility in Florida in late August. With a major facility offline, the disruption caused a shortage resulting in the company diverting the supply of nitrous oxide to medical customers rather than to food manufacturing. The shortage came during the Christmas and holiday season when canned whipped cream use is normally at its highest.[26]
Similarly, cooking spray, which is made from various types of oils combined with lecithin (an emulsifier), may use nitrous oxide as a propellant. Other propellants used in cooking spray include food-grade alcohol and propane.
Medicine
[edit]
2O tanks used in dentistry
Nitrous oxide has been used in dentistry and surgery, as an anaesthetic and analgesic, since 1844.[27] In the early days, the gas was administered through simple inhalers consisting of a breathing bag made of rubber cloth.[28] Today, the gas is administered in hospitals by means of an automated relative analgesia machine, with an anaesthetic vaporiser and a medical ventilator, that delivers a precisely dosed and breath-actuated flow of nitrous oxide mixed with oxygen in a 2:1 ratio.
Nitrous oxide is a weak general anaesthetic, and so is generally not used alone in general anaesthesia, but used as a carrier gas (mixed with oxygen) for more powerful general anaesthetic drugs such as sevoflurane or desflurane. It has a minimum alveolar concentration of 105% and a blood/gas partition coefficient of 0.46. The use of nitrous oxide in anaesthesia can increase the risk of postoperative nausea and vomiting.[29][30][31]
Dentists use a simpler machine which only delivers an N
2O/O
2 mixture for the patient to inhale while conscious but must still be a recognised purpose designed dedicated relative analgesic flowmeter with a minimum 30% of oxygen at all times and a maximum upper limit of 70% nitrous oxide. The patient is kept conscious throughout the procedure, and retains adequate mental faculties to respond to questions and instructions from the dentist.[32]
Inhalation of nitrous oxide is used frequently to relieve pain associated with childbirth, trauma, oral surgery and acute coronary syndrome (including heart attacks). Its use during labour has been shown to be a safe and effective aid for birthing women.[33] Its use for acute coronary syndrome is of unknown benefit.[34]
In Canada and the UK, Entonox and Nitronox are used commonly by ambulance crews (including unregistered practitioners) as rapid and highly effective analgesic gas.
Fifty per cent nitrous oxide can be considered for use by trained non-professional first aid responders in prehospital settings, given the relative ease and safety of administering 50% nitrous oxide as an analgesic. The rapid reversibility of its effect would also prevent it from precluding diagnosis.[35]
Recreational use
[edit]


Recreational inhalation of nitrous oxide, with the purpose of causing euphoria and/or slight hallucinations, began as a phenomenon for the British upper class in 1799, known as "laughing gas parties".[36]
Starting in the 19th century, the widespread availability of the gas for medical and culinary purposes allowed for recreational use to expand greatly globally. In the UK as of 2014, nitrous oxide was estimated to be used by almost half a million young people at nightspots, festivals and parties.[37]
Widespread recreational use of the drug throughout the UK was featured in the 2017 Vice documentary Inside The Laughing Gas Black Market, in which journalist Matt Shea met with dealers of the drug who stole it from hospitals.[38]
A significant issue cited in London's press is the effect of nitrous oxide canister littering, which is highly visible and causes significant complaints from communities.[39]
Prior to 8 November 2023, nitrous oxide was subject to the Psychoactive Substances Act 2016 in the UK. It was already illegal to produce, supply, import or export nitrous oxide for recreational use. However, the UK government updated the law on 8 November 2023 to include possession of nitrous oxide by classifying it as a Class C drug under the Misuse of Drugs Act 1971.[40]
While casual use of nitrous oxide is understood by most recreational users to be a route to a "safe high", many are unaware that excessive consumption has the potential to cause neurological harm which, if left untreated, can result in permanent neurological damage.[41] In Australia, recreation use became a public health concern following a rise in reported cases of neurotoxicity and a rise in emergency room admissions, and in (the state of) South Australia legislation was passed in 2020 to restrict canister sales.[42]
Safety
[edit]Nitrous oxide is a significant occupational hazard for surgeons, dentists and nurses. Because nitrous oxide is minimally metabolised in humans (with a rate of 0.004%), it retains its potency when exhaled into the room by the patient, and can pose an intoxicating and prolonged exposure hazard to the clinic staff if the room is poorly ventilated. Where nitrous oxide is administered, a continuous-flow fresh-air ventilation system or N
2O scavenger system is used to prevent a waste-gas buildup.[citation needed]
The National Institute for Occupational Safety and Health recommends that workers' exposure to nitrous oxide should be controlled during the administration of anaesthetic gas in medical, dental and veterinary operators.[43] It set a recommended exposure limit (REL) of 25 ppm (46 mg/m3) to escaped anaesthetic.[44]
Mental and manual impairment
[edit]Exposure to nitrous oxide causes short-term decreases in mental performance, audiovisual ability and manual dexterity.[45] These effects coupled with the induced spatial and temporal disorientation could result in physical harm to the user from environmental hazards.[46]
Neurotoxicity and neuroprotection
[edit]Nitrous oxide is neurotoxic and there is evidence that medium or long-term habitual consumption of significant quantities can cause neurological harm with the potential for permanent damage if left untreated.[42][41]
Like other NMDA receptor antagonists, it has been suggested that N
2O produces neurotoxicity in the form of Olney's lesions in rodents upon prolonged (several hour) exposure.[47][48][49][50]
It has been argued that, because N
2O is rapidly expelled from the body under normal circumstances, it is less likely to be neurotoxic than other NMDAR antagonists.[51] Indeed, in rodents, short-term exposure results in only mild injury that is rapidly reversible, and neuronal death occurs only after constant and sustained exposure.[47] Nitrous oxide also may cause neurotoxicity after extended exposure because of hypoxia. This is especially true of non-medical formulations such as whipped-cream chargers (also known as "whippets" or "nangs"),[52] which never contain oxygen, since oxygen makes cream rancid.[53]
In heavy (≥400 g or ≥200 L of N2O gas in one session) or frequent (regular, i.e., daily or weekly) users reported to poison control centers, signs of peripheral neuropathy have been noted: the presence of ataxia (gait abnormalities) or paresthesia (perception of abnormal sensations, e.g. tingling, numbness, prickling, mostly in the extremities). These are considered an early sign of neurological damage and indicates chronic toxicity.[54]
Nitrous oxide at 75% by volume reduces ischemia-induced neuronal death induced by occlusion of the middle cerebral artery in rodents, and decreases NMDA-induced Ca2+ influx in neuronal cell cultures, a critical event involved in excitotoxicity.[51]
DNA damage
[edit]Occupational exposure to ambient nitrous oxide has been associated with DNA damage, due to interruptions in DNA synthesis.[55] This correlation is dose-dependent[56][57] and does not appear to extend to casual recreational use; however, further research is needed to confirm the duration and quantity of exposure needed to cause damage.
Oxygen deprivation
[edit]If pure nitrous oxide is inhaled without oxygen, oxygen deprivation can occur, resulting in low blood pressure, fainting, and even heart attacks. This can occur if the user inhales large quantities continuously, as with a strap-on mask connected to a gas canister. It can also happen if the user engages in excessive breath-holding or uses any other inhalation system that cuts off a supply of fresh air.[citation needed]
Vitamin B12 deficiency
[edit]Long-term exposure to nitrous oxide may cause vitamin B12 deficiency. This can cause serious neurotoxicity if the user has preexisting vitamin B12 deficiency.[58] It inactivates the cobalamin form of vitamin B12 by oxidation. Symptoms of vitamin B12 deficiency, including sensory neuropathy, myelopathy and encephalopathy, may occur within days or weeks of exposure to nitrous oxide anaesthesia in people with subclinical vitamin B12 deficiency.
Symptoms are treated with high doses of vitamin B12, but recovery can be slow and incomplete.[59]
People with normal vitamin B12 levels have stores to make the effects of nitrous oxide insignificant, unless exposure is repeated and prolonged (nitrous oxide abuse). Vitamin B12 levels should be checked in people with risk factors for vitamin B12 deficiency prior to using nitrous oxide anaesthesia.[60]
Prenatal development
[edit]Several experimental studies in rats indicate that chronic exposure of pregnant females to nitrous oxide may have adverse effects on the developing fetus.[61][62][63]
Chemical/physical risks
[edit]At room temperature (20 °C [68 °F]) the saturated vapour pressure is 50.525 bar, rising up to 72.45 bar at 36.4 °C (97.5 °F)—the critical temperature. The pressure curve is thus unusually sensitive to temperature.[64]
As with many strong oxidisers, contamination of parts with fuels have been implicated in rocketry accidents, where small quantities of nitrous/fuel mixtures explode due to "water hammer"-like effects (sometimes called "dieseling"—heating due to adiabatic compression of gases can reach decomposition temperatures).[65] Some common building materials such as stainless steel and aluminium can act as fuels with strong oxidisers such as nitrous oxide, as can contaminants that may ignite due to adiabatic compression.[66]
There also have been incidents where nitrous oxide decomposition in plumbing has led to the explosion of large tanks.[20]
Mechanism of action
[edit]The pharmacological mechanism of action of N
2O in medicine is not fully known. However, it has been shown to directly modulate a broad range of ligand-gated ion channels, and this likely plays a major role in many of its effects. It moderately blocks NMDAR and β2-subunit-containing nACh channels, weakly inhibits AMPA, kainate, GABAC and 5-HT3 receptors, and slightly potentiates GABAA and glycine receptors.[67][68] It also has been shown to activate two-pore-domain K+
channels.[69] While N
2O affects quite a few ion channels, its anaesthetic, hallucinogenic and euphoriant effects are likely caused predominantly, or fully, via inhibition of NMDA receptor-mediated currents.[67][70] In addition to its effects on ion channels, N
2O may act to imitate nitric oxide (NO) in the central nervous system, and this may be related to its analgesic and anxiolytic properties.[70] Nitrous oxide is 30 to 40 times more soluble than nitrogen.
Известно, что эффекты вдыхания субанестезирующих доз закиси азота различаются в зависимости от нескольких факторов, включая условия и индивидуальные различия; [71][72] however, from his discussion, Jay (2008)[46] suggests that it has been reliably known to induce the following states and sensations:
- Опьянение
- Эйфория/дисфория
- Пространственная дезориентация
- Временная дезориентация
- Снижение болевой чувствительности.
У меньшинства пользователей также наблюдаются неконтролируемые вокализации и мышечные спазмы. Эти эффекты обычно исчезают через несколько минут после удаления источника закиси азота. [ 46 ]
Анксиолитический эффект
[ редактировать ]В поведенческих тестах на тревогу низкая доза N
2 O является эффективным анксиолитиком, и этот противотревожный эффект связан с повышенной активностью рецепторов ГАМК А , поскольку он частично устраняется бензодиазепиновых рецепторов антагонистами . Отражая это, животные, у которых развилась толерантность к анксиолитическому действию бензодиазепинов, частично толерантны к N.
2О . [ 73 ] Действительно, у людей, получавших 30% N
2 O в клинических исследованиях на людях антагонисты бензодиазепиновых рецепторов снижали субъективные ощущения «приподнятого настроения», но не изменяли психомоторные характеристики. [ 74 ] [ 75 ]
Анальгетический эффект
[ редактировать ]Анальгетический эффект Н.
2 O связаны с взаимодействием эндогенной опиоидной системы и нисходящей норадренергической системы. Когда животным хронически дают морфин, у них развивается толерантность к его обезболивающему эффекту, что также делает животных толерантными к обезболивающему эффекту N.
2О . [ 76 ] Введение антител , связывающих и блокирующих активность некоторых эндогенных опиоидов (не β-эндорфина ), также блокирует антиноцицептивные эффекты N.
2О . [ 77 ] Препараты, ингибирующие распад эндогенных опиоидов, также усиливают антиноцицептивный эффект N.
2О . [ 77 ] Несколько экспериментов показали, что антагонисты опиоидных рецепторов, наносимые непосредственно на мозг, блокируют антиноцицептивные эффекты N.
2 О , но эти препараты не оказывают эффекта при введении в спинной мозг .
Помимо непрямого действия, закись азота, как и морфин, [ 78 ] также напрямую взаимодействует с эндогенной опиоидной системой путем связывания с сайтами связывания опиоидных рецепторов. [ 79 ] [ 80 ]
И наоборот, антагонисты α 2 -адренорецепторов блокируют обезболивающее действие N.
2 О при введении непосредственно в спинной мозг, но не при введении непосредственно в головной мозг. [ 81 ] Действительно, мыши с нокаутом α2B - адренорецепторов или животные с истощением норадреналина практически полностью резистентны к антиноцицептивному действию N.
2О . [ 82 ] Видимо Н
2 O -индуцированное высвобождение эндогенных опиоидов вызывает растормаживание норадренергических нейронов ствола мозга , которые выделяют норадреналин в спинной мозг и подавляют передачу болевых сигналов. [ 83 ] Именно так Н.
2 O вызывает высвобождение эндогенных опиоидных пептидов, остается неопределенным.
Свойства и реакции
[ редактировать ]Закись азота — бесцветный газ со слабым сладковатым запахом.
Закись азота поддерживает горение, высвобождая диполярный связанный кислородный радикал, и, таким образом, может повторно зажечь светящуюся лучину .
Н
2 O инертен при комнатной температуре и мало реагирует. При повышенных температурах его реакционная способность увеличивается. Например, закись азота реагирует с NaNH.
2 при 187 °C (369 °F) с получением NaN .
3 :
- 2 NaNH 2 + N 2 O → NaN 3 + NaOH + NH 3
Вышеуказанная реакция представляет собой путь, принятый в коммерческой химической промышленности для производства солей азидов , которые используются в качестве детонаторов. [ 84 ]
История
[ редактировать ]Газ был впервые синтезирован в 1772 году английским натурфилософом и химиком Джозефом Пристли , который назвал его дефлогистизированным азотистым воздухом (см. теорию флогистона ). [ 85 ] или воспламеняющийся азотистый воздух . [ 86 ] Пристли опубликовал свое открытие в книге « Опыты и наблюдения над различными видами воздуха» (1775) , где описал, как получить препарат «уменьшенного азотистого воздуха» путем нагревания железных опилок, смоченных азотной кислотой . [ 87 ]
Раннее использование
[ редактировать ]
Первое важное применение закиси азота стало возможным благодаря Томасу Беддосу и Джеймсу Уотту , которые вместе работали над публикацией книги «Соображения о медицинском использовании и производстве искусственных эфиров» (1794) . Эта книга была важна по двум причинам. Во-первых, Джеймс Уатт изобрел новую машину для производства « искусственного воздуха » (включая закись азота) и новый «дыхательный аппарат» для вдыхания этого газа. Во-вторых, в книге также представлены новые медицинские теории Томаса Беддоса о том, что туберкулез и другие легочные заболевания можно лечить вдыханием «искусственного воздуха». [ 27 ]

Машина для производства «фальшивого воздуха» состояла из трех частей: печи для сжигания необходимого материала, сосуда с водой, через который по спиральной трубе проходил образующийся газ (для «смывания» примесей) и, наконец, газового баллона. с помощью газометра, с помощью которого образующийся газ, «воздух», можно было подавать в переносные воздушные мешки (сделанные из воздухонепроницаемого маслянистого шелка). Дыхательный аппарат представлял собой одну из переносных подушек безопасности, соединенную трубкой с загубником. С разработкой и производством этого нового оборудования к 1794 году был открыт путь к клиническим испытаниям . [ нужны разъяснения ] которая началась в 1798 году, когда Томас Беддос основал « Пневматическое учреждение для облегчения болезней с помощью медицинских газов» в Хотвеллсе ( Бристоль ). В подвале здания большая машина производила газы под наблюдением молодого Хамфри Дэви, которому было предложено экспериментировать с новыми газами, которые пациенты могли бы вдыхать. [ 27 ] Первой важной работой Дэви было исследование закиси азота и публикация его результатов в книге « Исследования, химические и философские» (1800 г.) . В этой публикации Дэви отмечает обезболивающий эффект закиси азота на странице 465 и ее потенциал для использования при хирургических операциях на странице 556. [ 88 ] Дэви придумал название «веселящий газ» для закиси азота. [ 89 ]
Несмотря на открытие Дэви, что вдыхание закиси азота может избавить находящегося в сознании человека от боли, прошло еще 44 года, прежде чем врачи попытались использовать ее для анестезии . Использование закиси азота в качестве рекреационного наркотика на «вечеринках с веселящим газом», организованных в первую очередь для представителей высшего класса Великобритании , стало немедленным успехом, начиная с 1799 года. люди также «хихикают» в состоянии эйфории и часто разражаются смехом. [ 90 ]
Одним из первых коммерческих производителей в США был Джордж По , двоюродный брат поэта Эдгара Аллана По , который также был первым, кто сжижал газ. [ 91 ]
Использование анестетика
[ редактировать ]Впервые закись азота была использована в качестве анестезирующего препарата при лечении пациента, когда дантист Хорас Уэллс с помощью Гарднера Куинси Колтона и Джона Мэнки Риггса продемонстрировал нечувствительность к боли при удалении зуба 11 декабря 1844 года. [ 92 ] В последующие недели Уэллс лечил первых 12–15 пациентов закисью азота в Хартфорде, штат Коннектикут , и, по его собственным данным, только в двух случаях он потерпел неудачу. [ 93 ] Несмотря на то, что Уэллс сообщил об этих убедительных результатах медицинскому обществу Бостона в декабре 1844 года, этот новый метод не был сразу принят другими стоматологами. Причина этого, скорее всего, заключалась в том, что Уэллс в январе 1845 года на своей первой публичной демонстрации на медицинском факультете в Бостоне оказался частично неудачным, что заставило его коллег усомниться в ее эффективности и безопасности. [ 94 ] Этот метод не получил широкого распространения до 1863 года, когда Гарднер Куинси Колтон успешно начал использовать его во всех своих клиниках «Колтонской стоматологической ассоциации», которые он только что открыл в Нью-Хейвене и Нью-Йорке . [ 27 ] В течение следующих трех лет Колтон и его коллеги успешно вводили закись азота более чем 25 000 пациентам. [ 28 ] Сегодня закись азота применяется в стоматологии как анксиолитик, как дополнение к местному анестетику .
Однако закись азота не оказалась достаточно сильным анестетиком для использования при крупных операциях в больницах. Вместо этого диэтиловый эфир , являющийся более сильным и мощным анестетиком, был продемонстрирован и принят к использованию в октябре 1846 года, наряду с хлороформом в 1847 году. [ 27 ] Однако, когда Джозеф Томас Кловер в 1876 году изобрел «газо-эфирный ингалятор», в больницах стало обычной практикой начинать все анестезиологические процедуры с легкой подачи закиси азота, а затем постепенно увеличивать анестезию с помощью более сильного эфира или хлороформа. Газо-эфирный ингалятор Клевера был предназначен для подачи пациенту закиси азота и эфира одновременно, при этом точная смесь контролируется оператором аппарата. Он использовался во многих больницах до 1930-х годов. [ 28 ] Хотя сегодня в больницах используется более совершенный наркозный аппарат , эти аппараты по-прежнему используют тот же принцип, что и газо-эфирный ингалятор Клевера, для инициирования анестезии закисью азота перед введением более мощного анестетика.
Как патентованное лекарство
[ редактировать ]Популяризация закиси азота Колтоном привела к ее принятию рядом не слишком уважаемых шарлатанов , которые рекламировали ее как лекарство от чахотки , золотухи , катара и других заболеваний крови, горла и легких. Лечение закисью азота проводилось и лицензировалось как патентованное лекарство такими компаниями, как CL Blood и Джером Харрис из Бостона и Чарльзом Э. Барни из Чикаго. [ 95 ] [ 96 ]
Производство
[ редактировать ]Опубликован обзор различных способов получения закиси азота. [ 97 ]
Промышленные методы
[ редактировать ]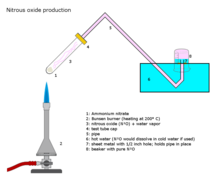
Закись азота получают в промышленных масштабах путем осторожного нагревания нитрата аммония. [ 97 ] при температуре около 250 °C разлагается на закись азота и водяной пар. [ 98 ]
- NH 4 NO 3 → 2 H 2 O + N 2 O
Добавление различных фосфатных солей способствует образованию более чистого газа при несколько более низких температурах. Эту реакцию трудно контролировать, что приводит к детонации . [ 99 ]
Лабораторные методы
[ редактировать ]Разложение нитрата аммония также является распространенным лабораторным методом подготовки газа. Эквивалентно его можно получить нагреванием смеси нитрата натрия и сульфата аммония : [ 100 ]
- 2 NaNO 3 + (NH 4 ) 2 SO 4 → Na 2 SO 4 + 2 N 2 O + 4 H 2 O
Другой метод предполагает реакцию мочевины, азотной и серной кислот: [ 101 ]
- 2 (NH 2 ) 2 CO + 2 HNO 3 + H 2 SO 4 → 2 N 2 O + 2 CO 2 + (NH 4 ) 2 SO 4 + 2 H 2 O
прямом окислении аммиака катализатором диоксид марганца - оксид висмута : Сообщалось о [ 102 ] ср. Оствальдовский процесс .
- 2 NH 3 + 2 О 2 → Н 2 О + 3 Н 2 О
Хлорид гидроксиламмония реагирует с нитритом натрия с образованием закиси азота. Если к раствору гидроксиламина добавить нитрит, единственным оставшимся побочным продуктом будет соленая вода. Однако если к раствору нитрита добавить раствор гидроксиламина (нитрит в избытке), то образуются и токсичные высшие оксиды азота:
- NH 3 OHCl + NaNO 2 → N 2 O + NaCl + 2 H 2 O
Лечение ГНО
3 с SnCl
2 и HCl также было продемонстрировано:
- 2 HNO 3 + 8 HCl + 4 SnCl 2 → 5 H 2 O + 4 SnCl 4 + N 2 O
Азотистистая кислота разлагается на N 2 O и воду с периодом полураспада 16 дней при 25 °C и pH 1–3. [ 103 ]
- Ч 2 Н 2 О 2 → Ч 2 О + Н 2 О
Атмосферное явление
[ редактировать ]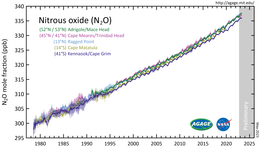



Закись азота является второстепенным компонентом земной атмосферы и активной частью планетарного цикла азота . Согласно анализу проб воздуха, собранных с объектов по всему миру, в 2017 году его концентрация превысила 330 частей на миллиард . [ 8 ] Темпы роста примерно на 1 миллиардную долю в год также ускорились в последние десятилетия. [ 9 ] Содержание закиси азота в атмосфере выросло более чем на 20% по сравнению с базовым уровнем около 270 частей на миллиард в 1750 году. [ 105 ]
Важные атмосферные свойства N
2 O сведены в следующую таблицу:
| Свойство | Ценить |
|---|---|
| Потенциал разрушения озона (ODP) | 0.017 [ 106 ] ( CCl 3 F = 1) |
| Потенциал глобального потепления (ПГП: 100 лет) | 273 [ 107 ] ( СО 2 = 1) |
| Время жизни атмосферы | 116 ± 9 лет [ 108 ] |
В 2022 году МГЭИК сообщила, что: «Нарушение человеком естественного азотного цикла посредством использования синтетических удобрений и навоза, а также отложение азота в результате наземного сельского хозяйства и сжигания ископаемого топлива стали крупнейшим фактором увеличения атмосферных выбросов». N2O 31,0 ± 0,5 частей на миллиард (10%) в период с 1980 по 2019 год». [ 108 ]
Выбросы по источникам
[ редактировать ]17,0 (от 12,2 до 23,5) миллионов тонн общего среднегодового азота в N
2 O выбрасывался в 2007–2016 гг. [ 108 ] Около 40% N
Выбросы 2 O происходят от человека, а остальная часть является частью естественного цикла азота . [ 109 ] Затем
2 O , ежегодно выбрасываемый людьми, имеет парниковый эффект, эквивалентный примерно 3 миллиардам тонн углекислого газа: для сравнения, в 2019 году люди выбросили 37 миллиардов тонн фактического углекислого газа, а метан эквивалентен 9 миллиардам тонн углекислого газа. [ 110 ]
Большая часть Н
2 O, выбрасываемый в атмосферу из природных и антропогенных источников, вырабатывается такими микроорганизмами, как денитрифицирующие бактерии и грибы в почвах и океанах. [ 111 ] Почвы под естественной растительностью являются важным источником закиси азота, на их долю приходится 60% всех выбросов, образующихся естественным путем. Другие природные источники включают океаны (35%) и химические реакции в атмосфере (5%). [ 112 ] Водно-болотные угодья также могут быть источниками выбросов закиси азота . [ 113 ] [ 114 ] Выбросы от таяния вечной мерзлоты могут быть значительными, но по состоянию на 2022 год это не точно. [ 108 ]
Основными компонентами антропогенных выбросов являются удобренные сельскохозяйственные почвы и навоз скота (42 %), стоки и вымывание удобрений (25 %), сжигание биомассы (10 %), сжигание ископаемого топлива и промышленные процессы (10 %), биологическая деградация других азотсодержащие выбросы в атмосферу (9%) и сточные воды жизнедеятельности человека (5%). [ 115 ] [ 116 ] [ 117 ] [ 118 ] [ 119 ] Сельское хозяйство увеличивает производство закиси азота за счет обработки почвы, использования азотных удобрений и переработки отходов животноводства. [ 120 ] Эти действия стимулируют встречающиеся в природе бактерии производить больше закиси азота. Выбросы закиси азота из почвы сложно измерить, поскольку они заметно меняются во времени и пространстве. [ 121 ] и большая часть годовых выбросов может происходить при благоприятных условиях в «горячие моменты». [ 122 ] [ 123 ] и/или в благоприятных местах, известных как «горячие точки». [ 124 ]
производство азотной кислоты и адипиновой кислоты Среди промышленных выбросов крупнейшими источниками выбросов закиси азота являются . Выбросы адипиновой кислоты возникают, в частности, в результате разложения промежуточного продукта нитроловой кислоты, полученного в результате нитрования циклогексанона. [ 115 ] [ 125 ] [ 126 ]
Биологические процессы
[ редактировать ]Естественные процессы, в результате которых образуется закись азота, можно классифицировать как нитрификацию и денитрификацию . В частности, они включают в себя:
- аэробная автотрофная нитрификация, ступенчатое окисление аммиака ( NH
3 ) в нитрит ( NO −
2 ) и нитратить ( NO −
3 ) - анаэробная гетеротрофная денитрификация, ступенчатое восстановление NO −
3 к НЕТ −
2 , оксид азота (NO), N
2 O и в конечном итоге N
2 , где факультативно-анаэробные бактерии используют NO −
3 как акцептор электронов при дыхании органического вещества в условиях недостаточности кислорода ( O
2 ) - денитрификация нитрификатора, осуществляемая автотрофными NH
3 -окисляющие бактерии и путь образования аммиака ( NH
3 ) окисляется до нитрита ( NO −
2 ), с последующим снижением NO −
2 к оксиду азота (NO), N
2 O и молекулярный азот ( N
2 ) - гетеротрофная нитрификация
- аэробная денитрификация теми же гетеротрофными нитрификаторами
- грибковая денитрификация
- небиологическая хемоденитрификация
На эти процессы влияют химические и физические свойства почвы, такие как наличие минерального азота и органических веществ , кислотность и тип почвы, а также факторы, связанные с климатом, такие как температура почвы и содержание воды.
Выброс газа в атмосферу в значительной степени ограничивается его потреблением внутри клеток процессом, катализируемым ферментом редуктазой закиси азота . [ 127 ]
Воздействие на окружающую среду
[ редактировать ]Глобальный учет N
Источники и поглотители 2 O за десятилетие, заканчивающееся в 2016 году, указывают на то, что около 40% из средних выбросов азота в размере 17 TgN/год ( тераграммов или миллионов метрических тонн азота в год) возникли в результате человеческой деятельности, и показывает, что рост выбросов в основном происходил за счет расширение сельского хозяйства . [ 11 ] [ 12 ]
Парниковый эффект
[ редактировать ]
Закись азота обладает значительным потенциалом глобального потепления как парниковый газ . В пересчете на молекулу за 100-летний период закись азота обладает в 265 раз большей способностью улавливать тепло в атмосфере, чем диоксид углерода ( CO
2 ). [ 107 ] Однако из-за его низкой концентрации (менее 1/1000 от концентрации CO
2 ), его вклад в парниковый эффект составляет менее трети вклада углекислого газа, а также меньше, чем метана . [ 128 ] С другой стороны, поскольку около 40% N
Попадание 2 О в атмосферу является результатом деятельности человека, [ 115 ] контроль за закисью азота является частью усилий по ограничению выбросов парниковых газов. [ 129 ]
Большая часть антропогенных выбросов закиси азота в атмосферу представляет собой выбросы парниковых газов в результате сельского хозяйства , когда фермеры вносят на поля азотные удобрения, а также в результате разложения навоза животных. Сокращение выбросов может стать горячей темой в политике по изменению климата . [ 130 ]
Закись азота также выделяется как побочный продукт сжигания ископаемого топлива, хотя его количество зависит от того, какое топливо использовалось. Он также выделяется при производстве азотной кислоты , которая используется при синтезе азотных удобрений. Производство адипиновой кислоты, предшественника нейлона и других синтетических волокон для одежды, также приводит к выбросу закиси азота. [ 131 ]
Повышение концентрации закиси азота в атмосфере считается возможным фактором, способствующим чрезвычайно интенсивному глобальному потеплению во время пограничного события сеномана и турона . [ 132 ]
Истощение озонового слоя
[ редактировать ]Закись азота также участвует в истончении озонового слоя . Исследование 2009 года показало, что N
Выбросы 2 O были наиболее важными выбросами, разрушающими озоновый слой, и ожидалось, что они останутся крупнейшими на протяжении всего 21 века. [ 10 ] [ 133 ]
Законность
[ редактировать ]Индия
[ редактировать ]Перекачка закиси азота из баллонов в меньшие по размеру и более транспортабельные резервуары типа Е емкостью 1590 литров. [ 134 ] является законным, если предполагаемое использование газа предназначено для медицинской анестезии.
Новая Зеландия
[ редактировать ]Министерство здравоохранения предупредило, что закись азота является лекарством, отпускаемым по рецепту, а ее продажа или хранение без рецепта является преступлением в соответствии с Законом о лекарственных средствах. [ 135 ] Это заявление, казалось бы, запретило бы любое немедицинское использование закиси азота, хотя подразумевается, что по закону оно будет использоваться только в рекреационных целях.
Великобритания
[ редактировать ]В августе 2015 года совет лондонского района Ламбет ( Великобритания ) запретил использование препарата в рекреационных целях, в результате чего правонарушители будут подлежать штрафу на месте в размере до 1000 фунтов стерлингов. [ 136 ]
В сентябре 2023 года правительство объявило, что к концу года закись азота будет объявлена незаконной, а ее хранение может караться тюремным заключением на срок до двух лет или штрафом в неограниченном размере. [ 137 ]
НАС
[ редактировать ]Владение закисью азота является законным в соответствии с федеральным законом и не подпадает под действие DEA . [ 138 ] Однако это регулируется Управлением по контролю за продуктами и лекарствами в соответствии с Законом о пищевых лекарствах и косметике; Судебное преследование возможно в соответствии с его положениями о «неправильной маркировке», запрещающими продажу или распространение закиси азота для целей потребления человеком . Во многих штатах действуют законы, регулирующие хранение, продажу и распространение закиси азота. Такие законы обычно запрещают распространение среди несовершеннолетних или ограничивают количество закиси азота, которое можно продавать без специальной лицензии. [ нужна ссылка ] Например, в штате Калифорния хранение вещей в целях развлечения запрещено и квалифицируется как правонарушение. [ 139 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ «[Закись азота]» . Degruyter.com . Проверено 24 июля 2022 г.
- ^ Номенклатура неорганической химии ИЮПАК 2005 . PDF , с. 317.
- ^ Такахаси М., Сибасаки-Китакава Н., Ёкояма С., Такахаси С. (1996). «Вязкость газообразной закиси азота от 298,15 К до 398,15 К при давлениях до 25 МПа». Журнал химических и инженерных данных . 41 (6): 1495–1498. дои : 10.1021/je960060d . ISSN 0021-9568 .
- ^ Тарендаш А.С. (2001). Давайте рассмотрим: химия, физические условия (3-е изд.). Образовательная серия Бэррона. п. 44 . ISBN 978-0-7641-1664-3 .
- ^ ПабХим. «Закись азота» . pubchem.ncbi.nlm.nih.gov . Проверено 29 марта 2022 г.
- ^ Jump up to: а б Квакс М.Л., Ван дер Стинховен Т.Дж., Бронкхорст М.В., Эмминк Б.Л. (июль 2020 г.). «Обморожение: неизвестный риск при использовании закиси азота в качестве наркотика для вечеринок». Акта Хирургика Бельгика . 120 (1–4). Тейлор и Фрэнсис от имени Королевского бельгийского общества хирургии: 140–143. дои : 10.1080/00015458.2020.1782160 . ISSN 0001-5458 . ПМИД 32543291 . S2CID 219702849 .
- ^ Организация WH (2019). Модельный список основных лекарственных средств Всемирной организации здравоохранения: 21-й список 2019 г. Женева: Всемирная организация здравоохранения. hdl : 10665/325771 .
- ^ Jump up to: а б «Молярная доля оксида азота (N2O)» (PDF) . Массачусетский технологический институт. Архивировано (PDF) из оригинала 9 октября 2022 года . Проверено 15 февраля 2021 г.
- ^ Jump up to: а б «Тенденции в области закиси азота в атмосфере» . Национальное управление океанических и атмосферных исследований / Лаборатории исследования системы Земли . Проверено 15 февраля 2021 г.
- ^ Jump up to: а б Равишанкара А.Р., Дэниел Дж.С., Портманн Р.В. (2009). «Закись азота (N 2 O): доминирующее озоноразрушающее вещество, выбрасываемое в выбросы в 21 веке» . Наука . 326 (5949): 123–5. Бибкод : 2009Sci...326..123R . дои : 10.1126/science.1176985 . ПМИД 19713491 . S2CID 2100618 .
- ^ Jump up to: а б Тиан Х., Сюй Р., Канаделл Дж.Г., Томпсон Р.Л., Винивартер В., Сунтхаралингам П. и др. (октябрь 2020 г.). «Комплексная количественная оценка глобальных источников и поглотителей закиси азота» . Природа . 586 (7828): 248–256. Бибкод : 2020Natur.586..248T . дои : 10.1038/s41586-020-2780-0 . hdl : 1871.1/c74d4b68-ecf4-4c6d-890d-a1d0aaef01c9 . ISSN 1476-4687 . ПМИД 33028999 . S2CID 222217027 . Архивировано из оригинала 3 декабря 2020 года . Проверено 9 ноября 2020 г.
{{cite journal}}: CS1 maint: bot: исходный статус URL неизвестен ( ссылка ) - ^ Jump up to: а б Томпсон, Р.Л., Лассалетта, Л., Патра, ПК (2019). «Ускорение глобальных выбросов N 2 O, наблюдаемое в результате двух десятилетий атмосферной инверсии» . Нат. Клим. Изменять . 9 (12): 993–998. Бибкод : 2019NatCC...9..993T . дои : 10.1038/s41558-019-0613-7 . hdl : 11250/2646484 . S2CID 208302708 .
- ^ «Снизить выбросы закиси азота» . Ag имеет значение . 13 декабря 2021 г. Проверено 1 апреля 2024 г.
- ^ «Глава 8». ДО5 Изменение климата, 2013 г.: Физическая научная основа . стр. 677–678.
- ^ «Выбросы закиси азота представляют собой растущую климатическую угрозу, говорится в исследовании» . физ.орг . Проверено 9 ноября 2020 г.
- ^ Мундшенк С. (3 августа 2022 г.). «Нидерланды показывают, как не бороться с изменением климата | The Spectator» . www.spectator.co.uk . Проверено 28 августа 2022 г.
- ^ Бергер, Бруно (5 октября 2007 г.). «Безопасна ли закись азота?» (PDF) . Швейцарская двигательная лаборатория. стр. 1–2. Архивировано (PDF) из оригинала 9 октября 2022 года.
... Самогерметизация (давление пара при 20 ° C составляет ~ 50,1 бар ... Нетоксично, низкая реактивность -> относительно безопасное обращение (Общая безопасность ???).. .Дополнительная энергия от разложения (как монотопливо: ISP 170 с)...Удельный импульс не сильно меняется при использовании O/F...[страница 2] N 2 O является монотопливом (как H 2 O 2 или гидразин) ...)
- ^ Годдард, Р.Х. (1914) «Ракетный аппарат», патент США 1,103,503.
- ^ Безопасность закиси азота . Группа космических двигателей (2012)
- ^ Jump up to: а б Мунке, Конрад (2 июля 2001 г.) Разрыв прицепа с закисью азота , доклад на семинаре CGA «Безопасность и надежность промышленных газов, оборудования и объектов», 15–17 октября 2001 г., Сент-Луис, штат Миссури.
- ^ «Правила безопасности для масштабируемых композитов для N
2 O " (PDF) . Scaled Composites. 17 июня 2009 г. Архивировано из оригинала (PDF) 12 июля 2011 г. Проверено 29 декабря 2013 г.Например, N2O, текущий при давлении 130 фунтов на квадратный дюйм в трубе из эпоксидного композита, не будет реагировать даже с Потребляемая энергия зажигания 2500 Дж. Однако при давлении 600 фунтов на квадратный дюйм требуемая энергия зажигания составляла всего 6 Дж.
- ^ FR-5904 . Пратт и Уитни Самолеты.
- ^ Клайн, Аллен В. (январь 2000 г.) «Основы работы двигателя: детонация и преждевременное зажигание» . КОНТАКТ! Журнал
- ^ «Продукты Holley Performance, часто задаваемые вопросы по системам закиси азота» . Холли . Проверено 18 декабря 2013 г.
- ^ «Explora Science | Использование азота в качестве топлива и в кулинарии» . Архивировано из оригинала 27 февраля 2019 года . Проверено 19 февраля 2019 г.
- ^ Дьюи С. (21 декабря 2016 г.). «Настоящая причина, по которой в это Рождество в продуктовых магазинах заканчиваются взбитые сливки» . Вашингтон Пост . Проверено 22 декабря 2016 г.
- ^ Jump up to: а б с д и Снидер В. (2005). «Систематическая медицина». Открытие лекарств – история . Джон Уайли и сыновья. стр. 74–87. ISBN 978-0-471-89980-8 .
- ^ Jump up to: а б с Миллер А.Х. (1941). «Техническое развитие газовой анестезии» . Анестезиология . 2 (4): 398–409. дои : 10.1097/00000542-194107000-00004 . S2CID 71117361 .
- ^ Диватиа СП, Вайдья Дж.С., Бадве Р.А., Хавалдар Р.В. (1996). «Отказ от закиси азота во время анестезии снижает частоту послеоперационной тошноты и рвоты» . Анестезиология . 85 (5): 1055–1062. дои : 10.1097/00000542-199611000-00014 . ПМИД 8916823 . S2CID 41549796 .
- ^ Хартунг Дж (1996). «Двадцать четыре из двадцати семи исследований показывают более высокую частоту рвоты, связанной с закисью азота, чем с альтернативными анестетиками». Анестезия и анальгезия . 83 (1): 114–116. дои : 10.1213/00000539-199607000-00020 .
- ^ Трамер М., Мур А., Маккуэй Х. (февраль 1996 г.). «Отказ от закиси азота при общей анестезии: метаанализ интраоперационной осведомленности и послеоперационной рвоты в рандомизированных контролируемых исследованиях» . Британский журнал анестезии . 76 (2): 186–193. дои : 10.1093/бья/76.2.186 . ПМИД 8777095 .
- ^ Совет по клиническим вопросам (2013). «Руководство по использованию закиси азота у детей-стоматологов» (PDF) . Справочное руководство V37 . 6 : 206–210. Архивировано (PDF) из оригинала 9 октября 2022 года.
- ^ Коупленд К. «Обезболивание закисью азота при родах» . Беременность.орг . Архивировано из оригинала 25 мая 2011 года.
- ^ О'Коннор Р.Э., Брейди В., Брукс С.С., Диркс Д., Иган Дж., Гаеммагами С. и др. (2010). «Часть 10: острые коронарные синдромы: Рекомендации Американской кардиологической ассоциации по сердечно-легочной реанимации и неотложной сердечно-сосудистой помощи, 2010 г.» . Тираж . 122 (18 Приложение 3): S787–817. doi : 10.1161/CIRCULATIONAHA.110.971028 . ПМИД 20956226 .
- ^ Фадди С.С., Гарлик С.Р. (1 декабря 2005 г.). «Систематический обзор безопасности анальгезии 50% закисью азота: могут ли непрофессионалы использовать обезболивающие газы на догоспитальном этапе?» . Журнал неотложной медицины . 22 (12): 901–908. дои : 10.1136/emj.2004.020891 . ПМК 1726638 . ПМИД 16299211 .
- ^ Дэви Х (1800). Исследования химические и философские: главным образом касающиеся закиси азота, или дифлогистированного азотистого воздуха, и его дыхания . Медицинская библиотека Фрэнсиса А. Каунтуэя. Лондон: напечатано для Дж. Джонсона, церковного двора Святого Павла, издательством Биггс и Коттл, Бристоль.
- ^ «Предупреждение о неправильном использовании веселящего газа» . Хранитель . Лондон. Ассоциация прессы . 9 августа 2014 года . Проверено 9 августа 2014 г.
- ^ VICE (7 февраля 2017 г.), Inside The Laughing Gas Black Market , заархивировано из оригинала 29 октября 2021 г. , получено 29 марта 2019 г.
- ^ «Переработка использованных баллонов с веселящим газом за наличные может помочь сделать Британию чище» . Метро . 10 июля 2018 года . Проверено 15 июля 2019 г.
- ^ «Запрет на закись азота: рекомендации» . GOV.UK. Проверено 6 декабря 2023 г.
- ^ Jump up to: а б «Закись азота: потребители веселящего газа рискуют повредить позвоночник, говорят врачи» . Проверено 26 марта 2023 г.
- ^ Jump up to: а б Эванс Э.Б., Эванс М.Р. (ноябрь 2021 г.). «Нанги, воздушные шары и крекеры: рекреационная нейротоксичность закиси азота» . Практика Aust J Gen (обзор). 50 (11): 834–838. дои : 10.31128/AJGP-10-20-5668 . ПМИД 34713284 . S2CID 240153502 .
- ^ CDC.gov Предупреждение NIOSH: контроль воздействия закиси азота во время введения анестетика . Цинциннати, Огайо: Министерство здравоохранения и социальных служб США, Служба общественного здравоохранения, Центры по контролю заболеваний, Национальный институт безопасности и гигиены труда, DHHS (NIOSH), Публикация № 94-100.
- ^ «Карманный справочник NIOSH по химическим опасностям – закись азота» . CDC . Проверено 21 ноября 2015 г.
- ^ Критерии рекомендуемого стандарта: профессиональное воздействие отработанных анестезирующих газов и паров . Цинциннати, Огайо: Министерство здравоохранения, образования и социального обеспечения США, Служба общественного здравоохранения, Центр контроля заболеваний, Национальный институт охраны труда, DHEW (NIOSH), Публикация № 77B140.
- ^ Jump up to: а б с Джей М. (1 сентября 2008 г.). «Закись азота: рекреационное использование, регулирование и снижение вреда». Наркотики и алкоголь сегодня . 8 (3): 22–25. дои : 10.1108/17459265200800022 .
- ^ Jump up to: а б Евтович-Тодорович В., Билс Дж., Беншофф Н., Олни Дж.В. (2003). «Длительное воздействие ингаляционного анестетика закиси азота убивает нейроны мозга взрослых крыс». Нейронаука . 122 (3): 609–16. doi : 10.1016/j.neuroscience.2003.07.012 . ПМИД 14622904 . S2CID 9407096 .
- ^ Накао С., Нагата А., Масузава М., Миямото Э., Ямада М., Нисидзава Н. и др. (2003). «Нейротоксичность и психотомиметическая активность антагонистов рецепторов NMDA». Масуи. Японский журнал анестезиологии (на японском языке). 52 (6): 594–602. ПМИД 12854473 .
- ^ Евтович-Тодорович В., Беншофф Н., Олни Дж.В. (2000). «Кетамин усиливает повреждение коры головного мозга, вызванное обычным анестетиком закисью азота у взрослых крыс» . Британский журнал фармакологии . 130 (7): 1692–8. дои : 10.1038/sj.bjp.0703479 . ПМЦ 1572233 . ПМИД 10928976 .
- ^ Евтович-Тодорович В., Картер Л.Б., Картер (2005). «Анестетики закись азота и кетамин более нейротоксичны для мозга старых, чем для молодых крыс». Нейробиология старения . 26 (6): 947–56. doi : 10.1016/j.neurobiolaging.2004.07.009 . ПМИД 15718054 . S2CID 25095727 .
- ^ Jump up to: а б Абраини Дж. Х., Дэвид Х. Н., Лемэр М. (2005). «Потенциально нейропротекторные и терапевтические свойства закиси азота и ксенона». Анналы Нью-Йоркской академии наук . 1053 (1): 289–300. Бибкод : 2005NYASA1053..289A . дои : 10.1111/j.1749-6632.2005.tb00036.x . ПМИД 16179534 . S2CID 34160112 .
- ^ Де Васконселлос К., Снейд-младший (2013). «Закись азота: мы все еще в равновесии? Качественный обзор текущих противоречий» . Британский журнал анестезии . 111 (6): 877–85. дои : 10.1093/bja/aet215 . ПМИД 23801743 .
- ^ Миддлтон Б (2012). Физика в наркозе . Банбери, Оксфордшир, Великобритания: Паб Scion. ООО ISBN 978-1-904842-98-9 .
- ^ ван Риель А (2022). «Тревожный рост числа отравлений в результате использования закиси азота в рекреационных целях после изменения законодательства ЕС, запрос в Голландский информационный центр по ядам» . Международный журнал наркополитики . 100 : 103519. doi : 10.1016/j.drugpo.2021.103519 . ПМИД 34753046 .
- ^ Рандхава Г., Боденхэм А (1 марта 2016 г.). «Растущее рекреационное использование закиси азота: новый взгляд на историю» . Британский журнал анестезии . стр. 321–324. дои : 10.1093/bja/aev297 . ПМИД 26323292 .
- ^ Вроньска-Нофер Т., Нофер Дж.Р., Яйте Дж., Дзюбалтовска Е., Шимчак В., Краевски В. и др. (1 марта 2012 г.). «Окислительное повреждение ДНК и окислительный стресс у лиц, профессионально подвергающихся воздействию закиси азота (N 2 O)». Мутационные исследования/Фундаментальные и молекулярные механизмы мутагенеза . 731 (1): 58–63. дои : 10.1016/j.mrfmmm.2011.10.010 . ПМИД 22085808 .
- ^ Вронска-Нофер Т., Палус Дж., Краевски В., Яйте Дж., Кучарска М., Стеткевич Дж. и др. (18 июня 2009 г.). «Повреждение ДНК, вызванное закисью азота: исследование медицинского персонала операционных». Мутационные исследования/Фундаментальные и молекулярные механизмы мутагенеза . 666 (1–2): 39–43. дои : 10.1016/j.mrfmmm.2009.03.012 . ПМИД 19439331 .
- ^ Флиппо Т.С., Холдер В.Д. младший (1993). «Неврологическая дегенерация, связанная с анестезией закисью азота у пациентов с дефицитом витамина B12». Архив хирургии . 128 (12): 1391–5. doi : 10.1001/archsurg.1993.01420240099018 . ПМИД 8250714 .
- ^ Джаннини А (1999). Злоупотребление наркотиками . Лос-Анджелес: Пресса медицинской информации. ISBN 978-1-885987-11-2 .
- ^ Конрад М. (4 октября 2006 г.). «Пернициозная анемия» . Медскейп . Проверено 2 июня 2008 г.
- ^ Виейра Э., Клитон-Джонс П., Остин Дж., Мойес Д., Шоу Р. (1980). «Влияние низких концентраций закиси азота на плоды крыс» . Анестезия и анальгезия . 59 (3): 175–7. дои : 10.1213/00000539-198003000-00002 . ПМИД 7189346 . S2CID 41966990 .
- ^ Виейра Э (1979). «Эффект хронического введения 0,5% закиси азота беременным крысам» . Британский журнал анестезии . 51 (4): 283–7. дои : 10.1093/бья/51.4.283 . ПМИД 465253 .
- ^ Виейра Э., Клитон-Джонс П., Мойес Д. (1983). «Влияние низких периодических концентраций закиси азота на развивающийся плод крысы» . Британский журнал анестезии . 55 (1): 67–9. дои : 10.1093/bja/55.1.67 . ПМИД 6821624 .
- ↑ Закись азота. Архивировано 30 марта 2016 г. в Wayback Machine . Энциклопедия Air Liquide Gas.
- ^ «Вазелин спровоцировал взрыв гибридной ракеты» . Укрокетман.com.
- ^ «Безопасность 20: Закись азота» (PDF) . Airproducts.com. Архивировано из оригинала (PDF) 1 сентября 2006 года.
- ^ Jump up to: а б Ямакура Т., Харрис Р.А. (2000). «Влияние газообразных анестетиков закиси азота и ксенона на лиганд-управляемые ионные каналы. Сравнение с изофлураном и этанолом» . Анестезиология . 93 (4): 1095–101. дои : 10.1097/00000542-200010000-00034 . ПМИД 11020766 . S2CID 4684919 .
- ^ Меннерик С., Евтович-Тодорович В., Тодорович С.М., Шен В., Олни Дж.В., Зорумски К.Ф. (1998). «Влияние закиси азота на возбуждающую и тормозящую синаптическую передачу в культурах гиппокампа» . Журнал неврологии . 18 (23): 9716–26. doi : 10.1523/JNEUROSCI.18-23-09716.1998 . ПМК 6793274 . ПМИД 9822732 .
- ^ Грусс М., Бушелл Т.Дж., Брайт Д.П., Либ В.Р., Мэти А., Фрэнкс Н.П. (2004). «Двухпоровый домен K + каналы являются новой мишенью для анестезирующих газов ксенона, закиси азота и циклопропана». Molecular Pharmacology . 65 (2): 443–52. : 10.1124 /mol.65.2.443 . PMID 14742687. . S2CID 7762447 doi
- ^ Jump up to: а б Эммануил Д.Е., Куок Р.М. (2007). «Достижения в понимании действия закиси азота» . Прогресс анестезии . 54 (1): 9–18. doi : 10.2344/0003-3006(2007)54[9:AIUTAO]2.0.CO;2 . ПМК 1821130 . ПМИД 17352529 .
- ^ Аткинсон Р.М., Грин Дж.Д., Ченовет Д.Е., Аткинсон Дж.Х. (1 октября 1979 г.). «Субъективные эффекты закиси азота: когнитивные, эмоциональные, перцептивные и трансцендентальные переживания». Журнал психоделических наркотиков . 11 (4): 317–330. дои : 10.1080/02791072.1979.10471415 . ПМИД 522172 .
- ^ Уокер DJ, Zacny JP (1 сентября 2001 г.). «Внутри- и межсубъектная изменчивость усиливающих и субъективных эффектов закиси азота у здоровых добровольцев». Наркотическая и алкогольная зависимость . 64 (1): 85–96. дои : 10.1016/s0376-8716(00)00234-9 . ПМИД 11470344 .
- ^ Эммануил Д.Е., Джонсон CH, Куок Р.М. (1994). «Анксиолитический эффект закиси азота у мышей в приподнятом крестообразном лабиринте: опосредование бензодиазепиновых рецепторов». Психофармакология . 115 (1–2): 167–72. дои : 10.1007/BF02244768 . ПМИД 7862891 . S2CID 21652496 .
- ^ Закни Дж.П., Яйник С., Коулсон Д., Личтор Дж.Л., Апфельбаум Дж.Л., Рупани Г. и др. (1995). «Флумазенил может ослабить некоторые субъективные эффекты закиси азота у людей: предварительный отчет». Фармакология Биохимия и поведение . 51 (4): 815–9. дои : 10.1016/0091-3057(95)00039-Y . ПМИД 7675863 . S2CID 39068081 .
- ^ Гиллман М.А. (2022 г.). «Что лучше для психиатрии: титрованная или фиксированная концентрация закиси азота?» . Передний. Психиатрия . 13 (773190): 460–3. дои : 10.3389/fpsyt.2022.773190 . ПМЦ 9441863 . ПМИД 36072452 .
- ^ Берковиц Б.А., Финк А.Д., Хайнс М.Д., Нгай С.Х. (1979). «Толерантность к аналгезии закисью азота у крыс и мышей» . Анестезиология . 51 (4): 309–12. дои : 10.1097/00000542-197910000-00006 . ПМИД 484891 . S2CID 26281498 .
- ^ Jump up to: а б Бранда Э.М., Рамза Дж.Т., Кэхилл Ф.Дж., Ценг Л.Ф., Куок Р.М. (2000). «Роль динорфина мозга в антиноцицепции закиси азота у мышей». Фармакология Биохимия и поведение . 65 (2): 217–21. дои : 10.1016/S0091-3057(99)00202-6 . ПМИД 10672972 . S2CID 1978597 .
- ^ Гиллман М.А. [1986a]. Мини-обзор: Анальгетик [субанестезирующий] закись азота взаимодействует с эндогенной опиоидной системой: обзор доказательств. Науки о жизни 39: 1209-1221.
- ^ (Дарас, К., Кантрилл, Р.К., Гиллман, Массачусетс [1983]. Замещение 3[H]-налоксона: доказательства того, что закись азота является опиоидным агонистом. Европейский журнал фармакологии 89: 177-8.
- ^ Ори, К., Форд-Райс, Ф., Лондон, ED [1989]. Влияние закиси азота и галотана на мю- и каппа-опиоидные рецепторы в мозге морских свинок. Анестезиология 70: 541-544.)
- ^ Го Т.З., Дэвис М.Ф., Кингери В.С., Паттерсон А.Дж., Лимберд Л.Е., Мейз М. (1999). «Закись азота вызывает у мышей антиноцицептивную реакцию через подтипы адренорецепторов альфа2В и/или альфа2С» . Анестезиология . 90 (2): 470–6. дои : 10.1097/00000542-199902000-00022 . ПМИД 9952154 .
- ^ Савамура С., Кингери В.С., Дэвис М.Ф., Агаше Г.С., Кларк Дж.Д., Коблика Б.К. и др. (2000). «Антиноцицептивное действие закиси азота опосредуется стимуляцией норадренергических нейронов ствола мозга и активацией [альфа] 2В- адренорецепторов» . Дж. Нейроски . 20 (24): 9242–51. doi : 10.1523/JNEUROSCI.20-24-09242.2000 . ПМК 6773006 . ПМИД 11125002 .
- ^ Мейз М., Фудзинага М. (2000). «Последние достижения в понимании действия и токсичности закиси азота» . Анестезия . 55 (4): 311–4. дои : 10.1046/j.1365-2044.2000.01463.x . ПМИД 10781114 . S2CID 39823627 .
- ^ Хаускрофт, Кэтрин Э., Шарп, Алан Г. (2008). «Глава 15: Группа 15 элементов». Неорганическая химия (3-е изд.). Пирсон. п. 464 . ISBN 978-0-13-175553-6 .
- ^ Киз Т (1941). «Развитие анестезии» . Анестезиология . 2 (5): 552–574. Бибкод : 1982AmSci..70..522D . дои : 10.1097/00000542-194109000-00008 . S2CID 73062366 .
- ^ МакЭвой Дж.Г. (6 марта 2015 г.). «Газы, Бог и баланс природы: комментарий к книге Пристли (1772) «Наблюдения за различными видами воздуха» » . Философские труды Королевского общества A: Математические, физические и технические науки . 373 (2039): 20140229. Бибкод : 2015RSPTA.37340229M . дои : 10.1098/rsta.2014.0229 . ПМК 4360083 . ПМИД 25750146 .
- ^ Пристли Дж. (1776 г.). «Опыты и наблюдения над различными видами воздуха» . Эровид .
- ^ Дэви Х (1800). Исследования химические и философские — главным образом касающиеся закиси азота или дефлогистированного азотистого воздуха и его дыхания . Напечатано для Дж. Джонсона.
- ^ Хардман Дж.Г. (2017). Оксфордский учебник анестезии . Издательство Оксфордского университета. п. 529. ИСБН 978-0-19-964204-5 .
- ^ Брехер Э.М. (1972). «Отчет Союза потребителей о законных и запрещенных наркотиках, Часть VI – Ингалянты, растворители и нюхание клея» . Журнал Consumer Reports . Проверено 18 декабря 2013 г.
- ^ «Джордж По мертв» . Вашингтон Пост . 3 февраля 1914 года. Архивировано из оригинала 1 марта 2013 года . Проверено 29 декабря 2007 г.
- ^ Эрвинг Х.В. (1933). «Открыватель анестезии: доктор Гораций Уэллс из Хартфорда» . Йельский журнал биологии и медицины . 5 (5): 421–430. ПМК 2606479 . ПМИД 21433572 .
- ^ Уэллс Х (1847 г.). История открытия и применения закиси азота, эфира и других паров в хирургических операциях . Дж. Гейлорд Уэллс.
- ^ Десаи С.П., Десаи М.С., Пандав К.С. (2007). «Открытие современной анестезии – вклад Дэви, Кларка, Лонга, Уэллса и Мортона» . Индианка Джей Анест . 51 (6): 472–8.
- ^ «Предполагаемая подделка» . Интер Океан . 28 сентября 1877 г. с. 8 . Проверено 26 октября 2015 г.
- ^ «Человек со зловещим именем» . Интер Океан . 19 февраля 1890 года . Проверено 26 октября 2015 г.
- ^ Jump up to: а б Пармон В.Н., Панов Г.И., Уриарте А., Носков А.С. (2005). «Закись азота в области химии окисления и применения и производства катализа». Катализ сегодня . 100 (2005): 115–131. дои : 10.1016/j.cattod.2004.12.012 .
- ^ Холлеман А.Ф., Виберг Э. (2001). Неорганическая химия . Сан-Диего: Академическая пресса. ISBN 978-0-12-352651-9 .
- ^ «Завод закиси азота» . Организация Санги. Архивировано из оригинала 27 ноября 2013 года . Проверено 18 декабря 2013 г.
- ^ «Семейство азота» . Архивировано 21 октября 2014 года в Wayback Machine . chemistry.tutorvista.com
- ^ «Получение закиси азота из мочевины, азотной и серной кислот» .
- ^ Сува Т., Мацусима А., Сузики Ю., Намина Ю. (1961). «Производство закиси азота каталитическим окислением аммиака» . Журнал Общества химической промышленности Японии . 64 (11): 1879–1888. дои : 10.1246/nikkashi1898.64.11_1879 .
- ^ Эгон Виберг, Арнольд Фредерик Холлеман (2001) Неорганическая химия , Elsevier ISBN 0-12-352651-5
- ^ " Н
2 O Budget» . Глобальный углеродный проект . Дата обращения 9 ноября 2020 . - ^ «Глава 6». ТДО Изменение климата 2001: Научная основа . п. 358.
- ^ Равишанкара А.Р., Дэниел Дж.С., Портманн Р.В. (27 августа 2009 г.), «Поддерживающие онлайн-материалы по закиси азота (N 2 O): доминирующему озоноразрушающему веществу, выбрасываемому в 21 веке» (PDF) , Science , 326 (5949) : 123–125, Bibcode : 2009Sci...326..123R , doi : 10.1126/science.1176985 , PMID 19713491 , S2CID 2100618 , заархивировано (PDF) из оригинала 9 октября 2022 г.
- ^ Jump up to: а б Агентство по охране окружающей среды США .
- ^ Jump up to: а б с д Глава 5: Глобальные углеродные и другие биогеохимические циклы и обратные связи . www.ipcc.ch (Отчет) . Проверено 6 мая 2023 г.
- ^ Агентство по охране окружающей среды США O (23 декабря 2015 г.). «Обзор парниковых газов» . www.epa.gov . Проверено 4 мая 2023 г.
- ^ «| Выбросы парниковых газов (ПГ) | Климатические наблюдения» . www.climatewatchdata.org . Проверено 4 мая 2023 г.
- ^ Слосс Л.Л. (1992). Справочник по технологии контроля оксидов азота . Уильям Эндрю. п. 6. ISBN 978-0-8155-1294-3 .
- ^ Агентство по охране окружающей среды США (2010), « Выбросы метана и закиси азота из природных источников ». Отчет EPA 430-R-10-001.
- ^ Банге Х.В. (2006). «Закись азота и метан в прибрежных водах Европы» . Устьевые, прибрежные и шельфовые науки . 70 (3): 361–374. Бибкод : 2006ECSS...70..361B . дои : 10.1016/j.ecss.2006.05.042 .
- ^ Томпсон А.Дж., Джаннопулос Дж., Претти Дж., Бэггс Э.М., Ричардсон DJ (2012). «Биологические источники и поглотители закиси азота и стратегии по снижению выбросов» . Философские труды Королевского общества Б. 367 (1593): 1157–1168. дои : 10.1098/rstb.2011.0415 . ПМК 3306631 . ПМИД 22451101 .
- ^ Jump up to: а б с К.Л. Денман, Г. Брассер и др. (2007), «Связь между изменениями в климатической системе и биогеохимией». В четвертом оценочном отчете Межправительственной группы экспертов по изменению климата , издательство Cambridge University Press.
- ^ Стейнфельд Х., Гербер П., Вассенаар Т., Кастель В., Росалес М., де Хаан К. (2006). Длинная тень животноводства: экологические проблемы и варианты . Фао.орг . Проверено 2 февраля 2008 г.
- ^ «Обзор парниковых газов: закись азота» . Агентство по охране окружающей среды США. 23 декабря 2015 года. Архивировано из оригинала 12 августа 2016 года . Проверено 31 марта 2016 г.
- ^ «Закись азота: источники и выбросы» . Агентство по охране окружающей среды США. 2006. Архивировано из оригинала 16 января 2008 года . Проверено 2 февраля 2008 г.
- ^ МГЭИК. 2013. Изменение климата: физическая основа (РГ I, полный отчет). п. 512.
- ^ Томпсон Р.Л., Лассалетта Л., Патра П.К., Уилсон С., Уэллс К.С., Грессент А. и др. (18 ноября 2019 г.). «Ускорение глобальных выбросов N 2 O, наблюдаемое в результате двух десятилетий атмосферной инверсии» . Природа Изменение климата . 9 (12): 993–998. Бибкод : 2019NatCC...9..993T . дои : 10.1038/s41558-019-0613-7 . hdl : 11250/2646484 . ISSN 1758-6798 . S2CID 208302708 .
- ^ Молодовская М., Варланд Дж., Ричардс Б.К., Оберг Г., Стенхейс Т.С. (2011). «Закись азота из гетерогенных сельскохозяйственных ландшафтов: анализ вклада источников с помощью Eddy Covariance и Chambers». Журнал Американского общества почвоведения . 75 (5): 1829. Бибкод : 2011SSASJ..75.1829M . дои : 10.2136/SSSAJ2010.0415 .
- ^ Молодовская М., Сингуринди О., Ричардс Б.К., Варланд Дж.С., Джонсон М., Оберг Г. и др. (2012). «Временная изменчивость закиси азота на удобренных пахотных землях: анализ горячего момента». Журнал Американского общества почвоведения . 76 (5): 1728–1740. Бибкод : 2012SSASJ..76.1728M . дои : 10.2136/sssaj2012.0039 . S2CID 54795634 .
- ^ Сингуринды О, Молодовская М, Ричардс Б.К., Стенхейс Т.С. (июль 2009 г.). «Выбросы закиси азота при низких температурах из удобренных навозом почв под кукурузой (Zea mays L.)». Сельское хозяйство, экосистемы и окружающая среда . 132 (1–2): 74–81. Бибкод : 2009AgEE..132...74S . дои : 10.1016/j.agee.2009.03.001 .
- ^ Мейсон С., Стоф С., Ричардс Б., Дас С., Гудейл С., Стинхейс Т. (2017). «Горячие точки выбросов закиси азота в удобренных и неудобренных многолетних травах на склонных к влажности маргинальных землях в штате Нью-Йорк». Журнал Американского общества почвоведения . 81 (3): 450–458. Бибкод : 2017SSASJ..81..450M . дои : 10.2136/sssaj2016.08.0249 .
- ^ Реймер Р.А., Слейтен К.С., Сипан М., Лоуэр М.В., Томлинсон П.Е. (1994). «Сокращение выбросов N 2 O, образующихся при производстве адипиновой кислоты». Экологический прогресс . 13 (2): 134–137. Бибкод : 1994EnvPr..13..134R . дои : 10.1002/эп.670130217 .
- ^ Симидзу А., Танака К., Фухимори М. (2000). «Сокращение выбросов N 2 O, образующихся при производстве адипиновой кислоты». Хемосфера – наука о глобальных изменениях . 2 (3–4): 425–434. Бибкод : 2000ChGCS...2..425S . дои : 10.1016/S1465-9972(00)00024-6 .
- ^ Шнайдер, Лиза К., Вюст, Аня, Помовски, Аня, Чжан, Лин, Эйнсле, Оливер (2014). «Не до смеха: разрушение монооксида азота парникового газа редуктазой закиси азота». В Кронеке, Питер М.Х., Соса Торрес, Марта Э. (ред.). Металлоориентированная биогеохимия газообразных соединений в окружающей среде . Ионы металлов в науках о жизни. Том. 14. Спрингер. стр. 177–210. дои : 10.1007/978-94-017-9269-1_8 . ISBN 978-94-017-9268-4 . ПМИД 25416395 .
- ^ Агентство по охране окружающей среды США, «Индикаторы изменения климата: концентрации парниковых газов в атмосфере », по состоянию на 14 февраля 2017 г. Веб-документ
- ^ «4.1.1 Источники парниковых газов» . МГЭИК ТДО РГ 1 2001 . Архивировано из оригинала 29 октября 2012 года . Проверено 21 сентября 2012 г.
- ^ Мундшенк С. (3 августа 2022 г.). «Нидерланды показывают, как не бороться с изменением климата | The Spectator» . www.spectator.co.uk . Проверено 28 августа 2022 г.
- ^ «Обзор парниковых газов: выбросы закиси азота» . Агентство по охране окружающей среды США. 6 октября 2016 г. Проверено 14 июля 2019 г.
- ^ Наафс Б.Д., Монтейро Ф.М., Пирсон А., Хиггинс М.Б., Панкост Р.Д., Риджвелл А. (10 декабря 2019 г.). «Принципиально иной глобальный круговорот морского азота в ответ на резкое сокращение кислорода в океане» . Труды Национальной академии наук Соединенных Штатов Америки . 116 (50): 24979–24984. Бибкод : 2019PNAS..11624979N . дои : 10.1073/pnas.1905553116 . ПМК 6911173 . ПМИД 31767742 .
- ^ Гроссман Л. (28 августа 2009 г.). «Веселящий газ представляет собой самую большую угрозу озоновому слою» . Новый учёный .
- ^ «Огайо Медикал» (PDF) . www.ohiomedical.com . Архивировано из оригинала (PDF) 17 апреля 2016 года . Проверено 20 сентября 2017 г.
- ^ Андертон Дж. (26 июня 2005 г.). «Пришло время фиктивной продажи веселящего газа» . Beehive.govt.nz. Архивировано из оригинала 8 января 2015 года.
- ^ «Совет Ламбета запрещает веселящий газ как легкий наркотик» . Новости Би-би-си . 17 августа 2015 года . Проверено 17 августа 2015 г.
- ^ «Закись азота: веселящий газ станет незаконным к концу года» . Новости Би-би-си . 5 сентября 2023 г. Проверено 5 сентября 2023 г.
- ^ «Законы США об закиси азота (в алфавитном порядке). На основе поиска в бесплатных юридических базах данных в Интернете. Проведено в мае 2002 г.» . Центр когнитивной свободы и этики. Архивировано из оригинала 24 января 2008 года . Проверено 27 января 2008 г.
- ^ «CAL. PEN. CODE § 381b: Кодекс Калифорнии – раздел 381b» . Lp.findlaw.com.
Внешние ссылки
[ редактировать ]- Руководство по охране труда при работе с закисью азота
- Интервью Пола Крутцена. Бесплатный просмотр видеоролика Пола Крутцена, лауреата Нобелевской премии за его работу по разложению озона, который беседует с Гарри Крото, лауреатом Нобелевской премии Vega Science Trust.
- Национальный реестр загрязнителей – Информационный бюллетень по оксиду азота
- Национальный институт охраны труда и здоровья – закись азота
- CDC - Карманный справочник NIOSH по химическим опасностям - закись азота
- Часто задаваемые вопросы по закиси азота
- Статья Erowid о закиси азота
- Закись азота названа чудовищным убийцей озона. Архивировано 29 сентября 2012 года в Wayback Machine , Science News.
- Статья Dental Fear Central об использовании закиси азота в стоматологии
- База данных измененных состояний
- Антагонисты 5-HT3
- Аэрозольные пропелленты
- Диссоциативные наркотики
- Добавки для электронного номера
- Эйфорианты
- Положительные аллостерические модуляторы ГАМКА-рецепторов
- Газообразные сигнальные молекулы
- Общие анестетики
- Агонисты глициновых рецепторов
- Парниковые газы
- Промышленные газы
- Промышленная гигиена
- Ингалянты
- Оксиды азота
- Монотопливо
- Никотиновые антагонисты
- Азотный цикл
- Антагонисты NMDA-рецепторов
- Ракетные окислители
- Следовые газы
- Основные лекарства Всемирной организации здравоохранения
- Нейротоксины

